Rituximab es un anticuerpo quimérico murino-humano dirigido contra el antígeno CD20 presente en los linfocitos B normales y neoplásicos. Su uso en los linfomas cutáneos de células B ha ido en creciente desarrollo en los últimos años. Así se plantea como una alternativa a los tratamientos clásicos de radioterapia y cirugía en los linfomas de curso indolente, el linfoma folicular y el linfoma de la zona marginal. También se utiliza en el tratamiento del linfoma cutáneo primario de células grandes tipo piernas como alternativa a la poliquimioterapia. Su desarrollo como alternativa terapéutica ha llevado a su uso intralesional también con buenos resultados. En este artículo se revisa la literatura publicada del uso de rituximab en los linfomas cutáneos primarios de células B.
Rituximab is a chimeric mouse-human antibody that targets the CD20 antigen, which is found in both normal and neoplastic B cells. In recent years, it has been increasingly used to treat cutaneous B-cell lymphoma and is now considered an alternative to classic treatment (radiotherapy and surgery) of 2 types of indolent lymphoma, namely, primary cutaneous follicle center lymphoma and primary cutaneous marginal zone B-cell lymphoma. Rituximab is also administered as an alternative to polychemotherapy in the treatment of primary cutaneous large B-cell lymphoma, leg type. Its use as an alternative drug led to it being administered intralesionally, with beneficial effects. In the present article, we review the literature published on the use of rituximab to treat primary cutaneous B-cell lymphoma.
Los linfomas cutáneos de células B (LCCB) primarios son un grupo de linfomas de estirpe B limitados a la piel en el momento del diagnóstico. La reciente clasificación de la World Health Organization (WHO)-European Organization for Research and Treatment of Cancer (EORTC) los divide en 3 subgrupos principales: linfoma folicular (LF), linfoma de la zona marginal (LZM) y linfoma cutáneo de células grandes difuso tipo piernas (LCGTP)1. Representan aproximadamente el 20-25% de todos los linfomas cutáneos primarios. La mayoría de los LCCB (más del 80%) corresponden a las 2 variedades de curso indolente, el LF y el LZM2. Las características principales de estas 3 entidades se resumen en la tabla 13. Tanto el LF como el LZM tienen un curso poco agresivo, con una superviviencia estimada superior al 95% a los 5 años1. Sin embargo, aunque el pronóstico es excelente, las tasas de recurrencia tras el tratamiento son altas, y varían del 14 al 62%3. La forma más frecuente de presentación del LF y del LZM es en forma de placas o nódulos, en ocasiones con una distribución regional, siendo el tronco la localización más frecuente (48,9%), seguido de la cara (26,4%)4,5. El curso benigno de estos linfomas B cutáneos, así como su frecuente distribución multifocal, hace que el tratamiento a aplicar deba ser seleccionado con cautela. Las modalidades más aplicadas son la radioterapia (RT) y la cirugía4,5, con riesgo de secuelas y sin ser ideales para lesiones multifocales y/o recidivantes. Esta situación lleva a la necesidad de explorar otras opciones terapéuticas. En ausencia de ensayos clínicos controlados, no hay un consenso claro del tratamiento de los LCCB indolentes3. El LCGTP sin embargo tiene un curso rápidamente progresivo con altas tasas de recurrencia y tendencia a la diseminación extracutánea, con una superviviencia a los 5 años del 50%3. En más del 70% de los pacientes las lesiones están localizadas en las piernas, y se presentan en forma de nódulos o tumores ulcerados. Es esencial establecer el diagnóstico diferencial con un linfoma no Hodgkin (LNH) difuso de célula grande sistémico con afectación cutánea6. En el tratamiento del LCGTP se ha introducido también en los últimos años rituximab sistémico solo o en combinación con otros agentes quimioterápicos.
Características de los linfomas cutáneos primarios de células B más frecuentes
| LZM | LF | LCCGTP | |
| Clínica | Adulto joven o adultosPlacas o tumores únicos o múltiples en las piernasRecaídas cutáneas frecuentesA veces asociado a infección por Borrelia burgdorferiAfectación extracutánea infrecuente | AdultosTumores solitarios o agrupados en la cabeza o troncoRecaída cutánea en el 20%Diseminación extracutánea en el 5-10% | Tumores únicos o múltiples en las piernas; raramente en otras localizacionesRecaídas cutáneas frecuentesDiseminación extracutánea frecuente |
| Histología | Infiltrado difuso o parcheado de células B pequeñasIncluye células de la zona marginal (centrocito-like), células linfoplasmocitoides y plasmáticas | Infiltrado folicular o difuso o ambosCentrocitos y centroblastos | Infiltrado monomorfo con predominancia de centroblastos e inmunoblastos |
| IHQ | CD79a+, Bcl-2+, Bcl-6-, CD10-, ciclina D1-, CD5- | CD20+, CD79a+, Bcl2-, Bcl- 6+, MUM1-, CD10± | CD20+, CD79a+, Bcl-6±, CD10-, Bcl-2+, MUM-1+ |
| Genética | Reordenamiento clonal del IgH 50-60%t(14-18) en un pequeño porcentaje | Reordenamiento clonal IgHt(14;18) ausente | Reordenamiento clonal del IgH en la mayoría de los casost(9:21) |
| Tratamiento | RT, cirugía, INF-α, rituximabQT sistémica reservada para lesiones generalizadas o afectación extracutánea (CHOP, CHOP-R) | RT, cirugía, INF-α, rituximabQT sistémica reservada para lesiones generalizadas o afectación extracutánea(CHOP, CHOP-R) | RT en lesiones solitariasPoliquimioterapia: CHOP, R-CHOPRituximab |
| Supervivencia a los 5 años | >95% | 95% | 50% |
El rituximab es un anticuerpo monoclonal quimérico, ratón-humano, IgG dirigido contra el antígeno CD20 presente en casi todas las células B neoplásicas y normales. Ha sido utilizado con éxito en el tratamiento de los LNH de células B sistémicos solo o más frecuentemente en combinación con otros agentes quimioterápicos7. En los últimos años el rituximab se ha estado utilizando con buenos resultados en Dermatología en una variedad de dermatosis8 y en los LCCB.
En estudios in vitro rituximab ha demostrado inducir la lisis de las células B del linfoma mediante citotoxicidad mediada por anticuerpos, activación del complemento e inducción directa de la apoptosis. Este mecanismo es independiente del sistema inmunológico y se produce porque la región variable de origen murino se liga con alta afinidad al antígeno CD20 expresado en los linfocitos B malignos, parando su proliferación e induciendo su apoptosis probablemente a través de los canales de calcio transmembrana6. Además ha demostrado inducir una respuesta antígeno-específica de las células T actuando como una vacuna9. Rituximab también es capaz de sensibilizar las células a los efectos citotóxicos de otros quimioterápicos10.
Rituximab actúa además por la vía de la proteína bcl-2. Este marcador se encuentra sobreexpresado en el 85% de los LCGTP y se considera en dichos linfomas un factor de peor pronóstico11. En el caso de los linfomas difusos de células grandes sistémicos se ha observado que el añadir rituximab a combinaciones basadas en antraciclinas es especialmente beneficioso para los linfomas bcl-2 positivos, que tenían peor pronóstico cuando no se trataban con rituximab12.
Rituximab en los linfomas cutáneos primariosLinfoma folicular y linfoma de la zona marginalEl LF y el LZM primarios cutáneos son linfomas cutáneos de curso indolente a pesar de su alta tasa de recurrencia, por lo que es importante resaltar que en la mayoría de las ocasiones el tratamiento no debe ser agresivo. Las recomendaciones para el tratamiento del LF y del LZM incluyen: no tratar («esperar y ver»), la RT, la cirugía o el interferón alfa intralesional3. Pero en ocasiones las lesiones son múltiples, de gran tamaño, dolorosas, desfigurantes o pruriginosas y requieren tratamiento, lo que hace que la actitud expectante no sea una opción. Además, en estas situaciones las terapias dirigidas a la piel, como la cirugía o la RT, no son convenientes, especialmente en lesiones múltiples o en zonas donde pueden dejar secuelas estéticas importantes como en la cara o en el cuero cabelludo. En estas circunstancias se están utilizando otras alternativas de tratamiento, incluido el rituximab sistémico o intralesional.
Las tablas 2 y 3 resumen, respectivamente, los casos publicados de LF y LZM tratados con rituximab sistémico, y la tabla 4 los casos de LF y LZM tratados con rituximab intralesional.
Casos publicados de linfoma folicular tratado con rituximab intravenoso
| Autor/año | Número de pacientes | Número de infusiones | Respuesta | Duración de la respuesta (meses) | Comentarios |
| Heinzerling 200013 | 3 | 1, 2, 4 | 2 RP/1 RC | 5, 12, 10 | Reacción urticarial en los tumoresDesaparición de las células B en sangre periférica |
| Gellrich 200114 | 2 | 4-8 | RP | 9 | |
| Kennedy 200415 | 2 | 4 | RP, RC | 6,7 | |
| Lacouture 200516 | 1 | 4 | RC | 24 | Trata una recidiva tras RT |
| Fink-Puches 200517 | 2 | 3, 4 | RC, RC | 24, 14 | Un paciente recurrencia cutánea en otra localización |
| Gellrich 200518 | 8 | 8-10 | 6 RC, 2 RP | 7-30 | Demuestra curación histológica |
| Errante 200619 | 1 | 8 | RC | NE | Reacción urticarial |
| Gitelson 200620 | 2 | 4 | RC | 17-39 | Uno de ellos terapia de mantenimiento cada 2 meses, 8 meses |
| Kerl 200621 | 1 | 4 | RC | 18 | Sin recaída |
| Morales 200822 | 10 | 4 | 8 RC, 2 RP | 6-31 | Mantenimiento, variable en cada paciente |
| Valencak 200923 | 11 | 6 | RC | 6-57 | Trata lesiones multifocales, no candidatas a RT o cirugía |
| Brunet-Posenti 201124 | 1 | 4 | RC | NE | Reacción edematosa en la infusión |
| Total | 44 | 1-10 | 34 RC/10 RPRC del 77% | 6-57 |
Casos publicados de linfoma de la zona marginal tratado con rituximab intravenoso
| Autor/año | Número de pacientes | Número de infusiones | Respuesta | Duración de la respuesta (meses) | Comentarios |
| Soda 200125 | 1 | 4 | RP | 6 | Múltiples lesiones, usan rituximab como primera opción |
| Gellrich 200114 | 2 | 4-8 | RP | 9 | Tratamiento de mantenimiento |
| Gellrich 200518 | 1 | 8 | RP | 23 | Recaída a los 23 meses |
| Kerl 200621 | 1 | 4 | RC | 24 | Sin recaída, sin mantenimiento |
| Morales 200822 | 5 | 4-6 | 1 RC,2 RP, 1 EE, 1 RI | 6-23 | Utilizan tratamiento de mantenimiento en 3 de los pacientes |
| Valencak 200923 | 5 | 4-6 | 4 RC, 1 RP | 17-75 | Dos de ellos tratamiento adicional |
| Seker 201026 | 1 | 8 | RC | 13 | Todos multinodulares |
Casos publicados de linfoma folicular y linfoma de la zona marginal tratados con rituximab intralesional
| Autor | Número de lesiones/tipo | Tratamiento previo | Respuesta | Duración de la respuesta (meses) | Recaída |
| Heinzerling 200013 | 2 LF | 2/2 | 2 RP | 0-12 | 2/2 |
| Paul 200136 | 2 LF | 1/2 | 2 RC | 12 | 0/2 |
| Fink-Puches 200517 | 3 LF/4 LZM | 1/7 | 6 RC/1 RP (LZM) | 12-27 | 4 (3 LZM, 1 LF)/7 |
| Roguedas 200537 | 1 LF | 1/1 | RC | 12 | 1/1 |
| Kerl 2005 | 3 LF/3 LZM | 4/6 | 6 RC | 3-14 | 2 (1 LF, 1 LZM)/6 |
| Kyrtsonis 200638 | 2 LZM | 0/2 | 2 RC | 36-44 | 2/2 |
| Park 201039,a | 1 LZM | 0/1 | RC | 26 | 0/1 |
| Peñate 201240 | 18 LF/17 LZM | 25/35 | 14/18 RC en LF | 3-48 | 6/14 RC en LF |
| 11/17 RC en LZM | 4/11 RC en LZM |
Existen un total de 44 casos publicados de LF cutáneo tratados con rituximab intravenoso (tabla 2)13–24, con regímenes que van de las habituales 4 infusiones, una semanal, con la dosis estándar de 375mg/m2, hasta regímenes de 10 infusiones. La tasa de respuesta completa de toda la literatura publicada es de aproximadamente un 77%, con una duración de la respuesta que va de 6 a 57 meses. En el caso del LZM existen un total de 16 casos publicados tratados con rituximab sistémico (tabla 3)14,18,21,25,26, con una tasa de respuesta completa del 43% y una duración de la respuesta de entre 6 y 75 meses.
Esta aparente peor respuesta de rituximab de los pacientes con LZM deberá ser confirmada en el futuro con estudios amplios prospectivos, pero puede ser el resultado de varios mecanismos que produzcan resistencia al tratamiento con rituximab. Existe un estudio que publica la falta de eficacia del rituximab en pacientes con quimioinmunoterapia con LZM no cutáneo27. Una de las hipótesis es que las células B malignas adquieran nuevas mutaciones que les confieran resistencia a la apoptosis inducida por rituximab. Así, en un estudio sobre 4 pacientes con enfermedad recurrente se demostró el aumento de la actividad de bcl-2 tras el tratamiento con rituximab28. También se han encontrado variaciones en el lugar de unión de las células B al rituximab, así pacientes con determinados genotipos en la zona de unión al anticuerpo parecen tener mejor respuesta al tratamiento con rituximab y periodos más largos libres de enfermedad. Este polimorfismo en la expresión del antígeno CD20 en las células B malignas puede determinar la existencia de un subgrupo de pacientes con resistencia innata al tratamiento con rituximab29.
Las recaídas tras el tratamiento con rituximab intravenoso, tanto en el LF como en el LZM son frecuentes, del 20 y del 50% respectivamente. Sin embargo, las recaídas en los LCCB son frecuentes con todos los tratamientos a excepción de la cirugía y la RT3. Por esta razón algunos autores como Gellrich proponen tratamientos más prolongados de 8 ciclos en vez de 4, ya que así obtienen mejores tasas de respuesta y de remisión en sus pacientes (Tasa de Respuesta: 90%)18; sin embargo, los beneficios de prolongar el tratamiento no están claramente demostrados debido al pequeño número de pacientes publicados. Valencak en otro estudio posterior que incluye 16 pacientes obtiene respuesta completa en el 62% de los LCCB indolentes tratados con rituximab intravenoso, y propone tratamientos de 4 ciclos como suficientes, recalcando la ausencia de estudios que confirmen la necesidad de alargar el tratamiento23. Tampoco está claro en los trabajos publicados si la posibilidad de retratar a los pacientes con rituximab tras la recidiva ofrece algún beneficio, como ha sido demostrado en los linfomas foliculares sistémicos30,31.
La mayoría de los trabajos considera la respuesta completa como la desaparición de todas las lesiones cutáneas y lo evalúan de forma clínica y seguimiento periódico de los pacientes. Existen algunos trabajos en los que además se evalúa la respuesta histológica de las lesiones14,18,25 mediante una biopsia cutánea tras el tratamiento. En estos trabajos se describe la presencia de un infiltrado de células T CD8 positivas14, y una disminución de la expresión de CD2025.Gellrich18 toma biopsias en 8 de sus pacientes tratados en respuesta completa y encuentra que a pesar de obtener respuesta clínica completa en 8 pacientes, solo en 6 encuentra respuesta histológica completa.
El tratamiento con rituximab intravenoso es seguro y en general bien tolerado, especialmente si se compara con otros agentes quimioterápicos clásicos. Los efectos adversos se resumen en la tabla 532. Entre los efectos adversos cutáneos los más frecuentes son leves, en forma de rash o urticaria, presentes en aproximadamente un 15% de los pacientes. Los efectos secundarios cutáneos graves descritos como el pénfigo paraneoplásico o el síndrome de Steven-Johnson aparecen en menos del 2%. Es curioso cómo algunos autores describen la aparición de habones alrededor de las lesiones cutáneas en el LF tratado con rituximab sistémico; se cree que es debido a la liberación de citocinas inflamatorias13,19. Es de especial interés el riesgo de reactivación del virus de la hepatitis B en pacientes con infección crónica, ya que puede llegar a ser fulminante26,33. Las guías americanas de hepatología recomiendan el uso de lamivudina como profilaxis hasta 6 meses después de finalizar el tratamiento con rituximab intravenoso en pacientes portadores del AgHbs34, que algunos autores prolongan hasta 2 años después de finalizar el tratamiento al haberse descrito reactivaciones tardías de la hepatitis B26.
Efectos adversos de rituximab sistémico
| Efectos cutáneos | RashPruritoUrticariaInfecciones bacterianasReacciones liquenoidesPénfigo paraneoplásicoSteven-Johnson/necrólisis epidérmica tóxicaDermatitis vesículo-ampollosas |
| Efectos sistémicos | Reacción infusional fatal (primeras 24h)Síndrome de lisis tumoralReactivación de hepatitis B (puede ser fulminante)Arritmias cardíacas severasFallo renal (puede llegar a ser fatal)Reacciones de hipersensiblidadOtras: enfermedad del suero, síndrome inflamatorio artritis-reumatoide-like, vasculitis, mucositis |
Fuente: Scheinfield32.
En la mayoría de los trabajos se considera el rituximab intravenoso como tratamiento de elección para lesiones multifocales y también para lesiones situadas en la cara o cuero cabelludo, ya que la RT puede producir alopecia y efectos cutáneos irreversibles, como poiquilodermia o atrofia19,26.
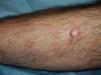
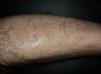
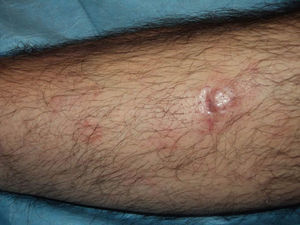
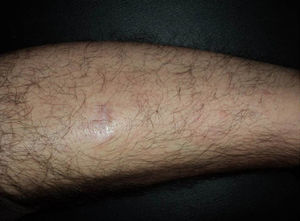
En los últimos años se ha generalizado el uso del rituximab intralesional para el LF y el LZM con la intención de hacer el tratamiento más cómodo y asequible minimizando efectos secundarios (figs. 1 y 2). Los casos publicados de LF y LZM tratados con rituximab intralesional se resumen en la tabla 617,21,35–40. Las tasas de respuesta completa con este tratamiento en los linfomas B indolentes son algo superiores a las de su uso intravenoso, con cifras del 83 al 89%, pero de nuevo con una alta tasa de recaídas tras el tratamiento (40-62%)3. En la mayoría de los estudios aplican regímenes de entre 10 y 30mg por lesión (en dilución de 10mg/ml), hasta 3 veces en semana y en ciclos de hasta 12 semanas, según respuesta. El efecto secundario más frecuente descrito es el dolor a la inyección17,21,35–39. Destaca por su número de pacientes un estudio recientemente publicado del Grupo Español de Linfomas Cutáneos, en el que se recopilan de manera retrospectiva los resultados de varios hospitales en el tratamiento de linfomas cutáneos B indolentes con rituximab intralesional40. Se recopilaron un total de 35 pacientes, 17 con LZM y 18 con LF con una media de 2 lesiones tratadas por paciente. La mayoría fueron tratados con 3 inyecciones semanales una semana de cada mes. Se obtuvo una tasa de respuesta completa del 74%, ligeramente inferior a los estudios anteriores3, y una mediana libre de enfermedad de 114 semanas. Se detectaron efectos secundarios en el 54% de los pacientes, siendo el más frecuente el dolor a la inyección. En un pequeño número de pacientes aparecía febrícula en las 6-12h siguientes a la inyección, transitoria y más frecuente en las primeras inyecciones. Algunos de los hallazgos más importantes de este trabajo es que no se encuentran aparentes factores predictores de respuesta ni diferencias en las respuestas del LZM y del LF, en contraposición a cuando se usa por vía sistémica.
Linfoma cutáneo difuso de células grandes tipo piernas tratado con rituximab en monoterapia
| Autor/año | Número de pacientes | Número de infusiones | Respuesta | Duración de la respuesta (meses) | Comentarios |
| Heinzerling 200013 | 5 | 4 | 1 RC/2 RP/2 PE | 6-13 | No efectos secundarios importantes |
| Sabroe 200042 | 1 | 4 | RP | 3 meses | Repiten el ciclo, pero recaída a las 3 semanas |
| Aboulafia 200143 | 1 | 4 | RC | NE | No efectos secundarios (evitan RT y poliQT) |
| Garbea 200244 | 1 | 7 | PE | 0 meses | Efectos adversos: fiebre, herpes zóster |
| Bonnekoh 200245 | 1 | 8 | RC | 8 meses | No efectos secundarios (evitan RT y poliQT) |
| Viguier 200246 | 1 | 4 | RC | 15 meses | Recaída, tratan con CHOP-R |
| Zinzani 200347 | 1 | 4 | RC | 8 meses | No efectos secundarios |
| Brogan 200348 | 3 | 4 | 1 RC/2 PE | 6 meses | Combinan con RT |
| Gellrich 200518 | 1 | 8 | PE | 0 meses | |
| Lacouture 200516 | 1 | 4 | RC | 17 meses | Recaída tras RT |
| Pedraz 200549 | 1 | 4 | RC | no especificada | |
| Fenot 201050 | 8 | 4 | 3 RC/3 RP/3 PE | 26-28 meses | 5 pacientes retratados con CHOP-R |
Fuente: Lacouture et al.16; Gellrich et al.18; Heinzerling et al.35; Sabroe et al.42; Aboulafia43; Garbea et al.44; Bonnekoh et al.45; Viguier et al.46; Zinzani et al.47; Brogan et al.48; Pedraz et al.49; y Fenot et al.50
EE: enfermedad estable; NE: no especifica; PE: progresión de la enfermedad; QT: quimioterapia; RC: respuesta completa; RP: respuesta parcial; RT: radioterapia.
De todos estos estudios podemos concluir que el uso intralesional de rituximab comienza a generalizarse por su comodidad, necesidad de menos dosis y menos efectos secundarios en casos seleccionados de pacientes con LCCB de bajo grado.
Linfoma primario cutáneo B de células grandes tipo piernasEl LCGTP es un LCCB más infrecuente que los 2 anteriores. Representa aproximadamente un 1-3% de todos los linfomas primarios cutáneos y a diferencia del LF y del LZM cutáneos tiene un curso más agresivo, con frecuente diseminación extracutánea y recurrencias tras el tratamiento. El pronóstico es intermedio con una tasa de supervivencia a los 5 años del 50% aproximadamente3. Se han descrito como factores de mal pronóstico en los linfomas cutáneos de células grandes el inicio a edades añosas, la ulceración y la tinción positiva para MUM-1 y bcl-2, así como de buen pronóstico la expresión de bcl-641. Sin embargo, esto puede ser controvertido, ya que al describir estos factores en los linfomas cutáneos de células grandes incluyen algunas formas de LF, que es típicamente bcl-6 positivo y de mejor pronóstico. Por el contrario, el LCGTP es típicamente MUM-1 positivo y de peor pronóstico, por lo que puede que la expresión de una u otra proteína no sea un factor pronóstico en sí, sino derivada del diagnóstico de 2 linfomas distintos con diferente pronóstico.
Las guías de manejo de los LCCB de la EORTC recomiendan el tratamiento del LCGTP con poliquimioterapia con o sin rituximab (regímenes CHOP-like o R-CHOP). En el caso de formas localizadas el tratamiento recomendado es la RT con buenas tasas de respuesta3. Existen 25 casos en la literatura de LCGTP tratados con rituximab en monoterapia (se resumen en la tabla 6)13,16,42–50. Se utilizaron regímenes de 4 a 8 infusiones con o sin combinación con RT local en los tumores. La tasa de respuesta completa de los casos publicados es de un 48%, pero esa respuesta solo se mantiene más de 6 meses en 4 de los pacientes, lo que supone un 18%, por lo tanto las recaídas tras el tratamiento son frecuentes (82%). En todos los casos el tratamiento fue bien tolerado, sin efectos secundarios importantes.
El papel del rituximab en monoterapia en el LCGTP no está bien definido, los datos de la literatura sugieren que produce una marcada respuesta inicial, pero con recaídas frecuentes y progresión de la enfermedad.
El tratamiento recomendado con poliquimioterapia CHOP o CHOP-like en el LCGTP obtiene tasas de respuesta completa del 81%, pero de nuevo las recaídas son del 54%3. Es por ello que algunos autores recomiendan el uso de rituximab intravenoso por ser menos agresivo y más adaptado a pacientes de edad avanzada16,43,45,49. A pesar de las recomendaciones de la WHO-EORTC algunos autores se plantean si tratamientos intensificados con mayor toxicidad realmente mejoran el pronóstico de estos pacientes. La mayoría sugiere la elección del tratamiento de forma individualizada, adaptado a la edad del paciente, y consideran la opción de rituximab intravenoso como tratamiento paliativo.
Otros procesos linfoproliferativos BExiste un caso de linfoma cutáneo intravascular de células B grandes tratado con CHOP-R con respuesta completa clínica e histológica mantenida durante 6 meses. Estos resultados parecen prometedores, ya que se trata de un linfoma muy agresivo, aunque muy infrecuente, por lo que establecer protocolos de tratamiento es muy difícil51.
Existe un caso publicado de pseudolinfoma B refractario a tratamientos habituales tratado con rituximab intralesional con buen resultado52.
ConclusionesRituximab es un anticuerpo anti-CD20 de uso creciente en el tratamiento de los LCCB. Presenta buenas tasas de respuesta en los linfomas B indolentes, el LF y el LZM, tanto intravenoso como intralesional, aunque con frecuentes recidivas. Su uso no es de primera elección, pero se debe considerar en pacientes con lesiones múltiples y/o recidivantes o lesiones en localizaciones visibles donde la radioterapia o la cirugía puedan dejar secuelas y cicatrices. Su uso intralesional se está generalizando en los últimos años con resultados similares a su uso intravenoso, pero con menores efectos secundarios y menor coste. La utilidad y protocolo del rituximab en otros linfomas cutáneos B aún no están aclarados y son necesarios más estudios. Es posible que en el futuro la determinación de predictores moleculares de respuesta, el desarrollo de nuevos ensayos clínicos, así como nuevas combinaciones con otros tratamientos u otros anticuerpos monoclonales ayude a determinar su papel como tratamiento en los LCCB.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.