Actualmente la microscopia confocal reflectante es la técnica diagnóstica no invasiva más prometedora para el estudio de estructuras cutáneas situadas entre la capa córnea y la dermis reticular superficial, obteniendo imágenes paralelas a la superficie cutánea en tiempo real y con una resolución microscópica similar a la observada en la histología convencional. Numerosos estudios han señalado las principales características confocales que se observan en distintas enfermedades cutáneas, tanto tumorales como inflamatorias, demostrando una buena correlación con ciertos patrones dermatoscópicos, así como con el examen histológico. Además, se han descrito algoritmos diagnósticos y patrones confocales que han demostrado unas altas tasas de sensibilidad y especificidad para el diagnóstico de tumores cutáneos de tipo melanoma y no melanoma. Las posibles aplicaciones presentes y futuras de esta tecnología son muy amplias, no solo como herramienta diagnóstica no invasiva, sino también para la evaluación de distintos procesos dinámicos como aquellos que ocurren tras la exposición de la piel a la radiación ultravioleta, o la respuesta de los tumores a terapias no invasivas como la terapia fotodinámica. Explicamos con detalle los hallazgos confocales característicos de los principales tumores cutáneos de tipo no melanoma y discutimos las posibles aplicaciones de esta novedosa técnica diagnóstica en la práctica diaria de la consulta dermatológica.
Reflectance confocal microscopy is currently the most promising noninvasive diagnostic tool for studying cutaneous structures between the stratum corneum and the superficial reticular dermis. This tool gives real-time images parallel to the skin surface; the microscopic resolution is similar to that of conventional histology. Numerous studies have identified the main confocal features of various inflammatory skin diseases and tumors, demonstrating the good correlation of these features with certain dermatoscopic patterns and histologic findings. Confocal patterns and diagnostic algorithms have been shown to have high sensitivity and specificity in melanoma and nonmelanoma skin cancer. Possible present and future applications of this noninvasive technology are wide ranging and reach beyond its use in noninvasive diagnosis. This tool can also be used, for example, to evaluate dynamic skin processes that occur after UV exposure or to assess tumor response to noninvasive treatments such as photodynamic therapy. We explain the characteristic confocal features found in the main nonmelanoma skin tumors and discuss possible applications for this novel diagnostic technique in routine dermatology practice.
La Dermatología está experimentando en los últimos años una auténtica revolución tecnológica, tanto desde el punto de vista del diagnóstico clínico como de la terapéutica en general. La tendencia actual a ser menos invasivos ha culminado en el desarrollo de distintas tecnologías de imagen1–7 e incluso en la aparición de nuevos fármacos que llegan a evitar en muchos casos la cirugía oncológica8–10.
El cáncer cutáneo no melanoma (CCNM) es el cáncer más frecuente en la población caucásica y su incidencia sigue aumentando11. El análisis histológico es el gold standard del diagnóstico oncológico cutáneo, pero presenta ciertas desventajas como la necesidad de realizar una pequeña extirpación de tejido para su posterior análisis ex vivo, el cual generalmente se realiza en diferido. Debido principalmente a estas limitaciones se han desarrollado nuevos métodos diagnósticos no invasivos que ofrecen un resultado in vivo, in situ, en tiempo real y sin dejar cicatriz. Una de las principales ventajas de estas tecnologías de imagen es la información dinámica cutánea que nos permite la realización de estudios longitudinales sobre distintos procesos cutáneos. Entre estas nuevas tecnologías se encuentran la resonancia magnética, la ultrasonografía de alta frecuencia, la tomografía óptica coherente y más recientemente la microscopia confocal reflectante (MCR)12,13.
De todas estas la MCR es la nueva técnica diagnóstica que ha demostrado mejor correlación con la histología en el diagnóstico de CCNM con altas tasas de sensibilidad y especificidad14–16.
Hasta la fecha se han descrito diferentes patrones confocales que permiten la identificación de distintos tumores cutáneos, diferenciándolos entre ellos y de la piel normal.
Microscopio confocal reflectante y patrones de piel normalActualmente, entre las nuevas tecnologías diagnósticas de imagen, la MCR es la que posee mayor número de estudios clínicos realizados y actualmente ofrece aplicaciones clínicas reales, principalmente en enfermedad cutánea tumoral. Entre las principales características del microscopio confocal se encuentran la obtención no invasiva de imágenes, pudiendo ser estas in vivo y en tiempo real con una resolución comparable a la histología convencional (hasta 1μm lateral y 3μm axial)13.
Técnicamente el microscopio confocal reflectante, al igual que cualquier sistema óptico, consiste en una fuente de luz, generalmente un diodo de baja potencia, un condensador, un objetivo, un diafragma y un detector. Se denomina «confocal» porque el plano tisular estudiado está conjugado con el punto de donde parte la fuente de luz y con el diafragma colocado delante del detector4. Las imágenes que obtiene el MCR en tiempo real son paralelas a la superficie cutánea y se forman a partir de la luz reflejada desde un plano concreto, de forma que la reflexión de la luz desde estructuras localizadas en planos anteriores y posteriores al plano enfocado es rechazada por el diafragma. El contraste de la imagen se produce por las diferencias en los índices de refracción de las distintas estructuras tisulares y celulares. La máxima refractilidad en la piel la ofrecen las estructuras que poseen melanina (melanosomas, melanocitos, melanófagos y queratinocitos pigmentados entre otras) seguidas de las estructuras con queratina, tales como la capa córnea, el infundíbulo, el tallo piloso, etc. La mínima refractilidad la ofrecen el núcleo, el aire y el suero17. Las estructuras microscópicas, cuyo tamaño es similar a la longitud de onda de la luz incidente, son aquellas que poseen mayor índice de reflexión (tabla 1). Hasta el momento, la máxima profundidad de estudio que alcanza la MCR es de aproximadamente 300μm13, aunque posiblemente en un futuro próximo sea mayor.
Escala de refractilidad de las estructuras cutáneas en el microscopio confocal reflectante (de mayor a menor)
| Melanina (máxima refractilidad): melanocitos, melanófagos, queratinocitos pigmentados |
| Estructuras con queratina: capa córnea, infundíbulo, tallo piloso |
| Células de Langerhans activadas |
| Queratinocitos de las capas granulosa y espinosa |
| Adipocitos |
| Colágeno |
| Células sanguíneas |
| Núcleos (refractilidad mínima) |
| Aire y suero (refractilidad nula) |
Antes de profundizar en las características confocales típicas de los distintos tumores cutáneos es necesario conocer los patrones que identifican las estructuras de la piel normal (tabla 2). De forma resumida, la epidermis está compuesta por 4 capas diferentes principalmente formadas por queratinocitos y 2 poblaciones de células dendríticas minoritarias: las células de Langerhans y los melanocitos. Estas capas pueden distinguirse en las imágenes confocales debido a las diferencias citológicas y arquitecturales características de cada una de ellas y a la profundidad donde están localizadas17. Generalmente, la obtención de imágenes confocales comienza en la superficie y progresa en profundidad. Por lo tanto, la primera imagen que se visualiza es la capa córnea debido a la diferencia entre su índice de refracción y el del medio de inmersión aplicado en el anillo de contacto con la piel, generalmente agua. Esta capa aparece como una superficie de refractilidad variable compuesta por unas células poligonales, planas y anucleadas cuyo tamaño oscila entre las 30 y 40μm. El grosor total de la capa córnea depende del área topográfica, de la exposición solar y del fototipo cutáneo, factores que también influyen directamente en la profundidad de los dermatoglifos, los cuales se observan como unos surcos oscuros que separan los corneocitos en islotes.
Hallazgos confocales en la piel normal
| Estructuras poligonales de 30-40μm, planas, anucleadas, refráctiles en la capa córnea (corneocitos) |
| Valles oscuros lineales separando grupos de corneocitos (dermatoglifos) |
| Patrón en «panal de abejas» homogéneo en estratos granuloso y espinoso (queratinocitos) |
| Patrón en «empedrado» en la capa basal (fototipos altos) |
| «Anillos papilares» brillantes en capa basal circundante a las papilas dérmicas (fototipos altos) |
| Estructuras fasciculares refráctiles en la dermis (colágeno) |
| Espacios redondos oscuros en la dermis (vasos) y pequeñas estructuras refráctiles en movimiento en su interior (células sanguíneas) |
La siguiente capa es la granulosa, la cual se observa con una distribución regular a una profundidad de aproximadamente 20μm y con un grosor de 3 a 10 células, dependiendo de la localización de la piel. Los queratinocitos de esta capa presentan un tamaño aproximado de 25μm, y su núcleo aparece como una estructura oscura ovalada central rodeada de un citoplasma de apariencia granular debido a la presencia de múltiples estructuras refráctiles de 0,1 a 1,0μm, que corresponden a los gránulos de queratohialina. Los bordes de los granulocitos están bien demarcados y constituyen un característico patrón confocal denominado en «panal de abejas».
La capa espinosa, localizada a unas 30-100μm bajo el estrato córneo, está formada por queratinocitos poligonales con un tamaño aproximado de 15μm que se aplanan progresivamente hacia la superficie. El grosor de esta capa oscila de 5 a 10 células, las cuales presentan una zona oscura y ovalada en el centro, que corresponde al núcleo, y unos bordes celulares muy bien demarcados que constituyen junto con la capa granulosa el típico patrón en «panal de abejas».
La unión dermoepidérmica, localizada a 50-100μm de profundidad, contiene la capa basal formada por una sola fila de células cuboidales y algunos melanocitos dispersos con forma redondeada o dendrítica. Las células basales son más pequeñas que el resto de queratinocitos pertenecientes a las otras capas de la epidermis, presentando un diámetro aproximado de 10μm, y son más refráctiles debido al alto contenido en melanina, aunque esto último depende del fototipo de piel en estudio. La melanina en los queratinocitos basales está situada de forma característica sobre el núcleo, donde ejerce su función protectora. La refractilidad de la capa basal varía en función del fototipo de piel y la localización anatómica. En una piel con fototipo claro los queratinocitos basales presentan poco brillo y son difíciles de visualizar, mientras que en los fototipos más oscuros muestran un patrón característico denominado en «empedrado», formado por células redondeadas muy brillantes debido a la melanina localizada a nivel supranuclear. En las regiones anatómicas donde existen crestas interpapilares estas células altamente refráctiles se observan formando círculos alrededor de unas zonas oscuras que corresponden a las papilas dérmicas, dando lugar a otro patrón confocal característico denominado «anillo papilar». Debajo de este nivel, en el interior de las papilas dérmicas, se pueden apreciar fascículos de colágeno de refractilidad variable, así como estructuras redondeadas refráctiles con centro oscuro que corresponden a los capilares sanguíneos y en cuyo interior, durante la toma de imágenes, puede observarse en tiempo real las células sanguíneas en movimiento.
Patrones y características confocales del carcinoma basocelularEl carcinoma basocelular (CBC) es el cáncer cutáneo más frecuente, afectando principalmente a adultos con fototipo claro. Entre los factores patogénicos más importantes se encuentra la exposición a radiación ultravioleta, ciertas alteraciones genéticas y situaciones de compromiso inmunológico. La presentación clínica del CBC es variable y está relacionada con el principal subtipo histológico: superficial, nodular o morfeiforme18. Es un tumor de crecimiento lento y la incidencia de metástasis es muy baja. Posiblemente debido a su alta incidencia (80% de los tumores cutáneos no melanoma) el CBC es una de las malignidades cutáneas que ha sido más exhaustivamente analizada con el microscopio confocal19–22. Varios estudios han descrito las principales características confocales del CBC, y un largo estudio multicéntrico desarrollado en 2004 por Nori et al. ha demostrado una alta tasa de sensibilidad y especificidad para determinados parámetros de MCR14.
Se estudiaron 152 lesiones con MCR y posteriormente realizaron la correlación histológica. Se describieron 5 criterios mayores diagnósticos de CBC: presencia de núcleos elongados homogéneos, polarización de los núcleos a lo largo del mismo eje de orientación, infiltrado inflamatorio prominente, aumento de la vasculatura dérmica y pleomorfismo de la epidermis suprayacente. Estos criterios mostraron una sensibilidad del 100% para 2 o más criterios y una especificidad del 95,7% y sensibilidad del 82,9% con la coexistencia de 4 o más criterios. Estos resultados mostraron poca variabilidad entre los distintos examinadores y subtipos de CBC.
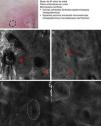
Existen unos patrones confocales comunes a los distintos subtipos de CBC que permiten realizar el diagnóstico de CBC de forma relativamente sencilla, al igual que ocurre con el examen histológico (tabla 3). El principal patrón de MCR que define al CBC se trata de la presencia de unas estructuras densas formadas por una población homogénea de células tumorales cuyos núcleos son elongados y están orientados a lo largo del mismo eje común, fenómeno denominado «polarización nuclear» (fig. 1A)19. Este fenómeno, cuando se observa alrededor de una lobulación o islote tumoral, se denomina «empalizada periférica», ya que las células elongadas se sitúan de forma perpendicular al borde del tumor. Con relativa frecuencia, alrededor de los agregados tumorales se visualiza un área oscura debido probablemente a los depósitos de mucina y que se corresponde en la histología tradicional con el característico clefting o «separación» de los islotes tumorales del estroma (fig. 1B y D). Algunos de nosotros (MU, SG) y otros colaboradores estudiaron 13 casos de CBC, incluyendo los 3 subtipos histológicos principales, y encontramos una buena correlación lineal entre las áreas oscuras del MCR y el grosor de la mucina peritumoral22. En ocasiones la refractilidad del estroma es superior a la de los islotes tumorales, los cuales se observan más oscuros de lo habitual (hiporrefráctiles) recibiendo la denominación de «siluetas oscuras» (fig. 2B y C). Este fenómeno fue descrito por primera vez por H. Ravinobitz (Universidad de Miami, EE. UU.) y recientemente ha sido detallado17. Otro patrón confocal característico del CBC se refiere a la desorganización existente en las capas epidérmicas situadas justo encima del tumor. Es frecuente que el patrón típico en «panal de abejas» esté alterado y en su lugar se observen queratinocitos irregulares, probablemente debido al daño actínico crónico que suele existir en los pacientes que desarrollan carcinomas basocelulares. El estroma que rodea los nidos tumorales puede aparecer relativamente refráctil debido a las fibras y haces de colágeno (figs. 1C y 2B yC). La alteración del flujo sanguíneo característica del CBC, debida probablemente a la angiogénesis tumoral y descrita como una elongación de los capilares sanguíneos con un aumento de su número y diámetro, se observa en MCR como numerosos espacios oscuros, redondeados o lineales confluyentes (arboriformes) en cuyo interior se aprecian células con distinta refractilidad en movimiento (fig. 1B), proceso denominado «tráfico leucocitario»23. Además, se pueden visualizar pequeñas estructuras refráctiles en la dermis que se corresponden con células inflamatorias. Las características confocales principales del CBC pigmentado son similares a las del CBC no pigmentado, pero presentan además abundantes estructuras brillantes de distinta morfología debido al contenido en melanina. En el interior de los islotes tumorales se observan estructuras amorfas y particuladas muy brillantes, así como estructuras dendríticas que parecen corresponderse con cúmulos de melanina y melanocitos respectivamente24.
Patrones confocales característicos de carcinoma basocelular
| Elongación de los núcleos |
| Polarización: elongación celular en la misma dirección |
| Empalizada: polarización celular perpendicular al borde del islote tumoral |
| «Clefting»: espacio oscuro separando los nidos tumorales del estroma |
| Patrón en panal de abejas alterado en la epidermis suprayacente al tumor |
| Espacios oscuros redondeados y lineales con abundantes estructuras refráctiles rodando en su interior en la dermis papilar (vasos dilatados y arboriformes) |
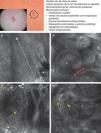
Presentación clínica y dermoscópica del carcinoma basocelular pigmentado. A. Imagen de microscopia confocal reflectante (MCR) (0,5×0,5mm) tomada de una profundidad de aproximadamente 30μm bajo la superficie cutánea. Se observa una elongación de los núcleos en el mismo eje («polarización nuclear», línea). B. Imagen (MCR 0,5×0,5mm) en la que se aprecian islotes tumorales con «empalizada periférica» característica (astericos) y despegamiento del estroma (e). C y D. Asimismo, en su vecindad se aprecian vasos dilatados (flechas) y en su interior melanocitos dendríticos brillantes. Imágenes MCR 0,5×0,5mm que revelan la presencia de tumor (asterisco) con dendritas intratumorales (flecha amarilla). En el interior del estroma (e) se observan agregados de melanófagos (flechas blancas).
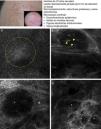
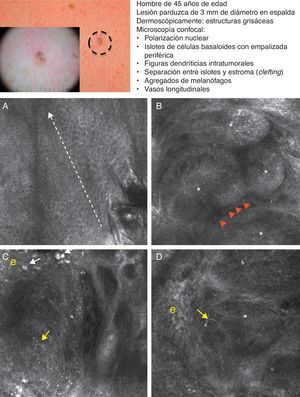
Presentación clínica y dermoscópica del carcinoma basocelular. A. Imagen (0,5×0,5mm) de la zona inferior de la epidermis presentando ensombrecimiento epidérmico (círculo discontinuo). B. Imagen (0,5×0,5mm) de la dermis donde se aprecian los islotes tumorales no refráctiles en patrón denominado dark silhouette. En su interior destaca la presencia de células dendríticas (cabezas de flecha) que parece corresponder a melanocitos intratumorales. C. Imagen (MCR 0,5×0,5mm) en la dermis donde se aprecia islote tumoral (asterisco) no refráctil en patrón denominado dark silhouette rodeado por estroma refráctil (e). En su interior destaca la presencia de un particulado refráctil, posiblemente melanina. D. Imagen (MCR 0,5×0,5mm) en la dermis profunda donde se aprecian islotes tumorales (asterisco) no refráctiles de menor tamaño.
En el estroma se aprecian principalmente estructuras brillantes grandes y mal definidas que corresponden a melanófagos y otras más pequeñas que se corresponden con melanina (fig. 1C).
Recientemente Guitera et al. han publicado un extenso estudio prospectivo de 710 lesiones equívocas consecutivas que incluyeron 216 melanomas, 266 nevus y 119 CBC, 67 máculas pigmentadas faciales y 42 lesiones clasificadas como otros tumores cutáneos. Mediante un análisis multivariante, realizado en el 50% de las lesiones elegidas al azar, han identificado 8 factores independientes significativos para el diagnóstico de CBC, con un 97,1% de sensibilidad y un 93,4% de especificidad16. Cinco de los factores definidos son positivos: estructuras elongadas polarizadas en la capa superficial, telangiectasias lineales horizontales, nidos compactos de células hiporrefráctiles, empalizada periférica y un nuevo concepto denominado «ensombramiento epidérmico» o epidermal shadowing (fig. 2A) definido como amplias áreas apagadas y desestructuradas de la epidermis debido al clefting paralelo a la superficie cutánea de los nidos tumorales subyacentes. Los 3 factores negativos son: patrón en «panal de abejas atípico», papilas «no visibles» y nidos cerebriformes.
Patrones y características confocales de neoplasia epidermoide o escamosaQueratosis actínicaLa queratosis actínica (QA) representa uno de los tumores cutáneos más frecuentes y está formada por una proliferación de queratinocitos atípicos limitada a la epidermis. Se han definido 3 grados de QA en función de la extensión de la atipia25. Se han descrito distintos factores de riesgo asociados a la QA, siendo los principales el fototipo cutáneo claro, la exposición intermitente o prolongada a la radiación ultravioleta, la predisposición genética y la inmunosupresión. Se ha relacionado la QA con la «cancerización de campo», concepto que sugiere que la zona anatómica completa con daño actínico muestra similares cambios histológicos antes de que estos sean clínicamente visibles26–28. Aunque el análisis anatomopatológico es el gold standard para el diagnóstico de QA, lo cierto es que en la mayoría de los casos el diagnóstico es estrictamente clínico y se realiza bajo inspección visual y táctil. En el estudio confocal de la QA se observan ciertas características que facilitan un diagnóstico no invasivo29 (tabla 4). En la capa córnea los queratinocitos aparecen despegados unos de otros, lo cual se observa como la presencia de unas estructuras poligonales altamente refráctiles, mientras que la retención nuclear, fénomeno que se corresponde en histología con paraqueratosis, se visualiza como unas estructuras oscuras redondeadas situadas en el centro de los corneocitos. La alteración arquitectural y el pleomorfismo celular se aprecia en MCR como pérdida del patrón regular característico en «panal de abejas», también llamado patrón en «panal de abejas atípico», y la presencia de células con núcleos oscuros de formas y tamaños irregulares. En las imágenes confocales de la dermis superficial se pueden observar distintos grados de elastosis solar, la cual se reconoce como fibras de colágeno agrupadas y reticuladas con una refractilidad moderada-alta, así como la presencia de vasos sanguíneos pequeños redondeados y ligeramente elongados30,31.
Hallazgos en microscopia confocal reflectante de la queratosis actínica
| Abundantes estructuras poligonales brillantes independientes con espacios oscuros en su interior en la capa córnea (hiperqueratosis paraqueratósica) |
| Patrón en «panal de abejas atípico» en epidermis |
| Patrón reticulado irregular característico en la dermis (elastosis solar) |
La enfermedad de Bowen (EB) es un tipo de carcinoma de células escamosas in situ, caracterizado histológicamente por una proliferación de queratinocitos atípicos y pleomórficos que afecta a toda la epidermis. Son muy frecuentes la disqueratosis, las mitosis y las células multinucleadas32. Clínicamente la EB puede prestarse a confusión con otros tumores de piel de tipo no melanoma y con ciertas dermatosis inflamatorias como el eccema o la psoriasis33. Ulrich et al. han publicado recientemente un estudio en el que se analizaron los distintos criterios confocales hallados en 10 lesiones de EB y su correlación con el examen histológico rutinario correspondiente34. Los hallazgos confocales más prevalentes encontrados fueron la disrupción de la capa córnea, el patrón epidérmico en «panal de abejas atípico» con mayor grado de displasia arquitectural y citológica que el observado en la QA, la presencia de 2 tipos de células targetoides características y una vascularización característica con vasos en forma de «S» en el centro de las papilas dérmicas. El primer tipo de células targetoides se trata de células grandes con un centro oscuro, un borde brillante y un halo periférico oscuro, mientras que el segundo tipo son células grandes con centro brillante y halo oscuro. Estas células targetoides parecen corresponderse con distintos estados de la disqueratosis que se observa en la histología tradicional. Otros parámetros observados fueron la paraqueratosis, la presencia de células multinucleadas y la elastosis solar (tabla 5)
Características confocales de la enfermedad de Bowen
| Disrupción de la capa córnea |
| Patrón en «panal de abejas atípico» en la epidermis |
| Células targetoides características, grandes y con halo periférico oscuro en la epidermis (células disqueratósicas) |
| Espacios oscuros circulares en el centro de los anillos papilares (vasos sanguíneos característicos en forma de «S») |
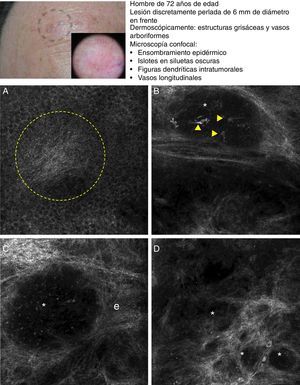
El carcinoma de células escamosas (CCE) es un frecuente tumor cutáneo que deriva de los queratinocitos epidérmicos. La presentación clínica clásica consiste en una placa roja y escamosa que presenta o no ulceración, por lo que puede llegar a ser difícil de distinguir de otros trastornos cutáneos35. Teniendo en cuenta su capacidad metastásica es muy importante el diagnóstico precoz de esta enfermedad, para el cual nos podemos ayudar de la dermatoscopia y la MCR. Histológicamente, el CCE está formado por queratinocitos irregulares con numerosos núcleos pleomórficos y abundante citoplasma eosinofílico, así como disqueratosis y paraqueratosis en la capa córnea36. Tanto la dermatoscopia como la MCR presentan una limitación diagnóstica en este carcinoma debido a la superficie costrosa que le suele acompañar. En el caso del examen con microscopio confocal suele ser necesario retirar la costra antes de realizar el estudio completo de la lesión. Rishpon et al. publicaron en 2009 un trabajo sobre las características confocales observadas en 38 lesiones compatibles con CCE confirmadas con histología posteriormente37. Se definieron como rasgos típicos de CCE la presencia de un patrón epidérmico en «panal de abejas atípico» o patrón desarraigado (fig. 3B y C), la visualización de grandes células redondeadas con atipia nuclear en las capas espinosa y granulosa (fig. 3B y C), así como vasos sanguíneos redondeados atravesando las papilas dérmicas (fig. 3D)37. En la capa córnea se suelen observar unas estructuras brillantes amorfas que corresponde a la presencia de costras en la superficie tumoral, además de células poligonales nucleadas delimitadas por un borde brillante rodeando el núcleo oscuro (paraqueratosis) (fig. 3A). Cuando la hiperqueratosis y acantosis lo permiten puede observarse en la dermis el aumento de vasculatura y la elastosis solar, así como los islotes tumorales en los casos de CCE invasivo38 (tabla 6).
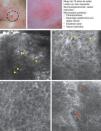
Presentación clínica y dermoscópica del carcinoma de células escamosas in situ. A. Imagen (0,5×0,5mm) del estrato córneo evidenciado numerosas células poliédricas altamente brillantes (cabeza de flechas). B. Imagen (0,5×0,5mm) del estrato granuloso presentando un patrón en panal atípico con desarraigo arquitectural y células atípicas (flechas). C. Imagen (0,5×0,5mm) del estrato espinoso presentando desarraigo arquitectural importante. D. Imagen (0,5×0,5mm) de la dermis revelando elastosis solar(es) y vasos redondos (cabezas de flecha).
Hallazgos confocales típicos del carcinoma de células escamosas
| Estructuras brillantes amorfas (costra) y células poligonales con centro oscuro y borde brillante (células paraqueratósicas) en la capa córnea |
| Patrón epidérmico en «panal de abejas atípico» |
| Células grandes nucleadas en distintas capas epidérmicas |
| Estructuras redondeadas oscuras en la dermis papilar (vasos sanguíneos) |
| Estructuras fasciculares refráctiles con reticulado característico en la dermis (elastosis solar) |
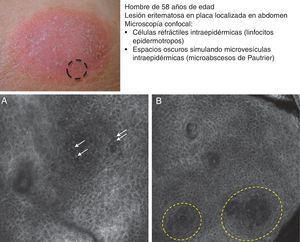
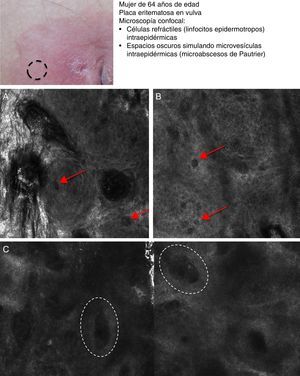
La micosis fungoide (MF) representa el linfoma cutáneo de células T (LCCT) más frecuente. La clasificación de los linfomas generalmente se basa en los resultados de distintos análisis como la histología, la genética molecular y la realización de inmunofenotipos39. El diagnóstico diferencial es complicado y amplio, incluyendo numerosas enfermedades eccematosas tan frecuentes como la psoriasis o el eccema crónico. Los parámetros histológicos hallados en la MF han sido estudiados en profundidad y se ha demostrado que solo determinadas características pueden establecer el diagnóstico diferencial de MF40. La presencia de linfocitos con halo a su alrededor o la combinación de distintos criterios como el epidermotropismo, el infiltrado inflamatorio en placa a lo largo de la unión dermoepidérmica (UDE) y la presencia de fibrosis en las papilas dérmicas se han definido como los principales rasgos histológicos necesarios para establecer el diagnóstico precoz de MF. Los microabcesos de Pautrier, considerados como hallazgos específicos de la MF, solo están presentes en una minoría de casos y mayoritariamente en lesiones avanzadas de MF en estadio en placa. En la práctica clínica es frecuente la realización de numerosos exámenes clínicos e histológicos antes de alcanzar el diagnóstico de MF, en ocasiones llegando a retrasarse el inicio del tratamiento apropiado años o incluso décadas. Además, se ha demostrado que en 2 o más biopsias realizadas en lesiones diferentes de MF del mismo paciente, llevadas a cabo el mismo día, con frecuencia presentan características histopatológicas diferentes41. Por este motivo, es fundamental la selección de la lesión más adecuada de MF donde realizar la biopsia para que sea definitivamente diagnóstica. La MCR nos sirve en este caso para reducir el número de falsos negativos en la histología, ya que nos ayuda a seleccionar el mejor lugar para realizar la biopsia. Agero et al. describieron por primera vez las características confocales de la MF y concluyeron que el microscopio confocal es una herramienta útil para seleccionar el área más apropiada de biopsia. Los principales rasgos de MCR hallados en lesiones de LCCT son: presencia de células pequeñas ligeramente refráctiles en la epidermis (linfocitos epidermotropos) (fig. 4A), anillos papilares hiporrefráctiles debido a la presencia de linfocitos atípicos en la UDE, espacios oscuros de tipo microvesículas en el interior de la epidermis (principalmente en el estadio en placa) que corresponden a los microabscesos de Pautrier (fig. 4B) y la existencia de vasos sanguíneos dilatados con paredes engrosadas (tabla 7). Los espacios microvesiculares se distinguen de aquellos observados en el eccema agudo debido a la ausencia de espongiosis y paraqueratosis, además de la presencia de otras características sugestivas de MF como los anillos papilares hiporrefráctiles22,42. Lange-Asschenfeldt et al. han publicado recientemente un estudio de MCR sobre 39 lesiones en 15 pacientes con diagnóstico histológico previo confirmado de MF, parapsoriasis, síndrome de Sezary o papulosis linfomatoide donde han revisado los parámetros confocales definidos para el LCCT y, además, han demostrando una alta concordancia interinvestigador43.
Presentación clínica de lesión de micosis fungoides tipo placa. A. Imagen (0,5×0,5mm) del estrato espinoso superficial revelando disrupción y presencia de células brillantes (epidermotropismo, flechas blancas) entre los queratinocitos. B. Imagen (0,5×0,5mm) del estrato espinoso revelando pequeños espacios oscuros que se corresponden con microabscesos de Pautrier (círculo discontinuo). En su interior se observan células intensamente refráctiles que se corresponden con linfocitos atípicos.
Rasgos confocales característicos de la micosis fungoide
| Pequeñas estructuras refráctiles en el interior de la epidermis (linfocitos epidermotropos) |
| Espacios oscuros intraepidérmicos (microabscesos de Pautrier) en estadio en placa |
| Anillos papilares hiporrefráctiles |
| Estructuras oscuras redondeadas y lineales con bordes hiperrefráctiles en la dermis (vasos sanguíneos dilatados con paredes engrosadas) |
Tanto la enfermedad de Paget mamaria (EPM) como la extramamaria (EPEM) son adenocarcinomas intraepidérmicos poco frecuentes que comparten la mayor parte de sus características clínicas e histológicas imitando distintas enfermedades cutáneas inflamatorias e infecciosas. El origen de ambas enfermedades es controvertido, principalmente en la EPEM44. La hipótesis más aceptada sobre la EPM es que consiste en la extensión epidérmica de un carcinoma ductal invasivo del tejido mamario subyacente, ya que en la mayoría de los casos ambas enfermedades aparecen de forma asociada. Sin embargo, en la EPEM el porcentaje de casos asociados a una neoplasia interna es mucho menor (9-32% de los casos), y actualmente se considera un tumor primario intraepidérmico cuyas células pueden originarse tanto en los ductos de las glándulas apocrinas como en determinadas células madre queratinocíticas pluripotenciales (células de Toker). El perfil inmunohistoquímico de las células de la enfermedad de Paget (EP) está bien caracterizado e indica claramente la diferenciación glandular, y aunque demuestra grandes similitudes entre la EPM y la EPEM existen ciertas diferencias sutiles que pueden reflejar el distinto origen de ambas enfermedades44.
La EPM afecta de forma exclusiva al pezón y/o areola. Clínicamente se presenta como una placa eritematoescamosa unilateral de crecimiento lento y bordes irregulares bien definidos, que con frecuencia produce picor o sensación de quemazón. El diagnóstico de la EPM puede llegar a ser un verdadero reto, ya que clínicamente puede simular otras enfermedades inflamatorias o infecciosas frecuentes como la dermatitis eccematosa del pezón. Por este motivo es habitual el retraso en el diagnóstico y, por lo tanto, en el correcto manejo de la enfermedad.
La EPEM aparece con mayor frecuencia en la región anogenital y otras regiones ricas en glándulas apocrinas, como la axila y el pabellón auricular, siendo el síntoma más frecuente de presentación clínica el prurito intenso. Las lesiones clínicas son similares a las de la EPM y en ocasiones muestran hiper o hipopigmentación45.
La EP tiene por naturaleza un carácter multicéntrico, por lo que suele ser necesaria la realización de varias biopsias para mapear los límites de la lesión antes de iniciar el tratamiento, que generalmente es quirúrgico y requiere amplios márgenes de resección.
Los hallazgos histológicos son similares en la EPM y la EPEM46. Las células de Paget son grandes y presentan un citoplasma claro y finamente granular y un núcleo central amplio. La atipia y el pleomorfismo que muestran son intensos, siendo de disposición aislada o en pequeños nidos infiltrando las distintas capas de la epidermis. Este patrón histológico característico de infiltración epidérmica se ha denominado «extensión pagetoide» para indicar cualquier condición donde las células se distribuyen de esa forma en el interior de un epitelio. Otras situaciones patológicas donde puede observarse este patrón, y con las que es necesario hacer diagnóstico diferencial son: melanoma de extensión superficial, enfermedad de Bowen, micosis fungoide, histiocitosis de células de Langerhans y el nevus de Spitz44,47.
Debido probablemente a que la MCR ha demostrado ser una excelente herramienta para la identificación de la extensión pagetoide del lentigo maligno melanoma y del melanoma de extensión superficial48 se han descrito los principales hallazgos confocales de la EP. Longo et al. publicaron en 2007 un caso de EPM pigmentada donde el estudio con MCR fue sugestivo de melanoma debido a la infiltración pagetoide de unas células grandes, redondas y atípicas con citoplasma brillante y núcleo oscuro, así como la existencia de numerosas células grandes con largas dendritas situadas en la capa córnea y anillos papilares mal definidos49. Recientemente Guitera et al. han publicado un artículo con 9 casos de EPEP y un caso de EPM50. En todos ellos observaron la infiltración pagetoide de células grandes aisladas o formando pequeños nidos, característica de esta enfermedad. En la capa granulosa las células de Paget se visualizaban oscuras o hiporrefráctiles. En 4 casos las células se observaban brillantes rodeadas de un halo oscuro, en forma de diana. Este halo oscuro puede corresponderse con el clefting o «despegamiento» de las células de Paget respecto a la epidermis que las rodea que se observa en histología y que podría ser debido a mucina segregada por las células de Paget o a fluido intercelular (fig. 5A y B). Aunque la mucina se presenta hiporrefráctil en el microscopio confocal, las células de Paget con frecuencia se observan hiperrefráctiles, probablemente debido a la reflexión de la luz que producen los gránulos secretores, así como al prominente aparato de Golgi y los numerosos ribosomas libres que contienen estas células. La epidermis se muestra en muchos casos alterada mostrando un patrón en «panal de abejas atípico o desordenado». Generalmente, los vasos sanguíneos son numerosos, pequeños y orientados verticalmente, característica habitual en la piel de la región anogenital. Teniendo en cuenta que la EP con frecuencia tiene una presentación clínica inespecífica simulando distintos procesos inflamatorios, alérgicos o infecciosos, el uso de la MCR puede facilitar su diagnóstico de forma precoz y por lo tanto adelantar en el tiempo el correcto manejo de esta enfermedad51. Por otro lado, el microscopio confocal puede ser útil en la selección del lugar más apropiado para realizar una biopsia, así como en la delimitación de los márgenes previos al tratamiento52 (tabla 8).
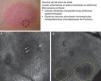
Presentación clínica de lesión de enfermedad de Paget extramamaria. A. Imagen (0,5×0,5mm) superficial (estrato córneo/estrato granuloso) donde se aprecia la «infiltración pagetoide» por unas células de baja refractilidad, oscuras (flechas). B. Imagen (0,5×0,5mm) del estrato espinoso que revela la infiltración de células pagetoides (flechas) de gran tamaño que duplica o triplica los queratinocitos circundantes y que altera la arquitectura normal en «panal de abejas». C. Submosaico (1×0,5mm) en la unión dermoepidérmica que demuestra borramiento de los anillos (círculos discontinuos) en cuyo interior se observa infiltrado inflamatorio.
Hallazgos confocales en la enfermedad de Paget
| Infiltración pagetoide de la epidermis por células grandes (2 veces más grandes que los queratinocitos normales) oscuras de forma individual o en pequeños grupos |
| Patrón en panal de abejas alterado a veces reemplazado por nidos celulares |
| En ocasiones estructuras celulares o nidos «en diana» con centro brillante y halo oscuro |
La MCR representa el principio de una nueva era para la Dermatología, principalmente en el ámbito de la enfermedad oncológica. Esta nueva tecnología presenta grandes ventajas diagnósticas frente a la histología tradicional, considerada el gold standard del diagnóstico cutáneo, como son el estudio in vivo, in situ y su carácter no invasivo, es decir, sin necesidad de realizar ninguna intervención previa y obteniendo el resultado de forma inmediata. Una vez que el patólogo o dermatólogo se acostumbra a la visualización de imágenes horizontales de la piel en una escala de grises, y realiza un entrenamiento adecuado sobre los distintos patrones, así como las principales características y hallazgos confocales, es posible realizar un diagnóstico diferencial sobre ciertas lesiones equívocas con altas tasas de sensibilidad y especificidad. Entre las aplicaciones de la MCR en la práctica clínica se encuentran la determinación de los márgenes quirúrgicos previo a cirugía en lesiones con márgenes clínicos pobremente definidos, donde el tratamiento ideal es la escisión de los mismos con márgenes libres verificados histológicamente, tal es el caso de ciertos tipos histológicos de carcinomas basocelulares en la cara, y algunos melanomas con márgenes mal definidos localizados en la cara y en el cuero cabelludo, como el lentigo maligno/lentigo maligno melanoma, melanoma amelanótico, etc.53,54. La detección precoz de tumor residual55 o la distinción entre cicatriz y tumor residual pueden ser otra aplicación de esta tecnología en oncología cutánea.
Por otro lado, el uso creciente de terapias no invasivas para el cáncer cutáneo no melanoma ha provocado un mayor interés de la aplicación de la MCR en la monitorización microscópica de la respuesta tumoral a estas modalidades terapéuticas, como el tratamiento tópico con imiquimod, la terapia fotodinámica o la crioterapia56–58. Estas aplicaciones son, hoy día, una realidad; así se han desarrollado versiones del equipo que permiten una mayor velocidad de obtención de imágenes y poseen una pieza de mano más pequeña y manejable para localizaciones complicadas como la nariz o el pabellón auricular (Vivascope 3000®, Lucid, Inc.,NY, USA). La MCR presenta un innegable interés para la cirugía cutánea oncológica gracias a su uso in vivo, tanto para delimitar los márgenes cutáneos previos a la cirugía, como para la selección del lugar idóneo antes de realizar una biopsia incisional. Además la posibilidad de utilizar del microscopio confocal ex vivo durante la cirugía micrográfica de Mohs ha abierto nuevas líneas de investigación con interesantes perspectivas. La utilidad del MCR en la enfermedad cutánea inflamatoria no se limita a su diagnóstico, sino que además parece que podría tener un papel importante en la predicción de su aparición o de respuesta a diversos tratamientos59. Las limitaciones de la MCR están fundamentalmente relacionadas con las propiedades ópticas de la piel, incluyendo la imposibilidad de valorar la dermis profunda y la atenuación de la luz por lesiones hiperqueratósicas. De hecho, en ocasiones es difícil diferenciar entre el carcinoma de células escamosas in situ e invasivo, debido a una inadecuada visualización de la unión dermoepidérmica. Otro desafío importante a tener en cuenta es la imposibilidad de diferenciar con precisión entre los distintos tipos de células cutáneas con morfología dendrítica, como melanocitos y células de Langerhans. En resumen, la MCR representa una valiosa herramienta, junto con el dermatoscopio, para realizar una mejor aproximación diagnóstica en la consulta del dermatólogo.
En 2008 se creó un grupo internacional de trabajo en MCR llamado International Confocal Working Group (ICG) formado por científicos, clínicos y expertos en telemedicina con el objetivo de promover la investigación y aplicación del MCR en Dermatología (www.skinconfocalmicroscopy.org). Actualmente está abierto un estudio multicéntrico de MCR en telemedicina mediante la plataforma denominada Vivanet en distintas ciudades de España, Francia e Italia, con el objetivo principal de desarrollar un procedimiento de telediagnóstico basado en MCR y dermatoscopia realizando una comparación entre la teleconsulta de tumores cutáneos con MCR vs dermatoscopia más MCR vs dermatoscopia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.