Los autores describen los factores peroxisome proliferator-activated receptors (PPAR) como conectores entre los mecanismos enzimáticos de la barrera epidérmica (BE) y las alteraciones inmuno/inflamatorias que caracterizan a dermatitis atópica (DA) y psoriasis. Igualmente, se describe una nueva conexión entre el metabolismo lipídico y la BE. El análisis de estos hechos permite sugerir que DA y psoriasis, aunque diferentes en su causalidad y clínica, exhiben al menos dos hechos patogénicos comunes, que se manifiestan por defectos en la expresión de PPAR-¿ y en la producción de IL-10 e IFN-γ. La capacidad de una formulación magistral de aceites de oliva (FMAO) para aumentar los niveles séricos de ambas citocinas, y regular el colesterol HDL sérico, en pacientes con alto riesgo inflamatorio/cardiovascular, junto a sus potentes efectos bactericidas y fungicidas, sugiere que estos sean algunos de los mecanismos responsables de los positivos efectos observados con la FMAO (oral y/o tópica) en pacientes con DA y psoriasis.
The authors describe peroxisome proliferator-activated receptor (PPAR) transcription factors as connectors between the enzymatic mechanisms of the epidermal barrier and the abnormal immune and inflammatory responses that characterize atopic dermatitis and psoriasis. Also described is a new connection between lipid metabolism and the epidermal barrier. A suggestion that emerges is that atopic dermatitis and psoriasis share at least 2 pathogenic mechanisms–namely, deficient expression of PPAR-#a and impaired production of interleukin-10 and interferon-γ–in spite of differences in causes and manifestations. A standardized olive oil formulation with powerful bactericidal and fungicidal effects also has the ability to increase serum levels of these 2 cytokines and regulate serum levels of high-density lipoprotein cholesterol in patients at high risk for inflammatory and cardiovascular disease, suggesting that these may be among the mechanisms responsible for the benefits observed following oral and/or topical administration in patients with atopic dermatitis or psoriasis.
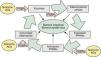
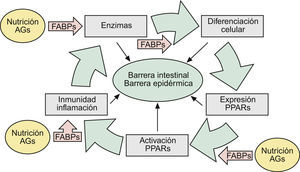
En una revisión previa describíamos como las alteraciones de la barrera epidérmica (BE) se debían fundamentalmente a hechos relacionados con las funciones de la filagrina (FLG)1. Sin embargo, teniendo en cuenta que las alteraciones genéticas de esta proteína acontecían en solamente 15 a 20% de los casos de dermatitis atópica (DA)2,3, sugeríamos que el resto se debían bien a alteraciones genéticas —con pérdida de función— de algunas de las enzimas implicadas en los mecanismos de activación de la misma, o bien a otros epifenómenos que sobrepasaban la actuación de estas enzimas, imponiendo similares alteraciones de la BE1. En este escenario enzimático, las denominadas fatty acid-binding proteins (FABP, ‘proteínas fijadoras de ácidos grasos’) jugaban un papel crucial, facilitando algunas acciones enzimáticas —en intestino y piel— mediante el transporte de substratos grasos de la dieta hasta las membranas celulares1 (fig. 1).
Aspectos nosológicos de los mecanismos comunes implicados en la formación y mantenimiento de las barreras intestinal y epidérmica: la ruta AFEP. Ver texto. AG: ácidos grasos; FABP: «fatty acid-binding proteins»: proteínas fijadoras de AG); PPAR: «peroxisome proliferator-activated receptors».
Esta ordenada disposición de actores (pro-FLG y FLG, enzimas LOX [lipoxigenasas], caspasas y matriptasa, etc., junto a las transportadoras FABP), destinada a procurar fenómenos de diferenciación celular en la BE (fig. 1), había sido evolutivamente adquirida1 con el fin de disponer de los adecuados mecanismos de defensa frente a las agresiones internas y externas, en un órgano tan aparentemente sutil como la piel humana, que contrasta con la simplista rudeza de sus ancestros más lejanos: peces y aves. En esta contemplación evolutiva, la certera definición de ictiosis alcanza un definitivo racional patogénico.
En los mecanismos reguladores de todos estos constituyentes epidérmicos, así como en la patogenia de sus alteraciones, destacaba la presencia —casi omnipresente— de los factores nucleares «peroxisome proliferator-activated receptors» (PPAR), así como de ciertos mecanismos inmunológico/inflamatorios aún no suficientemente comprendidos (fig. 1), que son los que serán analizados aquí.
Barrera intestinal y barrera epidérmica: nutrición, PPAR y pielEs hoy evidente que la alimentación puede ejercer efectos beneficiosos o perjudiciales para el organismo, a través de su impacto sobre la expresión de diversos genes del huésped, que se produce vía la activación o supresión de diferentes factores específicos de trascripción4,5. El grupo más importante de estos factores lo constituye un conjunto especial de receptores nucleares 1 (RN1), que mediatizan los efectos endógenos de los ácidos grasos (AG) de la alimentación: son los PPAR6–8. La regulación de la trascripción por PPAR, requiere de su heterodimerización previa con el receptor X de retinoides (RXR)6. Una vez activado por el agonista correspondiente, el heterodímero PPAR/RXR estimula su trascripción a través de su unión a elementos de respuesta del ADN (PPRE) presentes en, y alrededor, del segmento promotor de los genes diana.
Actualmente se conocen tres isotipos de PPAR: alfa, beta/delta y gamma, algunas de cuyas características iremos describiendo; pero dado el interés selectivo de este escrito, solamente analizaremos aquí los PPAR presentes en intestino delgado y piel, con especial referencia al más ubicuo de todos, el PPAR-α (tabla 1).
Factores nucleares PPAR-α en intestino y piel: características y funciones. Agonistas lipídicos de la alimentación
| Localización y función (refs.) | Agonistas de PPAR-α (refs.) |
|---|---|
| Intestino delgado: | Ácidos grasos10: |
| Enterocitos diferenciados8 | |
| ↑ β-oxidación AGs10: ↓ inflamación intestinal11 | Derivados de AG: |
| ↓ Absorción de colesterol y ↑ su transferencia a Apo-A1 (HDL)10 | |
| ↓ Absorción aminoácidos y ↑ motilidad intestinal10 | |
| ↓ los efectos del estrés oxidativo10 | |
| ↓ vía de señalización para IL-17 y EGFR8 | |
| Piel: | |
| Enterocitos diferenciados14,15 | |
| Desarrollo fetal de la piel15 | |
| Maduración barrera epidérmica: diferenciación QT24–26 | |
| Reparación injurias traumáticas cutáneas15 | |
| Disminuye migración de células de melanoma14 | |
| Aumentan la producción de sebo (¿acné?)21 | |
| Disminuido en DA, psoriasis, queratosis actínica y carcinoma escamoso14,22 | |
AA: ácido araquidónico; AG: ácidos grasos; Apo-A1: apolipoproteína A1; DHA: ácido docosahexaenoico; DA: dermatitis atópica; EGFR: receptor del factor de crecimiento epidérmico; EPA: ácido eicosapentaenoico; HDL: colesterol asociado a lipoproteínas de alta densidad; IL-17: interleucina 17 (proinflamatoria); 12/15 LOX: 12/15 lipoxigenasas; LTB4: leucotrieno B4; MUFA: ácidos grasos monoinsaturados (ácido oleico: componente mayoritario del aceite de oliva); OEA: oleoiletanolamida; PEA: palmitoiletanolamida; PUFA: ácidos grasos poliinsaturados; QT: queratinocitos.
Hay que destacar ya, que al igual que ocurría con algunas de las enzimas cutáneas y sistémicas analizadas por nosotros1, la importancia biológica de los PPAR-α viene determinada por su presencia casi ancestral en los mecanismos que rigen la evolución de las especies, pudiendo ser detectados en segmentos evolutivos anteriores a los animales9. En estas especies, los mecanismos de activación por ácido oleico (constituyente fundamental del aceite de oliva [AO], entre otras plantas) son similares a los que ocurren en humanos9, lo que da una idea bastante exacta de la importancia de este AG en la nutrición grasa como parcial soporte de la vida filogenética, y sugiere la presencia del olivo, o de otras plantas productoras de AG, en tiempos evolutivos remotos.
PPAR y barrera intestinal (BI)Los PPAR-α se expresan mayoritariamente en enterocitos diferenciados del intestino delgado10, hallándose por tanto expuestos a altos niveles de agonistas lipídicos procedentes de la alimentación. Estos agonistas son principalmente monoglicéridos y AG (y sus derivados), que provienen de la hidrólisis digestiva de los triglicéridos de la dieta, antes de su entrada a los enterocitos11. El papel de los PPAR-α sobre la expresión de genes que controlan la BI (ocupada del transporte de proteínas y enzimas metabólicas de fase I/II) ha sido descrito recientemente, estudiando las acciones de algunos de los AG más frecuentes en la alimentación. De esta manera, la activación de PPAR-α en los enterocitos diferenciados se traduce por una plétora de actividades12 (tabla 1). En primer lugar, los PPAR-α participan en regulación del catabolismo de los AG, a través de diversos mecanismos de absorción y su posterior β-oxidación en mitocondrias y peroxisomas, o de su ω-oxidación y de la generación de substratos energéticos para la glucogenolísis y el ciclo de Krebs. (Recordemos que la FABP intestinal [FABP-I] es en parte la responsable del transporte de los AG de la alimentación hasta los PPAR1). Dado que la β-oxidación de los AG se relaciona con la menor severidad de la enfermedad inflamatoria intestinal13, la activación nutricional de PPAR-α podría ser importante en el tratamiento de esta enfermedad y otras enfermedades con similitud inmuno-inflamatoria, cual es el caso de algunas cutáneas (DA y psoriasis, como se verá). En segundo lugar, la activación de PPAR-α contribuye a la reducción de los efectos del estrés oxidativo (EstrOx), que es llevada a cabo a través de la estimulación de diversos genes implicados en la defensa endógena frente al mismo. Cuenta tenida que el EstrOx se manifiesta por incrementos del daño celular y de fenómenos de apoptosis14, y que la activación de PPAR-α por diversos agonistas12 conlleva también la supresión de genes involucrados en mecanismos de apoptosis (como por ejemplo los de caspasa-3)10, se entienden así los positivos efectos de ciertos AG sobre el mismo. Finalmente, la activación de PPAR-α suprime la expresión del receptor para el factor epidérmico de crecimiento (EGFR) y la vía de señalización para interleucina 17 (IL-17) y para la respuesta inflamatoria10, entre otros hechos que tienen especial relevancia para el tema que nos ocupa (tabla 1).
Así pues, todo indica que, al igual que en el aparato digestivo y otros tejidos que expresan PPAR-α (como es el caso de la piel), el fin último de su activación es el de bloquear las células en transición hacia la fase G1-S del ciclo celular, reduciendo su proliferación e incrementando su diferenciación, al tiempo que se regula el metabolismo lipídico y el balance energético celular8,15, además de otros fenómenos inflamatorios e inmunes que iremos viendo. Estos datos: a) soportan la sugerencia1 de que la FABP-I es responsable del transporte de los AG de la dieta a los PPAR-α intestinales; b) dan una idea de la importancia de los AG monoinsaturados (MUFA: oleico) y poliinsaturados (PUFA: linoleico, linolénico, araquidónico) (tabla 1), todos componentes esenciales del AO, en la alimentación y el mantenimiento biológico sistémico de los vertebrados.
PPAR y barrera epidérmicaLa presencia de factores nucleares PPAR en la piel es hoy un hecho indiscutible, en donde realizan —al igual que en el aparato digestivo— sus acciones reguladoras sobre los fenómenos de proliferación (inhibición) y diferenciación (activación) celular, así como sobre el control negativo de las respuestas inflamatorias16. Cambia, por tanto, la diana celular, que pasa de ser un enterocito a un queratinocito (QT); pero, en cualquier caso, se trata de células ya diferenciadas por algunos de los procesos enzimáticos descritos en otra parte1 (fig. 1). La similitud de los comportamientos fisiológico y patogénico entre las BI y BE es, como veremos, un potente argumento para sostener que la alimentación repercute de manera obsesiva sobre la estructura y funcionalidad de la piel, explicándonos así parte de los hechos terapéuticos ya descritos1, más los que describiremos aquí.
Los tres isotipos de PPAR se expresan en condiciones fisiológicas tanto en la piel murina como humana, estando el PPAR-α implicado17 en funciones relacionadas con el desarrollo cutáneo fetal, la maduración de la BE y la actividad de los sebocitos (tabla 1). El PPAR-β/δ regula la diferenciación de estas últimas células, promueve el crecimiento del folículo piloso y exhibe efectos prodiferenciadores en QT, tanto en condiciones fisiológicas como inflamatorias. Además, ambos factores se consideran esenciales en la reparación tras diversas injurias de la piel17. Por el contrario, algunos autores sugieren que el papel directo del PPAR-γ sobre los QT parece ser poco importante (ver más adelante), si bien participa en la diferenciación de las glándulas sebáceas17. (Para una información más exhaustiva sobre fenómenos de regulación cutánea, otros que los debidos a PPAR, consultar ref. 18).
Aunque estos son sus aparentes papeles fisiológicos, el estudio progresivo de los PPAR en diversas enfermedades cutáneas está poniendo de manifiesto el papel específico de cada uno de ellos, ampliando sus hasta ahora descritas funciones biológicas. De esta manera, la expresión de PPAR-α se halla disminuida en fenómenos hiperproliferativos como psoriasis, así como en pacientes con DA, queratosis actínica y carcinoma escamoso de la piel, entre otros procesos (tabla 1); en tanto que, en los dos últimos, la expresión de PPAR-β/δ se halla aumentada16. Estos datos son consistentes con la reciente función adscrita al factor PPAR-β/δ, en la que se describe que su activación por ceramidas provoca la sobreexpresión del transportador de membrana celular ABCA12 («ATP binding cassette transporter, family 12»), que facilita el depósito de glucosilceramidas en los corpúsculos lamelares de los QT, contribuyendo así en la formación de la BE19. La importancia de este hecho es comprensible cuando se tiene en cuenta la desorganización lipídica existente en la DA, que se caracteriza por disminución en los niveles de algunas ceramidas20 y de AG (cual sería el caso del oleico)21 que permiten la pérdida de lípidos y agua característica de esta enfermedad22.
En la misma dirección, han sido algunos nuevos tratamientos los que han puesto en evidencia el papel crucial de los factores PPAR en la patogenia de diversas enfermedades de la piel. De este modo, todos los PPAR —cuando activados por sus agonistas específicos o por pan-agonistas— aumentan la producción de sebo tanto in vitro como in vivo en humanos23, lo que advierte de precaución para su uso en casos de acné (tabla 1). La expresión de PPAR-α se halla disminuida en modelos experimentales y en pacientes con DA24; y así, la aplicación tópica de un agonista específico de este receptor reduce la inflamación inducida experimentalmente por antígenos. Curiosamente, la administración oral de un agonista de PPAR-γ, reduce también la sintomatología clínica en DA en humanos25, lo que también le implica en la patogenia de la enfermedad. De hecho, parece que los efectos reguladores de los PPAR-γ sobre la inflamación contribuyen también a mantener la homeostasis de la BE25. En el mismo sentido otros autores sí describen la capacidad de los PPAR-γ para provocar la diferenciación de QT26–28, aunque sin la intensidad que lo hacen los PPAR-α activados por los endógenos 8S-HETE derivados de las acciones de la 12/15 LOX sobre los ácidos araquidónico y linoleico1,26,27 (tabla 1), ambos contenidos en el AO. Como se puede deducir, estos fenómenos vuelven a poner en evidencia la existencia de la ruta fisiológica AG→Enzimas (LOX)→PPAR, ya descrita por nosotros1 (fig. 1).
Finalmente se ha visto: a) que la activación de PPAR-α es también beneficiosa en modelos de dermatitis irritativa y alérgica de contacto29, que en ocasiones coexisten con DA o muestran hechos inmunopatogénicos parecidos; b) que la alimentación grasa en lactantes procura la expresión de FABP y PPAR-α1,30, lo que da una idea bastante exacta de lo que significa la lactancia materna en la prevención de enfermedades, incluidas las de la piel31, y c) que la alimentación grasa estimula la movilización duodeno-yeyunal de mediadores lipídicos que controlan la saciedad. Entre ellos destaca la oleoiletanolamida (OEA) y otras etanolamidas de ácidos grasos (FAE), pero no las de AG saturados (palmitoiletanolamida, p.e: PEA)32,33. Curiosamente, la OEA —un derivado natural del ácido oleico— se comporta como un potente agonista específico de factores PPAR-α del intestino delgado34, mientras que la PEA —un derivado natural del ácido palmítico (saturado)— funciona en la piel como un potente agente endógeno antiinflamatorio y antialérgico, vía la activación de PPAR-α35. Dado que la activación de PPAR-α por ácido oleico se acompaña también de incrementos de la motilidad intestinal12, estas observaciones experimentales se corresponden con los positivos efectos clínicos sobre el estreñimiento, observados por nosotros en pacientes con enfermedad renal crónica36 y ancianos37 mediante el uso de una formulación magistral de aceites de oliva (FMAO), que son refrendados por los potentes hechos inmunológicos, reguladores del colesterol HDL y microbicidas que se verán al final. Pero, en cualquier caso, estas observaciones contribuyen a completar la existencia de una ruta fisiológica Alimentación → AG → FABP → Enzimas (LOX) → PPAR («ruta AFEP» en la fig. 1), que se halla presente tanto en la BI como en la BE, proporcionando así un substrato científico a las relaciones entre alimentación y piel.
En resumen, los positivos efectos de la alimentación sobre la piel —alardeados para multitud de compuestos38, y algunos racionalmente descritos para determinados AO39–41—, pueden hoy ser científicamente comprendidos a la vista de las acciones desplegadas por los AG, y otros nutrientes, sobre la ruta AFEP (tabla 1 y fig. 1). No cabe duda, sin embargo, que el análisis crítico de todos los modelos PPAR hasta ahora descritos demuestra la existencia de muchas lagunas. Así, sabemos que los PPAR no son absolutamente indispensables para la completa maduración y renovación epidérmica, y que otros mecanismos deben de coexistir con ellos (si bien no son motivos de este escrito18), justificando así los procesos enzimáticos descritos por nosotros1. Pero, en cualquier caso, parece ya establecido que los PPAR aceleran la diferenciación de los QT, así como la recuperación de la BE tras diversas agresiones exógenas o endógenas17,42, como son los casos de DA y psoriasis, participando además en el control de algunos de los mecanismos inmunológico/inflamatorios que veremos a continuación.
Finalmente, no cabe hoy tampoco duda que muchos compuestos, artificialmente contenidos en la alimentación, pueden intervenir desfavorablemente en la ruta AFEP; y así, el carácter lipofílico de muchos pesticidas43,44 —utilizados como productos fitosanitarios—, les hace participar en algunos de los mecanismos citados, fundamentalmente en la activación de PPAR45 y/o caspasas proapoptóticas46 y/o receptores estrogénicos en células de cáncer de mama y ovario47, promoviendo situaciones potencialmente responsables de severos trastornos endocrinológicos48,49 y de la piel50–59. Además, la mayoría de estos productos se comportan como potentes agentes proinflamatorios43,46, lo que ya sugiere su posible interferencia con muchos de los mecanismos inmunológicos que vamos a describir aquí en DA y psoriasis.
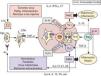
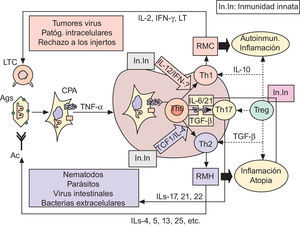
Inmunopatogenia de la barrera epidérmicaSobre fisiología del sistema inmunológico. Apuntes de fisiopatología y su modulaciónLa polarización de las respuestas inmunológicas (RI) hacia respuestas de mediación celular (mediadas por linfocitos T helper1: Th1) o hacia respuestas de mediación humoral (coordinadas por linfocitos Th2), es hoy un hecho fuera de toda duda60–63, a las que se ha venido a sumar recientemente un tercer tipo de RI, de carácter proinflamatorio, denominada Th1764. Desde el punto de vista funcional (fig. 2), está ya establecido que las células presentadoras de antígenos (CPA; fundamentalmente células dendríticas [CD]) captan los antígenos (Ag), los procesan y emigran —por la acción de TNF-α, entre otros factores quimiotácticos— a las zonas linfáticas subsidiarias de la zona agredida (generalmente, ganglios linfáticos), con el fin de presentar los Ag a los linfocitos TCD4+ naive o Th060–63. Una vez activadas por el Ag —en el contexto del complejo mayor de histocompatibilidad clase II (CMH-II) y de ciertas moléculas de coestimulación (fig. 2)— las células Th0 pueden adquirir al menos cuatro fenotipos diferentes: tres de ellos son efectores (Th1, Th2 y Th17), y el cuarto constituye un compartimento regulador que comprende a diferentes subpoblaciones linfocitarias, en las que destacan las células T reguladoras (Treg)63,65–67, que fueron inicialmente descritas por algunos de nosotros en un modelo tumoral experimental68.
Las respuestas inmunológicas y sus implicaciones patogénicas. Ver texto. Ac: anticuerpos; Ag: antígenos; CPA: células presentadoras de Ag; IFN-γ: interferón gamma; IL: interleucinas; In.In: inmunidad innata; LT: linfotoxina; LTC: linfocitos T citotóxicos (CD8+); RMC: respuesta de mediación celular; RMH: respuesta de mediación humoral; TCF1: factor 1 de células T; TGF-β: factor beta transformador del crecimiento; Th: linfocitos T «helper»; TNF-α: factor alfa de necrosis tumoral; Treg: células T reguladoras. Las flechas discontinuas indican supresión.
Entre las numerosas moléculas que influencian esta diferenciación, las citocinas producidas por las CPA, o por otras células auxiliares presentes en lo que en su día denominamos entorno de la presentación antigénica (EPA), coordinado por mecanismos de inmunidad innata61,67,69–71, son definitivas a la hora de explicar tanto la proliferación como la restricción hacia un subtipo celular en especial60–76. De esta manera (fig. 2): interleucina 12 (IL-12) e interferón gamma (IFN-γ) polarizan la RI hacia Th1; el factor 1 de células T (TCF1) y la interleucina 4 (IL-4) promueven el desarrollo hacia Th2; y la interleucina 6 (IL-6) y el factor beta transformador del crecimiento (TGF-β), en ausencia de citocinas Th1 y Th2, inducen la desviación hacia el fenotipo Th17. Igualmente (fig. 2), parece que la interleucina 21 (IL-21) puede sustituir las acciones de IL-6 para lograr la diferenciación y amplificación de Th17, que serían finalmente estabilizadas por las acciones de la interleucina 23 (IL-23)67,77. En estas actividades, por tanto, la presencia en el EPA de mecanismos de inmunidad innata (fig. 2) mediados por macrófagos inflamatorios productores de IL-12 o IL-6 y TNF-α, y por diversos tipos de células NK productoras de IFN-γ o IL-21, juegan un papel crucial en los mecanismos de polarización de las RI61,67–71,75–77.
Aunque la mayoría de las células inflamatorias que conforman el EPA son macrófagos, algunos de nosotros ya describimos el papel de los mastocitos en la patogenia del asma atópico70, así como su presencia en el cataclismo inmunológico cutáneo que acontece tras la irradiación por radiación UV78–80 o en la infección por virus del papiloma humano (VPH)80. Más recientemente se ha visto que estas células juegan un preciso papel inmunológico, a través de la anulación de los mecanismos supresores de células Treg. Así, los mastocitos altamente productores de IL-6, en ausencia de citocinas Th1 o Th2, conducen a células Treg y linfocitos T efectores hacia células Th17 productoras de IL-1781, potenciando así la inflamación. Paradójicamente, los mastocitos pueden promover también la activación de células Treg, provocando un cuadro de tolerancia82, lo que da una idea de la importancia reguladora de estas células, y la complejidad inmunológica a la que nos enfrentamos.
Esta regulación de la diferenciación por citocinas de los tres tipos celulares, es mediada por factores respectivos de trascripción denominados T-bet83, GATA-384 y RORγt85, siendo el factor FOXP3 el definitorio de células Treg86. En relación a este último, que es naturalmente inducido durante la diferenciación tímica de las células Tregs67, o en la periferia en presencia de TGF-β y ácido retinoico (AR)87, se sabe que la IL-6 es capaz de inhibirlo, determinando así la polarización definitiva hacia Th17. Ello sugiere que el balance endógeno entre las funciones de FOXP3 y RORγt es el determinante del tipo de RI generada86, constituyéndose de esta manera en dianas especiales para el estudio terapéutico de diferentes inmunomoduladores. Tal sucede con el AR, que se comporta como inductor natural de FOXP3 e inhibidor de los receptores para IL-6 e IL-23, inhibiendo así la respuesta Th17 inflamatoria a través de mecanismos de supresión mediados por células Treg88.
Una vez activadas, ya es sabido que las células Th1 producen IFN-γ y linfotoxina (LT) que, junto a la interleucina 2 (IL-2), son las responsables de la puesta en marcha de RI de mediación celular, cuyas acciones defensivas quedan resumidas en la figura 2. Las células Th2 segregan IL-4, IL-5, IL-13 e IL-25, entre otras interleucinas, que son esenciales para la generación apropiada de anticuerpos (Ac), dirigidos a realizar las funciones efectoras descritas en la figura 2. Finalmente, las células Th17 producen IL-17 e IL-21 e IL-22, estando su misión fisiológica encaminada a la destrucción de bacterias extracelulares67,77 o, en conspiración con Th1, a la dudosa resistencia frente a algunos tumores67,89. Como también se muestra en la figura 2, el descarrilamiento de una cualquiera de las RI conduce a cuadros de autoinmunidad e inflamación Th160,61,67,69, a fenómenos de atopia e inflamatorios Th260,61,67,70 —incluidos el envejecimiento intrínseco69,71 y el daño cutáneo por UV79,80 o por VPH80—, o a redundantes mecanismos de autoinmunidad, atopia e inflamación Th1763–67,77.
Hay que resaltar que existen todavía muchas lagunas en la comprensión absoluta de las RI en condiciones fisiológicas, siendo muchas de ellas desveladas por el estudio patogénico de algunas enfermedades o, al azar, por nuevos tratamientos. Así lo hemos visto ahora para el AR, y lo vimos para algunas glitazonas antidiabéticas y ciertos AG en el manejo de afecciones cutáneas como la DA y psoriasis1. Como ejemplo de esta dificultad, baste decir que en situaciones fisiológicas, al contrario que ocurre con las Th1 y Th2, es difícil encontrar gran número de células Th17, —no así en condiciones inflamatorias—, lo que dificulta su estudio67. Por todo ello, resulta difícil admitir que el bloqueo o la estimulación de tal o tal célula y/o citocina pudiera manifestarse por resultados terapéuticos evidentes; más aun si se tiene en cuenta que la mayor parte de nuestro conocimiento sobre estos mecanismos procede de experiencias en ratones, que en algunos aspectos difieren de los exhibidos en humanos90, lo que implica que muchos modelos murinos de DA no son válidos para su extrapolación a la realidad humana. Afortunadamente, el modelo canino de DA, con su expresión génica91 y patológica92 similar a la humana, nos ha permitido ciertos éxitos terapéuticos con nuestra FMAO (datos no mostrados) y a otros autores mediante el uso de inmunoterapia específica93 en estos animales. En segundo lugar, es claro que algunos factores reguladores juegan a dos o más bandas, como sucede con el TGF-β en el caso de las células Treg y las Th1766,67, por poner otro ejemplo añadido de aparente caos biológico. Es por ello, que el diseño terapéutico de delante atrás; es decir, ver primero los resultados y luego preguntarse más profundamente por qué, sigue siendo científicamente fundamental, y más en el tema de la nutrición que aquí nos ocupa, en el que la posibilidad de efectos secundarios severos se halla naturalmente minimizada.
En cualquier caso, la situación expuesta —válida desde el punto de vista nosológico— es simplista (fig. 2) en cuanto que son multitud los mecanismos que regulan las RI, incluidas las suficientemente conocidas moléculas clásicas de coestimulación CD28, CD80 y 86, los receptores Toll de la inmunidad innata, etc. Pero para el interés de este trabajo, solo destacamos la actuación de los denominados ligandos Notch, que son receptores de membrana que, además de regular las RI94,95, juegan un papel preponderante en las tomas de decisión sobre el destino final de muchas líneas celulares, incluidas las de la piel96. En este sentido, las señales Notch, junto a factores de trascripción como los PPAR-α descritos anteriormente, controlan la diferenciación de células epidérmicas18; y así, la depleción específica de Notch en los QT interfiere con la diferenciación fisiológica epidérmica, provocando severos defectos de la BE97,98, además de cuadros neonato-letales linfoproliferativos de células B, que son debidos a la sobreproducción y expresión sistémica de linfopoyetina del estroma tímico (LPET) por parte de los QT incapaces de diferenciarse97. La LPET, frecuentemente utilizada como biomarcador/centinela de los defectos de la BE, es una citocina del tipo interleucina 7 (IL-7), que se halla también implicada en la patogenia del asma y de la DA98–101, y que se mantiene mientras que los defectos de la BE persisten97. (Ver más adelante, y fig. 3). Dado que la LPET puede activar CD102 y linfocitos T103,104, se ha especulado que los niveles elevados de la misma pudieran sensibilizar a estas células para un subsiguiente estímulo alergénico en el pulmón105,106. Es importante destacar que la LPET también se halla elevada en las lesiones de psoriasis107, sin que exista evidencia que ligue a esta enfermedad con predisposición al asma. Este fenómeno puede ser explicado porque, al contrario que en la DA, la dominancia inmunológica en psoriasis corresponde a linfocitos Th1 que no responden a LPET107.
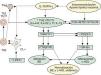
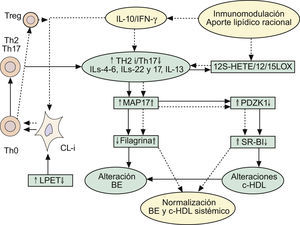
Implicaciones de la respuesta inmune Th2 en las alteraciones de la barrera epidérmica, y en el mantenimiento del circuito inflamatorio Th2/Th17 y supresión de la vía antiinflamatoria mediada por células Treg-IL-10. Repercusiones sobre el metabolismo lipídico. Ver texto. BE: barrera epidérmica; c-HDL: colesterol asociado a proteínas de alta densidad CL-i: células epidérmicas de Langerhans pro-inflamatorias; IFN-γ: interferón gamma; IL: interleucinas; LPET: linfopoyetina del estroma tímico; MAP17: proteína asociada a la membrana celula; PDZK1: gen que se localiza en la misma región del cromosoma 1q21 relacionada con la DA; Th: linfocitos T «helper»; Treg: células T reguladoras.
En este complejo contexto inmunológico, la DA se caracteriza (tabla 2) por la presencia dominante del circuito Th2 y, en menor intensidad, de Th172,3,108–113. La preponderancia Th2 (aumentos de IL-4 y 13 y disminuciones de IFN-γ) es manifiesta incluso en la piel no afecta del paciente con DA. Estas alteraciones son más pronunciadas en la lesión108, en donde se acompañan de la presencia de IL-5, IL-11 (profibrótica) y de reducciones severas en la expresión de IL-12108. Datos recientes, sin embargo, postulan que la evolución de la DA hacia la cronicidad eccematosa se caracteriza por la desviación progresiva hacia Th12,113, coexistiendo frecuentemente ambas formas de expresión celular (tabla 2), sin que hasta el momento se conozcan las causas de este desvarío inmune hacia un fenotipo similar al psoriático.
Características inmunológicas en dermatitis atópica (DA) y psoriasis
| Característica | Dermatitis atópica | Psoriasis | |
|---|---|---|---|
| Fase aguda | Fase crónica | ||
| Predominio RI | Th2 | Th2/Th1 | Th1 |
| ↑↑ Th17-IL-23 | ↑Th17-IL-23 | ↑↑↑Th17-IL-23 | |
| ↓Tregs-IL-10 | ↓ Tregs-IL-10 | ↓Tregs-IL-10 | |
| CPA: | |||
| CL (mCD) | + + + | + | ↑↑↑ |
| pCD | −116 o+107 | −116 o+107 | + + + (inicio) |
| IDEC* | + | + + + | + + + (mantenimiento) |
| Perfil citocinas: | ↑IL-4/5/13 y TNF-α | ↑↑IL-4/5/13 y TNF-α | |
| ↓IL-10 e IL-12/IFN-γ | ↑IL-12/IFN-γ, CSF-GM, IL-11 | ||
| ↓IL-10 | ↓IL-10 y ↑ IFN-γ (115) | ||
| Otros marcadores: | |||
| PPAR-α | ↓24 | ↓24 | ↓ |
| 12/15 LOX** | n.d | n.d | n.d |
| Ceramidas | ↓ | ↓ | ↓ |
| AGs (oleico) | ↓ | ↓ | ↓ |
| LPET | ↑ | ↑↑↑(local y sistémica) | ↑↑↑(sistémica) |
| FLG | normal a ↓↓↓** | ↓↓↓ | ¿?a |
Ver texto y, para otros marcadores ya clásicos, consultar ref. 115. +/↑↓: intensidad de la presencia; ***Sugerimos que en las formas muy iniciales de DA extrínseca, la filagrina (FLG) estaría poco afectada. AG: ácidos grasos; CL: células epidérmicas de Langerhans; CPA: células presentadoras de antígenos; IDEC: células dendríticas epidérmicas inflamatorias; LOX: lipoxigenasa; LPET: linfopoietina del estroma tímico; mCD: células dendríticas de estirpe mieloide; pCD: células dendríticas de estirpe mieloide; PPAR: «peroxisome proliferator-activated receptors»; RI: respuesta inmunológica.
Aunque son numerosas las alteraciones inmunológicas descritas tanto en DA como en psoriasis, datos recientes permiten establecer que (tabla 2): 1.o) la vía Th17-IL-23 se expresa con gran intensidad en psoriasis, y más débilmente o incluso ausente durante la fase aguda de la AD114, lo que explicaría la incidencia de infecciones recidivantes por bacteria extracelulares en la DA110; 2.o) cuando se analizan diferentes subpoblaciones de células T en sangre periférica, no se encuentran diferencias entre DA y psoriasis115, aunque en la piel de DA se observa menor expresión genómica de IL-17, IL-23 e IFNγ110; 3.o) el fenotipo celular en la piel psoriática es, por tanto, Th1/Th17, en tanto que el de la DA crónica es fundamentalmente de tipo Th2, junto a débil expresión de Th1/Th17114; 4.o) existen mayores subpoblaciones de células (CD4+ y CD8+) productoras de IL-22 en la piel de pacientes con DA crónica que en psoriasis, y que, además, el número de CD8+IL-22+ correlaciona directamente con la severidad de la AD114; si bien esta aparentemente nueva población T22+ deberá ser investigada más profundamente; 5.o) las cifras de Th17 en sangre correlacionan con la severidad de la DA111; 6.o) el infiltrado papilar dérmico por células T17+ en DA es mayor durante la fase aguda que la crónica111, y 7.o) que la estimulación de los QT por IL-17 da lugar a la producción de factor hematopoyético granulocito/monocítico (CSF-GM), IL-1 y 8, TNF-α y otros factores inflamatorios y de adhesión celular111, ya clásicamente descritos en pacientes con DA108,115. Otras características se resumen en la tabla 2.
En lo que concierne al papel iniciador de las CPA, recordemos que en condiciones fisiológicas la piel contiene al menos tres poblaciones de CD: células epidérmicas de Langerhans (CL), CD de origen mieloide/monocítica (mCD) y CD de origen plasmocitoide (pCD), a las que se une en casos de DA y psoriasis un cuarto subtipo denominado células dendríticas epidérmicas inflamatorias (IDEC), de carácter típicamente proinflamatorio116–118. Funcionalmente, parece que las mCD en DA expresan al menos dos fenotipos en sangre y piel que portan el receptor epsilon de alta afinidad para IgE (FcεRI), lo que ya podría contribuir a explicar la naturaleza bifásica (aguda y crónica) de la enfermedad (tabla 2): unas son las CL-FεRIhigh presentes en los momentos iniciales de la DA, y otras las IDEC, que también expresan el FcεRIhigh y se hallan en la fase crónica116. Por el contrario, las CD de origen plasmocitoide (pCD) —que también portan el FcεRIhigh, y son cruciales en los mecanismos de defensa antiviral mediados por IgE—, se hallan casi ausentes en las lesiones de los pacientes con DA116. Por ello se piensa que la DA se caracteriza en sus fases iniciales por la actuación de CL, en tanto que las IDEC participan en la cronicidad de la enfermedad, ya que se detectan tanto en la epidermis como en la dermis de los sujetos afectos117,118 (tabla 2). Este escenario celular: 1.°) permite distinguir a la DA de la psoriasis110,118, de la que se piensa que la iniciación patogénica es debida a células pCD, en tanto que la perpetuación es mantenida por IDEC de origen mieloide, aunque con diferentes marcadores que, en un EPA adecuado (fig. 2), conducen a distinta polarización inmunológica (Th1) que en DA (Th2)118; 2.o) se caracteriza, ya desde el inicio de la DA, por la casi ausencia de pCD epidérmicas116, que contrasta con su preponderancia en psoriasis (tabla 2), y 3.o) es, desde nuestro punto de vista, similar al que acontece en la cavidad peritoneal bajo la influencia de la 12/15 lipoxigenasa (12/15 LOX)119, lo que además permite establecer una conexión entre las alteraciones enzimáticas descritas y los trastornos inmuno-inflamatorios en las BI y BE1 (fig. 1). En este modelo (más asequible al estudio que el procurado por la complejidad celular de la piel), en donde el 95% de los macrófagos (Ma) expresan esta enzima (Ma CD11b 12/15 LOX+) y el 5% restante no (Ma CD11b 12/15 LOX-), los preponderantes MaLOX+ producen la citocina antiinflamatoria IL-10 (IL-10), manteniendo así un estado de tolerancia inmuno/inflamatoria, en tanto que los MaLOX− son CD netamente proinflamatorias. En ratones deficientes en 12/15 LOX, ya describimos1 que se producían serias alteraciones de la FLG, que se acompañaban de severos trastornos del metabolismo lipídico por ausencia de activación de PPAR. Además, estos animales muestran profundos trastornos en el tráfico y diferenciación de los Ma peritoneales, que se comportan como proinflamatorios tanto en condiciones basales como tras la estimulación con Estafilococo epidermidis119. De esta manera, estos Ma generan más cantidades IL-1, IL-3, IL-17 y TGF-β1 y menos de IL-12 y de quimiocinas migratorias. En resumen, las deficiencias genéticas en 12/15 LOX, o funcionales por ausencia de sus substratos adecuados (AG)1, podrían ser las responsables de los fenómenos que acontecen en las formas de DA intrínseca (DA-I). Pero además, tampoco se puede descartar su participación en formas de DA extrínseca (DA-E), ya que se ha visto muy recientemente que una lectina (Ym1/2) dependiente de IL-13 se expresa abundantemente en condiciones alérgicas, y que su bloqueo provoca disminución en la producción de IL-5 (responsable de la eosinofilia en todas las formas de DA) e IL-13120. Aun más, la producción de Ym1/2 en respuesta a IL-13 promueve la producción de citocinas Th2 e inflamación alérgica vía la inhibición de 12S-HETE por 12/15 LOX120. Ello explicaría por qué el suministro sistémico o tópico de algunos AG pudiera ser efectivo en el tratamiento de estas formas de DA-I (fig. 3). De hecho, tanto nuestros propios datos mediante el uso sistémico y tópico de una FMAO en humanos y perros1,40,41, como mediante el uso tópico de otras formas lipídicas por otros autores121–123, así lo sugiere (tabla 3). Además, esta secuencia de acontecimientos explicaría racionalmente1 las causas que conducen a las alteraciones de la BE en ausencia de mutaciones de la FLG121,123, así como la indefensión de los pacientes con DA frente a la infección cutánea por S. aureus124.
Comparación entre tratamientos clásicos y nuevas aproximaciones terapéuticas en dermatitis atópica y psoriasis
| Efectos sobre | Otros efectos | ||||
|---|---|---|---|---|---|
| Productos | Composición BE | Mecanismos inmunológicos | Antimicrobianos | c-HDL | Secundarios |
| Clásicos | |||||
| Corticoides | No | Sí (supresores) | No | No | Sí |
| ITCs | No | Sí (supresores) | No | No | Sí |
| Nuevos | |||||
| Ceramidas | Sí | No | ¿? | No | No |
| FMAO | Sí | Sí (reguladores)* | Sí** | Sí* | No |
BE: barrera epidérmica; c-HDL: colesterol HDL; FMAO: formulación magistral de aceites de oliva orgánicos virgen extra; ITC: inhibidores tópicos de la calcineurina.
Volviendo al tema de la complejidad inmunológica (mostrado en la fig. 2 y tabla 2) y las nuevas apuestas terapéuticas, hay que destacar que aunque se ha supuesto que la IL-10, por tratarse de una citocina pro-Th2, se hallaba implicada negativamente en los mecanismos patogénicos de la DA, existen hoy suficientes ejemplos que demuestran su crucial participación antiinflamatoria en DA: 1.o) las células Treg productoras de IL-10 suprimen las respuestas Th2 a alérgenos125 y las inducidas por LPET sobre células mDC que, como ya vimos1, se caracterizaban por un fenotipo Th2 proinflamatorio dominado por la alta producción de TNF-α y baja de IL-10, en modelos de asma y DA126. De hecho, las CD activadas por LPET inducen en linfocitos Th0 la producción de IL-4, IL-5, IL-13 y TNF-α, pero no la de IFN-γ ni IL-10127,128, siendo la respuesta de las CL similar a las de las CD sanguíneas128,129. 2.o) Estos mismos efectos son observados durante el tratamiento experimental con inmunomoduladores como la imidazoquinolina130 y el bacilo de Calmette-Guérin (BCG)131, en los que la supresión de la respuesta Th2 inflamatoria por IL-10 se acompaña también de elevaciones en la producción de IFN-γ. (Recordemos que clásicamente se ha considerado que la IL-10 suprimía las respuestas Th1 y, por ende la producción de IFN-γ, entre otros efectos inmunodepresores132). 3.o) En un modelo de depleción de receptores FcR, la ausencia o atenuación de sintomatología DA se correlaciona con los incrementos de IL-10 y células Treg (FOXp3) en la piel de los animales133. 4.o) En el modelo canino de DA citado91, la mejoría clínica por inmunoterapia alérgeno-específica se correlaciona con incrementos en los niveles de IL-10 sérica y en los porcentajes de células Treg circulantes93. 5.o) En un estudio piloto en humanos, el parcial éxito clínico de la inmunoterapia subcutánea alérgeno-específica se relacionó con incrementos en las cifras de IL-10 y disminuciones de la IgE específica134. 6.o) El uso de cistatina (un inhibidor de proteasas naturalmente presente en helmintos) inhibe las respuestas inflamatoria y alérgica en un modelo experimental, vía la producción de IL-10, explicando así la menor incidencia de procesos alérgicos en sujetos con parasitación por gusanos135. 7.o) la transferencia del gen de IL-10 suprime la eosinofilia y la hiperreactividad aérea en un modelo murino, vía la supresión de las funciones de las CPA, pero sin alterar la respuesta inmune sistémica136. Finalmente, la reducción en los niveles de IFN-γ en sangre periférica se asocia a mayor riesgo de DA durante los primeros dos años de la vida137 y a mayor colonización por estafilococo dorado en niños con DA138.
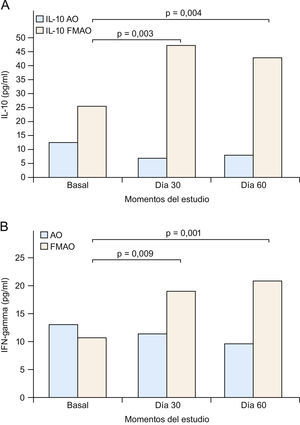
Así pues, todo indica que tanto IL-10 como IFN-γ se constituyen en dianas especiales para el tratamiento de la DA (fig. 3) y posiblemente psoriasis. Este racional, junto al ya descrito sobre los defectos PPAR, fue utilizado por nosotros en nuestro estudio con la FMAO en pacientes con DA o psoriasis1,40,41. De hecho, como se comunica aquí por primera vez, la FMAO se comporta como un potente inductor de IL-10 e IFN-γ (figs. 4A y B) en un modelo humano altamente inflamatorio, de elevado riesgo cardiovascular e infeccioso, con frecuentes alteraciones cutáneas (xerosis, prurito e infecciones) y con serios trastornos de la señalización PPAR139, como es el caso de los pacientes con enfermedad renal crónica36,140. De acuerdo a los trabajos que sugieren tratamientos «de fuera adentro» en DA121,122, nosotros sugerimos que la administración oral de la FMAO (tratamiento «de dentro afuera») sería capaz de normalizar las alteraciones sistémicas inflamatorias de la DA, vía la producción de IL-10 e IFN-γ por células Treg (fig. 3), en tanto que su aplicación tópica pudiese resolver el adecuado aporte lipídico a la BE, además de inducir un proceso de inmunoregulación local (tabla 3). Por otra parte, la potente actividad microbicida exhibida in vitro por la FMAO frente a Staphylococcus aureus, Pseudomonas aeruginosa, Candida albicans y Aspergillus niger, supondría un argumento adicional para su uso en ambas enfermedades124 (tabla 3).
A) La administración de una formulación magistral de aceites de oliva (FMAO) aumenta los niveles séricos de interleucina 10 (IL-10) e interferón gamma (IFN-γ) en pacientes con enfermedad renal crónica. Aceite de oliva convencional. Los pacientes tomaron AO o FMAO durante 30 días. Se estableció un periodo de seguimiento sin FMAO de 30 días (día 60), si bien todos los pacientes siguieron tomando su AO habitual. B) Clasificación funcional de la dermatitis atópica (DA). CL: células epidérmicas de Langerhans; FABP: «fatty acid-binding proteins» (‘proteínas fijadoras de ácidos grasos’); IFN-γ: interferón gamma; LOX: lipoxigenasas; PPAR: «peroxisome proliferator-activated receptors»; Th: linfocitos T «helper».
Es importante destacar, que en tanto que la mayoría de los inductores de IL-10 no suelen provocar efectos secundarios, hay que tener especial precaución con el uso de esta citocina. Así, aunque la IL-10 recombinante mostró efectos clínicos prometedores en el tratamiento de la psoriasis141,142, estudios a largo plazo de los mismos autores demostraron la presencia de claros efectos indeseados143,144. En el mismo sentido fármaco-toxicológico, hay que resaltar los posibles efectos secundarios derivados del uso crónico de inhibidores tópicos de calcineurina145–147, que podrían ser mitigados mediante el uso de la FMAO o de otros compuestos de naturaleza lipídica121,122,145, que definitivamente no exhiben estos efectos indeseables (tabla 3).
Dado que las formas clásicas de DA (intrínseca: I y extrínseca: E) terminan por exhibir trastornos de la FLG, y teniendo en cuenta la baja prevalencia de DA-I (15–20% de los casos), similar a la producida por defectos de funcionalidad del gen que controla la FLG2,3, la pregunta que surge es: ¿Cómo repercute la RI en estas alteraciones de la FLG? Desde nuestro punto de vista, pensamos que la DA-I sería la forma en la que los defectos primarios de la BE jugarían un papel iniciador esencial, en tanto que la DA-E obedecería a alteraciones inmunológicas, por sensibilización alérgica y producción de IgE, que repercutirían posteriormente en las alteraciones de la BE. De hecho: 1.o) había ya datos115,148 que involucraban a IL-4 en la represión de la síntesis de ceramidas inducidas por IFN-γ; 2.o) resultados más recientes refuerzan esta situación, proponiendo (fig. 3) que las respuestas Th2 pueden inhibir la expresión de FLG a través del aumento de la expresión de MAP17 por IL-4, IL-6, IL-17 o IL-22 en QT149. La MAP17 es una proteína no glicosilada asociada a la membrana celular, que aumenta el comportamiento maligno de células tumorales carcinomatosas a través del incremento de especies reactivas del oxígeno (EROx), siendo esta acción realizada por su dominio molecular que fija a PDZ150. Curiosamente, el gen PDZK1 se localiza en la misma región del cromosoma 1q21 que se halla relacionado con la DA, y que regula la expresión de proteínas de la envoltura córnea como FLG, loricrina e involucrina149. Por todo ello, es posible establecer que las respuestas Th2 provocan la disminución de la expresión de FLG vía el aumento de la expresión de MAP17 en los QT (fig. 3). De manera interesante, la sobreexpresión de MAP17 se traduce por deficiencias en el gen PDZK1, que se trasladan, a su vez, en defectos de la expresión hepática del receptor para HDL (SR-BI), con la consiguiente expresión de un fenotipo proaterogénico151 (fig. 3). Este hecho tiene especial importancia aquí, ya que el tratamiento oral con la FMAO normaliza los niveles de HDL (tabla 3) en pacientes con alto riesgo inflamatorio y de enfermedad cardiovascular36,37; y, como ya dijimos1, parece que la sensibilización alérgica cutánea se halla inversamente relacionada con las cifras séricas de colesterol HDL152,153. De igual manera, los pacientes adultos con psoriasis tienen un riesgo elevado de infarto de miocardio, asociado a descensos plasmáticos del colesterol HDL154,155.
ConclusionesAunque diferentes en su causalidad y manifestaciones clínicas, DA y psoriasis exhiben algunos mecanismos patogénicos comunes. Entre ellos destacan las alteraciones lipídicas de la BE, la deficiencia en la expresión de receptores PPAR-α y los defectos en la producción endógena de IL-10 e IFN-γ. Estos hechos pueden ser terapéuticamente aprovechados por determinados AG que, actuando como substratos de enzimas FABP y LOX, ejercen sus acciones reguladoras sobre la expresión y activación de PPAR y, por ende, sobre determinados brazos reguladores del sistema inmunológico (células Treg). Una alimentación adecuada en grasas (o su aplicación tópica) podría suponer un importante avance en el control de enfermedades inflamatorias intestinales y cutáneas; no en vano, la piel es un reflejo de nuestra nutrición.
Conflicto de interesesVicente G. Villarrubia es Director General de la empresa Bioaveda s.I. de I+D+i, propietaria de la formulación magistral de aceite de oliva referida en este trabajo. Los Dres. SVA, VPB y RCC son socios de dicha empresa. Este trabajo ha sido financiado en parte por la Agencia Invercaria de Capital/Riesgo, de la Consejería de Innovación, Ciencia y Empresa de la Junta de Andalucía.
A los Dres. Pedro Jaén Olasolo (Servicio de Dermatología, Hospital Ramón y Cajal, Madrid) y Luís A. Costa (Servicio de Oncología, Centro Gallego de Buenos Aires), por la revisión de este trabajo. A los Farmacéuticos José Miguel Llácer Gallach y Álvaro Llácer Pérez (Martos, Jaén) por su inestimable ayuda en la elaboración de las composiciones FMAO para uso tópico.