La psoriasis es una enfermedad inflamatoria crónica, de predisposición genética y origen multifactorial, que afecta aproximadamente al 1,5% de la población española, repercutiendo negativamente de forma importante en la calidad de vida de los pacientes, los cuales requieren frecuentemente tratamientos de larga duración, para controlar sus síntomas. Los tratamientos sistémicos clásicos (metotrexato, acitetrino, ciclosporina, luz ultravioleta), junto con las denominadas terapias biológicas (etanercept, infliximab, adalimumab, ustekinumab) permiten al dermatólogo disponer de un arsenal terapéutico más amplio y disponer, por lo tanto, de mayores posibilidades de control de pacientes con psoriasis severa y/o extensa. El metotrexato, un fármaco clásico en la terapia antipsoriásica, sigue siendo de gran utilidad tanto en monoterapia como asociado a otros fármacos sistémicos, en especial como rescate o combinación con los biológicos. El objetivo de este artículo es establecer el papel del metotrexato en el tratamiento de la psoriasis. Por ello hemos creído de interés elaborar una guía de uso de metotrexato en psoriasis, consensuada entre varios componentes del Grupo de Psoriasis de la Academia Española de Dermatología y Venereología, que facilite la utilización segura y precisa de este fármaco en el manejo de pacientes con psoriasis.
Psoriasis, a chronic multifactorial inflammatory disease that develops in genetically predisposed individuals, affects approximately 1.5% of the Spanish population. This disease has a negative impact on patients’ quality of life, and long-term therapy is often required to control the symptoms. In addition to the classical systemic treatments (methotrexate, acitretin, cyclosporine, and ultraviolet light), the group of drugs known as biologics (etanercept, infliximab, adalimumab, and ustekinumab) provides the dermatologist with an expanded therapeutic armamentarium, thereby improving the likelihood of controlling psoriasis in patients with severe and/or extensive disease. Methotrexate, a classic antipsoriatic drug, is still very useful either as single-drug therapy or in combination with other systemic drugs, particularly as a rescue therapy or combined with biologics. This article aims to establish the role of methotrexate in the treatment of psoriasis. We considered it of interest to develop guidelines for using methotrexate in the management of psoriasis with a view to ensuring the safe and proper use of this drug in the management of psoriasis. This document was developed by consensus among members of the Psoriasis Group of the Spanish Academy of Dermatology and Venereology.
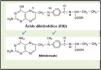
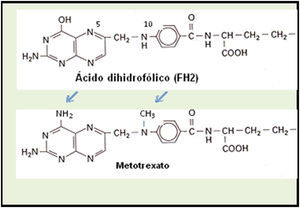
El metotrexato (MTX) (C20H22N8O5,) (fig. 1) es un antimetabolito análogo del ácido fólico (ácido 4-amino-10-metilfólico), derivado por metilación en N10 de la ametopterina, su precursor (fig. 1). Es un inhibidor competitivo de la enzima dihidrofólico-reductasa que cataliza la reducción del ácido dihidrofólico (FH2) en tetrahidrofólico (FH4). De forma empírica, la aminopterina fue utilizada por primera vez en 19511 para el tratamiento de la psoriasis y la artritis reumatoide. En 1958 se hace referencia a su uso de forma específica en el tratamiento de la psoriasis2. La Food and Drug Administration (FDA) aprobó en 1972 por primera vez la indicación de MTX para el tratamiento de la psoriasis.
Mecanismo de acciónEl MTX posee una triple acción antiinflamatoria, antiproliferativa e inmunosupresora.
El MTX interfiere la vía metabólica del ácido fólico, inhibiendo competitivamente la enzima dihidrofolato reductasa y por ende su activación a ácido folínico. Esta inhibición impide la síntesis del ácido desoxitimidílico (dTMP), indispensable para la síntesis de ADN. Su acción se debe a la intensa fijación con la enzima, si bien esta fijación es reversible, de manera que se necesita gran cantidad de moléculas de fármaco en contacto con la enzima para que esta permanezca inhibida, pues de lo contrario, la unión se disocia y la enzima recupera su actividad. Precisamente, esta característica condiciona la pauta de utilización y administración del fármaco. Además, aunque con menor sensibilidad, el MTX es capaz de inhibir parcialmente la formación del anillo púrico del ácido inosínico, precursor de todos los nucleótidos de purinas, tanto del ADN como del ARN. Además, concentraciones altas de MTX pueden llegar incluso a inhibir directamente la síntesis de proteínas.
Utilizado a dosis altas parece claro que su principal efecto es la acción antifolato; sin embargo, su mecanismo a dosis bajas no está aclarado, y se sugiere que pueda guardar más relación con la capacidad de formar poliglutamatos intracelulares (poliglutamación) y aumento de la formación de adenosina, que es un potente mediador antiiinflamatorio endógeno3,4.
Se ha propuesto que el principal mecanismo de acción del MTX (a dosis bajas) en la psoriasis y en otras enfermedades inflamatorias vendría determinado por la inducción de apoptosis en los linfocitos activados o por la inhibición de la activación y expresión de ciertas moléculas de adhesión por parte de los mismos5–8.
FarmacocinéticaA dosis inferiores a 30mg/m2 el MTX se absorbe por completo en el tracto gastrointestinal por transporte activo. Por encima de esa dosis la absorción es incompleta por saturación de transporte. Una vez absorbido, es inactivado parcialmente en el intestino y en el hígado, lo que hace que su biodisponibilidad sea baja. Se distribuye por todo el organismo, aunque en el líquido pleural y el líquido cefalorraquídeo penetra con dificultad y lentitud, alcanzando en esas localizaciones concentraciones 30 veces inferiores a las del plasma. Es eliminado prácticamente sin modificar (90%) por la orina, tanto por filtración como por secreción activa. Por lo tanto el aclaramiento de MTX se reduce en aquellas situaciones en las que lo hace el aclaramiento de creatinina. La disponibilidad de las vías oral e intravenosa son comparables, pero muy variables (25 a 70%), y alcanza su concentración sérica máxima a las 1–2h por via oral y a los 30–60min por via intramuscular.
IndicacionesEl MTX está indicado como tratamiento sistémico en la psoriasis en placas moderada-grave, la eritrodermia psoriásica, la psoriasis pustulosa generalizada, la psoriasis ungueal, la psoriasis palmo-plantar y, muy especialmente, en la artritis psoriásica. Es una buena alternativa terapéutica en psoriasis ante la falta de respuesta a tratamiento tópico, acitretino, PUVA/UVB de banda ancha-estrecha, o no disponibilidad o rechazo de los anteriores. Asimismo, se indica como medicamento de rescate en pacientes tratados con fármacos biológicos antipsoriásicos que presentan pérdida de eficacia o rebote, o en combinación con otros fármacos sistémicos con el fin de mantener la eficacia pero reduciendo los efectos adversos de los fármacos que se combinan.
La utilización de dosis bajas de MTX es especialmente útil asociado a infliximab, al impedir o reducir el desarrollo de anticuerpos inhibidores anti-TNF y mantener así la eficacia del fármaco9,10
El uso de MTX en niños está aprobado por la FDA para la artritis reumatoide. Suele ser bien tolerado y el control de riesgo de toxicidad es similar al uso en adultos. También se ha utilizado asociado a etanercept (autorizado para la psoriasis en placas a partir de los 8 años de edad) para el tratamiento de la psoriasis infantil11.
ContraindicacionesCuando se plantea la prescripción de MTX deben valorarse cuidosamente las contraindicaciones y precauciones especiales de empleo de este medicamento (tabla 1). En caso de indicación necesaria, la existencia en el paciente de alguna contraindicación relativa deberá influir en la elección de la dosis (dosis de prueba, ajuste) y/o el esquema de seguimiento y seguridad.
Contraindicaciones de uso de MTX
| Relativas |
|
| Absolutas |
|
MTX: metrotexato; TBC: tuberculosis.
El MTX es abortivo y teratógeno, con un patrón específico de malformaciones (categoría D de teratogenicidad de la FDA) por lo que está contraindicado en las embarazadas. Tampoco debe usarse en periodo de lactancia por sus potenciales alteraciones fetales óseas, cardiacas y neurológicas12. Su indicación en mujeres potencialmente fértiles se debe asociar al empleo de un método anticonceptivo eficaz. En caso de administración sin conocimiento de embarazo debe tenerse en cuenta para cualquier toma de decisiones, que las dosis necesarias para producir un efecto teratógeno son superiores a 10mg/sem, y que el período crítico desde el punto de vista de la producción de malformaciones es el comprendido entre las 6 y 8 primeras semanas desde la concepción13. Además de su capacidad mutagénica directa, el MTX es tóxico para las células en división, como los espermatocitos (produce oligospermia, que puede ser intensa y persistente, con efecto sobre la capacidad de fertilización masculina). Aunque no se ha establecido con claridad cuál sea el intervalo libre de riesgo entre la finalización del tratamiento y la posibilidad de gestación, atendiendo a sus características farmacológicas y mecanismo de acción se puede sugerir que los pacientes de sexo masculino eviten la procreación hasta por lo menos 3 meses después de finalizar el tratamiento (1 ciclo de espermatogénesis dura 74 días) y que la mujer evite embarazo, por lo menos, pasado un ciclo ovulatorio después de finalizado el tratamiento13.
Durante el tratamiento con MTX deben evitarse la vacunación con vacunas vivas, como polio oral, sarampión, parotiditis, rubeola, varicela y fiebre amarilla. Asimismo, está contraindicado en pacientes con hepatitis vírica activa.
Dosificación y vía de administraciónEl MTX se encuentra disponible en comprimidos de 2,5mg para toma oral y en jeringuillas precargadas de 7,5, 10, 15, 20 y 25mg para administración parenteral (subcutánea o intramuscular). También existen viales de 50 mg para su administración intramuscular que pueden emplearse de forma fraccionada o parcial, si bien esos casos hay que tener en cuenta que, al ser el MTX una substancia tóxica, plantean problemas de manipulación y desecho.
Desde su introducción en el tratamiento de la psoriasis se utiliza a dosis bajas en pauta semanal14 (un solo día o dividida en 3 tomas a intervalos de 12h, en 2 días consecutivos)15, con dosis que varían de 7,5mg a 30mg por semana. El fraccionamiento de la dosis persigue evitar o reducir los efectos adversos gastrointestinales, sin bien esto no está demostrado. La administración subcutánea de MTX puede reducir los efectos gastrointestinales de MTX y aumentar la eficacia terapéutica, aunque esto solo se ha podido comprobar en pacientes con artritis reumatoide16 y carecemos de estudios en psoriasis.
Eficacia en la psoriasisSu efecto terapéutico suele aparecer de forma lenta y progresiva a lo largo de las primeras 4 a 8 semanas subsiguientes al inicio de tratamiento. No se dispone de ensayos clínicos de valoración de la eficacia de MTX en monoterapia para la psoriasis, y los datos que disponemos hacen referencia a ensayos en los que se ha comparado el MTX a dosis variables frente a otros fármacos. Del análisis de los mismos17–20 se puede concluir que según la dosis utilizada, se alcanzan en los pacientes tratados con MTX los siguientes porcentajes de mejoría a las 12 semanas: 25% PASI 75 y 11% PASI 90 con dosis bajas (en aumento de 7,5 a 15mg/sem)18; el 60% PASI 75 y 40% PASI 90 a dosis más altas (hasta 15 a 22,5mg/sem)17,19,20 (tabla 2), y que la eficacia de MTX es inferior a la que se consigue con ciclosporina17,18, adalimumab19 e infliximab20, que son los fármacos comparativos en dichos estudios. Además, el subanálisis de los pacientes tratados con MTX en uno de ellos19 indica que, si no se ha conseguido una respuesta adecuada a las 12 semanas con una dosis de 20mg/sem, no se consigue mejorarla aumentando la dosis a 25mg/sem (Saurat, comunicación oral EADV Berlín, 2009). La superioridad en cuanto a la eficacia de los fármacos biológicos sobre el MTX parece establecida a la luz de los últimos metaanálisis y revisiones publicados21–23.
Toxicidad y efectos secundariosAunque la eficacia del MTX en la psoriasis moderada/grave está fuera de toda duda, hay que tener presente que aproximadamente un 30% de ellos experimentará algún tipo de toxicidad. Esta suele ser habitualmente moderada24,25, si bien puede llegar a ser letal en unos pocos casos, con una tasa de mortalidad cifrada en el 1,2 por 100.000 pacientes tratados26, por lo que hay que ser escrupulosos en adoptar medidas de evitación de riesgos (tabla 3).
Medidas para reducir riesgo de toxicidad por MTX
| Intervenciones | |
| |
| Medicamentos que aumentan toxicidad de MTXa | |
| AINE | Otros |
| • Salicilatos | • Ciclosporina |
| • Naproxeno | • Colchicina |
| • Ibuprofeno | • Dipiridamol |
| • Indometacina | • Etanol |
| • Fenilbutazona | • Fenitoína |
| Antibióticos | • Probenecid |
| • Trimetroprim-sulfa | • Sulfonilurea |
| • Sulfamidas | • Tiazida |
| • Tetraciclinas | • Furosemida |
| • Ciprofloxacino | • Barbitúricos |
AINE:antiinflamatorio no esteroideo; MTX: metrotexato.
La toxicidad por MTX depende de la concentración extracelular de fármaco alcanzada y del tiempo de exposición al mismo, por lo que para una dosis fija, la toxicidad será proporcional al tiempo de exposición. La mayoría de las reacciones adversas relacionadas con el MTX a dosis bajas semanal son leves (gastrointestinales y mucocutáneas) y las graves más relevantes (hematológica, hepática y pulmonar) son infrecuentes y a menudo asociadas a factores predisponentes previos.
Toxicidades leves o moderadas (secundarias)Las reacciones adversas más comunes en relación con la toma semanal de MTX son gastrointestinales, artromialgias y fiebre. Suelen ser leves y reversibles, no obligan a suspender el tratamiento y pueden reducirse ajustando o fraccionando la dosis, bien administrándolo por la noche, por vía subcutánea o tomando suplementos de ácido fólico27. Suelen aparecer en las primeras 24–48h después de la administración de MTX y, aunque leves, son una de las causas más frecuentes de abandono del fármaco28.
Toxicidad gastrointestinalUn 60% de los pacientes presenta toxicidad gastrointestinal que se manifiesta como estomatitis, náuseas, vómitos, dispepsia, dolor abdominal, indigestión, diarrea, anorexia y pérdida de peso27. De todos ellos las aftas se relacionan con dosis más altas de MTX y tienen mejor evolución con el aporte de folatos28.
Toxicidades graves (principales)La principal toxicidad grave asociada a MTX es órgano específica: hematológica, hepática y pulmonar, con una mortalidad asociada decreciente en ese orden29. Su aparición está asociada frecuentemente a la existencia de factores concomitantes no suficientemente valorados13, y que deberemos tener muy en cuenta al hacer el cribado previo a la indicación individualizada de MTX (tabla 1). Otros factores muy importantes para evitar las toxicidades graves son: hacer un aporte complementario de ácido fólico en situaciones de excesivo consumo del mismo, tener en cuenta las posibles interacciones medicamentosas y asegurar que no haya error en la pauta elegida (con frecuencia es la sobredosis, por error en la ingesta, la causa más frecuente de mielosupresión aguda).
La importancia que tiene el error en la pauta de MTX ha sido motivo de que las autoridades sanitarias de nuestro país (Agencia Española del Medicamento y Productos Sanitarios, AEMPS) emitieran una nota de farmacovigilancia al respecto30, y que el Reino Unido, la National Patient Safety Agency (NPSA) conjuntamente con la British Society Rheumatology (BSR) y la British Academy of Dermatology (BAD) hayan elaborado un folleto de alerta de obligada entrega a los pacientes que toman MTX31.
La farmacocinética ha abierto un camino interesante respecto a la valoración de la toxicidad y la respuesta clínica. El empleo de estudios genéticos para determinar la tasa de metabolización y minimizar el riesgo de toxicidad está establecido en las indicaciones oncológicas32. Como hemos comentado, aún no está esclarecido del todo cuál es el mecanismo de acción de MTX cuando se usa a dosis bajas en la psoriasis, pero parece que guarda relación con el proceso de poliglutamación, clave en la acción antiinflamatoria del fármaco. Este proceso farmacocinético es muy variable entre pacientes, habiéndose comprobado que aquellos pacientes con artritis reumatoide que poseen una acción de poliglutamación alta responden de manera más eficaz a MTX33, por lo que en ese tipo de pacientes podría reducirse la dosis de MTX con igual eficacia, pero menor riesgo de toxicidad.
Asimismo, otros estudios de farmacogenética han puesto de evidencia que la asociación de diversos polimorfismos en las vías metabólicas del folato, pirimidina y purina, o en los trasportadores del flujo intracelular de MTX se asocian a la eficacia y/o toxicidad del MTX en la psoriasis34,35. Los estudios farmacocinéticos no han demostrado, sin embargo, que la efectividad del fármaco se correlacione con la concentración de poliglutamatos de MTX en los hematíes36. Cuando la dosis se ajusta de acuerdo con estudios farmacocinéticos individualizados, la administración de suplementos de folato (20mg/sem) parece reducir la eficacia del fármaco37. Sin duda este es un interesante terreno de investigación para el futuro.
Toxicidad hematológicaEn casos de coexistencia de ciertos factores de riesgo (tabla 1), o en los casos de administración de dosis altas de MTX por error posológico o por una estrategia terapéutica a dosis altas (en el tratamiento de carcinoma epidermoide de cabeza y cuello) la toxicidad más preocupante e inmediata del MTX es la mielosupresión (leucopenia, trombopenia y anemia), ya que puede llegar a producir la muerte.
Esta toxicidad es derivada de la acción tóxica directa del MTX sobre la médula ósea en la mayoría de casos, y es dosis dependiente, si bien en casos históricos y excepcionales se ha referido como reacción idiosincrática, independiente de la dosis. En estos casos suelen asociarse factores favorecedores como la insuficiencia renal, edad avanzada, hipoalbuminemia, hipoplasia medular subyacente, macrocitosis persistente, toma asociada de medicamentos o bajos niveles de ácido fólico38. Esta potencial toxicidad es lo que justifica la consideración de realizar una dosis de prueba inicial de MTX al inicio del tratamiento.
Rescate con ácido folínicoEn los casos en los que aparezca toxicidad hematológica aguda, es prioritario neutralizar y contrarrestar la actividad de MTX mediante el aporte de tetrahidrofolato. Este rescate se realiza mediante el aporte endovenoso de ácido folínico (N5-formil-FH4), el cual se introduce en el ciclo de los folatos y se transforma en tetrahidrofolatos activos, lo que hace innecesaria la transformación de FH2 en FH4.
Debe instaurarse siempre que los niveles plasmáticos de MTX se mantengan por encima de 10−8M más de 48h y hay que tener en cuenta que la dosis de ácido folínico debe aumentarse en proporción a la concentración de MTX que se desea neutralizar. La terapia de rescate no es necesaria cuando se utilizan dosis bajas (15–10mg/m2), ya que los niveles plasmáticos descienden por debajo de 10−8M antes de las 48h. El aporte de ácido folínico es proporcional a la concentración de MTX a las 24h de la ingesta (tabla 4) y su administración debe mantenerse hasta que los niveles de MTX desciendan por debajo de 5×10−8M. Como es lógico, durante el periodo de rescate se deberán realizar determinaciones de la concentración plasmática de MTX cada 12–24h.
Toxicidad hepáticaUn porcentaje pequeño de pacientes pueden presentar una elevación de transaminasas como expresión de toxicidad aguda por el fármaco. Dicha alteración es apreciable en las primeras semanas de inicio de tratamiento, reduciéndose por lo general en las siguientes semanas sin necesidad de reajuste de medicación. Nuevamente se suele relacionar con la presencia de otros factores de riesgo hepático relativo (tabla 1) y es otra de las situaciones que puede justificar la indicación de una dosis de prueba inicial. Desde luego, su aparición y, sobre todo su persistencia, obligan a hacer un seguimiento clínico y analítico más frecuente y/o a ajustar la dosis. La analítica de control para valorar la posible afectación hepática debe realizarse el día previo a la toma de MTX, para desechar la transaminitis que puede aparecer en algunos pacientes el día de la toma del medicamento, que es muy leve y transitoria, no asociada a toxicidad real.
Sin embargo, la mayor dificultad que el uso de MTX a largo plazo ha presentado históricamente es la derivada de su potencial hepatotoxicidad crónica (fibrosis, cirrosis), siendo el principal motivo que justifica el tratamiento intermitente o discontinuo con el fin de evitar la toxicidad acumulativa hepática. Tradicionalmente, para la valoración de este riesgo se ha indicado la realización de biopsia hepática periódica, a partir de una cierta dosis de acúmulo (tan bajas como 1–1,5g, que se alcanzan en dos años de tratamiento a dosis de 15mg/sem)39, condicionando el mantenimiento del tratamiento a los hallazgos patológicos39,40. La supuesta hepatotoxicidad de MTX ha sido más relevante en la literatura dermatólógica39 que en la reumatológica40, y eso podría ser debido a la introducción de ciertos factores de confusión en la valoración de la hepatotoxicidad en los pacientes con psoriasis, lo que ha llevado a replantearse la necesidad de la biopsia hepática41,42. La presencia de esteatosis hepática no alcohólica, cuya prevalencia en los pacientes psoriásicos se acerca al 50%43, asociada a síndrome metabólico e intolerancia a la glucosa44, podría explicar la mayor hepatotoxicidad del MTX en este grupo de pacientes. Además siempre hay que comprobar la posibilidad de que el paciente esté tomando otros fármacos por patología asociada que posean hepatotoxicidad, lo que aumentaría la toxicidad del MTX.
La hepatotoxicidad por MTX sería más frecuente en aquellos pacientes con factores de riesgo previo (tabla 1), especialmente con ingesta abundante de alcohol y antecedentes de hepatopatía, con alteraciones persistentes de las transaminasas, pacientes obesos y/o diabéticos. El consenso actual sugiere que es en este tipo de pacientes en los que la prevención debería ser más exigente, y no tanto en el resto de pacientes, que presentarían un riesgo menor y muy parecido al publicado en las guías de pacientes con artritis reumatoide40. En el grupo de menor riesgo hepatotóxico se ha elevado la dosis acumulativa de alerta hasta los 3,5–4g25.
Biopsia hepáticaAunque tradicionalmente se consideraba que la determinación de transaminasas en los pacientes con psoriasis no constituía un buen marcador de hepatotoxicidad asociada a MTX, estudios recientes indican que la determinación seriada de ALT y GGT, teniendo en cuenta la ingesta de alcohol como factor de riesgo, de forma análoga a lo que se recomienda en pacientes con artritis reumatoide, permitiría seleccionar a los candidatos a biopsia hepática45. En los últimos años se ha valorado la posibilidad de disponer de una medida indirecta del daño hepático mediante la determinación seriada del péptido aminoterminal de protocolágeno III (PIIINP)45. En aquellos pacientes que requieran utilizar MTX a largo plazo, la estandarización de esta determinación puede llegar a sustituir la biopsia hepática46 (o por lo menos limitar su práctica) y, por lo tanto, los riesgos que conlleva (1,5 complicaciones por 1.000 biopsias: hemorragia subcapsular, perforación de vesícula biliar, neumotórax, hemoperitoneo, además de la carga de ansiedad que supone para el paciente al que se le propone realizarla)39. La biopsia hepática no sería necesaria en pacientes con dosis acumuladas de MTX inferiores a 3–4g y niveles normales de PIIINP46,47 (tabla 5). Sin embargo, debe tenerse en cuenta que los niveles de PIIINP pueden estar elevados en presencia de artritis psoriásica activa y esteatohepatitis.
Guía de uso de los valores de PIIINP en pacientes tratados con MTX
| Valores PIIINP (μg/l) | Actitud |
|---|---|
| 1,7–4,2 | Normalidad en adultos |
| >4,2 en al menos 3 muestras realizadas durante un periodo de 12 meses | Considerar realización de una biopsia |
| >8,0 en 2 muestras consecutivas | Considerar realización de una biopsia |
| >10 en al menos 3 muestras realizadas durante un periodo de 12 meses | Considerar supresión del tratamiento |
MTX: metrotexato; PIIINP: péptido aminoterminal de protocolágeno III.
La práctica de otras pruebas no invasivas disponibles permiten predecir la presencia (Fibrotest®) o la ausencia de fibrosis hepática significativa (Fibroscan®), y por lo tanto pueden ser pruebas no invasivas de gran utilidad para la selección de los pacientes candidatos a biopsia hepáticaz48,49.
En nuestra opinión, la consideración de biopsia hepática corresponde a otra época con menor oferta terapéutica para la psoriasis. Los riesgos y costes que conlleva la práctica de biopsia hepática no justificarían su realización, y sería suficiente utilizar como signos de alerta de riesgo de hepatotoxicidad en el uso de MTX a largo plazo la dosis acumulada de 3,5–4g, la alteración de enzimas hepáticas y la variación de los niveles estables de PIIINP50 (tabla 5). En caso de riesgo (niveles PIIINP superiores a 4,2μg/l) se debería considerar realizar la biopsia hepática, o abandonar su uso y buscar una alternativa terapéutica, y manejar al paciente candidato en conjunto con la unidad de hepatología.
Toxicidad pulmonarLa principal toxicidad pulmonar asociada a MTX es la aparición de neumonitis intersticial aguda, que se caracteriza por la aparición de tos no productiva, disnea de reposo, fiebre y afectación del estado general, junto con leucocitosis en la analítica sanguínea y afectación intersticial bilateral difusa e infiltrado alveolar en la radiografía de tórax51 (tabla 6). Aunque es rara, se le ha estimado una incidencia y prevalencia de 3,9 y 5,5% pacientes-año expuestos a MTX52, y aunque parece mucho más frecuente en casos de tratamiento de la artritis reumatoide53,54 que en psoriasis, también se ha referido en pacientes psoriásicos ya desde el inicio de su indicación para esta enfermedad55. Suele presentarse de forma subaguda, sus síntomas aparecen antes de llegar al diagnóstico de confirmación, no parece estar relacionada con la dosis acumulada y en su patogénesis se han involucrado la coexistencia de diversos factores de riesgo, pero con resultados contradictorios52. Ante su sospecha siempre hay que descartar otras causas infecciosas de neumonitis (especialmente por Pneumocystis jiroveci) y su tratamiento requiere la suspensión inmediata del MTX, la administración de corticoides por va sistémica y soporte respiratorio. No está aclarado si la neumonitis secundaria a MTX se produce por hipersensibilidad o como reacción idiosincrática. Asocia un riesgo de mortalidad que algunos autores han cifrado en el 20%56.
Criterios diagnósticos de neumonitis secundaria a MTX (adaptado de Kremer51, Searles80 y McKendry81)
| Criterios clínicos |
|
| Pruebas complementarias |
|
MTX: metrotexato.
La fibrosis pulmonar es otra de las toxicidades asociadas tradicionalmente a MTX, si bien parece estar relacionada con la administración de MTX a dosis altas y no con la dosis baja semanal que se utiliza en psoriasis y artritis psoriásica57. Además, se han comunicado otras reacciones adversas pulmonares (bronquitis con hiperreactividad bronquial, bronquiolitis obliterante con neumonía organizada, edema pulmonar, pleuritis y derrame pleural) en la literatura reumatológica, si bien no está aclarado si dichas reacciones son secundarias al uso de MTX o a la patología de base (artritis reumatoide)58.
Selección de pacientes y manejo clínicoCribado y seguimiento (tabla 7)La indicación de tratamiento con MTX deber ser individualizada para conseguir el mayor beneficio terapéutico con el menor riesgo de toxicidad posible. Debe iniciarse con la historia y examen físico del paciente, valorando tipo y evolución de su psoriasis, artritis asociada, medidas de afectación de la gravedad de la psoriasis (PASI/BSA/PGA/DLQI)59, presencia de comorbilidades y situaciones que puedan suponer contraindicaciones relativas, mayor riesgo hepatotóxico o ajuste de dosis y, particularmente, indagar sobre los medicamentos que el paciente pueda estar tomando por otras indicaciones (tablas 1 y 3).
Cribado de pacientes candidatos a tratamiento con MTX
| Historia clínica |
|
| Estudios basales |
|
| Estudios seguimiento |
|
| Línea de contacto fácil y directa con la consulta de enfermería dermatológica |
MTX: metrotexato; PIIINP: péptido aminoterminal de protocolágeno III; PPD:derivado protéico purificado ; TBC: tuberculosis.
Antes de iniciar el tratamiento debe solicitarse un hemograma completo, pruebas de función hepática y renal, bioquímica y, si procede, test de embarazo y serología de virus (hepatitis B y C, VIH). Se aconseja realizar también Mantoux (y booster si procede) y radiografía de tórax (basal). Esta última recomendación para el despistaje de tuberculosis (TBC) no es aceptada de forma generalizada, pero en nuestra opinión debe realizarse en el contexto de la valoración unificada de un paciente con psoriasis con indicación de tratamiento sistémico (clásico o biológico), pues con frecuencia y debido a la cronicidad de la enfermedad, un mismo paciente es cambiado a algún otro fármaco antipsoriásico con indicación de cribado de TBC, tal como ha sido sugerido por otros autores13, o como referencia basal en el caso de que apareciera una complicación pulmonar.
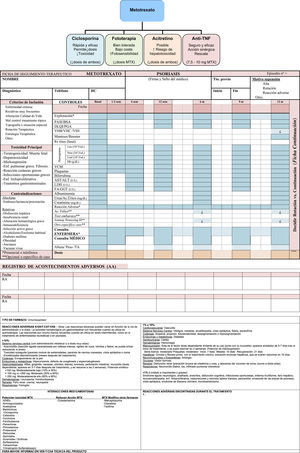
Para el seguimiento se requiere la cooperación y compromiso del paciente. Es necesario que mantenga, un seguimiento presencial en la consulta de enfermería y de dermatología, con un fácil acceso a la misma y con repetición periódica de controles analíticos, tal como se hace en el manejo de pacientes con psoriasis moderada-grave59. Se recomienda hacer un seguimiento protocolizado (fig. 2) (Ficha de Seguimiento Terapéutico) y modificarlo en función de riesgos asociados o alteración de pruebas previas.
Tras la dosis de prueba inicial se recomienda realizar un hemograma a los 7–14 días y posteriormente cada 3 meses. De forma similar se debe valorar la función renal y hepática, al inicio y posteriormente cada 3 meses. En casos que así lo requieran, por coexistencia de riesgos asociados, o alteraciones analíticas basales puede ser necesario hacer determinaciones periódicas más frecuentes hasta su control o normalización. Debe asegurarse la anticoncepción (tanto femenina como masculina), y valorar la necesidad de repetir la prueba de Mantoux (o ensayos de liberación de interferón gamma, si están disponibles) anualmente mientras sean negativas para descartar la presencia de tuberculosis (latente), evidenciada por una conversión de la prueba, mientras se mantenga el tratamiento. Se debe tener un control estricto sobre la dosis total acumulada y si se sospecha toxicidad directa hacer determinaciones de niveles plasmáticos de MTX y, cuando la dosis acumulada supere 1,0–1,5g, en presencia de ingesta enólica abundante, esteatosis hepática o ante la sospecha de toxicidad hepática, de PIIINP, si se dispone de dicha prueba.
Consideraciones de uso y estrategias terapéuticasEl uso tradicional de MTX en la psoriasis ha sido en monoterapia, especialmente cuando la psoriasis se acompaña de artritis, pero con el advenimiento de nuevos fármacos y enfoques estratégicos en el manejo de la psoriasis, el MTX ha adquirido un renovado protagonismo e interés utilizado de forma combinada con otros medicamentos antipsoriásicos. Debemos tener presente que la psoriasis sigue siendo una enfermedad crónica, por lo que las estrategias de rotación, secuenciación o combinación dirigidas a mantener una eficacia terapéutica aceptable con la menor dosis y el menor riesgo posibles siguen estando vigentes, especialmente al considerar la indicación de MTX, dado que su toxicidad más frecuente se relaciona con su acúmulo. Recordemos, que en el manejo de pacientes psoriásicos el tratamiento individual y personalizado, ajustado a los condicionantes de la evolución de la enfermedad y estilos de vida son fundamentales para conseguir el máximo grado de eficacia60.
Dosis de pruebaDado el potencial tóxico de este fármaco y la posibilidad de aparición de reacciones idiosincráticas graves (especialmente hematológica), o leves, pero de consideración (mucositis, transaminasemia), ha inducido a que en la práctica clínica se utilice una dosis reducida inicial de prueba. Sin embargo, no parece haber evidencia ni consenso de práctica clínica sobre la necesidad de ello. De hecho, las reacciones anafilactoides y de hipersensibilidad se han descrito mayoritariamente en pacientes que previamente han tomado MTX, a dosis altas38, y que presentan alguna patología reumatológica, pero no así en el ámbito de uso de MTX a dosis bajas en pacientes con psoriasis. Asimismo, las reacciones de leucopenia o pancitopenia se han descrito sobre todo en pacientes con patología asociada de base (especialmente en hemodiálisis e insuficiencia renal). En nuestra opinión, la administración de dosis de prueba a dosis bajas tiene especial consideración en aquellos pacientes que asocien alguna contraindicación relativa (tabla 1), en pacientes ancianos o en aquella situación clínica que así lo aconseje, siendo una aproximación razonable el reducir la dosis elegida en un 50% en las primeras 1–2 semanas. La ficha técnica del preparado oral recomienda realizar una prueba inicial con 7,5mg y la del preparado inyectable la administración de una dosis de 5 a 10mg61.
En cualquier caso, la importancia del tema no radicaría tanto en la discusión sobre la dosis inicial a emplear, sino en la necesidad de valorar al paciente prontamente (a las 1–2 semanas) tras la primera toma de MTX, tanto clínica como hematológicamente, independientemente de la dosis utilizada de inicio. Si tras esa pronta valoración no se aprecian alternaciones, es razonable subir la dosis a nivel de mantenimiento y seguir el protocolo de seguimiento habitual.
Aporte suplementario de ácido fólicoEl aporte suplementario de acido fólico tiene una acción ambivalente sobre la actividad del MTX: por una parte puede reducir su efecto terapéutico pero por otra parece demostrado que también reduce sus potenciales efectos adversos28. Un reciente metaanálisis62 indica que el aporte suplementario de folatos tiende a reducir la toxicidad hematológica, mucocutánea y gastrointestinal (estando indicada en caso de que estén presentes) y reduce de forma significativa la hepatotoxicidad, aunque no previene ni reduce la toxicidad pulmonar63,64.
Sin embargo, no se acepta de forma universal la necesidad de un aporte suplementario, ni queda claro si es preferible emplear ácido fólico o folínico, ni las dosis y pauta necesarias65, existiendo opiniones contrapuestas sobre su uso rutinario66, y datos ambivalentes sobre una posible reducción de la eficacia terapéutica del MTX62. En algunos pacientes, dependiendo de su perfil metabólico de MTX, la administración de ácido fólico sería preferible a la de ácido folínico, por cuanto aumentaría la eficacia del tratamiento67.
En nuestra opinión, sí es necesario un aporte complementario de ácido fólico en pacientes en tratamiento con MTX que concomitantemente padecen una situación de déficit o mayor consumo de folatos (infecciones o toma de ciertos antibióticos), o en los casos de uso de dosis altas (que no se utiliza en psoriasis). El uso rutinario del mismo debería contemplarse de forma individualizada, en función de que la previsión o compensación de potenciales efectos adversos. Debería valorarse si es más rentable realizar determinaciones sanguíneas periódicas de ácido fólico en pacientes que toman MTX o instaurar aporte suplementario de forma rutinaria. Recordamos que una dieta equilibrada suele aportar cantidades diarias de ácido fólico suficientes. Un parámetro indirecto útil para valorar la indicación de determinar los niveles de ácido fólico puede ser la observación seriada en el tiempo del volumen corpuscular medio (VCM) en el hemograma (descartar macrocitosis).
En cuanto a la dosis y pauta de ácido fólico tampoco existe unanimidad. Una opción es la de indicar la toma diaria de 5mg de ácido fólico (salvo en los días que se toma el MTX), y otra la de pautar ácido folínico 15mg a la semana, a las 24–48h de la toma de MTX. Una posición pragmática, con el fin de simplificar el régimen terapéutico, especialmente cuando el paciente presenta buena salud y no asocia patología o situación de mayor consumo de ácido fólico, puede ser la de indicar una única toma de 5mg 1–2 días, separada 24–48h de la administración de MTX, para no interferir con su efecto terapéutico) y realizar de forma opcional y esporádica, coincidiendo con una analítica de rutina de seguimiento, determinaciones de los niveles de ácido fólico en sangre para, según valores, modificar dosis y/o pauta.
Rotación, secuenciación, intermitenciaDebido a la limitación de uso de MTX en relación con su toxicidad por acúmulo, y dado el gran valor terapéutico de este fármaco no solo como indicación primaria antipsoriásica, sino como fármaco rescatador de brotes de actividad de la enfermedad en pacientes sometidos a tratamientos biológicos, se sugiere mantener una política de ahorro a lo largo del tiempo. Por ello, es con el uso de MTX donde las estrategias de rotación, secuenciación o intermitencia tienen un papel preponderante. Su asociación con acitetrino, con cilclosporina o, incluso, con antipsoriásicos biológicos, ha de tenerse muy en cuenta en el abordaje terapéutico de la psoriasis68.
Dosis de ajusteCon el fin de evitar toxicidades y prolongar el uso de MTX en el tiempo, es recomendable, una vez alcanzado el objetivo terapéutico en el paciente ajustar la dosis a la mínima necesaria eficaz para mantener el blanqueamiento alcanzado. Asimismo, será procedente ajustar la dosis a la de edad del paciente, función renal o ante la presencia de potenciales comorbilidades que asocien riesgo de toxicidad del MTX.
CombinacionesCuando el objetivo terapéutico que se plantea es el de mantener la eficacia y reducir los riesgos de toxicidad asociada, el MTX en combinación con otras terapias o fármacos ha demostrado ser de gran utilidad (fig. 2). Asociado a ciclosporina permite reducir la dosis y la toxicidad de ambos medicamentos, con gran efectividad69,70, si bien hay que tener en cuenta que aumenta el riesgo de inmunosupresión. También se ha demostrado seguro y eficaz combinado con UVB de banda estrecha71, aunque presenta un aumento de la fototoxicidad. También puede asociarse a acitetrino a dosis bajas72, pero sin olvidar que se produce un mayor riesgo de hepatotoxicidad.
Pero quizás donde mejor ha resaltado la utilidad de este fármaco ha sido con la introducción de los tratamientos biológicos de la psoriasis, que han llevado a introducir conceptos en la estrategia terapéutica tales como solapamiento, cambio terapéutico, recuperación de la pérdida de eficacia, bloqueo de anticuerpos anti-TNF, etc. Estas funciones estratégicas las cumplen eficazmente el MTX73,74 y la ciclosporina.
La mayor parte de la experiencia referida al empleo de MTX con fármacos biológicos procede de su empleo combinado en la artritis reumatoide y enfermedad inflamatoria intestinal, donde esta estrategia se ha demostrado particularmente adecuada en el caso de infliximab tanto para optimizar los resultados terapéuticos como para minimizar la pérdida de respuesta y el desarrollo de efectos adversos relacionados con las infusiones. En este sentido, en estudios farmacodinámicos se ha comprobado cómo la adición de dosis bajas de MTX (7,5mg/sem) en pacientes tratados con infliximab disminuye el aclaramiento del fármaco, quizás a través de la inhibición en la formación de anticuerpos frente a este último75. Su utilidad en dermatología no ha sido demostrada de forma explícita. En algunos estudios abiertos se ha sugerido la optimización de resultados clínicos mediante el empleo combinado de MTX con etanercept sin adición de efectos adversos o el empleo de pautas puntuales de MTX durante fluctuaciones de la psoriasis en pacientes en tratamiento continuo con etanercept76,77. La combinación de adalimumab con MTX podría incrementar los resultados clínicos tanto en la psoriasis cutánea como en la articular, según se concluye del estudio ADEPT, en el que se evaluó el resultado de la adición de adalimumab en pacientes según realizasen o no tratamiento con MTX78.
SuspensiónPor otra parte, se debería suspender o modificar el uso de MTX en caso de aparición de efectos adversos o intolerancia, fracaso terapéutico o respuesta insuficiente respecto al objetivo terapéutico marcado al inicio del tratamiento, aparición de nuevas situaciones o comorbilidades en el paciente que no justifiquen riesgo/beneficio terapéutico o cuando se haya acumulado una dosis importante (1,5–2g en pacientes con alto perfil de riesgo hepático y 3,5–4g con bajo perfil de riesgo hepático) y no se disponga de la posibilidad de determinar PIIINP. En el contexto del panorama actual, con la amplia gama de terapias antipsoriasis, no parece justificado la realización de biopsias hepáticas como medida de control de seguridad del uso de MTX, salvo en situaciones excepcionales. La suspensión brusca de MTX no suele asociarse a un efecto rebote de las lesiones.
Conclusiones (tabla 8)El MTX fue el primer fármaco de uso sistémico para la psoriasis. Con más de 50 años de experiencia sigue siendo eficaz, seguro, barato y cómodo para su uso por vía oral, por lo que puede considerarse el estándar de la terapia sistémica39, especialmente cuando se plantean estrategias antipsoriásicas a largo plazo con un fármaco sistémico clásico en pacientes bien seleccionados y controlados. Sin duda, existen hoy día otros medicamentos, especialmente los denominados biológicos, que han aportado una mayor eficacia terapéutica. Sin embargo, el MTX sigue teniendo un papel importante en ese escenario, comportándose como un fiel aliado en estrategias de rescate, pérdida de respuesta o en asociaciones. El futuro próximo puede hacer todavía más específica y eficaz su indicación, a medida que las investigaciones farmacogenéticas permitan identificar a aquellos pacientes con mayor posibilidad de respuesta y menor riesgo de efectos adversos, así como por la posibilidad de evitar la práctica de biopsias hepáticas para determinar su potencial hepatotoxicidad por acúmulo.
Resumen
| Indicaciones |
|
|
| Contraindicaciones |
| |
| Eficacia |
| |
| Dosificación |
| |
| Dosis de prueba |
| |
| Aporte ácido fólico |
| |
| Toxicidad grave |
| |
| Toxicidad leve |
| |
| Precaución especial |
| |
| Estrategias |
| |
| Combinaciones |
|
|
| Rotación/cambio |
| |
| Cribado y seguimiento |
| |
MTX: metrotexato; PASI:Psoriasis Activity Skin Index.
Por todo ello, podemos concluir que el MTX tiene pasado, tiene presencia actual y muy probablemente la tenga en años venideros, tal como han opinado otros autores79.
Conflicto de interesesLos autores no reconocen ningún conflicto de interés en relación con la confección de la presenta guía. Sin embargo, todos los participantes en la misma han tenido y/o tienen diverso grado de relación con la industria farmacéutica y han recibido remuneración económica por colaboración en conferencias, investigación en ensayos clínicos o asesoría científica de las mismas. Al final del trabajo, en el addendum, se hace relación de las declaraciones personales.