El papel de la vitamina D en enfermedades cutáneas ha cobrado interés en los últimos años. La relación entre esta vitamina y algunas dermatosis ha supuesto la publicación de múltiples trabajos al respecto. Como dermatólogos, conocer sus principales fuentes, síntesis, niveles plasmáticos y algunos de los factores modificadores son varios de los aspectos a recordar. Asimismo, es preciso resaltar los últimos descubrimientos sobre el papel de la vitamina D en las diferentes enfermedades dermatológicas, como el lupus eritematoso, la ictiosis, la dermatitis atópica, la hidrosadenitis supurativa, el acné, la alopecia areata y androgenética, el melanoma y el cáncer cutáneo no melanoma, así como la relevancia como terapia adyuvante en pacientes en tratamiento crónico con corticoides. Acercamos al lector la información más relevante y reciente de la relación entre la vitamina D y las enfermedades de la piel, así como la importancia de conocer los niveles de esta vitamina.
In recent years, the growing interest in the role played by vitamin D in skin disease has given rise to the publication of many studies of the relationship between this vitamin and certain skin conditions. As dermatologists, we need to understand, among other aspects, how vitamin D is synthesized and the main sources in humans, as well as plasma levels and the factors that can modify them. Of particular interest are the latest discoveries about the role of vitamin D in skin diseases such as lupus erythematosus, ichthyosis, atopic dermatitis, hidradenitis suppurativa, acne, alopecia areata, androgenetic alopecia, melanoma, and nonmelanoma skin cancer. Also of interest is the importance of vitamin D as adjuvant therapy in patients on long-term treatment with corticosteroids. In this review, we provide an overview of the most important and most recent information regarding the relationship between vitamin D and skin disease and discuss the importance of assessing individual vitamin D status and correcting deficiencies.
El raquitismo, una enfermedad relacionada con el déficit de vitamina D, fue descrito por primera vez por Glisson, DeBoot y Whistler en el siglo diecisiete. Posteriormente, en 1882, Sniadecki se percató de la importancia de la exposición solar para la prevención y curación de la condición. Hoy sabemos que la función de la vitamina D en el organismo va más allá de la regulación en el metabolismo mineral óseo, implicando a un amplio abanico de especialidades médicas en la función de esta vitamina. En 1945 Charpy1 publicó el primer trabajo que relacionaba la vitamina D y el lupus vulgar. Deschasaux et al. publicaron en 20162 qué sabía la población sobre la vitamina D, observando que más de un tercio de la misma desconocía el papel de esta vitamina en el organismo, datos relevantes dado que hasta el 40% de la población estudiada mostraba niveles insuficientes. En los últimos años han aparecido nuevos e interesantes trabajos que relacionan los niveles de vitamina D y algunas dermatosis frecuentes. El objetivo de este trabajo es acercar al lector la relación entre la vitamina D y la dermatología con el nivel de evidencia que existe actualmente.
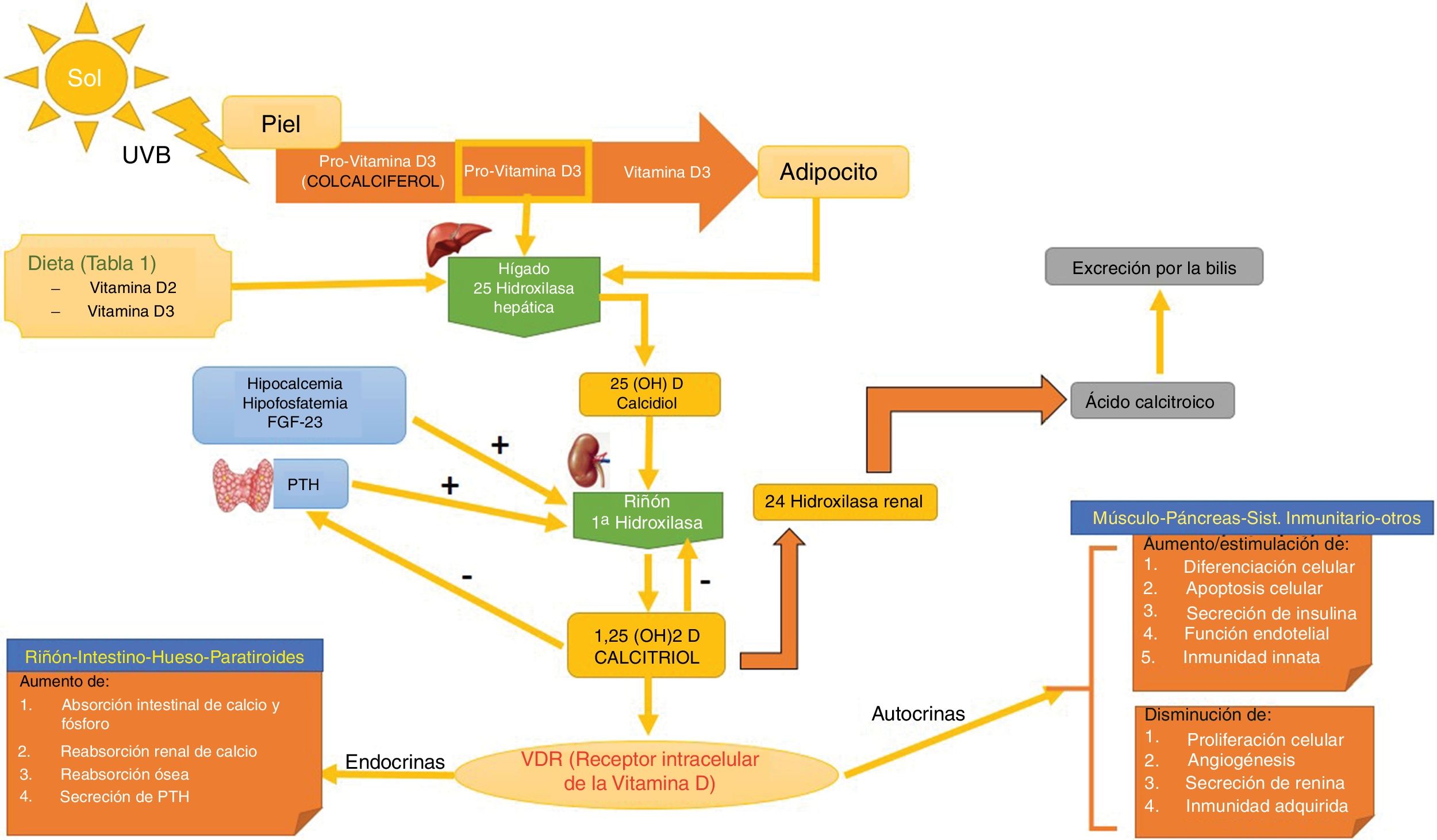
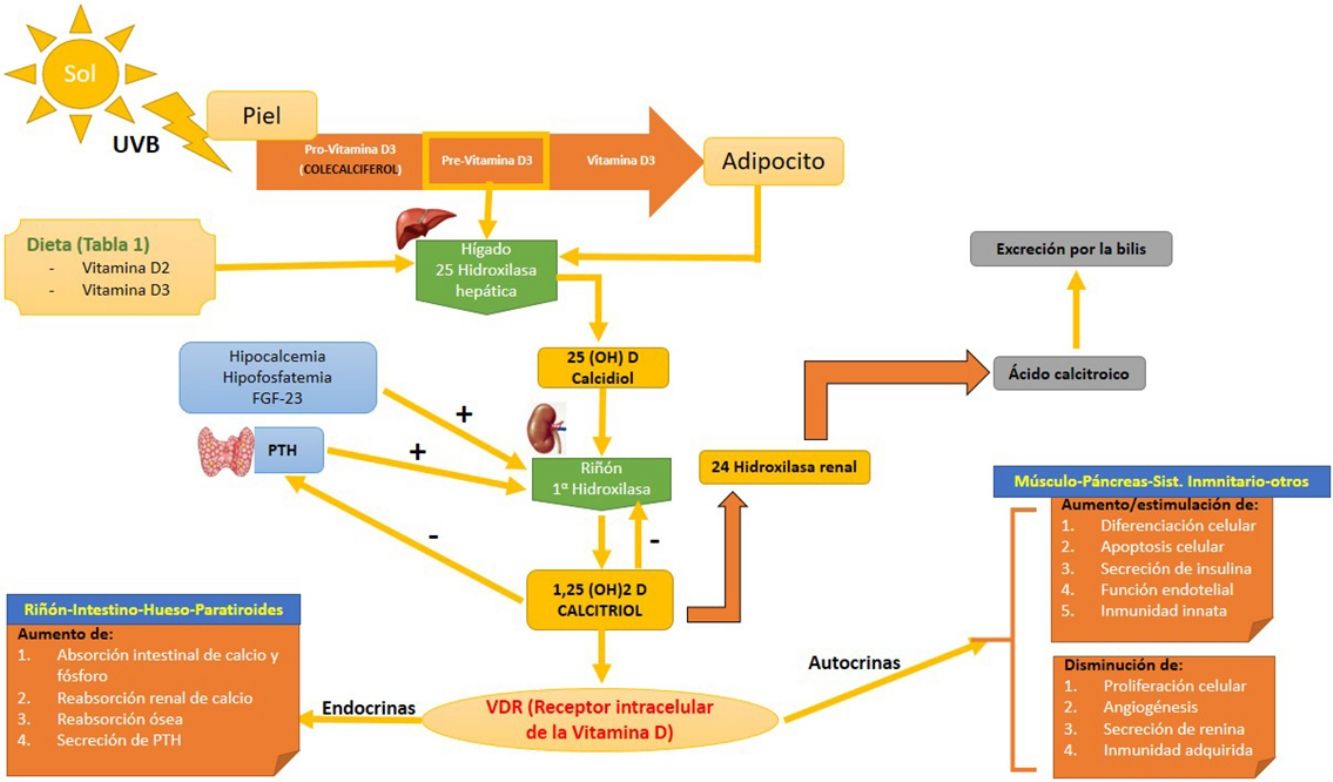
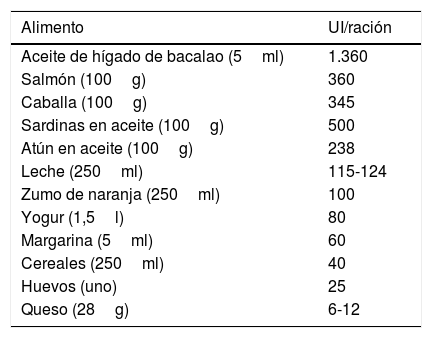
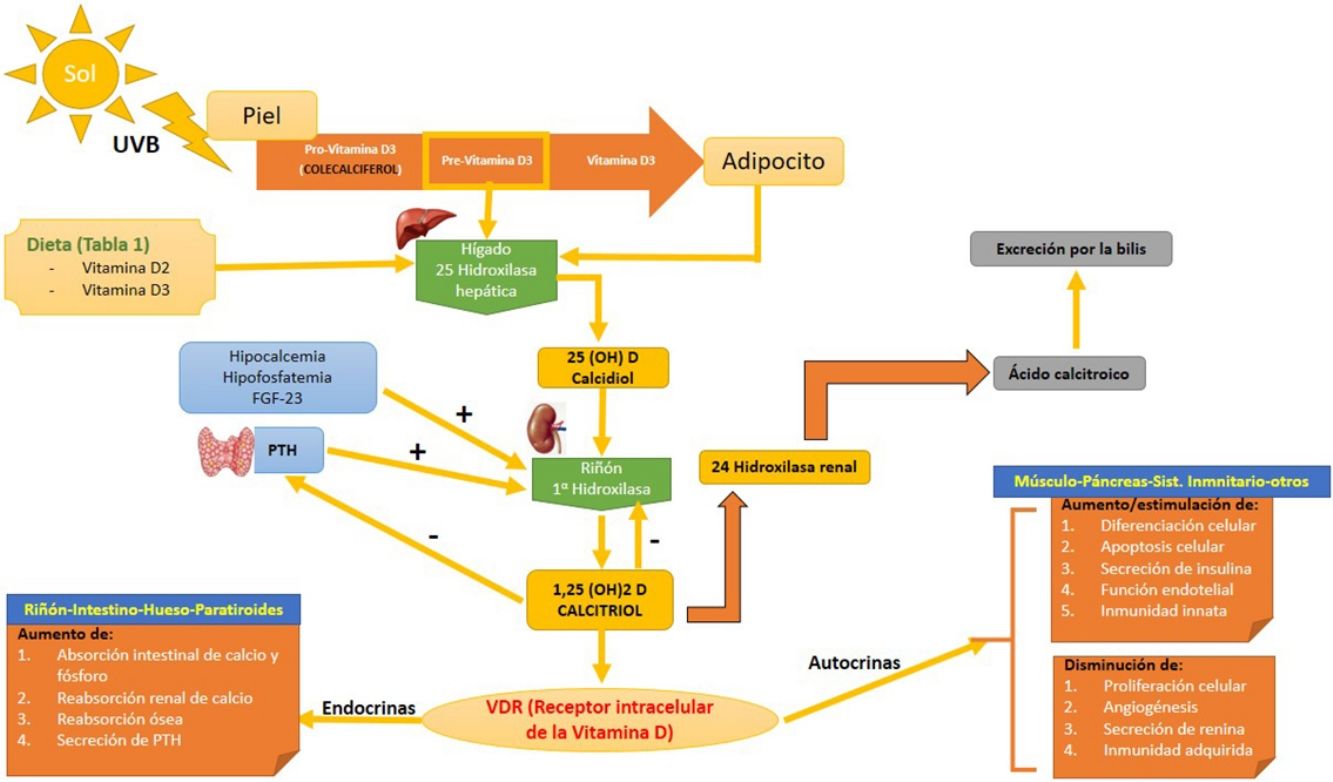
Síntesis (fig. 1)Existen 2 formas de obtener vitamina D. A través de la alimentación, una pequeña parte de la vitamina D activa en forma de colecalciferol se obtiene a partir de su consumo en alimentos de origen animal, siendo los alimentos más ricos en ella algunos pescados azules y la yema de huevo (tabla 1). Otra forma de provitamina D, el ergocalciferol, se encuentra en pequeñas cantidades en alimentos de origen vegetal. Y otra forma, mediante la exposición solar, donde los fotones de la radiación UVB fotoisomerizan el 7-dehidrocolesterol de la epidermis a precolecalciferol, que rápidamente es convertido por una reacción mediada por calor a colecalficerol o vitamina D3. Ambas moléculas son hidroxiladas en el hígado a calcifediol (25-hidroxivitamina D [25(OH)D]), que a su vez sufre una segunda hidroxilación a nivel renal mediante la acción de la enzima 25(OH)D-1-hidroxilasa a calcitriol, metabolito activo que realiza las diferentes funciones al unirse a su receptor celular. Entre las moléculas que participan en la regulación de este proceso, encontramos los niveles de PTH, los niveles de calcio y fósforo, e incluso el TGF-beta.
Alimentos ricos en vitamina D
| Alimento | UI/ración |
|---|---|
| Aceite de hígado de bacalao (5ml) | 1.360 |
| Salmón (100g) | 360 |
| Caballa (100g) | 345 |
| Sardinas en aceite (100g) | 500 |
| Atún en aceite (100g) | 238 |
| Leche (250ml) | 115-124 |
| Zumo de naranja (250ml) | 100 |
| Yogur (1,5l) | 80 |
| Margarina (5ml) | 60 |
| Cereales (250ml) | 40 |
| Huevos (uno) | 25 |
| Queso (28g) | 6-12 |
Fuente: Gilaberte et al.15.
Metabolismo de la vitamina D. Se puede adquirir la vitamina D a través de la dieta, o bien mediante una reacción a través de la UVB donde la la provitamina D3 (sintetizada a nivel cutáneo) es convertida a previtamina D3. El primer paso hepático la convierte a calcidiol o 25(OH)D mediante la 25 hidroxilasa hepática. El segundo paso a nivel renal la convierte en su metabolito activo, 1,25(OH)D o calcitriol a través de la alfa-1-hidroxilasa renal. Este mecanismo está regulado por los niveles séricos de calcio y fósforo inorgánico, entre otros, que son detectados por la glándula paratiroides, secretando la PTH. Ambos aumentan la actividad de la alfa-1-hidroxilasa. Los niveles de calcitriol regulan la secreción de PTH. La 1,25(OH)D actúa a través de los receptores de vitamina D (VDR) intracelulares, que activa el proceso de transcripción y traslación del ARN mensajero con la síntesis de proteínas dependientes de vitamina D, con su correspondiente actividad en función de la célula diana. La excreción de la vitamina D a través de la bilis está mediada por la actividad de la 24 hidroxilasa renal, que convierte el 1,25(OH)D en ácido calcitroico.
Los requerimientos diarios de vitamina D dependen de la edad y además son diferentes según la sociedad médica consultada. Así, según el Instituto de Medicina (IOM) se necesitan 400UI al día en el primer año de vida, 600UI al día entre 1 y 70 años de edad, alcanzando las 800UI al día en mayores de 70 años3. Sin embargo, la American Endocrine Society recomienda entre 400-1.000UI/día en el primer año de vida y entre 600-1.000UI/día por encima de esta edad.
En 2009 se consolidó como marcador óptimo de vitamina D en sangre la 25(OH)D4. En cuanto a los niveles deseables, de nuevo varían según las sociedades. Mientras que para el IOM a partir 20ng/ml serían niveles suficientes y saludables de vitamina D (anexo), la American Endocrine Society establece que por debajo de este nivel existe deficiencia, entre 20 y 30ng/ml insuficiencia, considerando suficiente un valor por encima de 30ng/ml (75mmol/l) para mantener una salud óptima5. Actualmente existe una alarma mundial en cuanto al déficit de vitamina D tanto en población sana como enferma. A raíz de este problema se publicó en The New England Journal of Medicine (NEJM)6 el planteamiento de si realmente esta situación correspondía a una pandemia. Entre un 35-70% de la población europea muestra niveles insuficientes de 25(OH)D según ciertos estudios7, mientras que en Australia y Nueva Zelanda este porcentaje es del 9 y el 6%, respectivamente. La publicación de estos datos podría plantear la posibilidad de realizar un screening de vitamina D a personas sanas, sin embargo, esta medida no está respaldada por el IOM y el US Preventive Services Task Force, motivo por el que no se recomienda de manera rutinaria.
La toxicidad por vitamina D puede conllevar serios riesgos para la salud. Se consideran niveles tóxicos por encima de 200ng/ml séricos de manera persistente. Los síntomas más frecuentes son la anorexia, la pérdida de peso, la poliuria y las arritmias cardíacas. Además, aumenta el riesgo de formación de cálculos renales, así como la calcificación de vasos sanguíneos y tejidos, con las correspondientes complicaciones asociadas. Esta situación puede observarse en ingestas de vitamina D superiores a 10.000UI al día, lo que implica niveles de 25(OH)D por encima de 200-240ng/ml. No obstante, la mayoría de asociaciones no recomiendan niveles de 25(OH)D por encima de 125-150ng/ml para poder evitar los efectos secundarios del exceso de esta vitamina.
Factores modificadoresExisten personas con mayor susceptibilidad para presentar niveles deficientes de vitamina D, por debajo de los 20ng/ml establecidos (tabla 2). Entre ellos, los factores de riesgo reconocidos son la obesidad8, el tabaquismo activo9, los fototipos altos10, aunque esto actualmente es controvertido, la exposición solar insuficiente, y la edad11. Los ancianos muestran menor síntesis cutánea de 7-dehidrocolesterol, disminución de la absorción intestinal de vitamina D secundaria a un menor número de receptores de vitamina D en los enterocitos, junto con una menor capacidad de hidroxilación de la vitamina a nivel hepático y renal. Existen ciertas situaciones clínicas que predisponen a tener niveles de vitamina D inadecuados12, como la osteoporosis, la enfermedad renal crónica, la insuficiencia hepática, la enfermedad inflamatoria intestinal, el hiperparatiroidismo, el hipertiroidismo, el hipogonadismo, la enfermedad celiaca, y la toma crónica de algunos fármacos como anticonvulsivantes, antirretrovirales, rifampicina, tratamiento hormonal para el cáncer de mama o próstata, y, sobre todo, los corticoides. El embarazo es una situación fisiológica que también puede condicionar niveles bajos de 25(OH)D.
Factores de riesgo asociados a niveles bajos de vitamina D
| Factores de riesgo de hipovitaminosis D |
|---|
| Exposición solar inadecuada (actualmente controvertido) |
| Tabaquismo |
| Obesidad |
| Fototipo alto (IV o mayor) |
| Ancianos |
| Institucionalizados |
| Tratamiento activo con corticoides, antiepilépticos, tratamiento hormonal para el cáncer de mama o próstata, inmunosupresores o antirretrovirales |
| Antecedentes personales de osteoporosis |
| Enfermedad renal crónica |
| Insuficiencia hepática |
| Enfermedad inflamatoria intestinal |
| Hiperparatiroidismo |
| Hipogonadismo |
| Enfermedad celiaca |
Bikle13 publicó en 2016 las principales funciones de la vitamina D. Recientemente se ha publicado un artículo respecto a la relación entre la vitamina D y la dermatología14. Se ha demostrado que la vitamina D tiene propiedades antiproliferativas, como inhibir la angiogénesis, la capacidad metastásica de algunas neoplasias, participar en la reparación del DNA, e incluso la relación entre ciertas mutaciones en el receptor de la vitamina D y el cáncer. Desde el punto de vista metabólico, la vitamina D juega un papel importante en la homeostasis glucídica, lipídica y arteriovascular. También participa en la modulación del sistema inmunitario, ya que regula la diferenciación de los linfocitos Th 1-9-17, así como la inducción de la formación de pépticos antimicrobianos como catelicidinas. En dermatología es importante por su papel inmunomodulador del queratinocito, como describen Gilaberte et al.15. La vitamina D juega un papel importante en la homeostasis de la glucosa a través de la secreción de insulina por las células beta pancreáticas16, que expresan alfa-1-hidroxilasa mediante la estimulación celular a través de sus receptores para la vitamina D de alta afinidad. A su vez disminuye la resistencia insulínica periférica mediante la activación de los receptores PPAR-gamma a nivel hepático, muscular y adiposo. Esta relación ha postulado el papel de la vitamina D como factor protector en el desarrollo de la diabetes mellitus tipo 217. En cuanto al metabolismo lipídico, la vitamina D puede actuar de manera indirecta, no solo por la posible acción secundaria de mejorar la resistencia periférica a la insulina18, o por la disminución de la concentración de PTH, que ha demostrado tener un efecto lipolítico19, sino también por la reducción de la producción hepática de lípidos a través de un aumento de la calcemia, que podría reducir la producción hepática de triglicéridos20. Pittas et al. en 201021 publicaron una revisión sistemática sobre la relación entre la presión arterial y los niveles de vitamina D. La conclusión del trabajo fue que niveles deficientes de vitamina D (<20ng/ml) se asociaban a un mayor riesgo de desarrollar hipertensión arterial. Otros estudios han demostrado que la suplementación con vitamina D mejoró las cifras de presión arterial en aquellos pacientes hipertensos22. Esto es mediado por diferentes efectos; en primer lugar, efectos directos sobre los receptores de la vitamina D que disminuyen la inflamación vascular y corrigen la disfunción endotelial; por otro lado, regula la proliferación, migración y mineralización de las células musculares vasculares23; y por último, también por el efecto indirecto que posee al disminuir la concentración plasmática de PTH, hormona que actúa sobre el sistema renina-angiotensina-aldosterona. Además, recientemente se ha comprobado su efecto estimulante del óxido nítrico reduciendo el estrés oxidativo en el sistema cardiovascular24. Por tanto, como podemos observar, la vitamina D no solo posee acción sobre el metabolismo óseo, sino que está involucrada en muchas otras funciones en el organismo (tabla 3).
Funciones de la vitamina D en el organismo
| Funciones de la vitamina D |
|---|
| Papel en el metabolismo mineral óseo |
| Papel en el control de la cancerogénesis y metástasis. Antiproliferativo, prodiferenciación, incrementa la apoptosis, inhibe la angiogénesis, participa en la reparación del DNA |
| Regulación de la glucemia. Regula la secreción de insulina por el páncreas y disminuye la resistencia periférica a la insulina |
| Regulación de la síntesis de lípidos |
| Regulación de la presión arterial a nivel del sistema renina-angiotensina-aldosterona. Inhibe la producción de renina a nivel renal |
| Estimula la síntesis de óxido nítrico en el sistema cardiocirculatorio |
| Efecto inmunomodulador en el queratinocito. Regula la proliferación y diferenciación en estadios iniciales |
| Regula el ciclo de crecimiento del folículo piloso |
| Regulación de las vías innata y adaptativa del sistema inmunitario. Participa en la proliferación y activación de las células dendríticas, regulación de la activación de los linfocitos CD4, reduce la formación de linfocitos Th 1-9-17, promueve la diferenciación de los Th2 y T reguladores. Participa en la activación de los receptores selectivos Toll-like (TLR 1/2) |
La vitamina D se ha implicado en la patogenia e incluso en el tratamiento de una gran variedad de enfermedades dermatológicas que a continuación se van a comentar.
PsoriasisKrafka25 y Thacker26 relacionaron por primera vez la psoriasis y la vitamina D. El ensayo de vitamina D oral como tratamiento fracasó dado el riesgo de hipercalcemia, de modo que los análogos tópicos (calcipotriol y tacalcitol) fueron una auténtica revolución en el tratamiento de esta enfermedad. Bergler-Czop y Brzezińska-Wcislo27 publicaron la relación entre los niveles plasmáticos de 25(OH)D y el PASI, observando puntuaciones mayores en pacientes con niveles más bajos. Orgaz-Molina et al.28 demostraron que aquellos pacientes con psoriasis y un IMC por encima de 27 mostraban mayor riesgo de presentar niveles insuficientes de 25(OH)D. A su vez se han relacionado las comorbilidades de la psoriasis (diabetes mellitus, obesidad y síndrome metabólico) con una dieta pobre en vitamina D29. Es necesario recomendar dietas que aporten esta vitamina dado el efecto beneficioso sobre muchas de las comorbilidades asociadas a la psoriasis. Actualmente el uso de la vitamina D en psoriasis presenta un grado de recomendación B, con un nivel de evidencia IIa.
Dermatitis atópicaLa dermatitis atópica (DA) es una enfermedad inflamatoria crónica y recurrente, caracterizada inicialmente por prurito y lesiones eccematosas. Afecta hasta un 20% de la población infantil, y en torno al 7,2% de los pacientes adultos30. Se relaciona con una alteración del sistema inmune cutáneo y el defecto en la síntesis de la barrera cutánea, principalmente filagrina31,32. Se han sumado múltiples publicaciones que estudian la asociación entre la DA y la vitamina D. Kim et al.33 publicaron un metaanálisis y revisión sistemática de 11 artículos, 7 estudios observacionales y 4 ensayos clínicos. Comparados con los controles, los pacientes con DA presentaban niveles más bajos de vitamina D, sobre todo en edad pediátrica. Los suplementos orales de vitamina D se relacionaron con disminución en la puntuación del SCORAD y el EASI en pacientes en edad pediátrica, considerándose un posible tratamiento adyuvante en caso de niveles deficientes (por debajo de 20ng/ml). Van der Schaft et al.34 publicaron una serie de 210 pacientes adultos con DA donde la suplementación con vitamina D en caso de niveles deficientes no mostró mejoría significativa en las lesiones eccematosas. Se han publicado varios trabajos35-37 en los que la suplementación de vitamina D en niños disminuye la colonización de Staphylococcus aureus, microorganismo que participa en los brotes de DA. A pesar de confirmar que los pacientes con DA del adulto presentan niveles de vitamina D insuficientes38, existen controversias respecto a la adyuvancia de esta vitamina en este grupo etario; en la edad pediátrica presenta un grado de recomendación B y un nivel de evidencia IIa.
Ictiosis congénitaLos pacientes con ictiosis congénita muestran niveles bajos de 25(OH)D asociados a cifras de PTH elevadas39. De hecho, la suplementación con vitamina D en estos pacientes con 60.000UI de colecalciferol oral durante 10 días, y posteriormente 400-600UI/día de mantenimiento, mostró una rápida respuesta al tratamiento con evidente mejoría del cuadro dermatológico al quinto día, tanto en la descamación como en la disminución de la rigidez cutánea. De los 7 niños estudiados, 6 mostraban niveles de 25(OH)D por debajo de 4ng/ml. Aunque se necesitan más estudios al respecto, tales datos abren una puerta interesante al manejo de la ictiosis congénita. Lucker et al.40 publicaron los resultados obtenidos de la aplicación tópica de calcipotriol en pacientes con ictiosis congénitas (síndrome de Netherton, lamelar, ampollosa de Siemens y la forma eritrodérmica de Brocq). Salvo la forma ampollosa, el resto mejoraron la descamación y el enrojecimiento asociado. Respecto a las ictiosis donde no predomina la hiperproliferación epidérmica y la hiperqueratosis de retención, como la ictiosis ligada a X, la vulgar o las formas adquiridas, la aplicación tópica de análogos de la vitamina D no demostró ser efectiva41. Neema et al.42 plantearon la posibilidad de asociar vitamina D al tratamiento con retinoides orales en aquellos pacientes con niveles bajos de vitamina. A pesar de los resultados publicados, actualmente el grado de recomendación de la suplementación con vitamina D en los pacientes con ictiosis es C y el nivel de evidencia es IIIa.
AcnéEl interés por el papel de la vitamina D en el acné surgió en 193843. En 2016 se publicó en PloS One44 un estudio comparativo de niveles séricos de 25(OH)D en adolescentes con y sin acné. Estos mostraron niveles más bajos respecto al grupo control, existiendo una relación inversa entre los mismos, y la gravedad del acné y el número de lesiones inflamatorias. Tras suplementar durante 2 meses con vitamina D se observó una reducción de las lesiones inflamatorias sin cambio en las no inflamatorias. La relación entre la vitamina D y la reducción en la síntesis de IL-6 y 8 y metaloproteinasa-945, o la reducción en la expresión de IL-17 mediante la acción sobre el linfocito Th1746, podría justificar su papel en esta enfermedad. Zouboulis et al.47 describieron el efecto sobre las glándulas sebáceas y el aumento de la lipogénesis cuando existen niveles insuficientes de vitamina D, y por tanto, un aumento de lesiones inflamatorias. Recientemente se ha publicado un trabajo48 donde se observó que los niveles de 25(OH)D aumentaron en aquellos pacientes que habían recibido isotretinoína oral, comparados con los niveles previos al inicio del tratamiento, concluyendo que el papel de la vitamina D en la patogénesis inflamatoria de las lesiones de acné juega un papel importante en el desarrollo de las mismas. Actualmente el uso de la vitamina D en el acné presenta un grado de recomendación B, con un nivel de evidencia IIb.
Hidrosadenitis supurativaLa hidrosadenitis supurativa (HS) es una de las enfermedades inflamatorias crónicas en dermatología con una importante repercusión en la calidad de vida del paciente. Se han publicado trabajos relacionando los niveles de vitamina D y la HS49,50. Los pacientes con HS presentan niveles más bajos de vitamina D comparados con la población sana, y a su vez los niveles de vitamina D son inversamente proporcionales a la gravedad de la enfermedad. El suplemento de vitamina D durante 6 meses mostró una mejoría de los nódulos inflamatorios en el 79% de los pacientes (14 pacientes tratados); sin embargo, como ocurre con el acné, las lesiones no inflamatorias no mostraron cambios significativos. Como se ha descrito en algunos trabajos51, las alteraciones metabólicas y endocrinas de la enfermedad convierten a la vitamina D en uno de los focos terapéuticos, dada su relación con el síndrome metabólico, entre otros. Es necesario desarrollar estudios futuros bien diseñados y con un número de pacientes suficiente para poder determinar el papel que juega la vitamina D en la HS. Actualmente su uso presenta un grado de recomendación B, con un nivel de evidencia III.
VitíligoExisten en la literatura más de 300 artículos que relacionan la vitamina D con el vitíligo. Karagün et al.52 estudiaron los niveles plasmáticos de vitamina D en 50 pacientes, y observaron niveles más bajos comparados con los controles sanos, así como una correlación inversa con la extensión de la enfermedad. Upala y Sanguankeo53 concluyeron en su metaanálisis que existe una clara relación entre el vitíligo y los niveles bajos de vitamina D. Actualmente disponemos de publicaciones referentes al tratamiento con análogos de la vitamina D sólo54 o combinados con otros tratamientos55, con resultados variables. Sin embargo, no disponemos de ensayos clínicos que demuestren la eficacia de los suplementos de vitamina D en estos pacientes. Khurrum y AlGhamdi56 no encontraron diferencias significativas en los niveles de vitamina D entre pacientes con vitíligo y controles sanos; no obstante, en el análisis por subgrupos, se observó que en el grupo de pacientes con vitíligo los niveles más bajos de vitamina D se asociaban a ser varón, joven, con un corto tiempo de evolución del vitíligo y a no haber recibido tratamiento con fototerapia. Actualmente el uso de la vitamina D en el vitíligo presenta un grado de recomendación B, con un nivel de evidencia IIa.
Lupus eritematoso sistémico (LES)El lupus eritematoso sistémico (LES) presenta niveles deficientes de vitamina D en comparación con la población sana, como se ha demostrado en múltiples trabajos57,58. En la revista PloS One59 se publicó la relación entre los niveles de vitamina D y la gravedad del LES, donde el 71,4% de los pacientes presentaban niveles de vitamina D por debajo de los 30ng/ml. Además, se observó relación entre niveles más bajos de vitamina D y la actividad de la enfermedad con peores puntuaciones en la escala SLEDAI. Sin embargo, la suplementación de 400-1.000UI/día de vitamina D no consiguió niveles por encima de 30ng/ml. Karimzadeh et al.60 publicaron un estudio comparativo con placebo, en el cual los pacientes con LES suplementados con vitamina D presentaban un aumento significativo de 25(OH)D sérica sin efectos sobre la actividad de la enfermedad. Algunos trabajos61 defienden la importancia de suplementar con vitamina D por el efecto protector cardiovascular, la posible mejoría de los síntomas sistémicos y el desarrollo cognitivo de los pacientes. Recientemente se ha publicado una revisión sobre el tema en la cual se defiende el papel de la vitamina D en el LES por su función inmunomoduladora62. El uso de la vitamina D en LES presenta un grado de recomendación B, con un nivel de evidencia IIa.
Erupción solar polimorfa (ESP)La erupción solar polimorfa (ESP) es una fotodermatosis idiopática de etiopatogenia desconocida, más frecuente en mujeres jóvenes, relacionada con la exposición a la radiación UVA, y menos frecuentemente a UVB. Schweintzger et al.63 describieron la ausencia de relación entre el número y función de los linfocitos T reguladores y los niveles de vitamina D, considerando que existen otros factores que afectan a la respuesta inmunológica que sucede en la ESP. Sin embargo, se ha demostrado que los pacientes con ESP muestran niveles bajos de vitamina D, y que la exposición a UVB 311nm mediante fototerapia los aumenta64, correlacionándose con una mejoría clínica de las lesiones. Gruber-Wackernagel et al.65 publicaron un único ensayo clínico comparado con placebo, donde se observó que la aplicación tópica de calcipotriol una semana antes de la exposición reducía los síntomas casi en un tercio de los pacientes expuestos al fototest, considerándolo una posible medida profiláctica. No obstante, esta medida no se ha instaurado de manera consensuada en las unidades de fotobiología como tratamiento de la ESP. El uso de la vitamina D en la ESP presenta un grado de recomendación B, con un nivel de evidencia IIb.
Alopecia areataDiferentes trabajos han explorado el papel de la vitamina D en la alopecia areata (AA)66-69. Thompson et al.70 no encontraron asociación entre la suplementación con vitamina D y la incidencia de AA en una cohorte de 55.929 mujeres. Sin embargo, otros trabajos han observado que los pacientes con AA presentan niveles más bajos de vitamina D respecto a los controles sanos71, y que estos son aún más bajos en aquellos con AA universal frente a las formas ofiásicas o en placas. No obstante, los niveles de vitamina D no presentan diferencias significativas según la edad, el sexo, la duración de la enfermedad o su recurrencia, o la historia familiar de AA. La determinación del número de receptores de vitamina D en sangre y a nivel tisular presentó niveles más bajos respecto al grupo de controles sanos. A pesar de que los análogos tópicos de la vitamina se pueden utilizar en la AA72,73, no hay estudios que demuestren que los suplementos orales con vitamina D sean eficaces en la enfermedad. Actualmente el uso de la vitamina D en la AA presenta un grado de recomendación B, con un nivel de evidencia IIb.
Melanoma y metástasis de melanomaEl interés por conocer el papel de la vitamina D en el melanoma ha sido objeto de múltiples trabajos74-77. Orlow et al.78 identificaron ciertos haplotipos de SNPs del receptor de la vitamina D (VDR) relacionados con el aumento de la supervivencia en aquellos melanomas de áreas fotoexpuestas (rs1544410/BsmI y rs731236/TaqI). Posteriormente, se publicó la relación inversamente proporcional entre el grosor del Breslow y los niveles de vitamina D79, así como la posible relación con la ulceración80 en aquellos pacientes con niveles séricos bajos. De hecho, se ha demostrado que aquellos pacientes con niveles bajos de vitamina D detectados tras el diagnóstico de melanoma, e incluso aquellos que tras iniciar el suplemento no alcanzaron niveles por encima de 20ng/ml, presentaron peor pronóstico. Sin embargo, en un estudio reciente realizado a 3.578 pacientes, no se encontró una relación significativa entre la supervivencia del melanoma, determinada por el nivel de Breslow, el número de mitosis y la ulceración, y los polimorfismos (SNPs) descritos en la vía de la vitamina D y su receptor81. Dicha controversia se ha convertido en el motor de nuevos estudios al respecto, para determinar la posible ventaja de recomendar suplementos de vitamina D en pacientes con melanoma en áreas expuestas o no a la radiación solar82. El uso de la vitamina D en los pacientes con melanoma presenta un grado de recomendación B, con un nivel de evidencia IIb.
Cáncer cutáneo no melanoma (CCNM)El papel de la vitamina D en la carcinogénesis83 dio lugar al estudio de su relación con el cáncer cutáneo no melanoma (CCNM)84. Tanto el carcinoma basocelular como el espinocelular expresan receptores de vitamina D en sus células. Eide et al.85 relacionaron niveles elevados de vitamina D con un aumento del riesgo de carcinomas de origen queratinocítico. Por otro lado, la vitamina D es capaz de inhibir la vía de señalización del hedgehog en el carcinoma basocelular86. Se ha identificado que el polimorfismo del receptor de la vitamina D Bsml aumenta el riesgo de tener un CCNM87. Sin embargo, en un estudio prospectivo con más de 60.000 participantes, el suplemento de vitamina D88 no se asoció con el riesgo de carcinoma espinocelular ni con la incidencia de carcinoma basocelular. Los factores de confusión como la exposición solar y el fototipo, entre otros, generan ciertas controversias que requieren la realización de ensayos clínicos para conocer el papel de la vitamina D en el CCNM. El uso de la vitamina D en los pacientes con CCNM presenta un grado de recomendación B, con un nivel de evidencia IIb.
Suplemento para pacientes en tratamiento crónico con corticoides sistémicosEl uso de corticoides sistémicos de manera crónica da lugar a una serie de complicaciones, como la osteoporosis. La actividad osteolítica observada a corto plazo, asociada a la apoptosis de osteoblastos y osteocitos en tratamientos prolongados, son los responsables de este suceso. El riesgo relativo global de fracturas asociadas al tratamiento con corticoides es 1,33, mayor para las fracturas de origen vertebral (RR 2,60), fracturas de cadera (RR 1,60), y en último lugar, fracturas de antebrazo o de Colles (RR 1,09). Hay que tener en cuenta los factores de riesgo asociados en cada paciente89, como la edad avanzada, los antecedentes familiares de fractura u osteoporosis, la menopausia precoz, el tabaquismo y el bajo índice de masa corporal determinado mediante densitometría ósea. El suplemento con vitamina D durante el tratamiento prolongado con corticoides orales está defendido por múltiples estudios90,91. El metaanálisis de Reid et al.92 demuestra la correlación entre los niveles de 25(OH)D deficientes y el riesgo de fractura. Otro metaanálisis93 que incluyó 11 ensayos clínicos realizados en personas mayores de 65 años —la mayoría mujeres— mostró que el suplemento de 800UI/día de colecalciferol redujo el riesgo de fractura de cadera un 30%, y el riesgo de fractura no vertebral un 14%, independientemente de asociar suplementos de calcio o no. Varios trabajos han demostrado que la administración de fármacos antirresortivos94,95, como risedronato o alendronato, junto con suplementos de colecalciferol durante 13 meses, se asoció con un aumento de la densidad mineral ósea evaluada mediante densitometría. En la tabla 4 quedan recogidas las indicaciones de suplemento de vitamina D en los pacientes con tratamiento corticoideo crónico. En la tabla 5 reflejamos las formas disponibles de suplementos de vitamina D, y en la tabla 6 detallamos la posología recomendada en función de los niveles de vitamina D en sangre.
Indicaciones con suplementos de vitamina D durante el tratamiento con corticoides
| Mujeres posmenopáusicas | Mujeres premenopáusicas y varones |
|---|---|
| Pacientes que vayan a recibir o estén recibiendo más de 5mg/día de corticoide durante más de 3 meses | Pacientes que vayan a recibir o estén recibiendo más de 7,5mg/día de corticoide durante más de 3 meses |
| Pacientes con densidad mineral ósea con una puntuación T-score inferior a −1,5 que vayan a recibir o estén recibiendo más de 2,5mg/día de corticoide durante más de 3 meses | Pacientes con densidad mineral ósea con una puntuación T-score inferior a −1,5 que vayan a recibir o estén recibiendo más de 5mg/día de corticoide durante más de 3 meses |
| A todos los pacientes con antecedentes de fracturas óseas previas por fragilidad |
Presentaciones comerciales de vitamina D en España
| Colecalciferol |
|---|
| Gotas. Frasco 10ml (20.000UI): 0,05mg=400UI=6 gotas |
| Solución oral 2,5ml (25.000UI) equivalentes a 0,625mg |
| Calcifediol |
| Gota: 0,1mg/ml (6.000UI); 240UI (4μg)=1 gota |
| Ampollas bebibles: |
| 0,266mg (16.000UI) |
| 3mg (180.000UI) |
| Cápsulas blandas 0,266mg (16.000UI) |
Posología del suplemento de vitamina D según los niveles de 25(OH)D sérica
| Tratamiento de la deficiencia (10-19ng/ml) |
| Colecalciferol 25.000UI semanales durante 8 semanas y posteriormente cada 15 días durante 8 semanas más con una dosis de mantenimiento de 25.000UI cada 2-4 semanas |
| Calcifediol 16.000UI semanales durante 10 semanas y después mensuales |
| Tratamiento de la deficiencia grave (<10ng/ml) |
| Colecalciferol 25.000UI: 2 veces a la semana durante 6 semanas, seguido de 25.000UI semanales durante 4 semanas y una dosis de mantenimiento de 25.000UI cada 2-4 semanas según niveles séricos |
| Calcifediol choque 3mg (180.000UI): un envase, posteriormente continuar con 16.000UI mensuales según niveles séricos a los 2 meses de la dosis de carga |
La vitamina D tiene una pléyade de funciones celulares en múltiples órganos y tejidos en los que existen receptores para la misma. En dermatología parece una hormona fundamental, no solamente porque su síntesis se realiza en la piel, sino por sus múltiples acciones, lo que se refleja en las diferentes enfermedades en las que parece implicada. La tabla 7 resume las enfermedades en las que se deberían determinar los niveles séricos de vitamina D, y en función de los mismos, y considerando los grados de evidencia científica (tabla 8), plantear la suplementación de nuestros pacientes.
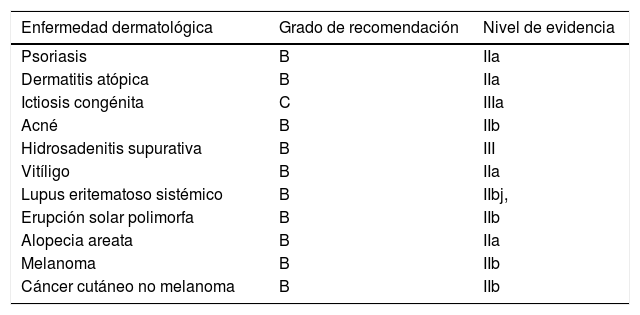
Enfermedades dermatológicas y suplementos de vitamina D. Grado de recomendación y nivel de evidencia
| Enfermedad dermatológica | Grado de recomendación | Nivel de evidencia |
|---|---|---|
| Psoriasis | B | IIa |
| Dermatitis atópica | B | IIa |
| Ictiosis congénita | C | IIIa |
| Acné | B | IIb |
| Hidrosadenitis supurativa | B | III |
| Vitíligo | B | IIa |
| Lupus eritematoso sistémico | B | IIbj, |
| Erupción solar polimorfa | B | IIb |
| Alopecia areata | B | IIa |
| Melanoma | B | IIb |
| Cáncer cutáneo no melanoma | B | IIb |
Los autores declaran no tener ningún conflicto de intereses.
| nmol/l | ng/ml | Estado de salud |
|---|---|---|
| < 30 | < 12 | Asociado con la deficiencia de vitamina D, que provoca raquitismo en bebés y niños y osteomalacia en adultos |
| 30-50 | 12-20 | Generalmente considerado inadecuado para huesos |
| ≥ 50 | ≥ 20 | Generalmente se considera adecuado para huesos y salud general en individuos sanos |
| > 125 | > 50 | La evidencia emergente vincula los efectos adversos potenciales con tales niveles altos, particularmente > 150 nmol/l (> 60 ng/ml) |
1 nmol/l equivale a 0,4 ng/ml.
Fuente: Institute of Medicine, Food and Nutrition Board3.