Los probióticos, definidos como microorganismos vivos que proveen un beneficio para la salud del huésped, se han propuesto como una opción terapéutica para la dermatitis atópica (DA), habiéndose identificado varios mecanismos de acción. Se evaluó la eficacia del uso de probióticos para disminuir la gravedad de dermatitis atópica en pacientes pediátricos menores de 18años.
Material y métodosSe realizó una revisión sistemática y metaanálisis que incluyó ensayos clínicos aleatorizados en pacientes menores de 18años con diagnóstico establecido de dermatitis atópica, cuya gravedad estuvo medida por el Scoring Atopic Dermatitis (SCORAD) comparando el efecto de probióticos con el placebo, mediante la investigación en bases de datos MEDLINE, Web Of Science (WOS), Scopus, ClinicalTrials.gov, Epistemonikos, Trip medical database, Biblioteca virtual en salud (BVS).
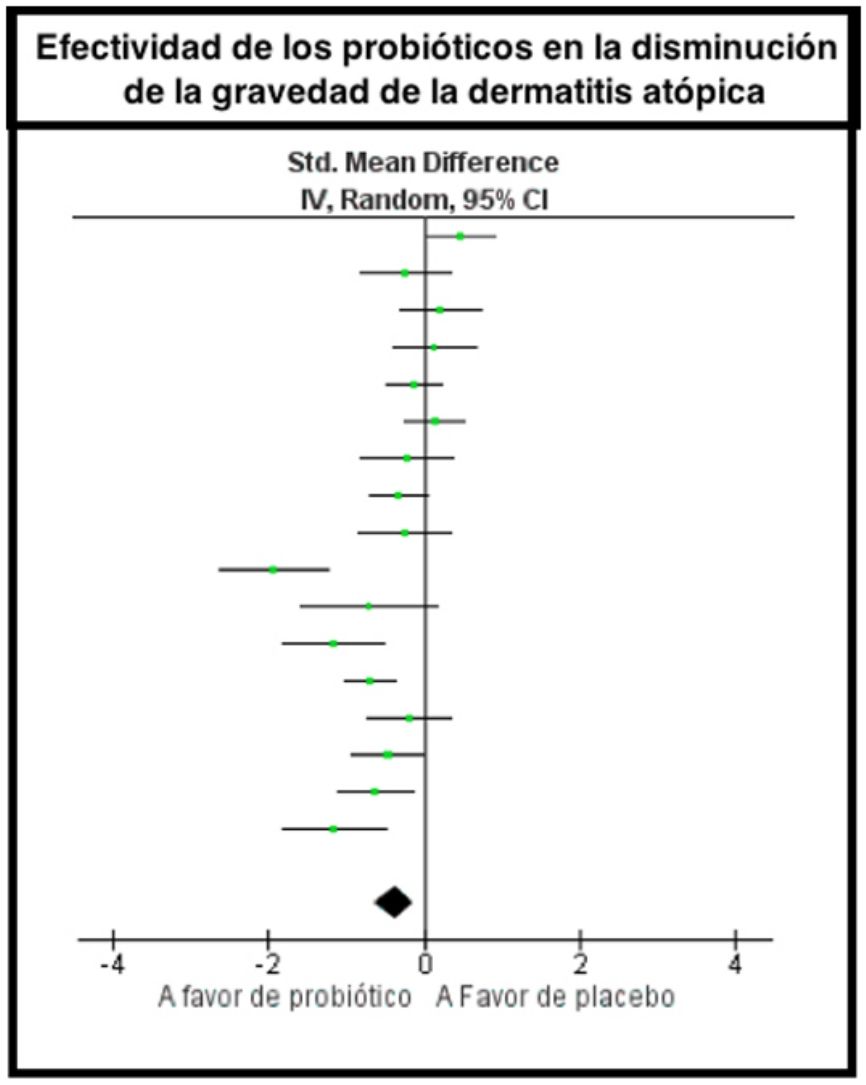
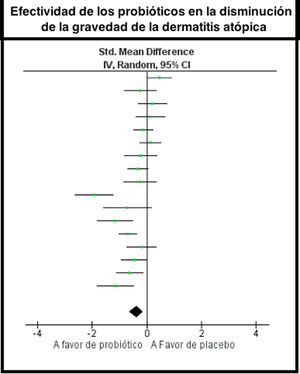
ResultadosSe obtuvieron 20 estudios que fueron incluidos en la revisión sistemática, de los cuales 16 apoyan el uso de probióticos para reducir la gravedad del SCORAD en la dermatitis atópica. En el metaanálisis se obtuvo como resultado global una diferencia de medias de −0,38, con un IC95% de −0,63 a −0,14, a favor del uso de probióticos; sin embargo, se encontró una alta heterogeneidad en los estudios debido a la variabilidad clínica y metodológica, con un I2=76%.
ConclusionesEl uso de probióticos es beneficioso para reducir la gravedad de la DA medida según SCORAD, a pesar de la presencia de una alta heterogeneidad clínica, derivada de sus diferentes tipos, dosis y variabilidad de una escala subjetiva como es el SCORAD.
Probiotics, defined as live microbial dietary supplements that provide health benefits for the host, have been suggested as a treatment for atopic dermatitis based on a variety of proposed mechanisms of action. We analyzed evidence for the efficacy of probiotics to attenuate the severity of atopic dermatitis in pediatric patients younger than the age of 18years.
Material and methodsSystematic review of trials of probiotics that included patients under the age of 18years with a confirmed diagnosis of atopic dermatitis scored for severity using the Scoring Atopic Dermatitis SCORAD) tool. We performed a meta-analysis of the randomized placebo controlled trials. The following databases were searched: MEDLINE, Web of Science, Scopus, ClinicalTrials.gov, Epistemonikos, Trip Medical Database, and the Spanish Virtual Health Library.
ResultsTwenty trials were retrieved and included in the systematic review. Sixteen supported the use of probiotics to attenuate SCORAD-evaluated severity. Meta-analysis found an overall mean difference in effect between probiotics and placebo of −0.38 (95%CI, −0.63 to −0.14) in favor of probiotics. However, trial heterogeneity was high (I2 statistic, 76%) due to clinical and methodological variability.
ConclusionsIn spite of clinical heterogeneity in trials attributable to different types of probiotic products and doses, and to the subjective variability of the SCORAD scale, we conclude that probiotics are beneficial for reducing the severity of atopic dermatitis as reflected by the SCORAD index.
La dermatitis atópica es una patología crónica y recidivante de la piel asociada con anormalidades en la función de barrera de la piel, sensibilización inmunológica y otros mecanismos1.
La prevalencia general de esta enfermedad ha aumentado de dos a tres veces en las últimas décadas. La enfermedad se manifiesta durante el primer año de vida en aproximadamente el 60% de los casos, pero puede comenzar a cualquier edad. Su curso puede ser continuo durante largos periodos o de naturaleza recurrente. La DA es leve en aproximadamente el 80% de los niños afectados2.
Los probióticos son definidos según la OMS como «microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren un beneficio para la salud al huésped»3.
Se han propuesto múltiples mecanismos a través de los cuales los probióticos disminuyen la atopia, incluido el cambio del equilibrio Th1/Th2 hacia Th1 mediante la inhibición de las citocinas Th2 o el aumento de la producción de citocinas reguladoras como IL-10 a través de la maduración de células dendríticas o sus receptores4.
El objetivo de este estudio es realizar una revisión sistemática y metaanálisis para determinar si la administración de probióticos por vía oral disminuye la gravedad de la dermatitis atópica según el Scoring Atopic Dermatitis (SCORAD) en pacientes menores de 18años con diagnóstico de DA establecido.
Material y métodosSe realizó una revisión sistemática que incluyó ensayos clínicos aleatorizados publicados hasta el año 2020. Los estudios debían comparar el efecto de probióticos con el efecto del placebo para reducir la gravedad de la dermatitis atópica. La población estudiada fueron pacientes menores de 18años con diagnóstico establecido de dermatitis atópica, cuya severidad estuvo medida por la escala SCORAD.
Se excluyeron estudios que no cumplieron con los criterios de inclusión, estudios no concluyentes, que presenten conflictos de intereses, revisiones narrativas, con resultados diferentes a los buscados, estudios realizados en animales, que tengan intervenciones diferentes al interés clínico de esta investigación, población mayor de 18años.
La búsqueda se realizó en bases de datos MEDLINE, Web Of Science (WOS), Scopus, ClinicalTrials.gov, Epistemonikos, Trip medical database, Biblioteca virtual en salud (BVS), con la siguiente estrategia de búsqueda: (((«Dermatitis, Atopic»[Majr]) AND «Probiotics»[Majr])) AND (((«Child»[Mesh]) OR «Child, Preschool»[Mesh]) OR «Adolescent»[Mesh]).
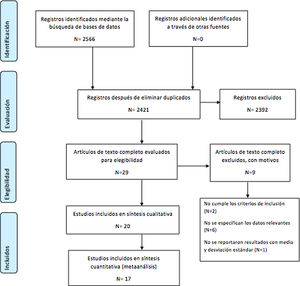
Se encontraron un total de 2.566 artículos, y tras eliminar duplicados se obtuvieron 2.421 artículos, de los cuales, aplicando los criterios de inclusión, se obtuvieron 29 artículos, excluyendo 2.392 registros. Los autores MFT y AFPL evaluaron los 29 artículos a partir de su nivel de evidencia, descartando 9 registros: 2 fueron excluidos por no cumplir criterios de inclusión, 6 no especificaron datos relevantes y uno no incluyó resultados estadísticos necesarios. Finalmente se incluyeron 20 estudios en la revisión sistemática y 17 estudios en el metaanálisis (fig. 1).
Análisis estadísticoLa información se extrajo en bases de datos mediante los programas Microsoft Excel y Review Manager (Rev Man) versión 5.4. Se seleccionaron los resultados de las investigaciones que permitieron obtener la diferencia de medias como medida de tamaño de efecto continua y su desviación estándar con intervalos de confianza (IC) del 95%. En los casos en que fue posible se tomaron los datos directos, y en otros se calcularon mediante la calculadora de Rev Man versión 5.4. Se tomó como desenlace clínico para el metaanálisis la diferencia entre los puntajes de SCORAD basal y final de seguimiento.
Se usó como determinante de heterogeneidad la prueba de chi-cuadrado, considerando heterogeneidad una p<0-05 y el coeficiente de inconsistencia entre los estudios (I2), considerando como heterogeneidad si este es >40%. Se utilizó el modelo de efectos aleatorios para realizar el metaanálisis y se elaboró un gráfico de funnel plot para valorar el riesgo de sesgo de publicación5.
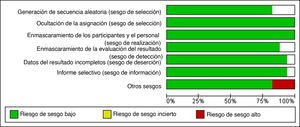
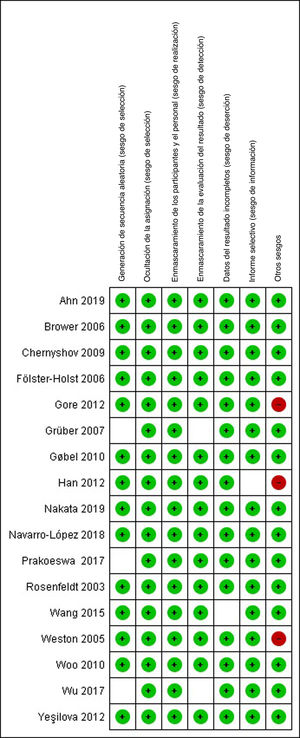
Valoración de riesgo de sesgoSe analizó de cada estudio el riesgo de sesgos de selección, realización, detección, desgaste y notificación según los criterios propuestos por el manual de revisiones sistemáticas de Cochrane. Dicho análisis se puede observar en las figuras 2 y 3, donde se presentan los riesgos de sesgo individuales de acuerdo con el criterio de ambas investigadoras.
Se analizaron 20 estudios incluidos en la revisión sistemática (tabla 1), de los cuales 16 apoyan el uso de probióticos para reducir la gravedad del SCORAD en la dermatitis atópica. En referencia al tipo de probiótico, 7 utilizaron combinaciones de cepas y 13 utilizaron cepas únicas, siendo utilizado con mayor frecuencia el género Lactobacillus, especie rhamnosus. La frecuencia de administración del probiótico varía de 1 a 2 veces al día y la duración del tratamiento en los estudios varía de entre 4 a 12semanas.
Estudios incluidos
| Estudio | Población | Probióticos (género, especie, cepa) | Duración | Conclusión del estudio | |
|---|---|---|---|---|---|
| 1 | Navarro-López et al.4, 2018 | 47 niños de 4 a 17 años con DA, SCORAD moderado | Bifidobacterium lactis CECT 8145, B. longum CECT 7347 y Lactobacillus casei CECT 9104 | 12 semanas | El uso de probióticos es útil en la reducción de SCORAD |
| 2 | Prakoeswa et al.6, 2017 | 22 niños de 0-14 años con DA | Lactobacillus plantarum IS-10506 | 12 semanas | El uso de probióticos es un tratamiento potencial para la DA en niños |
| 3 | Wang y Wang7, 2015 | 212 niños de 1 a 18 años DA y al menos una prueba positiva de punción cutánea o anticuerpo IgE específico para alérgenos comunes | Lactobacillus paracasei GMNL-133, Lactobacillus fermentum GM090 | 12 semanas | La mezcla de probióticos se asocia con una mejora clínica de la DA |
| 4 | Wu et al.8, 2017 | 67 niños de 4 a 48 meses con DA, SCORAD ≥ 15 | Lactobacillus rhamnosus (MP108) | 8 semanas | El uso de probiótico disminuye todos los parámetros del SCORAD en niños con DA |
| 5 | Han et al.9, 2012 | 83 niños de 1 a 13 años con DA, SCORAD entre 20 y 50 | Lactobacillus plantarum CJLP133 | 16 semanas | La suplementación con probióticos es beneficiosa para el tratamiento de la DA |
| 6 | Gore et al.10, 2012 | 137 niños de 3 a 6 meses con DA, SCORAD ≥ 10 | Lactobacillus paracasei CNCM I-2116 o Bifidobacterium lactis CNCM I-3446 | 12 semanas | No se encontró beneficio del uso de probióticos en el tratamiento de la DA |
| 7 | Woo et al.11, 2010 | 75 niños de 2 a 10 años con DA, SCORAD>25 | Lactobacillus sakei KCTC 10755BP | 14 semanas | El uso de probióticos está asociado a una mejora clínica de la DA en niños |
| 8 | Weston12, 2005 | 53 niños con diagnóstico de DA y SCORAD ≥ 25 | Lactobacillus fermentum VRI-033 PCC | 16 semanas | El suplemento probiótico es beneficioso para reducir la extensión y la severidad del SCORAD |
| 9 | Sistek et al.13, 2006 | 49 niños de 1 a 10 años y al menos una prueba positiva de punción cutánea o anticuerpo IgE específico o una prueba RAST positiva para alérgenos comunes | Lactobacillus rhamnosus y Bifidobacterium lactis | 18 semanas | Los probióticos mejoran la clínica de la DA solo en pacientes con sensibilidad a alimentos |
| 10 | Grüber et al.14, 2007 | 102 niños de 3 a 12 meses con DA, SCORAD moderado a severo | Lactobacillus rhamnosus GG | 12 semanas | No se encontró efecto terapéutico para disminuir la severidad de la DA |
| 11 | Brouwer et al.15, 2006 | 50 niños menores de 5 meses con DA | Lactobacillus rhamnosus (NP-Lrh), Lactobacillus GG (NP-LGG) | 12 semanas | No hay efectos estadísticamente significativos de la suplementación con probióticos en SCORAD, parámetros inflamatorios o producción de citocinas |
| 12 | Fölster-Holst et al.16, 2006 | 54 niños de 1 a 55 meses con DA moderada a severa | Lactobacillus rhamnosus strain GG (LGG) | 8 semanas | No hubo diferencias significativas entre los grupos con respecto a los síntomas clínicos (SCORAD, prurito, pérdida de sueño) |
| 13 | Rosenfeldt et al.17, 2003 | 43 niños de 1 a 13 años con DA | Lactobacillus rhamnosus (19070-2) liofilizado y Lactobacillus reuteri (DSM 122460) | 6 semanas | Una combinación de probióticos fue beneficiosa en el tratamiento de la DA |
| 14 | Yeşilova et al.18, 2012 | 40 niños de 1 a 13 años con DA | Bifidobacterium bifidum, Lactobacillus acidophilus, L. casei, L. salivarius | 8 semanas | El uso de probióticos es efectivo para reducir el índice SCORAD de pacientes con DA |
| 15 | Nakata et al.19, 2019 | 59 niños de 10 meses a 3 años con DA | Lactobacillus acidophilus L-92 (L-92) | 24 semanas | La ingesta de una cantidad específica de L-92 funciona como un tratamiento complementario de la DA |
| 16 | Han et al.9, 2012 | 124 niños de 2-13 años con DA leve a moderada | Lactobacillus pentosus | 4 semanas | Los índices SCORAD para el grupo de probióticos mejoran significativamente en comparación con los del grupo de placebo en la DA |
| 17 | Gøbel et al.20, 2010 | 50 niños de 7 a 24 meses con DA | Lactobacillus acidophilus NCFM, Bifidobacterium animalis ssp. lactis Bi-07 | 8 semanas | No hubo un efecto clínico o inmunológico general de la suplementación con probióticos en niños con DA |
| 18 | Chernyshov21, 2009 | 58 niños de 2 meses a 4 años con DA | Lactobacillus rhamnosus R0011, L. helveticus R0052 | 4 semanas | El uso del probiótico Lactobacillus acidófilo se asoció con un mayor número de pacientes que lograron una mejoría clínica marcada y un mayor efecto de ahorro de corticosteroides |
| 19 | Isolauri et al22, 2000 | 27 niños con una edad media de 4,6 meses con DA | Bifidobacterium lactis Bb-12, Lactobacillus strain GG | 8 semanas | Se produjo una mejora significativa en la condición de la piel en pacientes que recibieron fórmulas suplementadas con probióticos, en comparación con el grupo no suplementado |
| 20 | Viljanen et al.23, 2005 | 230 niños de 1,4-11,9 meses con DA | Lactobacillus GG (LGG), L. rhamnosus LC705 (LC705), Bifidobacterium breve Bbi99, Propionibacterium freudenreichii ssp. shermanii JS (Propionibacterium JS) | 4 semanas | El tratamiento con LGG muestra una mayor disminución de SCORAD que el grupo placebo en los lactantes que padecen DA asociados a IgE |
B.: Bifidobacterium; DA: dermatitis atópica; IgE: inmunoglobulina E; L.: Lactobacillus; SCORAD: Scoring Atopic Dermatitis.
En el metaanálisis se incluyeron 17 estudios y se obtuvo como resultado global una diferencia de medias de −0,38, con un IC95% de −0,63 a −0,14, a favor del uso de probióticos; sin embargo, se encontró una alta heterogeneidad en los estudios debido a la variabilidad clínica y metodológica, con un I2=76% y chi cuadrado con p=0,00001 (fig. 4).
Se realizaron análisis de subgrupos de acuerdo con el tipo de cepa (fig. 5) y el tiempo de seguimiento (fig. 6) del uso de probióticos para reducir el SCORAD; sin embargo, en ambos análisis se encontró una alta heterogeneidad. En relación con el tipo de cepa no se encuentra mayor beneficio con el uso de Lactobacillus rhamnosus en comparación con el resto de las cepas de probiótico. De acuerdo con el tiempo de administración, se encontró un mayor beneficio tras la administración de probióticos durante 12semanas.
Se realizó un análisis de sensibilidad, sin obtener variaciones tras revisar de forma repetida los datos, y los resultados no sugirieron cambios importantes. Se evaluó el sesgo de reporte a partir de un gráfico Funnel plot (fig. 7) y se corroboró por el método de «trim and fill»24, donde se puede observar una distribución simétrica de los estudios que se acerca a la forma de un embudo, con lo cual se descarta la presencia de sesgo de publicación.
DiscusiónLos resultados de esta revisión sistemática indican que los probióticos tienen un efecto beneficioso en los pacientes pediátricos con dermatitis atópica.
Dichos resultados se sustentan por los resultados obtenidos en el metaanálisis, en donde el resultado global apoya el uso de probióticos para disminuir el SCORAD. Sin embargo, la heterogeneidad de los estudios no permite determinar la magnitud real en la que los probióticos disminuyen la gravedad de la DA medida según SCORAD.
Esta heterogeneidad se debe a las diferentes intervenciones en cada estudio, dadas por el uso de diferentes cepas, la dosis de probióticos, la duración distinta de los tratamientos y la subjetividad de la escala SCORAD para evaluar la gravedad de la DA.
Dada la heterogeneidad de las características de las poblaciones entre los diferentes estudios, el análisis por subgrupos no refleja resultados potencialmente reales, salvo por el seguimiento, en cuyo caso se estableció que la eficacia del uso de probióticos se observa tras su administración por más de 12 semanas.
Makrgeorgou et al.25 realizaron una actualización de revisión sistemática similar a la presente, basándose en una revisión anterior realizada en 2017. Dicha revisión incluyó 39 artículos que, si bien aportan una muestra significativa, no analiza específicamente a la población pediátrica e incluye el uso de simbióticos. El estudio concluye que los probióticos disminuyen la gravedad del SCORAD, pero con un puntaje muy bajo para determinar un cambio significativo en los síntomas de dermatitis atópica.
La revisión sistemática realizada por Huang et al.26 establece que falta más evidencia para recomendar probióticos de manera generalizada. Esto se debe a que los artículos incluidos abarcan poblaciones pequeñas y heterogéneas, lo cual disminuye el poder de evidencia de la revisión. A diferencia de la presente revisión, que incluye mayor cantidad de estudios y con poblaciones más grandes.
Entre las limitaciones de esta revisión sistemática podemos destacar el uso de diferentes cepas de probióticos, lo cual puede llegar a influir en diferentes resultados y conclusiones individuales de cada ensayo. Además, existen varias diferencias importantes entre los participantes de los ensayos clínicos: en algunos se estableció que los participantes deben consumir una dieta estricta sin alimentos fermentados, restricción del consumo de antibióticos y otros requerimientos que no estuvieron presentes en todos los ensayos clínicos.
En el análisis estadístico para la realización del metaanálisis se encontró heterogeneidad entre las poblaciones de los diferentes estudios. Esto significó una limitación al momento de analizar los resultados, ya que impidió determinar el puntaje de disminución de SCORAD que se espera en pacientes con DA tras la administración de probiótico. Otra limitante puede verse relacionada con la asociación de empresas farmacéuticas, así como de fábricas de alimentos en la elaboración de los probióticos para los ensayos, lo cual podría ser un posible conflicto de intereses.
El uso de probióticos ha sido tratado durante varios años, especialmente enfocado a enfermedades relacionadas con el sistema digestivo. Considerando que existe una oferta de probióticos en el mercado de nuestro país, se puede incursionar en su uso para el tratamiento coadyuvante de la DA.
ConclusiónLos probióticos por vía oral, en especial las cepas de bacterias del género Lactobacillus, son útiles para reducir la gravedad de la dermatitis atópica, pero se requieren estudios más homogéneos para determinar la magnitud de este beneficio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a la Pontificia Universidad Católica del Ecuador por incentivar la realización de esta investigación.