En los últimos años han aparecido una serie de nuevos fármacos desarrollados por biología molecular. Estos medicamentos actúan bloqueando moléculas específicas del sistema inmunológico y se desarrollan para actuar sobre dianas específicas que tienen un papel importante en la fisiopatología de determinadas enfermedades para cuyo tratamiento son aprobadas. Con el tiempo se ha ido adquiriendo experiencia con estos medicamentos en el tratamiento de dermatosis para las que no han sido diseñados, pero para las que, por compartir un mismo mecanismo fisiopatológico, pueden ser útiles. El empleo de estos medicamentos en el tratamiento de casos difíciles de numerosas enfermedades dermatológicas para las cuales no están aprobados es creciente. Esta segunda parte de la revisión analiza el uso, fuera de indicación, en el tratamiento de la dermatosis de los siguientes fármacos biológicos: etanercept, efalizumab, alefacept, rituximab, daclizumab, basiliximab, omalizumab y cetuximab.
In recent years, a series of new drugs have been developed through the application of molecular biology. These drugs act by blocking specific molecules of the immune system and have been developed to act on specific targets that play an important role in the pathophysiology of the diseases in which their therapeutic use has now been approved. Over time, experience has been accumulated in the use of these drugs in the treatment of skin diseases for which they have not been approved but in which the pathophysiology suggests that they could also be effective. The use of these drugs is increasing in difficult-to-treat cases of skin diseases for which the drugs are not approved. The second part of this review of off-label use of biologic agents in dermatology considers the use of etanercept, efalizumab, alefacept, rituximab, basiliximab, omalizumab, and cetuximab.
En los últimos años, numerosos fármacos biológicos han ido apareciendo en el mercado. Estos fármacos se definen como proteínas derivadas de seres vivos (sean animales, microorganismos o seres humanos) que se emplean en la prevención, tratamiento o curación de diferentes enfermedades. En la primera parte de la presente revisión se revisaron dos anticuerpos monoclonales dirigidos contra el factor de necrosis tumoral (TNF). En esta segunda parte se revisará otro fármaco que actúa disminuyendo el efecto del TNF (etanercept), un inhibidor del LFA-1 (efalizumab), un inhibidor del LFA 3 (alefacept), un anticuerpo antirreceptor CD20 (rituximab), un anticuerpo antiinmunoglobulina E (IgE) (omalizumab), dos anticuerpos frente al receptor de la interleuquina 2 (daclizumab y basiliximab) y un anticuerpo antirreceptor del factor de crecimiento epidérmico (cetuximab).
Estos fármacos se han utilizado en numerosas dermatosis sin aprobación en base a su mecanismo fisiopatológico, habiéndose publicado diferentes revisiones de estos usos con anterioridad1-7. En casos de dermatosis con mala evolución a pesar de los tratamientos convencionales se recurre con frecuencia a los nuevos medicamentos biológicos que en ocasiones son de gran utilidad. Este hecho hace que se publiquen incesantemente nuevos artículos describiendo la efectividad en diferentes enfermedades de difícil control. La presente revisión recopila las publicaciones existentes en este momento, aunque es posible que cuando se publique hayan aparecido numerosas publicaciones nuevas al respecto.
EtanerceptEs una proteína de fusión completamente humana compuesta por la porción extracelular del receptor de tipo 2 del TNF asociada a la porción constante de la IgG18. Se une exclusivamente al TNF alfa soluble, evitando que éste se una a sus receptores. Etanercept, a diferencia de infliximab, no fija complemento. Fue el primer fármaco biológico aprobado para la psoriasis y la artritis psoriásica (psoriasis en placas moderada/severa en pacientes que hayan experimentado una falta de respuesta, intolerancia o que presenten contraindicación para las terapias sistémicas tradicionales). Además está aprobado para el tratamiento de la artritis reumatoide, artritis reumatoide juvenil y espondilitis anquilopoyética9-12.
PosologíaLa dosis habitual es de 50mg por vía subcutánea dos veces en semana que pueden reducirse posteriormente a 25mg dos veces en semana.
La formación de anticuerpos antietanercept ocurre en menos del 10% de los pacientes y no implica un descenso de su eficacia.
Efectos secundariosEs un fármaco generalmente bien tolerado. Las reacciones cutáneas en el punto de inyección son el efecto adverso más frecuente, apareciendo en el 40% de los pacientes tratados.
Al igual que otras moléculas que bloquean la acción de la citoquina, el TNF se ha asociado al tratamiento con etanercept el desarrollo de infecciones, especialmente aquellas en las que la formación de granulomas supone la principal defensa. Se ha documentado una mayor tasa de tuberculosis entre los paciente que reciben estos fármacos respecto a la población general13. Además se han comunicado casos de linfomas asociados al tratamiento con este fármaco, cuya relación con el mismo o con la inmunosupresión asociada que suelen presentar estos pacientes está por dilucidar14.
ContraindicacionesAlergia a etanercept o a cualquiera de sus componentes. También, presentar cualquier infección activa.
Usos en dermatosis fuera de indicación (tabla 1)ColagenosisLupus eritematoso. Aunque es bien conocido el posible efecto inductor de lupus eritematoso en pacientes tratados con etanercept15-26 se han descrito los casos de dos pacientes con lupus eritematoso subagudo que han respondido a esta medicación. Norman et al27 publican el caso de una mujer de 42 años con una erupción clínica e histológicamente compatible con lupus eritematoso subagudo localizada en áreas fotoexpuestas, además de polimiositis. Fue tratada con metotrexato, hidroxicloroquina y prednisona sin control de las lesiones. Al añadir etanercept a una dosis de 25mg dos veces en semana, las lesiones de lupus fueron lentamente desapareciendo, por lo que se pudo suspender el antipalúdico y reducir la dosis del corticoide. Además, Fautrel et al28 publican el caso de una mujer de 65 años diagnosticada de artritis reumatoide y lupus eritematoso subagudo que fue tratada, para su artritis reumatoide, con etanercept y paralelamente a la mejoría de su artritis reumatoide experimentó una desaparición completa de las lesiones de lupus eritematoso.
Dermatosis para las que ha sido utilizado etanercept fuera de la indicación aprobada
Colagenosis
|
Dermatosis neutrofílicas
|
Enfermedad injerto contra huésped
|
Dermatitis espongióticas
|
Enfermedades ampollosas
|
Dermatosis granulomatosas
|
Vasculitis
|
Miscelánea
|
Dermatomiositis. Existen varias descripciones del posible efecto terapéutico de etanercept en pacientes afectos de dermatomiositis (DM)27, 29, 30. En una serie de 8 pacientes con DM/polimiositis tratados con etanercept (6), infliximab (1) o ambos (1) 6 de ellos obtuvieron mejoría30. En otra paciente de 42 años con DM refractaria a tratamiento con metotrexato, hidroxicloroquina y micofenolato y con mala tolerancia a los corticoides orales se asoció metotrexato con etanercept a dosis de 25mg dos veces a la semana con respuesta excelente a las 24 semanas de tratamiento, con mejoría tanto de los síntomas cutáneos como de los musculares27.
Paradójicamente, Iannone31 describe una serie de 5 pacientes tratados con etanercept con empeoramiento de la enfermedad en todos ellos.
Esclerodermia. En un estudio piloto preliminar que incluía a 10 pacientes con esclerodermia sistémica se instauró tratamiento con etanercept a una dosis de 25mg dos veces en semana. A los 6 meses de tratamiento hubo mejoría en los índices cutáneos en 4 pacientes y curación de las úlceras digitales sin alteración de la función pulmonar. Además, los pacientes se encontraban subjetivamente mejor32.
Dermatosis neutrofílicasSíndrome de Sweet. Yamauchi33 ha obtenido buenos resultados en dos mujeres con síndrome de Sweet y artritis reumatoide. Una paciente de 42 años con síndrome de Sweet de 10 años de evolución y con lesiones faciales múltiples, recidivantes tras tratamientos con esteroides sistémicos y azatioprina, fue diagnosticada de artritis reumatoide, comenzando tratamiento con etanercept 50mg semanales. Presentó mejoría progresiva desde las 2 semanas de tratamiento con desaparición de todas las lesiones a las 6 semanas. Tras la supresión de etanercept las lesiones recidivan, volviendo a resolverse al reintroducir el fármaco. La segunda paciente presentó brotes recurrentes de lesiones de síndrome de Sweet, que eran refractarias a dapsona y que se resolvían con esteroides pero recidivaban posteriormente. Tras introducir etanercept a dosis de 25mg dos veces en semana las lesiones se resolvieron progresivamente, estando la paciente asintomática durante los 6 meses que duró el seguimiento33.
Pioderma gangrenoso. La experiencia con etanercept en pacientes con pioderma gangrenoso es menor que con infliximab, dado que éste está aprobado para el tratamiento de la enfermedad inflamatoria intestinal (EII) y etanercept no, siendo la EII la causa más frecuente del pioderma gangrenoso. No obstante, existen varios artículos que hacen referencia a su posible utilidad.
Hubbard34 describe el caso de un paciente con ulceraciones cutáneas extensas asociadas a abscesos en el psoas y en bazo y que había respondido muy bien a infliximab, pero que tuvo que suspender por una reacción anafilactoide. Realizó tratamiento con etanercept 25mg tres veces en semana durante 3 semanas sin éxito.
Roy35 obtiene muy buenos resultados en tres pacientes con pioderma gangrenoso tratado con etanercept 50mg a la semana. Dos de sus pacientes obtienen resolución completa de las lesiones en dos meses, persistiendo una lesión de menor tamaño en el tercero. Los tres pacientes fueron tratados exclusivamente con etanercept, sin asociarse esteroides ni inmunosupresores.
Mc Gowan36 publica el caso de un paciente de 30 años con pioderma gangrenoso que mejora con etanercept en asociación con prednisona en todo momento y que requirió dosis de etanercept de 100mg a la semana.
Un paciente de 30 años con pioderma gangrenoso de dos años de evolución asociado a hepatitis autoinmune realizó tratamiento con etanercept 25mg dos veces en semana asociado a prednisona; las lesiones fueron mejorando progresivamente, pudiéndose retirar la prednisona a los tres meses. Durante el seguimiento, que duró 5 meses, el paciente se encontró asintomático desde el punto de vista dermatológico37.
Otro paciente de 80 años con una úlcera en un pie diagnosticada de pioderma gangrenoso y que era refractaria a prednisona y ciclosporina fue tratado con etanercept, 25mg dos veces en semana, asociado a ciclosporina con mejoría rápida y desaparición de la úlcera a las 8 semanas; el tratamiento se suspendió, estando el paciente asintomático durante un año38.
Por último, Disla39 obtiene una buena respuesta en un paciente de 40 años con pioderma gangrenoso asociado a artritis reumatoide con resolución completa de las úlceras a las 4 semanas.
Enfermedad injerto contra huéspedEl uso de medicaciones anti-TNF en el tratamiento de la enfermedad injerto contra huésped (EICH) se basa en la importancia fisiopatológica de esta citoquina en el desarrollo de esta enfermedad40-44.
Enfermedad injerto contra huésped aguda. Se ha documentado el caso de una niña de 11 años con EICH aguda refractaria a esteroides que alcanzó una remisión completa tras recibir etanercept a dosis de 0,4mg/kg dos veces a la semana45. Wolff46 publica un ensayo de fase II con 21 pacientes diagnosticados de EICH aguda refractaria a corticoides orales, tratados con etanercept 16mg/semana los días 1, 5, 9, 13, 17 y daclizumab (anticuerpo antiinterleuquina 2) los días 1, 4, 8, 15 y 22 en 21. Del total de pacientes, 8 alcanzaron una remisión completa, 6 una remisión parcial y 7 no respondieron. Durante el tratamiento 11 pacientes presentaron complicaciones infecciosas. De los 21 pacientes 12 desarrollaron posteriormente una EICH crónica.
Kennedy47 asoció etanercept a gammaglobulina antitimocítica con o sin micofenolato mofetil en pacientes con EICH aguda, demostrando que la asociación de etanercept aumentaba la supervivencia comparándola con la terapéutica convencional, sin un aumento asociado de las infecciones.
Otro ensayo48 trató con etanercept (25mg dos veces en semana) asociado a metilprednisolona (2mg/kg/día) y tacrolimus a 20 pacientes con EICH aguda demostrada con biopsia, obteniendo una resolución completa en el 75 % de los pacientes a las 4 semanas de tratamiento.
Busca et al49 publican recientemente una serie de 21 pacientes con EICH aguda (13 pacientes) y crónica (8 pacientes) tratados con etanercept 25mg dos veces a la semana, alcanzando en un 55 % de los pacientes una respuesta completa y en un 9 % una respuesta parcial. Las complicaciones infecciosas fueron frecuentes, incluyendo la reactivación de citomegalovirus (CMV) en un 48 % de los pacientes tratados.
Enfermedad injerto contra huésped crónica. Diez pacientes de un estudio diagnosticados de EICH crónica fueron tratados con etanercept y corticoides orales y 4 pacientes también con micofenolato mofetilo. Un 70 % de estos pacientes experimentó cierta mejoría durante el seguimiento, que fue de dos meses, sin efectos adversos50.
En el estudio de Busca49, previamente descrito, un 62 % de los pacientes presentaron algún tipo de respuesta, aunque ésta fue completa tan sólo en uno de los 8 pacientes con EICH crónica.
Dermatitis espongióticasEczema dishidrótico. Una paciente de 40 años con eczema dishidrótico recalcitrante de 6 años de duración había sido tratada con esteroides tópicos, PUVA, azatioprina, ciclosporina, acitretino, metotrexato, micofenolato, sulfasalacina, minociclina y ciclos repetidos de prednisona. Se le introdujo etanercept 25mg dos veces en semana, con curación de todas las lesiones a las 6 semanas de tratamiento, mejoría que se mantuvo hasta los 4 meses de tratamiento, momento en el cual sufre un rebrote de lesiones que no se controlaron a pesar de subir la dosis de etanercept a 50mg dos veces a la semana51.
Dermatitis atópica. Buka52 describe el caso de dos niños con eczema atópico que trata con etanercept y que no obtuvieron mejoría. Además ambos sufrieron complicaciones (uno una infección por Staphylococcus aureus meticilin-resistente y el otro un exantema viral) sin que se pudiera establecer la relación de estas complicaciones con el tratamiento.
Enfermedades ampollosasPenfigoide ampolloso. Un hombre de 64 años con psoriasis de larga evolución comenzó con un penfigoide ampolloso, siendo tratado con prednisona con gran mejoría tanto de la psoriasis como del penfigoide. Posteriormente se asoció etanercept 25mg dos veces en semana, y más tarde, debido a un rebrote del penfigoide al reducirse la dosis de prednisona, se subió la dosis de etanercept a 50mg dos veces en semana con resolución de todas las ampollas53.
Penfigoide cicatricial. Una paciente de 72 años con un penfigoide cicatricial oral y ocular había sido tratada sin éxito con prednisona, azatioprina y mofetil micofenolato. Se le prescribió etanercept 25mg dos veces en semana. Tres semanas después de comenzar el tratamiento la prednisona se pudo reducir hasta 1mg diario. A los 8 meses de seguimiento y tras sólo 6 inyecciones de etanercept la paciente se encontraba libre de enfermedad54.
Otra paciente de 82 años con penfigoide cicatricial ocular que había sido tratada con dapsona, ciclofosfamida, ciclosporina y corticoides comenzó tratamiento con 100mg de dapsona asociados a 25mg de etanercept dos veces en semana. Un mes después de comenzar este tratamiento la paciente comenzó a mejorar. A los 6 meses la hiperemia conjuntival había desaparecido presentando una mejoría en la visión. Durante el año que duró el tratamiento la paciente no experimentó ninguna recidiva55.
Cañizares56 publica una serie de tres pacientes con penfigoide cicatricial de los cuales dos tenían afectación oral y uno conjuntival, además de oral, que fueron tratados con 25mg de etanercept dos veces en semana. Los tres pacientes mejoraron de la enfermedad oral, adicionalmente la afectación conjuntival se estabilizó en el paciente que la padecía. La primera paciente asoció tratamiento con azatioprina, 100mg al día, y dapsona, 75mg al día, con buen control de la enfermedad que recidivó al suspender la administración de etanercept por falta de cobertura de su póliza de seguros. La segunda paciente asoció inmunoglobulina intravenosa con etanercept con buena respuesta. La última paciente fue tratada con etanercept, 25mg dos veces en semana en monoterapia, con curación de sus erosiones orales en un mes.
Pénfigo vulgar. Una mujer de 26 años con pénfigo vulgar con afectación oral y cutánea había sido tratada con azatioprina, micofenolato, esteroides sistémicos, ciclofosfamida, metotrexato, dapsona e inmunoglobulina presentando numerosos brotes severos. Se instauró tratamiento con 30mg diarios de prednisolona, 10mg de azatioprina y 25mg de etanercept dos veces en semana . Tras tres semanas de tratamiento las lesiones mejoraron mucho, con lo que la paciente progresivamente pudo reducir la dosis de prednisolona a 5mg diarios y de azatioprina a 50mg. Durante el seguimiento las lesiones de pénfigo vulgar se mantuvieron controladas, aunque aparecieron otras de pénfigo vegetante que precisaron ser tratadas con láser de CO257.
Otra paciente de 62 años con pénfigo y artritis reumatoide fue tratada con etanercept 25mg dos veces en semana asociado a 10mg de prednisona al día para su artritis reumatoide. Después de las tres dosis de etanercept la paciente refirió una remisión total de sus lesiones de pénfigo y pudo suspender la prednisona por completo; tras 4 meses de tratamiento estaba libre de enfermedad58.
Pénfigo foliáceo. Una paciente de 57 años con lesiones de pénfigo foliáceo en el tronco de dos años de duración había sido tratada con prednisolona a dosis de 30mg diarios sin éxito, por lo que se le pautó prednisona, 25mg diarios, y etanercept, 25mg dos veces en semana. La mejoría comenzó a notarse a los 15 días con resolución completa de las lesiones a las 6 semanas. La prednisona pudo suspenderse y la paciente se encontraba libre de enfermedad a los 4 meses de monoterapia con etanercept59.
Enfermedad de Hailey-Hailey. Una mujer de 47 años diagnosticada de enfermedad de Hailey-Hailey refractaria a infinidad de tratamientos (ciprofloxacino, tetraciclina, mupirocina, levofloxacino, fluconazol, acetónido de triamcinolona, ketoconazol, difenhidramina, ciclosporina, pimecrolimus, isotretinoina, crioterapia y láser) fue tratada con etanercept 25mg/semana durante un mes seguido de 50mg/semana durante 6 meses y posteriormente de 75mg/semana. En los primeros 10 meses su enfermedad mejoró de forma importante27.
Enfermedades granulomatosasSarcoidosis. Un ensayo realizado con etanercept para sarcoidosis pulmonar tuvo que suspenderse por ausencia de mejorías60. En sarcoidosis ocular tampoco ha habido buenos resultados61.
En sarcoidosis cutánea, a un paciente con lupus pernio con mala respuesta a prednisona, hidroxicloroquina y metotrexato se le asoció etanercept 25mg dos veces en semana. A los dos meses de comenzar este tratamiento presentó una gran mejoría que permitió reducir hasta suspender la prednisona y la hidroxicloroquina y reducir la dosis de metotrexato62. Durante los 18meses de seguimiento la paciente no presentó ningún signo de actividad de la enfermedad. Otro paciente con sarcoidosis cutánea progresiva con mala respuesta a corticoides sistémicos e inmunosupresores respondió significativamente a etanercept en monoterapia63. Paradójicamente, frente a estos buenos resultados en sarcoidosis cutáneas se ha publicado el caso de una paciente de 70 años con espondilitis anquilopoyética que fue tratada con etanercept y que desarrolló a los 21 meses de tratamiento lesiones faciales clínica e histológicamente compatibles con sarcoidosis y adenopatías pulmonares64. Tras suspender etanercept, las lesiones cutáneas de sarcoidosis desaparecieron en dos meses. Otra paciente con artritis reumatoide en tratamiento con etanercept desarrolló lesiones granulomatosas sarcoideas en ambas glándulas parótidas sin cumplir criterios de sarcoidosis65. Otro artículo describe el caso de dos mujeres con artritis reumatoide tratadas con etanercept que desarrollaron sarcoidosis66.
Granuloma anular. Existen datos discrepantes en cuanto a la eficacia de etanercept en el tratamiento del granuloma anular. Por un lado, Shupack67 publica el caso de un paciente con granuloma anular diseminado que fue tratado con 50mg dos veces en semana con mejoría a las 7 semanas que se mantuvo durante el seguimiento de 12 semanas y, por otro, Kreuter et al68 trataron a 4 pacientes con granuloma anular refractario con etanercept, dos de los pacientes no obtuvieron mejoría, mientras que los dos restantes empeoraron.
Necrobiosis lipoídica. Se ha publicado el caso de un paciente diagnosticado de necrobiosis lipoídica con lesiones ulceradas múltiples, refractario a esteroides y dapsona que fue tratado con desbridaje quirúrgico e injertos, seguido de prednisona 0,5mg/kg al día y etanercept 25mg dos veces en semana. Los esteroides se mantuvieron un año y etanercept 16 meses, permaneciendo el paciente asintomático durante un seguimiento de dos años69. Otro paciente con enfermedad refractaria y lesión única localizada en una pierna fue tratado con etanercept intralesional a una dosis de 25mg semanales con mejoría progresiva durante los 8 meses siguientes70.
Granulomas por silicona. Se ha tratado con etanercept a varios pacientes con reacciones granulomatosas a implantes de silicona, o a adulterantes contenidas en ésta. Pasternack71 describe el caso de dos pacientes con granulomas de cuerpo extraño a silicona en las piernas que había sido inyectada años antes con fines cosméticos. Las dos pacientes fueron tratadas con etanercept 25mg dos veces en semana, con mejoría a las dos semanas del inicio del tratamiento. Una de las pacientes experimentó una resolución completa a los dos meses del tratamiento y en la otra las lesiones persistían pero con desaparición de las molestias y el eritema. Otra referencia obtiene también una buena respuesta en otro paciente72. Paradójicamente un paciente que había recibido inyecciones de silicona 38 años antes para el tratamiento de cicatrices de acné y que estaba asintomático comenzó tratamiento con etanercept para una artritis, lo cual desencadenó la aparición de múltiples granulomas en las localizaciones donde se había inyectado la silicona73.
Granulomas cutáneos en la inmunodeficiencia variable común. La formación de granulomas en diferentes órganos como los pulmones, el bazo, el hígado y la piel es una complicación relativamente frecuente de la inmunodeficiencia variable común. Un varón de 18 años con granulomas cutáneos crónicos en el brazo izquierdo de 13 años de evolución, que eran refractarios a múltiples medicamentos incluyendo antibióticos, inmunoglobulina, esteroides sistémicos, interferón gamma, ciclosporina, metotrexato, antipalúdicos, radioterapia y cirugía, fue tratado con etanercept 25mg dos veces en semana. Un año después de comenzar el tratamiento presentaba una mejoría significativa, una reducción del tamaño de las masas medidas por resonancia magnética y una mejoría en la movilidad del miembro74.
VasculitisSíndrome de Behfet. En Turquía se llevó a cabo un ensayo clínico con 40 pacientes con enfermedad de Behfet que fueron aleatorizados a etanercept 25mg dos veces a la semana o placebo. El grupo de etanercept presentó un número de lesiones erosivas orales, nodulares y pápulo-pustulosas cutáneas significativamente menor que el grupo placebo75; no obstante, las lesiones genitales y la patergia no mejoraron. Se han publicado otros casos aislados con buenos resultados76,77. Sin embargo, Estrach78 publica el caso de un paciente con enfermedad refractaria a múltiples terapias en el que se instaura etanercept 25mg dos veces en semana sin mejorar tras tres meses de tratamiento. Tras suspender etanercept se introduce infliximab con resolución de todas las lesiones.
Granulomatosis de Wegener. Se han llevado a cabo varios ensayos con etanercept en pacientes diagnosticados de granulomatosis de Wegener. Stone79 realiza un estudio clínico de etanercept 25mg dos veces en semana frente a placebo en 20 pacientes, combinado con el tratamiento estándar. La actividad de la vasculitis se redujo de forma significativa y la dosis de prednisona que recibían pudo reducirse pero la diferencia no fue significativa. El objetivo principal de este estudio era valorar la seguridad de la asociación de etanercept a la terapia convencional, confirmándose como una combinación segura.
El Wegener Granulomatosis Etanercept Trial (WGET) fue un estudio randomizado controlado con placebo en el que se asoció etanercept o placebo a la terapéutica estándar de la granulomatosis de Wegener80. No se encontraron diferencias en la tasa de remisiones entre los dos grupos, ni tampoco en los períodos con actividad disminuida, concluyendo el estudio que etanercept no es efectivo para mantener las remisiones en pacientes con granulomatosis de Wegener.
Hay también alguna descripción anecdótica de casos con buena respuesta a etanercept como el publicado por Kleinert81.
Poliarteritis nodosa. Un niño de 5 años con una poliarteritis nodosa y lesiones cutáneas de púrpura palpable realizó varios tratamientos, que siempre incluían esteroides orales, entre los que se encontraban ciclofosfamida, inmunoglobulina intravenosa, azatioprina y metotrexato. Nueve años después del comienzo del cuadro se inicia tratamiento con etanercept asociado al que estaba realizando y que incluía 40mg de prednisona al día, 2,5mg/kg de azatioprina y 25mg de metotrexato semanal. Lentamente en los años siguientes la prednisona, el metotrexato y la azatioprina pudieron ser reducidos sin rebrotar la vasculitis82.
OtrasReticulohistiocitosis multicéntrica. Existen varios casos de esta rara enfermedad sistémica que causa artritis severa y nódulos cutáneos, tratados con etanercept83-85. Kovach83 describe el caso de una paciente de 46 años que había sido tratada con metotrexato, antipalúdicos, clorambucilo, prednisona, ciclofosfamida asociada a metotrexato y prednisona, y que resultó refractaria o intolerante a estos tratamientos. Se instauró tratamiento con etanercept 25mg dos veces en semana asociado a 20mg de prednisona y metotrexato con mejoría progresiva durante 7 meses. En ese momento la paciente experimentó un brote, motivo por el cual se sustituyó metotrexato por leflunomida; esta nueva asociación desencadenó una nueva mejoría, que permitió reducir las dosis de prednisona y de leflunomida. Otro caso, de una paciente de 22 años que se había tratado sin éxito con múltiples fármacos e intervenciones quirúrgicas fue tratada con 25mg de etanercept dos veces en semana asociado a hidroxicloroquina, produciéndose estabilización de la enfermedad85.
En contraposición con estos casos exitosos existe la descripción de un hombre de 42 años que no respondió a la asociación de esteroides orales y de etanercept a las dosis de 25 y 50mg dos veces en semana84.
Necrolisis epidérmica tóxica. La apoptosis inducida por el TNF es en parte responsable de las erosiones de mucosas y del despegamiento epidérmico en los pacientes con necrolisis epidérmica tóxica86. Famularo87 describe el caso de un paciente de 59 años con un cuadro de necrolisis epidérmica tóxica secundaria a ciprofloxacino que fue tratado con prednisona 1mg/kg y etanercept los días 4 y 8. A las pocas horas de la primera administración de etanercept se produjo una recuperación en las lesiones cutáneas y mucosas.
Acné. Un paciente de 22 años con acné refractario desde los 14, que había sido sometido a múltiples tratamientos que incluían antibióticos orales e isotretinoina y había presentado ideación suicida fue tratado con etanercept 25mg dos veces en semana durante 24 semanas. A las dos semanas de tratamiento dejaron de aparecer nuevas lesiones y a a las 24 semanas estaban ya todas resueltas88.
Otro paciente varón de 22 años de una familia con el síndrome PAPA (artritis piogénica estéril, pioderma y acné) fue tratado con etanercept 25mg dos veces en semana durante 30 meses, experimentando desaparición del acné y eliminación de los episodios de artritis89.
Hidrosadenitis. La hidrosadenitis supurativa es una entidad refractaria a múltiples tratamientos y que causa un intenso deterioro en la calidad de vida, motivo por el cual se han ensayado nuevas modalidades terapéuticas entre las que se encuentra etanercept.
Cusack90 ensaya etanercept a dosis de 25mg dos veces en semana en 6 pacientes con hidrosadenitis severa, midiendo la respuesta con una valoración por parte del paciente y con la escala DLQI (índice de calidad de vida en dermatología). Los 6 pacientes mejoraron, con una mejora del DLQI del 64% a las 24 semanas, refiriendo todos los enfermos que este tratamiento había sido el más efectivo que habían realizado. No obstante, en ninguno de los enfermos se alcanzó la resolución completa de las lesiones. Se ha descrito un caso aislado en el que también se obtiene una mejoría de la enfermedad después del tratamiento con etanercept91.
Estomatitis aftosa. Una paciente de 50 años con brotes semanales de aftas dolorosas de 24 años de evolución y refractaria a la terapéutica habitual, excepto a talidomida que sí controló las lesiones pero que tuvo que ser suspendida por neuropatía, fue tratada con etanercept 25mg dos veces en semana con mejoría significativa al mes de tratamiento, apareciendo brotes de fácil control con corticoterapia tópica. En uno de los brotes se administró a la paciente una dosis extra de 25mg de etanercept y las lesiones desaparecieron al día siguiente92.
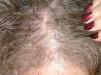
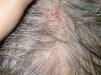
Alopecia areata. En una serie de 17 pacientes con alopecia areata moderada a severa tratados con etanercept 50mg dos veces en semana ninguno de ellos experimentó mejoría93. Otro paciente de 44 años con alopecia areata universal tampoco respondió a etanercept94.
Por otro lado, un paciente con antecedente de alopecia areata que se había resuelto hacía años comenzó tratamiento con etanercept para una artritis reumatoide y desarrolló un nuevo brote de alopecia95.
Eritema anular centrífugo. Un paciente de 57 años con un eritema anular centrífugo de un año de evolución recidivante tras interrumpir los repetidos ciclos de prednisona que se le habían pautado, realizó tratamiento con etanercept a dosis de 25mg dos veces a la semana, con mejoría rápida y llegando a estar asintomático al mes de tratamiento; así se mantuvo durante los 6 meses que éste duró, recidivando a las dos semanas de la interrupción del mismo. Al reintroducirse de nuevo el tratamiento las lesiones desaparecieron rápidamente96.
Amiloidosis primaria. La amiloidosis primaria no tiene un tratamiento eficaz. Se ha publicado un estudio que recoge 16 casos de pacientes tratados con etanercept a una dosis de 25mg dos veces en semana con unos resultados esperanzadores. Uno de estos pacientes presentaba lesiones cutáneas que mejoraron llamativamente a los tres meses del tratamiento97.
Prurito asociado a eritrodermia. Dos pacientes con prurito intenso asociado a eritrodermia en el contexto de un síndrome de Sézary fueron tratados con etanercept 25mg dos veces en semana, con mejoría intensa del prurito en uno y moderada en otro, sin mejoría de la eritrodermia98. Los autores comentan que han iniciado un ensayo clínico para valorar la eficacia de etanercept para el tratamiento del prurito intratable en pacientes con síndome de Sézary98.
Linfomas cutáneos T. Tsimberidou99 llevó a cabo un estudio en 13 pacientes con linfomas cutáneos T refractarios al menos a dos modalidades terapéuticas previas (estadios I-IIA) o a una modalidad (estadios IIB hasta IV). Doce de los 13 pacientes fueron evaluables, presentando una respuesta parcial uno y una respuesta mínima otro. Ambos pacientes tenían estadios precoces (IB).
Nevo epidérmico verrucoso inflamatorio lineal (NEVIL). Una paciente de 55 años con un NEVIL extenso y muy pruriginoso desde los 6 meses de edad y que afectaba cara, tronco y extremidades, siguiendo la líneas de Blaschko, había sido tratada con corticoides tópicos y sistémicos, pimecrolimus e isotretinoina, experimentando, tan sólo, mínimas mejorías. Basándose en las similitudes entre el NEVIL y la psoriasis se trató con etanercept una paciente con un NEVIL muy extenso y refractario a múltiples tratamientos. Después del tratamiento se produjo la desaparición del prurito con mejoría del eritema durante los 6 meses que duró el seguimiento100.
Síndrome SAPHO (sinovitis, acné, pustulosis, hiperóstosis y osteitis). Wagner101 describe los casos de dos pacientes con afectación esquelética severa. El primero de ellos había sido tratado con infliximab con buena respuesta pero presentando tras las infusiones cuadros de disnea, motivo por el cual lo sustituyó por etanercept 25mg dos veces en semana con importante mejoría. El segundo paciente con osteomielitis de mandíbula presentó durante el tratamiento con etanercept a las mismas dosis mejoría en la sintomatología, pudiendo reducir la dosis de prednisona de 20 a 7,5mg al día. Ambos pacientes se mantuvieron en remisión durante los 9 meses de seguimiento.
EfalizumabEs un anticuerpo monoclonal humanizado anti-CD11a, que es una subunidad del LFA-1. La molécula LFA-1 es el ligando del ICAM-1 y la unión de ambos desencadena diferentes mecanismos fisiopatológicos en la psoriasis, como son la migración de linfocitos T memoria a la epidermis y la dermis, la activación de estos en el foco inflamatorio y la adhesión del linfocito a los queratinocitos de la dermis102,103. Al unirse efalizumab al CD11a se bloquea de forma reversible la unión de éste con el ICAM-1.
Actualmente se encuentra aprobado para psoriasis en placas moderada/severa en pacientes que hayan experimentado una falta de respuesta, intolerancia o que presenten contraindicación para las terapias sistémicas tradicionales104.
PosologíaLa posología consiste en la aplicación subcutánea de una inyección de 0,7mg/kg la primera semana, seguidos de 1mg/kg semanales.
Efectos secundariosUno de los efectos secundarios descritos es un síndrome pseudogripal los primeros 2 o 3 días tras la administración, que consiste en febrícula o fiebre, mialgias, cefalea y escalofríos. Esta sintomatología suele desaparecer a partir de la tercera dosis.
En los ensayos clínicos se describe una tasa de infecciones ligeramente superior a la del grupo placebo. Sin embargo la mayoría de estas infecciones son leves105.
Se ha descrito en un número muy reducido de pacientes la aparición de trombopenias severas, generalmente en las primeras 12 semanas de uso. La trombopenia es reversible tras la supresión del fármaco y el tratamiento con glucocorticoides sistémicos.
La erupción papular localizada transitoria consiste en la aparición de numerosas pápulas y pequeñas placas eritematosas en flexuras, cuello y tórax que histológicamente se describen como dermatosis neutrofílica. Suelen aparecer en los dos primeros meses de uso y se controlan con facilidad con corticoterapia tópica.
Con menor frecuencia se produce una exacerbación inflamatoria generalizada de la psoriasis preexistente, que puede acompañarse de la aparición de lesiones nuevas en áreas previamente no afectadas. Este cuadro suele aparecer en las primeras 6 semanas de uso y para su control se recomienda la asociación de otro fármaco sistémico para la psoriasis.
Otro efecto adverso relativamente frecuente es la aparición de un rebrote poco tiempo después de suspender el efalizumab.
ContraindicacionesLas contraindicaciones para el empleo de efalizumab son las inmunodeficiencias, tuberculosis u otras infecciones graves activas, embarazo y lactancia y los antecedentes de una neoplasia en los últimos 10 años.
Usos en dermatosis fuera de indicación (tabla 2)Granuloma anularGoffe106 publica el caso de un paciente de 52 años que padecía un granuloma anular diseminado y psoriasis. Había sido tratado con eficacia variable con ciclosporina, clofazimina, PUVA, tazaroteno, corticoides intralesionales y tacrolimus. Se incluyó al paciente en un ensayo de efalizumab para la psoriasis. A las 4 semanas de tratamiento el granuloma anular había mejorado ostensiblemente, habiéndose resuelto por completo a los 3 meses. La mejoría fue paralela a la de su psoriasis.
Liquen planoSe ha documentado el caso de una mujer de 54 años con liquen plano cutáneo y liquen erosivo oral de tres meses de evolución que había sido previamente tratada con corticoides orales y tacrolimus tópico con una modesta mejoría. Se inició tratamiento con efalizumab a las dosis habituales, con mejoría del 75 % de las lesiones erosivas a las 10 semanas de tratamiento; además, las lesiones cutáneas también mejoraron, quedando tan sólo lesiones hiperpigmentadas residuales107.
En otro ensayo fueron tratados 4 pacientes con liquen erosivo oral con las dosis habituales de efalizumab, con mejoría de un 71 % de la superficie de la mucosa afecta de media y un 82% del dolor108.
Un paciente con liquen plano cutáneo sin liquen erosivo oral fue tratado a las dosis habituales de efalizumab, experimentando una mejoría rápida de sus lesiones cutáneas109, el paciente había sido tratado con ciclosporina y corticoides con anterioridad. A las 4 semanas ya se notaba una intensa mejoría de las lesiones.
Dermatitis atópicaExisten en la actualidad varios artículos que describen la utilidad de efalizumab para la dermatitis atópica. Weinberg110 en 2006 publicó los casos de dos pacientes con dermatitis atópica severa tratados con efalizumab. El primero, un niño de 8 años, había sido tratado con corticoides tópicos y sistémicos, ciclosporina y etanercept sin obtener buenos resultados. Tras comenzar tratamiento con efalizumab a las dosis habituales fue mejorando progresivamente de su dermatitis atópica. La segunda paciente, de 48 años, que había sido tratada con tacrolimus y corticoides tópicos y que rechazaba tratamiento con fototerapia, comenzó tratamiento con efalizumab a las dosis habituales experimentando mejoría 7 meses tras comenzar el tratamiento.
Hassan111 obtuvo buena respuesta en otro paciente de 19 años con un brote de dermatitis atópica, que había sido tratado con corticoides tópicos, inhibidores de la calcineurina y fototerapia. Se mantuvo 10 meses con efalizumab sin necesidad de otros tratamientos mejorando progresivamente en la severidad de su dermatitis atópica. Se practicaron biopsias al inicio y a los 6 meses del tratamiento, encontrándose un descenso de los linfocitos CD4 helper entre otros hallazgos.
Más recientemente se ha llevado a cabo un ensayo112 con 10 pacientes con efalizumab a las dosis habituales durante 12 semanas. Seis de los 10 pacientes consiguieron mejorías superiores al 50% en el EASI (eczema area and severity index). En uno de los pacientes se produjo un rebrote al suspender la medicación.
DermatomiositisHuber113 describe el caso de una paciente de 82 años diagnosticada de DM refractaria a corticoides sistémicos y a metotrexate. Inició tratamiento con efalizumab 1mg/kg semanal asociado a 40mg de prednisolona, con mejoría rápida de las lesiones cutáneas y del estado general. Un mes después se subió la dosis de efalizumab a 1,8mg/kg y se redujo la prednisolona a 10mg/día, con asociación de azatioprina a una dosis de 50mg/día, permaneciendo la enfermedad estable durante los 12 meses que duró el seguimiento.
Enfermedad injerto contra huéspedEn los mecanismos fisiopatológicos de la EICH participan los linfocitos T y su adhesión al endotelio y subsiguientemente al tejido afecto114. No existe experiencia en la EICH cutánea pero sí están en marcha estudios con efalizumab para la prevención de la misma en pacientes con trasplante renal114.
Alopecia areataHace ya varios años se propuso efalizumab como un fármaco que podría ser útil en la alopecia areata115. No obstante, hasta el año 2006 no se han publicado experiencias en este sentido116,117.
Se ha descrito el caso de un varón de 19 años con alopecia universal que mejoró intensamente tras el uso de efalizumab a las dosis habituales. Previamente había realizado únicamente tratamiento con corticoides tópicos. Un mes después de comenzar el tratamiento con efalizumab se pudo apreciar abundante crecimiento del pelo en el cuero cabelludo, que se mantuvo en los meses siguientes; a los tres meses había crecido pelo en el 50% del cuero cabelludo y a los 6 meses en el 90 %116.
Un niño de 8 años con dermatitis atópica y alopecia areata tratado con efalizumab para su dermatitis atópica experimentó además repoblación parcial de sus áreas de alopecia areata110.
Paradójicamente se ha publicado el caso de un paciente con psoriasis en tratamiento con efalizumab que desarrolló una alopecia areata con afectación del 70 % de la superficie corporal117.
Lupus eritematoso subagudoClayton118 describe el caso de una mujer de 47 años con lesiones en placas eritematosas en áreas fotoexpuestas y con estudio histológico y serológico compatible con lupus eritematoso subagudo. La paciente había sido tratada con infinidad de fármacos, experimentando respuestas pobres (corticoides tópicos y sistémicos, antipalúdicos, dapsona, sales de oro, azatioprina, talidomida, metotrexate, isotretinoina, leflunomida y micofenolato mofetilo). Se administró efalizumab a la dosis de 1mg/kg/semana, presentando a las 6 semanas de tratamiento una mejoría muy importante. A los 4 meses de tratamiento experimentó un brote que fue controlado subiendo la dosis de efalizumab a 1,25mg/kg/semana. Tras 5 meses de tratamiento la enfermedad continuaba controlada.
Paradójicamente se ha descrito el caso de una mujer de 65 años que entró en un protocolo de efalizumab para liquen plano erosivo oral y que desarrolló a las 8 semanas de tratamiento un brote de lesiones cutáneas sugestivas de lupus eritematoso subagudo con anticuerpos antinucleares (ANA) 1:160 y anti-Ro positivos119.
Recientemente ha sido publicado una estudio retrospectivo sobre 13 pacientes con lupus discoide refractario a los tratamientos inmunosupresores habituales tratados con efalizumab, que obtiene unos resultados esperanzadores, con una respuesta global en 11 de los 13 pacientes entre buena y excelente, una media de respuesta al tratamiento de 5,5 semanas y una disminución del título de ANA en 6 de los pacientes, con escasos efectos secundarios120.
AlefaceptEs una proteína de fusión dimérica recombinante del dominio de unión del LFA-3, que es ligando del CD2. Alefacept se une al CD2 de los linfocitos T memoria inhibiendo su activación. Además, la fracción constante de la IgG1 se une a macrófagos y células naturalkiller induciendo la apoptosis de los linfocitos T8.
Está aprobado en Estados Unidos para el tratamiento de la psoriasis en placa moderada/severa121. En el momento actual no tiene la aprobación en la Unión Europea.
PosologíaEl régimen aprobado es la administración semanal intramuscular de 15mg de alefacept durante un período de 12 semanas. Pueden realizarse ciclos subsiguientes dejando pasar al menos 12 semanas sin tratamiento.
Efectos secundariosNo se ha descrito un mayor número de infecciones ni de neoplasias en los pacientes tratados con alefacept frente a los tratados con placebo122. Se producen cuadros pseudogripales autolimitados en las primeras semanas de uso. Las reacciones en el punto de inyección descritas son mínimas122.
Las cifras de linfocitos CD4 descienden durante el tratamiento. Si éstas caen por debajo de 250 cél/microlitro el medicamento debe ser suspendido, reanudando su uso cuando suben por encima del citado límite. Si permanecen durante más de 4 semanas por debajo de 250 cél/microlitro debe suspenderse el fármaco indefinidamente122.
Aproximadamente un 3 % de los pacientes desarrollan anticuerpos anti-alefacept8.
ContraindicacionesSu uso está contraindicado si existe el antecedente de neoplasia, infección grave en las dos semanas previas al inicio del tratamiento o si la cifra de linfocitos CD4 es inferior a la normal122.
Uso en dermatosis fuera de la indicación aprobadaLiquen planoSe han descrito los casos de dos pacientes con liquen plano generalizado refractario a otros tratamientos y que respondieron a alefacept123. Se empleó la dosis de 15mg/semana durante 12 semanas, experimentando ambos pacientes una mejoría notable al mes de tratamiento. En los dos pacientes a las 12 semanas habían dejado de aparecer nuevas lesiones y en ambos habían mejorado en cierto grado las lesiones previas. También el prurito había desaparecido por completo en los dos pacientes.
Alopecia areataCuatro pacientes con alopecia areata extensa o universal fueron tratados con 15mg semanales de alefacept durante 3 meses. Los 4 pacientes recibieron corticoides intralesionales en zonas concretas. Todos los pacientes experimentaron una mejoría, siendo casi siempre muy modesta, y en ningún caso existió una respuesta completa. Las respuestas se observaron de 3 a 15 semanas después de comenzar el tratamiento124.
SarcoidosisSe ha descrito el caso de un paciente de 46 años con un lupus pernio recalcitrante que experimentó una mejora modesta a las 8 semanas de tratamiento125.
EsclerodermiaUna mujer de 58 años con esclerodermia progresiva con afectación cutánea refractaria a otros tratamientos (corticoides sistémicos, antipalúdicos, colchicina y metotrexato) fue tratada con alefacept durante tres meses sin experimentar ninguna mejoría126.
Enfermedad injerto contra huéspedSe ha publicado un ensayo con 7 pacientes con EICH resistente a corticoides sistémicos que fueron tratados con alefacept127. Existía afectación de la piel en los 7 pacientes, del tubo gastrointestinal en 5 y del hígado en tres127. Todos los pacientes respondieron, pero en 3 la respuesta inicial fue seguida de un rebrote, no alcanzándose la respuesta completa. La respuesta inicial fue muy rápida, notándose mejoría al día siguiente de comenzar el uso del fármaco. Sólo un paciente alcanzó una respuesta completa, la cual se logró a los 40 días de tratamiento.
RituximabRituximab es un anticuerpo quimérico monoclonal anti-CD20 que produce depleción de las células CD20 in vivo. Se trata del primer anticuerpo aprobado para el tratamiento de cáncer128. Actualmente está autorizado para el tratamiento del linfoma B CD20+ folicular y difuso de células grandes, refractario al tratamiento quimioterápico o como mantenimiento de la respuesta de estos linfomas tras tratamiento inicial. Además está indicado para el tratamiento de la artritis reumatoide en combinación con metotrexato en aquellos pacientes refractarios a los tratamientos habituales, incluyendo fármacos anti-TNF129.
La molécula CD20 es un antígeno transmembrana que se expresa en los linfocitos B maduros, pero no en las células plasmáticas, ni en las células madre ni en los linfocitos inmaduros128. Por este motivo, los niveles de inmunoglobulinas no decaen y a partir de la maduración de los linfocitos pre-B los niveles de linfocitos B maduros se recuperan tras cada ciclo de tratamiento130,131. Los mecanismos principales por los que se produce esta depleción de células CD20 parece ser el de citotoxicidad celular mediada por anticuerpos y el de lisis celular mediada por complemento132.
PosologíaRituximab se administra según una pauta habitual de infusiones intravenosas de 375mg/m2 semanales durante 4 semanas, pauta que se puede repetir según la respuesta129.
Efectos secundariosRespecto a su perfil de seguridad, se trata de un fármaco relativamente seguro cuyos principales efectos secundarios son de tipo alérgico (urticaria, fiebre y angioedema) relacionados con la primera infusión, siendo leves en la mayoría de los casos130,133,134. Este tipo de reacciones se estima que ocurren en un 18 % de los pacientes135. Además se han descrito reacciones locales tras el tratamiento por liberación local de citoquinas en las áreas en las que se localizan los tumores136,137.
Se ha descrito una mayor incidencia de infecciones en los pacientes tratados con este fármaco138.
El desarrollo de anticuerpos humanos antiquiméricos neutralizantes (HACA) es muy variable y parece depender de la enfermedad de base. El desarrollo de estos anticuerpos se asocia a una menor eficacia del fármaco139.
Usos fuera de indicaciónLa idea de utilizar este anticuerpo monoclonal para el tratamiento de enfermedades de base autoinmune comenzó poco después de que en 1997 se comercializara para el tratamiento de linfomas de bajo grado140, y se basa en la depleción de los linfocitos CD20+ tumorales y no tumorales sin afectar a las células plasmáticas, de modo que el objetivo que se pretende no es disminuir los niveles de autoanticuerpos, sino modificar el mecanismo de respuesta inmune mediante un cambio y renovación de las células CD20+ memoria.
Por este motivo, rituximab se ha utilizado para el tratamiento de enfermedades de origen autoinmune y parte de ellas corresponden a enfermedades con expresión dermatológica que a continuación pasamos a revisar.
Lupus eritematosoEl mecanismo por el cual rituximab tiene un efecto beneficioso en el tratamiento del lupus eritematoso sistémico (LES) parece que radica en interferir en la interacción entre la célula B y T, disminuyendo en último término la producción de linfocitos B autorreactivos141. Por este motivo existe una correlación entre la respuesta a rituximab y la depleción de linfocitos B.
Rituximab se ha utilizado para el tratamiento del lupus eritematoso principalmente cuando éste es muy activo y con afectación grave de órganos vitales como el sistema nervioso central, riñón o citopenias. Aunque no existen amplios estudios, parece que el uso de este fármaco en el tratamiento del LES refractario es beneficioso y seguro142-147.
Entre estos casos se han descrito algunos en los que, aparte de una mejoría de los síntomas sistémicos, también mejoró la clínica cutánea139,148-152. Además se ha descrito un caso de urticaria-vasculitis y angioedema en una paciente con LES refractario a múltiples tratamientos (mofetil micofenolato, bolos de metilprednisolona e inmunoglobulina intravenosa) que respondió de forma rápida al tratamiento sin que se produjeran nuevos episodios de urticaria o angioedema tras el tratamiento y permitiendo suspender los bolos de metilprednisolona153.
DermatomiositisRituximab ha demostrado utilidad terapéutica en algunos pacientes diagnosticados de DM. En esta enfermedad tienen un importante papel los anticuerpos que se depositan en el endotelio de los vasos y que tras activar la cascada del complemento provocan la liberación de mediadores de inflamación, necrosis y, finalmente, isquemia muscular y daño cutáneo154. Con el fin de disminuir estos autoanticuerpos se ha utilizado el rituximab como tratamiento para la DM.
Se han publicado tres estudios sobre la eficacia de rituximab en el tratamiento de DM con diferentes resultados. Levine155 obtiene buenos resultados en 6 pacientes con DM refractaria tratados con rituximab según la pauta convencional, presentando todos los pacientes mejoría de los síntomas cutáneos y musculares. Posteriormente Chung156 publica un estudio sobre 8 pacientes con DM refractaria que siguieron tratamiento con rituximab, dos dosis de 1g separadas por dos semanas. Sólo tres de los pacientes del estudio obtuvieron una mejoría parcial de la fuerza muscular y únicamente uno de ellos obtuvo una mejoría de las manifestaciones cutáneas. Recientemente Dinh157 publica los casos de tres pacientes con DM refractaria a múltiples tratamientos, donde se valora de manera exhaustiva la respuesta de la clínica cutánea. El primer paciente que presentaba hiperqueratosis palmar y poiquilodermia respondió al tratamiento y se mantuvo sin lesiones con infusiones cada 4 meses durante un período de seguimiento de dos años. El segundo paciente presentaba eritema y poiquilodermia en tronco, eritema en heliotropo y pápulas de Gottron. Después de 4 meses de tratamiento con rituximab a la pauta habitual la sintomatología cutánea era muy leve, permitiendo suspender los inmunosupresores durante 20 meses de seguimiento. Por último, el tercer paciente, que presentaba eritema periungueal, alopecia, poiquilodermia y eritema en heliotropo, respondió con mejoría de toda la sintomatología cutánea a los dos meses de finalizar el tratamiento con rituximab, excepto del eritema de dedos y periungueal.
Además de estos dos estudios se han publicado casos sueltos en los que el tratamiento con rituximab produjo una mejoría de la sintomatología y disminución de los niveles de enzimas musculares158,159. Dado el escaso número de pacientes con DM tratados con rituximab es difícil obtener conclusiones, aunque con los trabajos publicados parece que rituximab produce una mejoría de la sintomatología muscular, mientras que la sintomatología cutánea parece más refractaria al tratamiento, aunque hay casos en los que se ha obtenido una rápida y duradera respuesta.
VasculitisRituximab se ha utilizado para el tratamiento de diferentes vasculitis, especialmente para las vasculitis asociadas a anticuerpos contra antígenos del citoplasma de los neutrófilos (ANCA) y crioglobulinemia.
En este caso, a pesar de que rituximab no actúa sobre las células plasmáticas maduras, parece que tiene un papel beneficioso al actuar sobre los linfocitos CD20+ precursores de las células plasmáticas, con una disminución de los niveles de autoanticuerpos y formación de inmunocomplejos implicados en la génesis de las vasculitis. Se ha publicado una serie de 11 pacientes con vasculitis con ANCA + en la que todos los pacientes alcanzaron remisión de la enfermedad tras el tratamiento con rituximab en la pauta habitual160. Además se ha publicado otra serie de 9 pacientes en la que 8 de ellos alcanzaron una respuesta total161.
Se han descrito casos de enfermedad de Wegener tratados con rituximab, que respondieron al tratamiento a pesar de que se habían mostrado refractarios a otras modalidades de tratamiento. Ferraro describe el caso de un paciente con enfermedad de Wegener, que inicialmente se controló con ciclofosfamida y plasmaféresis. Posteriormente desarrolló un linfoma no hodgkiniano de alto grado, por lo que se desestimó controlar los brotes de vasculitis con ciclofosfamida introduciéndose rituximab. Después de dos ciclos de tratamiento con rituximab a las dosis habituales, el paciente se mantuvo en remisión sin necesidad de otros fármacos durante un período de seguimiento de 10 meses162. Otros autores han descrito respuestas similares al tratamiento con rituximab en pacientes con enfermedad de Wegener refractaria o con desarrollo de efectos secundarios que contraindicaban la administración de los fármacos inmunosupresores. En estos pacientes la respuesta a rituximab es rápida, se alcanza la remisión tras el primer ciclo y permite suspender los glucocorticoides, respondiendo de nuevo al tratamiento con rituximab si se desarrolla un nuevo brote163-169. Aunque muchos de los pacientes descritos sólo alcanzan respuestas transitorias166, también hay respuestas mantenidas en el tiempo170,171 y se ha descrito que en terapia de mantenimiento la asociación con leflunamida puede tener un efecto sinérgico172. En un estudio prospectivo realizado con 10 pacientes con vasculitis por enfermedad de Wegener tratados con rituximab se obtuvo una remisión de la enfermedad en todos ellos tras un ciclo con 4 dosis de rituximab, permitiendo suspender la corticoterapia asociada y normalizándose los niveles de c-ANCA. Cinco de los pacientes requirieron un nuevo ciclo por aumento de los niveles de autoanticuerpos. De estos pacientes, sólo uno presentó un brote de vasculitis tras la recuperación de los niveles de linfocitos CD20173.
Sin embargo, a pesar de estos buenos resultados del tratamiento de la enfermedad de Wegener con rituximab, también se han publicado resultados no tan prometedores. En un estudio realizado sobre 8 pacientes sólo 3 de ellos respondieron presentando mejoría clínica, otros 3 se mantuvieron estables y en 2 de ellos la enfermedad continuó progresando. Los niveles de CD20 cayeron, mientras que los de c-ANCA permanecieron estables174. La diferente respuesta de esta serie puede ser explicada porque estos pacientes presentaban una enfermedad principalmente con formación de granulomas (granulomas retrorbitarios, nódulos pulmonares y estenosis traqueal), mientras que los pacientes con una mejor respuesta son en los que predomina una vasculitis de pequeño vaso (glomerulonefritis, epiescleritis, hemorragias pulmonares…)175. Esta peor respuesta de las lesiones granulomatosas frente a la actividad de la vasculitis ha sido observada también en una reciente serie de 8 pacientes176.
También se ha utilizado rituximab para el tratamiento de vasculitis asociada a crioblobulinemia.
Existen algunos casos publicados de crioglobulinemia tipo I con buena respuesta al tratamiento con rituximab, aunque también hay casos que no respondieron177 o que incluso empeoraron y presentaron un aumento de los niveles de crioaglutininas178. Se ha descrito el caso de un paciente con crioglobulinemia tipo I asociada a leucemia linfática crónica que respondió al tratamiento con rituximab y fludarabina179.
Las crioglobulinemias tipo II y III se hallan asociadas, en la mayoría de los casos, a infección por el virus de la hepatitis C (VHC). La vasculitis puede afectar además de a la piel a órganos vitales como el riñón, y el tratamiento con interferón y ribavirina no es eficaz en muchos de los casos, mientras que el tratamiento con inmunosupresores presenta muchos efectos secundarios. Por este motivo, rituximab se plantea como una nueva y esperanzadora opción de tratamiento.
La serie más extensa de pacientes con crioglobulinemia mixta (II y III) tratados con rituximab la componen 20 pacientes con esta enfermedad, todos ellos con infección por el VHC y no respondedores al tratamiento con interferón a. En esta serie, 16 de los 20 pacientes obtuvieron una respuesta total, con disminución de las crioglobulinas, pero existía un acusado descenso de los anticuerpos anti-VHC y aumento de los niveles del ARN del virus180. Por este motivo, aunque en el tratamiento de la crioglobulinemia mixta rituximab parece eficaz, debe utilizarse con cautela. Previamente se había publicado una serie de 15 pacientes diagnosticados de crioglobulinemia mixta tipo II, no respondedores al tratamiento convencional. Todos los pacientes que presentaban clínica cutánea obtuvieron una respuesta positiva al tratamiento con rituximab181. Además, se ha publicado una serie de 4 pacientes con crioglobulinemia tipo II tratados con rituximab, donde tras el tratamiento uno de ellos presentó una respuesta completa y los otros tres una respuesta parcial, con desaparición de las crioglobulinas en dos de ellos182.
Se ha descrito un caso de crioglobulinemia tipo III no asociada a linfoma en un paciente con lesiones purpúricas y artralgias que respondió al tratamiento con rituximab, mientras que no lo había hecho con glucocorticoides, ciclofosfamida o plasmaféresis183. Igualmente, se han descrito casos de crioglobulinemia mixta esencial tipo II que también respondieron al tratamiento con rituximab184-186 y un caso que respondió al tratamiento con rituximab asociado a infliximab187.
Además, rituximab produjo una mejoría de la crioglobulinemia mixta tipo III en un paciente en el que se pautó el fármaco para tratamiento de un linfoma no hodgkiniano188. A pesar de estos casos que mostraron una buena respuesta, se ha descrio uno de crioglobulinemia mixta esencial que no respondió al tratamiento con rituximab189.
Enfermedades ampollosas autoinmunesDentro de las enfermedades autoinmunes, el grupo de enfermedades ampollosas constituye uno de los modelos mejor estudiados, conociéndose para la mayoría de ellas el antígeno específico y el tipo de anticuerpo que reacciona ante el mismo desarrollando la enfermedad.
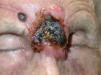
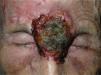
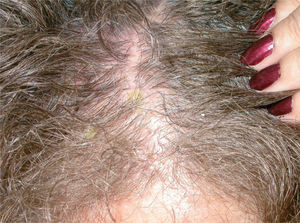
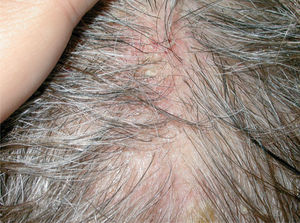
En la literatura revisada la mayor parte de los casos de enfermedades ampollosas autoinmunes tratados con rituximab son casos de pénfigo vulgar (PV). Así, se han publicado casos de un total de 56 pacientes con PV190-212 (tabla 3) (figs. 1 y 2), 8 con pénfigo paraneoplásico (PP)213-220, 3 con pénfigo foliáceo (PF)221,222, 3 con penfigoide ampolloso (PA)212'223, uno de pénfigo Ig A220, otro de penfigoide cicatricial212 y 5 con epidermolisis bullosa adquirida224-226.
Revisión de los casos de pénfigo vulgar publicados en la literatura revisada
| Autor | n | Edad Sexo | Tratamiento concomitante | Respuesta | Seguimiento efectos secundarios |
| Salopek 2002190 | 1 | 29M | C, MMF, CyA | Mejoría brotes ocasionales | 160 d |
| Virgolini 2003191 | 1 | 53M | C, CyA | Remisión completa | 40s |
| Cooper 2003192 | 1 | 54M | C, MMF | Remisión completa | Desconocido |
| Hermann 2003193 | 1 | 54M | C | Remisión completa | Desconocido |
| Morrison 2004194 | 3 | 51V37V47M | C, CFC, CFCF | Remisión completa Remisión completa Mejoría | 18m5m9m |
| España 2004195 | 1 | 39V | C | Remisión completa | 40s |
| Dupuy 2004196 | 3 | 34M 42M 20V | C, AZAC,CyA, MMFC | Respuesta parcialRespuesta parcial.Remisión completa | 40s72s40s |
| Cecchi 2005197 | 1 | 44M | C | Remisión completa | 10m |
| Kong 2005198 | 1 | 17M | C | Remisión completa | 17m |
| Arin 2005199 | 4 | 60M26M27M57M | C, MMFC, MTXC, MTXC, MMF | Respuesta completaMejoría brotes ocasionalesMejoría brotes ocasionalesRespuesta completa | 24m10m10m18m |
| Schmid 2005200 | 1 | 14M | C, MMF, Ig IV | Respuesta completa | 2a |
| Wenzel 2005201 | 1 | 55M | C | Respuesta completa | 3m |
| Ahmed 2006202 | 11 | Media 38a, 5V;6M | C, Ig IV | 9 Respuestas completas 2 Respuestas parciales | 22-37m |
| Domínguez 2006203 | 1 | 60M | C | Respuesta parcial | 1m |
| Niedermeier 2006204 | 1 | 26M | C, MMF | Respuesta completa y retardada (15m) | 15m |
| Esposito 2006205 | 2 | 45V49V | Monoterapia | Respuesta completaRespuesta completa | 7m6m |
| Pitarch 2006206 | 1 | 64V | C | Respuesta completa | 7m |
| Belgi 2006207 | 1 | 37M | C, MMF | Respuesta completa y tardía | 11m |
| Antonucci 2006208 | 5 | 30V31V28V35M29V | C en los 5 casos | Todos respuestas completas | 12m12m13m12m11m |
| Marzano 2007209 | 3 | 51V50M55V | Desconocido | Respuesta completa Respuesta parcial Respuesta mínima | 24m21m2m |
| Goh 2007210 | 5 | 48V62M57V46M57V | C, MMF, CyAC, MMFC, CyAC, AzaC | No respuesta Respuesta completa No respuesta Respuesta completa Respuesta completa | 13-18m |
| Borel 2007211 | 2 | 52M50M | C MMFC, AZA, CyA, IglV | Respuesta completa Respuesta completa | 15m 8m |
| Schmidt 2007212 | 4 | 39m81M68m17m17m | C, AZAC, CPC, MMFC, MMFC, MMF | Respuesta parcial Respuesta completa Respuesta completa Respuesta parcial | 21m16m9m 7m |
a: años; AZA: azatioprina; C: corticoides sistémicos; CP: ciclofosfamida; CyA: ciclosporina; d: días; m: meses; M: mujer; MMF: mofetil micofenolato; s: semanas; V: varón.
Lesiones residuales en cuero cabelludo de la misma paciente tras tres infusiones de rituximab intravenoso. Fuente: Esposito M, et al205.
El PV es una enfermedad ampollosa autoinmune en la que se ha demostrado una estrecha relación con los niveles de autoanticuerpos circulantes (antidesmogleína 3 y antidesmogleína I)190. Si consideramos que rituximab no produce una depleción de las células plasmáticas maduras, la buena respuesta con este fármaco se debería a la destrucción de clones de linfocitos CD20+ autorreactivos196. Otros autores consideran que los anticuerpos del pénfigo son producidos tanto por los linfocitos CD20 como por las células plasmáticas, pero que éstas últimas producirían IgG subclase I, menos patogénicas que las producidas por los linfocitos CD20 de tipo IgG4192,195,227. Además la depleción de linfocitos CD20 interfiere con otras funciones de éstos como la presentación de antígenos y la interacción con los linfocitos T y células dendríticas, pudiendo ser éste otro mecanismo de acción en el PV y otras enfermedades inmunológicas142.
Hasta la actualidad la mayor parte de las publicaciones de pénfigo vulgar y rituximab corresponden a casos clínicos90-212.
Los casos de PV tratados con rituximab responden en su mayoría de forma rápida al tratamiento, mejorando su sintomatología una o dos semanas después de la primera infusión. Los pacientes alcanzan la remisión clínica entre el primer y el noveno mes desde el inicio del tratamiento. Los casos con respuesta retardada a rituximab presentaban una afectación principalmente en mucosas204,207,209, por lo que se ha postulado que este tipo de afectación es más resistente al tratamiento con rituximab209. La respuesta se mantiene durante un período variable, desde pocos meses con rebrote posterior196, hasta un máximo de tres años tras haber finalizado el tratamiento199,209.
En todos los pacientes se produjo una depleción rápida de los niveles de linfocitos B en sangre periférica, recuperándose meses e incluso años después de finalizado el tratamiento199, coincidiendo en algunos casos con un rebrote de la enfermedad.
Respecto a los niveles de inmunoglobulinas en sangre periférica, sólo se ha descrito el caso de dos pacientes en los que se produjo un descenso198,212, en el resto no se alteraron, mientras que los anticuerpos antidesmogleína disminuyeron coincidiendo con la mejoría clínica. Sólo se ha descrito el caso de un paciente en el que a pesar de alcanzar prácticamente una remisión completa, lo que permitió suspender otras medicaciones, los títulos de autoanticuerpos no sólo no disminuyeron sino que aumentaron192.
De los 56 pacientes descritos, 37 obtuvieron una respuesta total, lo que hizo que se pudiera suspender otras medicaciones192-194,199,200,202,205,209,210,212. Sólo en dos pacientes rituximab se utilizó en monoterapia205.
La serie más larga es la de Ahmed202, que incluye a 11 pacientes con PV refractario a múltiples tratamientos, y donde con tratamiento de rituximab asociado a inmunoglobulina intravenosa se obtuvieron buenos resultados en todos ellos. En 9 pacientes se alcanzó la remisión completa de la enfermedad durante un período de seguimiento largo, 31 meses de media, postulándose un efecto sinérgico entre estos dos fármacos202.
Recientemente se ha publicado el primer estudio prospectivo en 5 pacientes con PV refractario tratados con 4 dosis de rituximab asociado al tratamiento inmunosupresor que estaban previamente realizando, en el que se obtuvo una respuesta completa en tres de los pacientes. Dos pacientes desarrollaron infecciones graves (neumonía comunitaria e infección por citomegalovirus)210.
Existe un caso descrito de PV vegetante en el que el tratamiento con rituximab no fue satisfactorio, hecho que podría explicarse en parte por la tendencia de estas lesiones a la sobreinfección209.
En general fue un fármaco bien tolerado, aunque en algunos de los pacientes se produjeron efectos secundarios graves, especialmente infecciones graves, muerte por neumonía por Pneumocystis carinii194, artritis de cadera por Pseudomonas aeruginosa196, neumonía comunitaria196,210,212, sepsis polimicrobiana190, enteropatía no infecciosa, neumonía por Haemophilus influenzae, sepsis por virus herpes zoster (VHZ)212, neumonía nosocomial212 e infección por CMV210. En opinión de algunos autores los pacientes con enfermedades autoinmunes tratados con rituximab desarrollan con más facilidad infecciones que los enfermos con neoplasias o discrasias sanguíneas. Este hecho puede deberse a la inmunosupresión adquirida de estos pacientes tras someterse a múltiples tratamientos inmunosupresores.
Respecto a rituximab en el tratamiento del PP, se han descrito casos que presentaron una importante mejoría tras el tratamiento213,214,218. Uno de estos casos era una paciente con pénfigo paraneoplásico y un linfoma no hodgkiniano, aunque es complicado determinar si la mejoría del PP se debe a rituximab o a la regresión del tumor tras el tratamiento con este fármaco214. Sin embargo, se han descrito otros 4 casos de PP asociados a linfomas no hodgkinianos que no respondieron al tratamiento216,217,219,228.
Rituximab también fue eficaz para el tratamiento de tres casos de PF con respuesta rápida al mismo221,222.
El único caso de pénfigo IgA tratado con rituximab corresponde a una mujer de 79 años de edad, con una leucemia linfática crónica, que desarrolló lesiones vesiculoampollosas en piel y mucosas, con una afectación más intensa de éstas últimas. La enfermedad se controló en tres meses, después del tratamiento con rituximab asociado a fludarabina220.
Se han publicado únicamente los casos de dos pacientes con PA que respondieron al tratamiento con rituximab. Uno de los pacientes era un niño en el que se alcanzó el control de la enfermedad tras tratamiento con dos ciclos de 4 infusiones de rituximab, permitiendo controlar la enfermedad a pesar de presentarse varios afectos adversos (enteropatía no infecciosa, neumonía por Haemophilus influenzae y sepsis por VHZ). El otro paciente era una mujer de 63 años de edad que a las dos semanas de iniciar el tratamiento con rituximab, con una buena respuesta, falleció por una neumonía nosocomial212.
Como dato curioso cabe destacar la respuesta de un niño de 14 años diagnosticado de síndrome IPEX (desregulación inmune, poliendocrinopatía, enteropatía, ligado al cromosoma X), que en el contexto de una dermatitis crónica tipo prúrigo nodular resistente a múltiples tratamientos desarrolló un PA que respondió al tratamiento con rituximab asociado al tratamiento inmunosupresor previo223.
Sólo se ha descrito el caso de un paciente con penfigoide cicatricial cuyas lesiones nasofaríngeas curaron después de ser tratadas con un ciclo de rituximab, mientras que las lesiones oculares no mostraron mejoría, probablemente por encontrarse en una fase muy avanzada212.
El primer caso de epidermolisis ampollosa adquirida tratado con rituximab fue publicado por Schmidt en el año 2006226. Se trataba de un varón de 46 años de edad con una enfermedad refractaria a tratamiento inmunosupresor (prednisona, azatioprina, dapsona y colchicina) que tras un único ciclo con rituximab alcanzó la remisión completa de la enfermedad durante un período de seguimiento de un año, permitiendo suspender otras medicaciones. Posteriormente se han publicado casos de tres pacientes más, dos de ellos con una buena respuesta al tratamiento combinado con inmunoadsorción y rituximab225 y un paciente con una respuesta parcial al tratamiento combinado de rituximab y mofetil micofenolato, durante un período de seguimiento de un año224.
Enfermedad injerto contra huéspedEn la EICH los linfocitos T y las células natural killer tienen un papel principal. Sin embargo, los linfocitos B también están implicados en el desarrollo de la enfermedad229,230. Se ha demostrado en un modelo murino de esclerosis sistémica que el desarrollo de fibrosis depende en gran medida de la expansión de linfocitos B activados tras la interacción con el linfocito T231. Este modelo se ha propuesto como uno de los mecanismos patogénicos de los cambios esclerodermiformes en la EICH232. Pero más aún, en los pacientes con EICH se ha podido determinar la presencia de autoantígenos similares a los asociados a las enfermedades autoinmunes230,232.
Rituximab se ha utilizado en el tratamiento de la EICH con el propósito de interferir en los mecanismos de la inmunidad humoral implicados en esta entidad. La primera serie de pacientes con EICH crónica y refractaria al tratamiento inmunosupresor convencional tratados con rituximab es la de Ratanatharathorn229, en la que 8 pacientes con cambios esclerodermiformes fueron tratados con rituximab (un ciclo de 4 semanas, 375mg/m2 semanal) asociado a su tratamiento inmunosupresor previo, con mejoría clínica en 4 de ellos. Además se han publicado otras series en las que también se han obtenido buenos resultados232,233. Cutler publicó una serie reciente234 que engloba 21 pacientes con EICH crónica y refractaria, con cambios cutáneos esclerodermiformes o liquenoides. La tasa total de respuestas es del 70%, con dos respuestas completas, durante un período de seguimiento de un año. Los pacientes presentaron una mayor mejoría de la clínica cutánea y musculoesquelética que de la afectación de mucosas o de órganos internos. La serie más extensa corresponde a Zaja, con 38 pacientes tratados y con una respuesta global de los cambios cutáneos asociados a la enfermedad de un 63 %, siendo enores las tasas de respuestas de las manifestaciones en mucosas235.
En algunos de los pacientes de estas series, simultáneamente con la mejoría clínica tras el tratamiento con rituximab, los niveles de autoanticuerpos se hicieron indetectables232.
Además de estas series, también se han publicado casos individuales de pacientes con EICH con mejoría de la clínica cutánea236-239. El primero de ellos, publicado en el año 2000237, se trataba de un paciente en el que rituximab se utilizó para tratamiento de trombocitopenia autoinmune con mejoría asociada de la EICH cutánea con cambios liquenoides, siendo el primer caso de respuesta de esta enfermedad a rituximab237.
OmalizumabOmalizumab es un anticuerpo monoclonal humanizado dirigido contra la fracción constante de la IgE. Logra disminuir las concentraciones séricas de IgE, impidiendo que ejerza sus acciones al unirse a los mastocitos y a otras células inmunológicas240.
Está aprobado para el tratamiento del asma alérgica severa persistente en pacientes mayores de 12 años con pruebas alérgicas positivas que presentan una función pulmonar reducida y con síntomas diarios frecuentes a pesar del tratamiento con agonistas betaadrenérgicos241. También ha sido efectivo en pacientes con alergia al látex242 y con rinitis alérgica243-245.
PosologíaLa dosificación de omalizumab se realiza dependiendo del peso del paciente y de la cuantificación de la IgE; así se considera que valores de IgE superiores a 1.000 UI/ml son demasiado altos para poder ser neutralizados. La vía de administración es subcutánea y se suministra cada 2-4 semanas.
Efectos secundariosOmalizumab tiene un perfil de seguridad muy aceptable, siendo las reacciones en el punto de inyección las más frecuentes. No obstante, se han descrito reacciones anafilácticas severas en un 0,1 % de los pacientes tratados. Estas reacciones se producen típicamente durante la primera hora tras la infusión, por lo que debe administrarse bajo supervisión médica246-249. No se ha demostrado la formación de anticuerpos contra omalizumab250.
ContraindicacionesNo debe emplearse omalizumab para el tratamiento de las reagudizaciones asmáticas. Dado que la IgE forma parte de la defensa inmunológica frente a infecciones por helmintos, no debe utilizarse omalizumab en pacientes con elevado riesgo de infecciones helmínticas, sobre todo cuando éstos viajan a zonas endémicas251. Tampoco debe utilizarse omalizumab si se es alérgico a éste o a alguno de sus componentes.
Usos fuera de indicaciónDermatitis atópicaExisten varias series de pacientes con dermatitis atópica tratados con omalizumab252. La utilización de omalizumab en esta patología se basa en la elevación de la IgE en los pacientes afectos de dermatitis atópica y en que esta última se encuentra dentro del espectro de la atopia al que también pertenece la rinitis y el asma en las que omalizumab se ha demostrado útil253. En contraposición con estos hechos está la opinión de otros expertos que consideran que la IgE no tiene un papel importante en el eczema y que los niveles de IgE en la dermatitis atópica son demasiado elevados para poder ser neutralizados con omalizumab254. Beck255 considera que posiblemente la falta de eficacia en algunos de los pacientes con dermatitis atópica a efalizumab se debe a las concentraciones séricas de IgE excesivamente elevadas. Por este motivo, propone la realización de un nuevo estudio que incluya sólo a pacientes con dermatitis atópica con concentraciones de IgE inferiores a 700 UI/ml.
Krathen256 publica una serie de tres pacientes adultos con dermatitis severa recalcitrante que trató con 450mg de omalizumab cada dos semanas. Las concentraciones séricas de IgE previas al tratamiento estaban entre 5.440 y 24.400 UI/ml. Ninguno de los tres pacientes experimentó mejoría.
Lane257 describe una serie de tres niños con dermatitis atópica refractaria y severa con edades comprendidas entre 10 y 13 años. Las dosis en este estudio variaron entre 150 y 450mg de omalizumab cada 2 semanas. Los tres enfermos experimentaron una importante mejoría. Todos se trataron de forma simultánea con medicación tópica que incluía corticoesteroides.
Por último, la serie más extensa incluye 7 pacientes con edades comprendidas entre los 7 y 58 años y cuantificación sérica de IgE entre 265 y 2.020 UI/ml. Las dosis de omalizumab eran de 375mg cada dos semanas en 6 pacientes y 300mg en el resto, manteniendo los enfermos su medicación habitual. La severidad del eczema era moderada en 4 pacientes, severa en uno y leve en el resto. Se valoró a los pacientes a los 3 y 7 meses de tratamiento. Todos los pacientes mejoraron y ninguno presentó brotes durante el tratamiento. Los autores concluyen que su experiencia debe confirmarse con ensayos clínicos aleatorizados258.
MastocitosisCarter publica su experiencia en el tratamiento de las reacciones anafilactoides en dos pacientes con mastocitosis sistémicas con omalizumab259.La primera paciente era una mujer de 17 años con urticaria pigmentosa desde los 3 meses de vida. Desde los 5 años presentaba frecuentes episodios de síncope. Fue tratada con 300mg mensuales de omalizumab con desaparición de los cuadros sincopales. El segundo paciente de 51 años presentaba urticaria pigmentosa con afectación de la médula ósea desde los 14 años. Padecía 14-15 cuadros de anafilaxia anuales, desde los 48 años, que precisaban adrenalina para su control. Se pautó omalizumab, 300mg mensuales, sin que volviera a presentar cuadros de anafilaxia durante los 5 meses que duró el tratamiento.
Urticaria crónicaBasándose en mecanismos patogénicos, algunos autores han propuesto una posible utilidad del omalizumab en el tratamiento de las urticarias crónicas260. Por el momento, no obstante, no existe ninguna experiencia publicada al respecto.
DaclizumabDaclizumab es un anticuerpo monoclonal humanizado frente al CD25 que es el receptor de la interleuquina 2 (IL2). Mediante este bloqueo impide la activación de los linfocitos T. Está aprobado en la profilaxis del rechazo agudo tras un trasplante renal alogénico, en asociación con otros fármacos inmunosupresores (ciclosporina y corticoesteroides)261.
PosologíaLa dosis es de 1mg/kg de peso que se aplica en las 24 horas previas al trasplante y después cada 14 días hasta completar 5 dosis.
Efectos secundariosEn raras ocasiones se han descrito reacciones de hipersensibilidad graves y agudas en las primeras 24 horas tras la administración. En un ensayo clínico realizado en pacientes sometidos a trasplante cardiaco existió mayor riesgo de muerte por infecciones en el grupo tratado con daclizumab.
ContraindicacionesEstá contraindicado en los pacientes con hipersensibilidad conocida a daclizumab o a cualquiera de los excipientes del producto.
Usos fuera de indicaciónPenfigoide ampollosoSe han descrito dos casos de penfigoide ampolloso tratados con daclizumab. El primero de ellos de trata de un paciente de 52 años con penfigoide ampolloso extenso que había sido tratado con esteroides orales, azatioprina, ciclosporina y micofenolato con aparición de diabetes mellitus. Se pautó daclizumab 100mg cada 15 días (6 dosis), azatioprina 50mg y prednisona 5mg diarios. Dos semanas después de comenzar el régimen las lesiones ampollosas fueron desapareciendo. Al suspender daclizumab las lesiones reaparecieron, volviendo a resolverse tras la reintroducción del mismo262.
Un niño de 10 años trasplantado de médula ósea por leucemia linfática aguda que presentó un penfigoide ampolloso a los 7 meses del trasplante a pesar de la medicación inmunosupresora que recibía y de dosis de hasta 2mg/kg de prednisona. Fue tratado con una combinación de rituximab y daclizumab, con una rápida mejoría de su penfigoide. A los dos meses de suspender la administración de daclizumab apareció una nueva ampolla que desapareció después de un nuevo ciclo238.
Pénfigo vulgarSe ha descrito un único caso de pénfigo tratado con daclizumab. Se trata de una mujer de 64 años con pénfigo vulgar extenso, refractaria a ciclosporina y azatioprina y que había desarrollado diabetes mellitus como consecuencia de la corticoterapia. Fue tratada con daclizumab 1mg/kg cada 2 semanas (6 ciclos) asociada a azatioprina y prednisolona. Las lesiones mucosas y cutáneas mejoraron a las tres semanas con resolución completa a los 30 días263.
Epidermolisis ampollosa adquiridaEgan264 ensaya daclizumab en tres pacientes con epidermolisis ampollosa adquirida, varones entre 33 y 44 años de edad. En los tres pacientes se redujo tras el tratamiento la expresión de CD25 en los linfocitos. Dos de los pacientes no experimentaron mejoría clínica, pero el tercero que tenía una clínica más inflamatoria si mejoró, presentando un nuevo brote al suspender daclizumab con control posterior al reintroducir el fármaco.
Leucemia eritrodérmica T del adultoUn paciente de 48 años con eritrodermia secundaria a leucemia-linfoma T del adulto no respondedor a multitud de tratamientos fue tratado con daclizumab en dosis de 1mg/kg semanales con resolución rápida de la eritrodermia y del prurito, junto con remisión histológica de las lesiones cutáneas. Durante 6 meses estuvo asintomático, apareciendo lesiones al espaciar las dosis de daclizumab. Al aumentar el número de dosis las lesiones desaparecieron de nuevo, reapareciendo a los 14 meses de comenzar el tratamiento265.
PsoriasisKrueger266 publica una serie de 19 pacientes con psoriasis que trata con daclizumab. Las dosis fueron 2mg/kg iniciales seguidas de 1mg/kg en las semanas 2, 4, 8 y 12. Se produjo una reducción del PASI (psoriasis area and severity index) del 30%, sin que se produjeran efectos adversos significativos.
Existen además varios casos aislados en los que también se obtuvieron respuestas exitosas267,268; como ejemplo, una eritrodermia psoriásica en un paciente infectado por el virus de la inmunodeficiencia humana (VIH) que se resolvió completamente en un mes268.
BasiliximabAnticuerpo monoclonal quimérico anti CD25, similar a daclizumab, previamente descrito. Tiene la misma indicación que aquel269.
PosologíaDos dosis de 20mg, la primera en las 4 horas antes del trasplante y la segunda a los 4 días del mismo.
Efectos secundariosSe han observado reacciones de hipersensibilidad severas y agudas (en menos de 24 horas), tanto en la exposición inicial a basiliximab como en la reexposición a un tratamiento subsiguiente.
ContraindicacionesHipersensibilidad al principio activo o a alguno de sus excipientes.
Usos fuera de indicaciónEpidermolisis ampollosa adquiridaUn paciente de 55 años con epidermolisis ampollosa adquirida que era refractaria a azatioprina y ciclosporina fue tratado con una combinación de ciclosporina 200mg diarios y una dosis única de 20mg de basiliximab intravenoso. Dos semanas después las lesiones ampollosas dejaron de aparecer, por lo que se pudo reducir la dosis de ciclosporina. A las 10 semanas se alcanzó la resolución completa de las lesiones270.
PsoriasisBagel271 realizó un estudio frente a placebo en voluntarios con psoriasis. Un 24 % de los pacientes tratados con basiliximab lograron una mejoría del 50% del PASI frente a un 17% de los tratados con placebo. Esta diferencia fue estadísticamente significativa. Diez pacientes suspendieron el tratamiento por efectos adversos, generalmente síndrome pseudogripal. Los autores concluyen que basiliximab no es un tratamiento razonable para pacientes con psoriasis debido a su perfil de riesgos-beneficios.
Existen publicaciones de casos aislados con buena respuesta pero recidiva rápida tras la supresión272. Un caso de psoriasis palmo-plantar recalcitrante a pesar de infinidad de tratamientos, que incluían incluso radioterapia, respondió muy favorablemente a basiliximab durante los 4 meses que duró el tratamiento273.
Mrowietz274 trata a dos pacientes con diferentes dosis. El primero es tratado con dos dosis de 20mg sin obtener ningún beneficio; el segundo recibe 20mg iniciales y dos dosis de 40mg los días 21 y 42, experimentando una mejoría del 83 % del PASI. El autor postula que las dosis necesarias para la psoriasis son mayores que las que se administran en pacientes trasplantados.
Por último, otro paciente de 80 años con psoriasis extensa refractaria fue tratado con basiliximab acompañado de su tratamiento previo que consistía en prednisolona, acitretino y ciclosporina, con lo que no lograba controlar la enfermedad. El paciente experimentó una rápida mejoría tras recibir únicamente dos dosis de basiliximab y dicha mejoría duró los 5 meses de seguimiento275.
Liquen plano erosivoUna mujer de 67 años con lesiones de liquen plano erosivo oral y genital estaba realizando tratamiento con ciclosporina desde hacía dos años. Se le administraron dos dosis de 20mg de basiliximab separadas por 4 días. Las lesiones se resolvieron, pero al mes de suspenderlo volvieron a reaparecer; no se reintrodujo el medicamento debido a su alto coste276.
CetuximabCetuximab es un anticuerpo monoclonal quimérico dirigido contra el receptor del factor de crecimiento epidérmico277 (EGFR). Está aprobado para tratar, asociado a irinotecan, a pacientes con carcinoma de colon con receptores (EGFR) positivos refractarios a regímenes quimioterapéuticos convencionales que incluyan irinotecan. También está aprobado en asociación a radioterapia en pacientes con carcinoma epidermoide localmente avanzado de cabeza y cuello278.
PosologíaEn todas las indicaciones cetuximab se administra una vez a la semana. La primera dosis es de 400mg/m2 de superficie corporal. Todas las dosis semanales posteriores son de 250mg/m2 cada una.
Efectos secundariosSe han descrito reacciones a la infusión que son infrecuentes y suelen aparecer en la primera hora de la misma y que pueden asociar disnea279. La erupción cutánea acneiforme es el efecto adverso más frecuente, ocurriendo en más de la mitad de los pacientes. Otras lesiones cutáneas descritas son las paroniquias, las reacciones eczematosas y la tricomegalia277.
ContraindicacionesEstá contraindicado en pacientes con reacciones de hipersensibilidad graves (grado 3 ó 4) conocidas a cetuximab.
Usos fuera de indicaciónCarcinoma epidermoide cutáneoSe ha publicado el caso de un paciente con un carcinoma epidermoide cutáneo localmente avanzado que respondió bien a cetuximab en monoterapia280. Recientemente se han publicado dos casos de pacientes con carcinoma epidermoide cutáneo con metástasis en tránsito a pesar de haberse sometido a múltiples cirugías y a radioterapia, que obtuvieron una respuesta muy buena tras tratamiento semanal con cetuximab (desaparición de los nódulos tumorales y adenopatías en uno y disminución del tamaño tumoral en el otro) con un tiempo de seguimiento de 16 y 12 semanas. Uno de los pacientes desarrolló una reacción acneiforme como efecto adverso281.
Además se está llevando a cabo un ensayo clínico en fase 2 con pacientes con carcinoma epidermoide cutáneo que exprese EGFR (en el momento actual en fase de reclutamiento) 282.
La experiencia del tratamiento del carcinoma epidermoide cutáneo es muy escasa. En nuestro servicio contamos con una única paciente que está recibiendo este fármaco para tratamiento de un carcinoma epidermoide cutáneo, de localización frontal, con metástasis satélites y en ganglios cervicales. A pesar de ser tratado quirúrgicamente en varias ocasiones y de recibir radioterapia hasta completar la dosis máxima, el tumor seguía progresando, motivo por el cual se decidió iniciar tratamiento con cetuximab. Aunque los ciclos de tratamiento no se han completado aún, la respuesta obtenida hasta ahora es pobre (figs. 3 y 4).
No existe experiencia con cetuximab en otras dermatosis, pero basándose en mecanismos patogénicos se ha propuesto su posible utilidad en otras enfermedades como la psoriasis283 y el carcinoma basocelular284.
ConclusiónEl desarrollo de los nuevos fármacos biológicos ha supuesto un gran avance en el tratamiento de numerosas enfermedades. Se aboga porque estos fármacos actúan sobre dianas fisiopatológicas concretas y que por tanto son más específicos que los antiguos medicamentos inmunosupresores no biológicos. En nuestra opinión la diferencia con los inmunosupresores clásicos no es tanto que sean más específicos que éstos, sino que se han desarrollado para actuar sobre una diana concreta gracias a las nuevas técnicas de biología molecular. No obstante, la especificidad de estas no es tanta, y así, por ejemplo, el TNF participa en numerosas funciones del sistema inmunológico y esto explica el porqué de su uso fuera de las indicaciones autorizadas en la ficha técnica de diferentes fármacos biológicos.
El motivo de esta revisión es recopilar la experiencia en el tratamiento de dermatosis fuera de indicación aprobada hasta el momento actual. No obstante somos conscientes de que en un breve período de tiempo se habrán añadido a los casos recogidos en esta revisión una infinidad de nuevas enfermedades para las que estos fármacos habrán sido empleados. Por nuestra parte, hemos querido dejar constancia de los datos existentes a día de hoy, aunque sabemos que cuando el presente trabajo llegue a las manos del lector será necesario completarlo revisando la experiencia de los últimos meses.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.