Sr. Director:
El sorafenib es un fármaco de reciente aparición, de administración oral, que pertenece a la familia de los inhibidores de la tirosín-kinasa y que ha demostrado alta efectividad en el tratamiento de carcinomas avanzados de células renales o hepatocelulares1. Actualmente está en estudio también para el tratamiento de otros tumores, como el melanoma metastático o el carcinoma papilar de tiroides2. Pero al igual que el resto de fármacos quimioterápicos, el sorafenib no está exento de efectos secundarios, tanto sistémicos como cutáneos. Más de un 93 % de los pacientes en tratamiento con sorafenib en monoterapia van a padecer algún tipo de reacción cutánea.
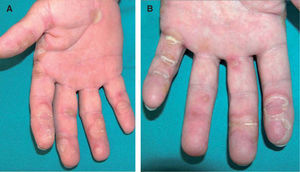
Presentamos el caso de un varón de 53 años, diagnosticado de carcinoma hepatocelular secundario a hepatopatía crónica por el virus de la hepatitis C, que inicia tratamiento con sorafenib a dosis de 400mg dos veces al día. Tras dos semanas de tratamiento, el paciente comienza con lesiones cutáneas en palmas y posteriormente en plantas, levemente dolorosas, sin clínica neurológica asociada. A la exploración física se observan pápulas y placas, algunas en forma de diana, edematosas, descamativas, localizadas en palmas, cara palmar de los dedos y las plantas de los pies (fig. 1).
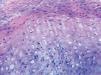
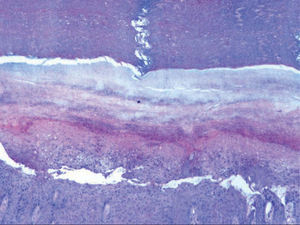
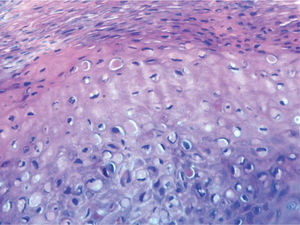
En el estudio histológico tomado de una lesión palmar se observa una epidermis con una gruesa capa córnea ortoqueratósica, observándose por debajo de la misma una extensa zona de paraqueratosis y notable acantosis irregular. Se identifican ocasionales queratinocitos necróticos, sin imágenes de degeneración vacuolar de la capa basal. En la dermis los vasos sanguíneos más superficiales están dilatados y se acompañan de un leve infiltrado celular de linfocitos e histiocitos (figs. 2 y 3).
Dada la clínica del paciente y su relación temporal tras iniciar tratamiento con sorafenib, se decidió instaurar tratamiento sintomático con corticoides tópicos y reducción a mitad de dosis del fármaco, con buena evolución y resolución progresiva de las lesiones cutáneas.
En forma de pequeñas moléculas o de anticuerpos monoclonales, el sorafenib bloquea la actividad de distintas estructuras de la tirosín-kinasa, retrasando la progresión de múltiples tumores sólidos y del melanoma metastático. Se administra por vía oral, a dosis de 400mg dos veces al día. Pero su actividad no se limita solo al ámbito tumoral, se asocia, con frecuencia, a diversas reacciones adversas como hipertensión, astenia, anorexia, diarrea o trastornos cutáneos. Más de un 93 % de los pacientes en tratamiento en monoterapia con sorafenib va a presentar reacciones adversas cutáneas, siendo frecuentes la alopecia (hasta en un 23 % de los casos), la estomatitis (12-35 %), la xerosis (11-23 %) o la erupción eritematodescamativa facial similar a la dermatitis seborreica (hasta en un 2 % de los casos)3.
Se han descrito también casos de hemorragias subungueales en astilla, vasculitis leucocitoclástica4, eritema exudativo multiforme5 o queratoacantomas6. Pero sin duda la reacción cutánea más frecuente con este fármaco es el síndrome de mano-pie, que aparece hasta en un 62 % de los casos5.
Definimos dicho síndrome como una reacción cutánea, rara vez dolorosa o asociada a parestesias, a veces ampollosa, que aparece entre el 22-62 % de los pacientes en tratamiento con sorafenib7. Clínicamente se manifiesta en forma de placas eritematosas, edematosas, asociadas a hiperqueratosis y descamación, distribuidas de forma simétrica en palmas y plantas, pudiendo afectar otras localizaciones, como caras laterales de los dedos o región periungueal2. Suelen aparecer tras 2-4 semanas de haber iniciado el tratamiento, siendo lesiones dosis dependientes, que desaparecerán rápidamente tras la suspensión del tratamiento2.
Su etiopatogenia es desconocida, pero el hecho de que sea una reacción dosis dependiente sugiere que se trate de un efecto tóxico directo sobre los queratinocitos de la piel, aunque estos no expresen VEGFR, receptor diana del sorafenib2.
Desde el punto de vista histológico se observa, en la epidermis, una hiperqueratosis ortoqueratósica, con importante paraqueratosis en el estrato córneo, y marcada hiperplasia epidérmica irregular, con focos de hipergranulosis. Existe importante edema intercelular, con exocitosis de linfocitos entre la epidermis hiperplásica. En dermis papilar se observa un edema moderado, con infiltrado linfocitario perivascular superficial1. El diagnóstico diferencial debe realizarse fundamentalmente con la eritrodiestesia palmo-plantar causada por otros agentes quimioterápicos, como la citarabina, el fluorouracilo, la capecitabina o la doxorrubicina, donde las lesiones tienden a ser más extensas, asociadas a parestesias y dolor, y con hallazgos histológicos característicos8. Así, además de hiperqueratosis y paraqueratosis en el estrato córneo, se observan también espongiosis y células apoptóticas en la epidermis, asociado a degeneración vacuolar de la capa basal y un infiltrado linfocitario perivascular en dermis media9.
El tratamiento consiste o bien en la reducción de dosis, o bien en la suspensión del fármaco durante una o dos semanas2. Distintos estudios concluyen que, al igual que ocurre con otros quimioterápicos como los inhibidores del factor de crecimiento epidérmico, la aparición de lesiones cutáneas asociadas al empleo de sorafenib podrían correlacionarse con una mayor respuesta al fármaco10.
En conclusión, nuestro paciente presentó unas lesiones palmoplantares edematosas, hiperqueratósicas y poco dolorosas similares a las descritas en el síndrome de mano-pie, tras tratamiento con sorafenib. La correlación temporal entre la administración del fármaco y la aparición de las lesiones, el estudio histológico (típico aunque no patognomónico) y la mejoría clínica tras la disminución de la dosis confirman la sospecha clínica, y coinciden con lo descrito por otros autores.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.