La hidroclorotiazida (HCTZ) y otros diuréticos tiazídicos son fármacos que se han empleado desde hace décadas para el tratamiento de la hipertensión arterial, la insuficiencia cardíaca o la enfermedad renal crónica. Las tiazidas se han asociado con reacciones de fotosensibilidad, siendo heterogéneas en cuanto a manifestación clínica y tiempo de recuperación, y en las cuales, el fototest, el fotoparche y la biopsia cutánea nos pueden ser útiles en el diagnóstico. En relación con estos fármacos, en los últimos años se ha evidenciado también un mayor riesgo dosis-dependiente de desarrollar determinados tipos de cáncer cutáneo en pacientes tratados de forma crónica con HCTZ. En esta revisión se comentan, asimismo, otros efectos adversos menos habituales o reconocidos de los diuréticos tiazídicos reportados de forma aislada en la literatura.
Hydrochlorothiazide and other thiazide diuretics have been used for decades to treat high blood pressure, heart failure, and chronic kidney disease. Thiazides have been linked to photosensitivity with heterogeneous clinical manifestations and recovery times. Diagnosis can be aided by phototesting, photopatch testing, and skin biopsy. Long-term use of hydrochlorothiazide has been linked to an increased dose-dependent risk of certain types of skin cancer in recent years. In this review, we also look at other less common or lesser-known adverse effects of thiazide diuretics that have been described in isolated reports.
Los diuréticos tiazídicos comenzaron a utilizarse en nuestra práctica clínica habitual en 1957 y, según su estructura química, se han clasificado en dos grupos: tiazidas y diuréticos con estructura química similar a las tiazidas. Durante más de cinco décadas, las tiazidas y sus análogos han sido un pilar en el tratamiento de la hipertensión, en monoterapia o en combinación con otros fármacos antihipertensivos fármacos, ya que proporcionan efectos sumatorios en la reducción de las cifras de presión arterial (PA)1. También se han utilizado ampliamente en condiciones de sobrecarga de volumen como la insuficiencia cardíaca (IC) y enfermedad renal crónica (ERC)2.
Mecanismo de acciónLos diuréticos tiazídicos ejercen su efecto diurético a través del bloqueo del canal de cloruro de sodio (Na/Cl) en el segmento proximal del túbulo distal. Cuando el canal de Na/Cl se bloquea, los bajos niveles de sodio atraviesan la membrana luminal, disminuyendo así la acción de la bomba de sodio-potasio (Na/K) y disminuyendo el paso de Na+ y agua al intersticio3.
El método de activación de los diuréticos tiazídicos es provocar un cambio en la concentración de Na+ distal al túbulo distal. Posteriormente, los canales iónicos y las bombas funcionan para equilibrar los niveles de Na+ alterados. El bloqueo del canal de Na/Cl provoca un aumento de la retención de sodio y agua en la luz y una disminución de Na+ en el túbulo distal. Al mismo tiempo, el bloqueo del canal de Na/Cl aumenta el flujo de iones a través del canal de Na/Ca, lo que produce un aumento de la reabsorción de calcio en el intersticio a cambio del retorno de Na+ al túbulo distal. A través de la retención de sodio mediada por la aldosterona que se precipita por un aumento del flujo de Na+ al túbulo colector, este mostrará un aumento de la reabsorción de Na+ y la excreción de iones de K+ y H+ en la orina4.
FarmacocinéticaLos diuréticos análogos a las tiazidas se absorben rápidamente en el tracto gastrointestinal. La ingesta de alimentos aumenta la absorción de hidroclorotiazida (HCTZ), mientras que la insuficiencia cardíaca o la insuficiencia renal la disminuyen. Las tiazidas se unen en un elevado porcentaje a proteínas plasmáticas para su distribución, lo que limita su filtrado glomerular y se excretan principalmente por vía renal, aunque existen marcadas diferencias en su metabolismo y excreción5,6 (tabla 1).
Características farmacocinéticas de los principales diuréticos tiazídicos
| Diurético tiazídico | Biodisponibilidad (%) | Pico (h) | Volumen de distribución (L/kg) | Duración del efecto (h) | Vida media (h) | Porcentaje de excreción renal |
|---|---|---|---|---|---|---|
| Hidroclorotiazida | 70 | 4-6 | 0,83 | 6-12 | 6-14 | 95 |
| Clortalidona | 65 | 2-6 | 0,14 | 40-72 | 47 | 65 |
| Indapamida | 95 | 1-4 | 24 | 11 | 70 | |
| Metolazona | 65 | 2-4 | 1-1,5 | 24-48 | 24-48 | 80 |
| Xipamida | 95 | 1-2 | 12-20 | 5-8 | 30 |
La clortalidona presenta una vida media mucho más larga (40-72 h) y un mayor volumen de distribución que la HCTZ porque el 98% del fármaco se une a la anhidrasa carbónica de los eritrocitos, alcanzando concentraciones de 7 a 10 veces mayores que en plasma. Por lo tanto, los glóbulos rojos actúan como un reservorio desde el cual el fármaco se libera a plasma y se elimina gradualmente por vía tubular en excreción renal. Indapamida y metolazona también se unen a la anhidrasa carbónica de eritrocitos, presentan un gran volumen de distribución y una vida media más larga que la HCTZ. Las tiazidas son ineficaces en pacientes con ERC grave porque la tasa de filtrado glomerular (TFG) limita la carga de Na+ filtrado alcanzando el túbulo distal, y en este nivel su efectividad es modesta (tabla 2).
Efectos adversos cutáneos secundarios reportados al tratamiento con diuréticos tiazídicos, fundamentalmente hidroclorotiazida
| Diuréticos tiazídicos | |
|---|---|
| Fotosensibilidad8–17 | La mayoría de las reacciones se presentarán en forma de quemaduras solaresHeterogeneidad clínica que obliga a sospechar a las tiazidas como agente culpableLa fotosensibilidad persistente puede observarse en algunos pacientes, a pesar de suspender el fármaco |
| Cáncer cutáneo18–28 | Aumento de riesgo de CEC dosis-dependiente y posiblemente de CCM y de neoplasias anexiales malignasNo aumento de riesgo o bajo riesgo de CBC y MMControversia en relación con LCCT |
| Prurito y eczema29–32 | Aproximadamente 1% de los pacientes desarrollan prurito crónicoMás frecuencia de procesos eccematosos, fotodistribuidos o no |
| Lupus inducido por fármacos33–38 | Fundamentalmente formas cutáneas: LECS sobre todo |
| Enfermedades ampollosas autoinmunes39,40 | Dudosa relación con el desarrollo de BPNo casos descritos de pénfigo vulgar |
| Liquen plano y erupción liquenoide por fármacos41–45 | Posibilidad de ELF, sobre todo en áreas fotoexpuestas |
| Miscelánea | Vasculitis de pequeño vaso16,46,47PEGA48,49 |
CEC: carcinoma espinocelular; CBC: carcinoma basocelular; CCM: carcinoma de células de Merkel; MM: melanoma maligno; LCCT: linfomas cutáneos de células T; LECS: lupus eritematoso cutáneo subagudo; BP: penfigoide ampolloso; ELF: erupciones liquenoides por fármacos; PEGA: pustulosis exantemática generalizada aguda.
Los diuréticos tiazídicos no reducen la presión arterial en individuos normotensos mostrando su eficacia solo en pacientes hipertensos. La disminución inicial de la PA está relacionada con la inhibición del canal Na/Cl ya explicado, que aumenta la diuresis y la natriuresis, disminuyendo el volumen plasmático y reduciendo el retorno venoso y el gasto cardíaco7.
Al igual que con otros fármacos antihipertensivos en monoterapia, solo el 40-60% de las personas tratadas con diuréticos tiazídicos logran un control adecuado de la presión arterial. Dentro de los principales factores predictores de respuesta se incluyen un nivel de presión arterial basal más alto, sexo femenino, menor tiempo de hipertensión diagnosticada o tratada, niveles de actividad de renina plasmática bajos y mayor disminución de la excreción urinaria de sodio. Los factores predictores negativos, por el contrario, incluyen sobre todo la mayor edad del paciente7.
AdministraciónLos diuréticos tiazídicos se administran por vía oral en forma de comprimidos. Los pacientes deben ingerirlos en toma matutina con alimentos. Generalmente, para el tratamiento de la hipertensión se requiere una dosis baja (25 mg al día) que se puede aumentar a 50 o 100 mg, en función de las necesidades terapéuticas individuales del paciente. Para los pacientes que sufren una mayor sobrecarga de volumen, la dosificación comienza con 50 a 100 mg con evolución de 50 a 200 mg, según el fármaco utilizado.
Tiazidas y fotosensibilidadAproximadamente el 8% de los efectos adversos por fármacos se presentan en forma de erupciones fotosensibles8. En el artículo publicado por Blakely et al.9 en 2019 sobre la fotosensibilidad inducida por fármacos, la HCTZ forma parte del grupo de fotosensibilizantes más comunes, con unos 60 casos publicados en la literatura. Aunque la urticaria parece ser la forma más frecuente de erupción cutánea por este fármaco, se han publicado otras formas menos comunes como exantema intertriginoso y flexural simétrico por fármacos (SDRIFE)10.
El mecanismo fisiopatológico que explicaría por qué las tiazidas comprenden un grupo de fármacos fotosensibilizantes todavía está por dilucidar. Estudios in vitro han demostrado un daño directo al ADN11 y a los lípidos de la membrana celular12.
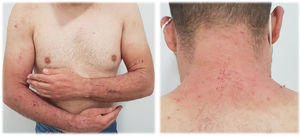
La presentación clínica comprende el desarrollo de una erupción cutánea simétrica localizada en áreas fotoexpuestas (cara, cuello, tronco anterior, cara dorsal de manos y antebrazos). La aparición de las lesiones puede presentarse de manera más o menos intensa, con diferentes patrones clínicos13:
- •
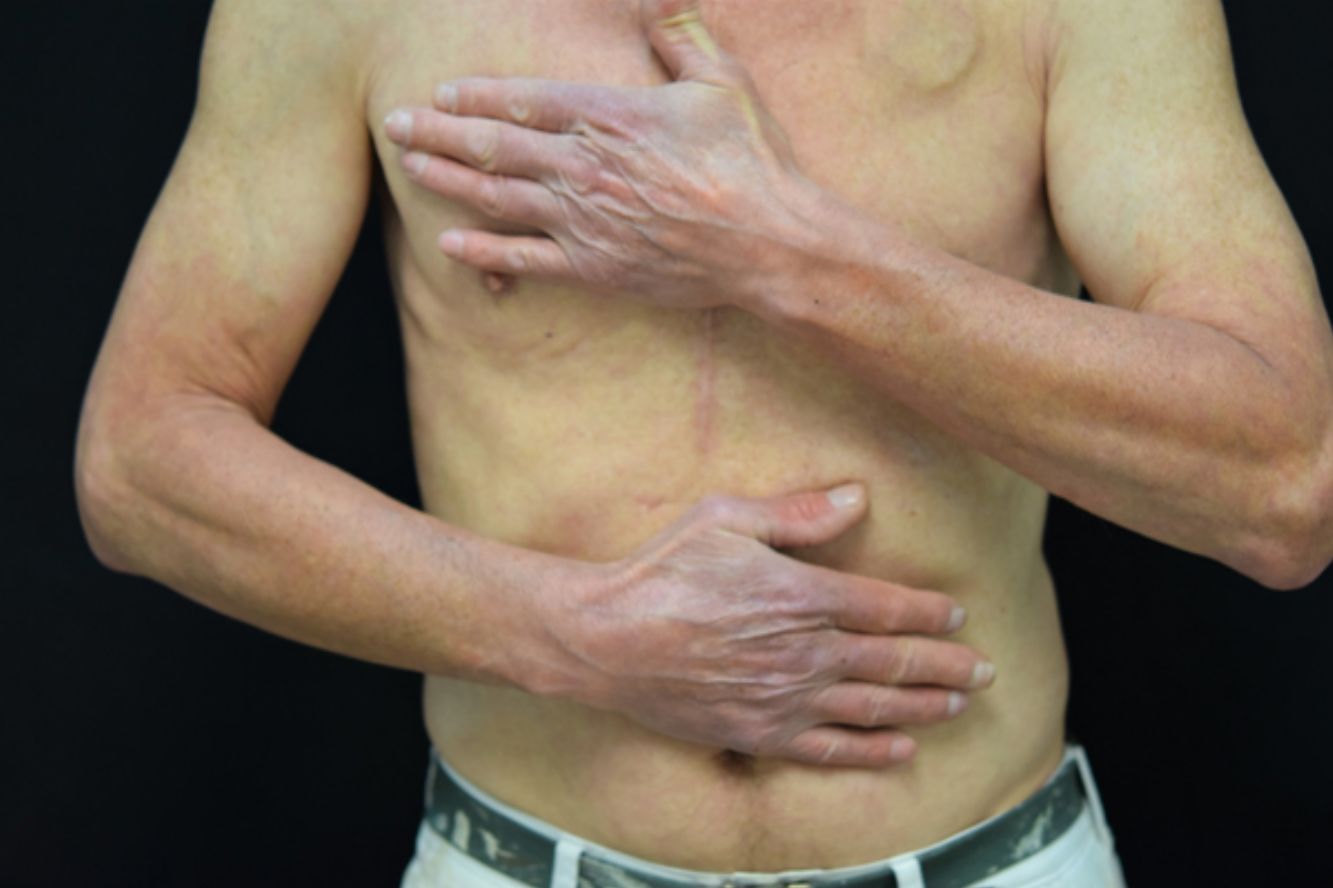
Erupción tipo quemadura solar (fig. 1). Las lesiones comprenden principalmente un eritema de bordes bien delimitados, con edema variable, que asocia normalmente prurito y/o sensación urente. El grado de intensidad de la erupción es variable de unos pacientes a otros. Parece que este tipo de reacción es más frecuente en la raza negra, independientemente del tiempo de duración del tratamiento.
- •
Erupción tipo eccematosa (fig. 2). Las lesiones corresponden a una dermatitis aguda o subaguda de intensidad variable, normalmente pruriginosa, cuyo eritema evoluciona rápidamente hacia la descamación. En estos casos, las pruebas epicutáneas serían prácticamente obligatorias.
- •
Erupción tipo lupus cutáneo subagudo-like. Indistinguible de un lupus subagudo cutáneo idiopático, tanto clínica como histopatológicamente. Algunos pacientes presentan anticuerpos antinucleares y anticuerpos anti-Ro/SS-A y/o anti-La/SS-B.
- •
Miscelánea. Se han publicado en la literatura múltiples formas de erupción fotosensible por tiazidas, como las reacciones liquenoides, queilitis, pseudoporfiria, petequias, fotoonicólisis, fotoleucomelanoderma e incluso cuadros de fotosensibilidad persistentes.
Es evidente que la presentación clínica de fotosensibilidad es heterogénea, de modo que la sospecha clínica deberá ser alta si se quiere alcanzar un diagnóstico correcto. Revisar los fármacos que toma el paciente y la relación cronológica entre la ingesta de la tiazida, cambios de dosis y el inicio de la erupción cutánea deberá favorecer la sospecha del efecto adverso relacionado con el fármaco. Según los datos publicados por Tsai et al.14, la mayoría de los pacientes desarrollan erupciones fotosensibles a HCTZ en los primeros tres años de tratamiento, independientemente de la edad y/o sexo. Sin embargo, aunque no disponible en todos los centros, se recomienda el estudio fotobiológico de estos pacientes para objetivar la relación causal entre el fármaco y la erupción fotosensible.
Mediante el fototest se podrá valorar el espectro de radiación que participa en la erupción fotosensible. Lo más importante es estudiar la dosis eritematosa mínima (DEM) para la radiación ultravioleta B (UVB) y la respuesta a UVA. Lo más frecuente es la presencia de reacciones anómalas a UVA, seguido estrechamente con la afectación de UVA + UVB. En casos excepcionales podrá verse la afectación de luz visible asociada a UVA y UVB, y más infrecuente todavía es la participación de UVB en la reacción fotosensible. El artículo publicado por Selvaag15 plantea un posible efecto sinérgico entre la radiación UVA y UVB en el desarrollo de reacciones de fotosensibilidad por tiazidas. Lo ideal será realizar el fototest mientras el paciente todavía toma la tiazida, y posteriormente, tras suspenderla, repetir el fototest para valorar cambios objetivos en la determinación de la reacción a los distintos espectros lumínicos. Sin embargo, no siempre es posible y el paciente suele suspender el fármaco por indicación médica antes de ser valorado en la consulta de fotobiología.
El tiempo de recuperación o normalización de la reacción fotolumínica es variable de un paciente a otro, aunque se espera que la fotosensibilidad se resuelva en los primeros seis meses. Sería pues recomendable repetir el fototest a las tres a cuatro semanas de haber suspendido el fármaco, y en caso de persistir la fotosensibilidad, repetir cada dos a tres meses el fototest hasta la normalización de la prueba (aumento de un 40% o más de la DEM determinada mientras tomaba el fármaco). En aquellos casos que la fotosensibilidad persista más allá de los seis meses (en algunos centros suelen esperar hasta 12 meses), debería considerarse la posibilidad de otra etiología distinta a las tiazidas (aunque no debemos olvidar que de forma infrecuente existe una forma de fotosensibilidad persistente con este fármaco). Además de lo comentado anteriormente, HCTZ aumenta el riesgo de reacciones de hipersensibilidad a alopurinol cuando se administran de forma concomitante, siendo otro de los fármacos involucrados en las reacciones cutáneas a fármacos, aunque no principalmente en forma de fotosensibilidad.
Es recomendable realizar una biopsia de la erupción cutánea con el fin de conocer el patrón histopatológico, del mismo modo que nos permite estudiar el diagnóstico diferencial en el paciente. Se publicó un caso de vasculitis inducida por HCTZ16, donde la biopsia fue clave para posteriormente realizar un test de degranulación de mastocitos.
El fotoparche también debería considerarse como prueba complementaria en estos pacientes, aunque la rentabilidad de la prueba es menor si se compara con el fototest. El alérgeno HCTZ 10% vaselina se puede encontrar en la serie de reacciones cutáneas por fármacos (Chemotechnique Diagnostics®). A pesar de considerar a este fármaco como una de las principales causas de erupciones fotosensibles, no forma parte de la batería de fotoparche en ninguno de los principales distribuidores. Se puede utilizar el alérgeno comercializado para realizar el fotoparche (deberá parchearse por duplicado, en oclusión durante 48 h, y posteriormente uno de los pocillos deberá irradiarse con UVA 5 J/cm2, mientras que el otro no deberá recibir radiación). La lectura a las 96 h es fundamental para interpretar el resultado. No se debe olvidar indicar al paciente que durante la semana del estudio utilice ropa oscura para evitar sesgos de resultados. Aunque normalmente esta prueba suele ser negativa, por la mayor disponibilidad de la misma (más accesible que un estudio de fotobiología), se recomienda su realización. La positividad de la prueba exclusivamente en el pocillo que recibió la radiación UVA confirmará la reacción fotoalérgica al fármaco, mientras que si ambos pocillos (el irradiado y el que no) muestran positividad, se considerará una dermatitis alérgica de contacto a tiazida fotoagravada. Hay que recordar que un estudio negativo no descarta que el paciente no sufra una erupción fotosensible al fármaco.
El manejo de estos pacientes puede resultar aparentemente sencillo, aunque en ocasiones la evolución no es la deseada tras suspender el fármaco. La primera decisión será valorar si es posible suspender el tratamiento (tanto si se ha confirmado con las pruebas complementarias comentadas anteriormente, como si únicamente existe una sospecha infundada de que es el responsable de la erupción fotosensible). En la mayoría de los casos será posible suspenderlo o bien cambiarlo por otro fármaco de distinto grupo o menor potencial sensibilizante (como la furosemida o indapamida), en caso de no ser posible deberá valorarse la gravedad de la erupción y las actividades laborales y sociales de exposición solar que tiene el paciente. Quizá el uso del fármaco por la noche podría disminuir el potencial fotosensibilizante, sin embargo, el uso de diuréticos por la noche podría afectar de forma relevante al descanso del paciente, y convertirlo en una opción inviable. El uso de fotoprotectores (principalmente físicos/mineral) y el uso de ropa oscura pueden evitar o disminuir los efectos cutáneos. En ocasiones, el paciente referirá una afectación de la calidad de vida asociado a síntomas como el prurito, que podrá manejarse con antihistamínicos orales y/o corticoides (tópicos u orales), con respuestas variables, habitualmente insatisfactorias en la mayoría de los casos. Robinson et al.17 plantearon la posibilidad de tratamiento con fototerapia, similar al endurecimiento o «hardening», utilizado con la urticaria solar, sin embargo, a pesar del éxito documentado en el artículo, no se ha publicado en la literatura nuevos trabajos que aumenten la evidencia de esta opción terapéutica. Dado que las reacciones cruzadas con la parafenilendiamina, o derivados del ácido paraaminobenzoico, podrían comprometer la evolución del paciente al indicar fotoprotectores que contengan el último alérgeno, la justificación de pruebas epicutáneas con fotoparche será de utilidad para estudiar a dichos pacientes.
Cáncer cutáneoEl cáncer cutáneo no melanoma (CCNM) es la neoplasia más frecuente en las personas de piel clara y su incidencia va en aumento18. En los últimos años existe un interés creciente entre la relación de CCNM y el tratamiento con diuréticos tiazídicos, especialmente en el caso de HCTZ. Estudios epidemiológicos realizados en Dinamarca en 2018 llevados a cabo con los datos procedentes de bases de datos nacionales obtuvieron como resultado que, con una dosis acumulada de HCTZ de 50.000 mg, el riesgo relativo (RR) era de 1,3 y 3,9 para carcinoma basocelular (CBC) y carcinoma espinocelular (CEC), respectivamente, en comparación con la población no expuesta o expuesta a dosis menores19. El riesgo parece ser, por tanto, dosis-dependiente, pues aumentó en pacientes con dosis acumuladas de HCTZ superiores a 200.000 mg, con un RR de 1,54 para CBC y de 7,38 para CEC19. Los metaanálisis de Shin et al.20 y Bendinelli et al.21 obtuvieron resultados similares, con una relación más prominente entre el uso de HCTZ y el riesgo de CEC con respecto al riesgo de CBC. Un estudio de base poblacional en personas mayores de 65 años ratificó este riesgo aumentado dosis-dependiente de CCNM global en pacientes tratados con tiazidas, pero no así con otras clases de antihipertensivos22. La actividad fotosensibilizante de las tiazidas podría explicar este incremento en la incidencia de CCNM, al aumentar la posibilidad de daño actínico18.
Con respecto al melanoma maligno (MM), al igual que con el CBC, el riesgo parece mínimo o nulo, pero existen algunas controversias en la literatura. De nuevo, mediante bases de datos nacionales, se observó de forma retrospectiva un aumento de MM en estos pacientes, principalmente de los subtipos lentigo maligno y melanoma nodular23. Sin embargo, un artículo reciente con una muestra superior a los 20.000 pacientes no encontró relación entre el uso de HCTZ y un mayor riesgo de MM ni de CBC, y sí lo evidenció en el caso del CEC, siendo este riesgo creciente a mayor duración de tratamiento y dosis acumulada24. Recientemente se ha publicado un estudio de cohortes25 para evaluar el posible riesgo de pacientes que inician el tratamiento con HCTZ o con otros diuréticos tiazida-like, mostrando de nuevo un riesgo aumentado de CEC en pacientes tratados con HCTZ, pero no de CBC ni de MM. Se estudió también a indapamida, que se relacionó con una mayor incidencia de MM, y a bendroflumetiazida, la cual no asoció riesgo significativo de ningún tipo de cáncer de piel.
Parece también existir un riesgo aumentado dosis-dependiente entre el uso de HCTZ y el desarrollo de carcinoma de células de Merkel (CCM) y neoplasias anexiales malignas26, aunque no se encontraron más estudios al respecto. Por último, la relación entre HCTZ y linfomas cutáneos de células T (LCCT), fundamentalmente micosis fungoide (MF) no está clara: Jahan-Tigh et al. observaron una mayor prevalencia del uso de HCTZ en pacientes diagnosticados de LCCT con respecto a la población general, así como una posible relación temporal, y propusieron que la HCTZ podría estar actuando como un desencadenante antigénico de la MF en un pequeño subconjunto de pacientes27. Tras el cese de esta medicación, las lesiones de MF desaparecieron en varios pacientes, mientras que la reintroducción de la HCTZ condujo a una reaparición o exacerbación de las mismas27. No obstante, recientemente un artículo publicado obtuvo como resultado una relación inversa, de tal forma que la exposición crónica a la HCTZ podría actuar como factor protector para el desarrollo de LCCT28.
Prurito y eczemaLos fármacos son una reconocida causa de prurito, sobre todo en pacientes de edad avanzada y polimedicados29. Especialmente llamativa parece la relación entre prurito y fármacos utilizados en enfermedades cardiovasculares, siendo la tasa de prurito en pacientes tratados con HCTZ cercana al 1%, y similar a la de inhibidores de la enzima convertidora de angiotensina (IECA), betabloqueantes, amiodarona y estatinas30. Mientras que el prurito con los IECA parece producirse como resultado de un aumento de los niveles de bradiquinina, se piensa que el mecanismo subyacente al prurito secundario a HCTZ es la inflamación cutánea30. Las tiazidas son causa de reacciones eccematosas, asociadas a fotosensibilidad o no, y se ha comprobado una relación estadísticamente significativa entre eczema crónico y pacientes tratados con tiazidas en relación con el grupo control31. Se ha postulado que HCTZ, al bloquear el cotransportador Na/Cl, afectaría a la función de barrera de la piel, ya que los canales de sodio poseen un papel en la diferenciación epidérmica32.
Lupus inducido por fármacosEl lupus eritematoso inducido por fármacos (LEIF) es un trastorno autoinmune similar al lupus, que suele aparecer con la exposición crónica a determinados fármacos y que se resuelve tras el cese de la medicación culpable33. Existe una lista creciente de fármacos implicados en la inducción de formas de lupus eritematoso cutáneo, tanto subagudas (LECS) como crónicas34. Los diuréticos tiazídicos se han asociado fundamentalmente con formas cutáneas, que generalmente cursan con placas eritematodescamativas clínica e histológicamente indistinguibles de un LECS idiopático. Además, puede observarse la presencia de anticuerpos anti-Ro/SS-A y anti-La/SS-B positivos en suero, así como depósito de inmunocomplejos en la membrana basal13. El primer caso de LEIF atribuido a HCTZ descrito en la literatura data de 198535 y, desde entonces, se han ido reportado nuevos. Se hallaron también casos asociados a la combinación de HCTZ y triamtereno36 y por otras tiazidas como clorotiazida37. Por último, también se ha descrito un caso de lupus eritematoso sistémico (LES) asociado a diuréticos tiazídicos38.
Enfermedades ampollosas autoinmunesDistintos fármacos han sido implicados como agentes causantes de penfigoide ampolloso (BP)39. El BP inducido por fármacos puede ser una enfermedad aguda y autolimitada que se resuelve tras la retirada del fármaco o un proceso crónico que parece ser precipitado por el fármaco y sigue el curso de la forma clásica. En la actualidad solo existen escasas comunicaciones de casos clínicos que responsabilizan a HCTZ como posible factor causal y notifican mejoría de las lesiones o resolución del cuadro en estos pacientes tras la suspensión de dicho diurético39,40. No se hallaron estudios que relacionen a los diuréticos tiazídicos con el pénfigo vulgar.
Liquen plano y erupción liquenoide por fármacosLas erupciones liquenoides por fármacos (ELF) se presentan como pápulas o placas descamativas de características eccematosas o psoriasiformes, de distribución simétrica y con predilección por el tronco y las extremidades, siendo en muchos casos erupciones fotodistribuidas. A diferencia de la ELF, el liquen plano (LP) tiende a ser más localizado, afecta con más frecuencia a las superficies de flexión, las mucosas y los genitales, y presenta estrías de Wickham, de las cuales suele carecer la ELF41. Los casos descritos de ELF asociados a diuréticos tiazídicos son fundamentalmente ELF fotodistribuidas, con rápida resolución tras el cese de HCTZ42,43. Sin et al. describieron un caso de LP inducido por HCTZ sin exposición a la luz solar, siendo considerado como «probable» en función del algoritmo de Naranjo44. Asimismo, se ha descrito una ELF crónica y generaliza en una mujer de mediana edad con leucemia linfática crónica que se atribuyó al tratamiento oral combinado de irbesartan más HCTZ45.
MisceláneaAunque muy poco frecuente, pero la HCTZ puede ser causa de vasculitis cutánea de pequeño vaso (VCPV)16,46,47. Asimismo, hasta la fecha, se han descrito dos casos de pustulosis exantemática generalizada aguda (PEGA)48,49. Es posible también reacciones de hipersensibilidad por reactividad cruzada en pacientes alérgicos a sulfonamidas50.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.