La terapia fotodinámica (TFD) constituye una alternativa terapéutica para las queratosis actínicas, la enfermedad de Bowen y determinados carcinomas basocelulares. Se utiliza además para el tratamiento de otras enfermedades cutáneas de diversa naturaleza, incluyendo enfermedades inflamatorias e infecciosas. Los principales inconvenientes de la TDF convencional son el tiempo que consume su realización (al paciente y al personal sanitario) y el dolor que produce. Recientemente se ha descrito la TFD con luz de día (TFDLD) como alternativa al procedimiento convencional. En diversos estudios se ha mostrado similar en eficacia y mejor tolerada que la TFD clásica en el tratamiento de queratosis actínicas leves-moderadas. No obstante, la mayoría de los estudios realizados proceden del norte de Europa, y no existen por ahora resultados en países de la latitud de España. El presente artículo revisa los principales estudios publicados hasta el momento, expone el protocolo de utilización y resume nuestra experiencia en un grupo de pacientes tratados.
Photodynamic therapy (PDT) is an option for the treatment of actinic keratosis, Bowen disease, and certain types of basal cell carcinoma. It is also used to treat various other types of skin condition, including inflammatory and infectious disorders. The main disadvantages of PDT are the time it takes to administer (both for the patient and for health professionals) and the pain associated with treatment. Daylight-mediated PDT has recently been reported to be an alternative to the conventional approach. Several studies have shown it to be similar in efficacy to and better tolerated than classic PDT for the treatment of mild to moderate actinic keratosis. Nevertheless, most of these studies are from northern Europe, and no data have been reported from southern Europe. The present article reviews the main studies published to date, presents the treatment protocol, and summarizes our experience with a group of treated patients.
La terapia fotodinámica (TFD) se ha consolidado en la última década como una alternativa terapéutica para las queratosis actínicas (QA), la enfermedad de Bowen y determinados tipos de carcinoma basocelular (CBC), con elevada eficacia y muy buen resultado cosmético1–5. Actualmente se incluye en las guías clínicas de tratamiento del cáncer de piel no melanoma1,4,6–10 y se considera un tratamiento de primera elección para las queratosis actínicas múltiples y el campo de cancerización4,11–15. En los últimos años la TFD ha ampliado su espectro terapéutico, que hoy en día incluye procesos infecciosos16–19, dermatosis inflamatorias8,20–22, enfermedades anexiales23–25, tumores cutáneos17,26–28 y fotoenvejecimiento8,29–31. También se ha reconocido su potencial como terapia preventiva en casos de difícil manejo, como los pacientes trasplantados y el síndrome de Gorlin32–36. Sin embargo la TFD convencional10 es laboriosa, requiere equipamiento adecuado, ocupa espacio en el centro donde se realiza y consume tiempo al personal sanitario y al paciente. El procedimiento según el protocolo clásico10 exige la incubación del fotosensibilizante durante un tiempo determinado —habitualmente 3 horas para el metil-éster del ácido 5-aminolevulínico (MAL, metilaminolevulinato) y 4-6h o más en caso de ácido 5-aminolevulínico (ALA)— y su posterior iluminación con una fuente de luz adecuada. Las dosis y fuentes de luz más utilizadas en Europa son 37J/cm2 (aproximadamente 8min) con Aktilite (Galderma, Lausanne, Switzerland) y 75-100J/cm2 (aproximadamente 20min) con Waldmann PDT1200L (Waldmann GmbH & Co., Villingen-Schwenningen, Alemania). Por otra parte, la terapia no está exenta de efectos secundarios37–44. El dolor durante la iluminación es el más frecuente y limitante de ellos, y en ocasiones puede determinar la interrupción de la irradiación o requerir la administración de analgesia o anestesia local o regional45,46.
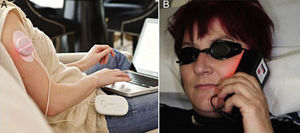
Con la intención de optimizar el procedimiento y facilitar el tratamiento ambulatorio de los pacientes se utilizaron fuentes de luz portátiles47–49 (fig. 1) y se acuñó el concepto novedoso de «terapia fotodinámica ambulatoria»50. Sin embargo, esta modalidad es costosa y únicamente útil en el tratamiento de lesiones de pequeño tamaño. Sin duda, la simplificación metodológica más determinante se ha conseguido en los últimos años con la introducción de la luz de día como fuente de iluminación51,52.
TFD ambulatoria50 con fuentes de luz portátiles. A. Ambulight® (Ambicare Health Ltd., St Andrews, Fife, UK) (http://www.ambicarehealth.com/ambulight-pdt/): LED adhesivo de luz roja —pico de emisión 640+–25 nm— que emite una dosis de 75J/cm2 con baja irradiancia (7mW/cm2) a lo largo de 3h49. Imagen cortesía de Ambicare Heath Ltd. B. AK-derm® (Sellas GmbH, Ennepetal, Alemania): LED de alta irradiancia (70-80mW/cm2) que emite 37J/cm2 en 8min, con un pico de emisión en 630nm+–5nm. Imagen cortesía del Dr. Helger Stege (Klinikum Lippe, Detmold, Alemania).
Se entiende por «luz de día» la combinación de la luz solar directa y reflejada durante el día en el exterior53. Su utilización como fuente de luz en la TFD ha contribuido sustancialmente a abaratar los costes del procedimiento, a generalizar su realización y a facilitar su cumplimiento por el paciente.
Estudios clínicos y publicaciones disponibles (tabla 1)Strasswimmer y Grande sugirieron en el año 2006 que la luz ambiental podría activar una reacción fotodinámica54, afirmación que fue cuestionada posteriormente por otros autores55. Batchelor et al. fueron los primeros en describir la eficacia y tolerancia de la TFDLD en un paciente de 90 años con QA múltiples en el cuero cabelludo51. Wiegell et al. (Hospital Bispebjerg, Dinamarca) han publicado desde el año 2008 los principales estudios sobre TFDLD disponibles hasta el momento, la mayoría de ellos centrados en el tratamiento de las QA (tabla 1). Inicialmente demostraron en un estudio piloto con 29 pacientes que la TFDLD era tan eficaz como la convencional con LED rojo y mucho menos dolorosa para el tratamiento de las QA52. Sugirieron que la activación progresiva y más lenta de pequeñas cantidades de fotosensibilizante (en lugar de la activación rápida de grandes cantidades de protoporfirina ix [Ppix] formadas en el tejido diana tras varias horas de incubación) podría reducir el dolor asociado al tratamiento y que, puesto que la luz roja y la azul forman parte del espectro de la luz de día, el empleo de esta como fuente de luz para el tratamiento podría resultar eficaz y facilitaría la terapia. En un estudio posterior comparando la eficacia de la TFDLD empleando MAL al 16 y al 8%56 no se observaron diferencias en las tasas de respuesta obtenidas en los grados de eritema y dolor producidos con cada una de las concentraciones empleadas. Los autores sugirieron que concentraciones de fotosensibilizante inferiores a las habitualmente utilizadas (MAL 16%) pueden ser efectivas. En 2011 se publicaron los resultados del primer estudio multicéntrico para evaluar la eficacia de la TFDLD en pacientes con QA no hiperqueratósicas, en el que se observaron resultados similares tras exposiciones a la luz de día de 1,5 y 2,5h de duración57. Los autores recomendaron exposiciones de 2h de duración. Estos últimos estudios ratificaron las observaciones del primero en cuanto a la eficacia de la TFDLD en QA no hiperqueratósicas, aunque la eficacia resultó menor en las lesiones con mayor hiperqueratosis58.
Resumen de las características y resultados de los principales estudios de TFD con luz de día realizados hasta el momento en queratosis actínicas
| Autores | Wiegell et al.52 | Wiegell et al.56 | Wiegell et al.57 | Wiegell et al.58 | Braathen59 | Shumack et al. |
| Revista | BJD | BJD | BJD | BJD | ADV | NP |
| Año de publicación | 2008 | 2009 | 2011 | 2012 | 2012 | 2012 |
| Estudio | Aleatorizado, controlado, ciego simple | Aleatorizado, doble ciego | Aleatorizado, multiéntrico | Aleatorizado, multicéntrico | Serie de casos retrospectiva | Multicéntrico, aleatorizado, ciego, control intrapaciente |
| País | Dinamarca | Dinamarca | DinamarcaNoruegaSuecia | DinamarcaNoruegaSuecia | Suiza | Australia |
| N.° de centros participantes | 1 | 1 | 9 | 9 | 1 | 7 |
| Objetivo del estudio | Comparar TFDC empleando LED rojo con TFDLD sin oclusión | Comparar tasas de respuesta y efectos adversos con TFDLD empleando MAL al 8 y al 16% | Comparar la eficacia de MAL-PDT con 1,5 vs 2,5h de luz de día | Evaluar la eficacia de MAL-PDT en QA de diferente severidad | Evaluar la factibilidad de la TFDLD, cumplimiento y satisfacción en el ámbito privado | Determinar la no inferioridad de la TFDLD y el dolor máximo ocasionado |
| Meses de tratamiento | Jn-S 2006 | Jn-S 2007 | Jn-O 2008 | Jn-O 2008 | A-S 2011 | Mz-My 2012 |
| Revisión de los pacientes | Tres meses | Tres meses | Tres meses | Tres meses | Tres meses | Tres meses |
| N.° de sesiones administradas | 1 | 1 | 1 | 1 | 1 | 1 |
| N.° casos | 29 | 30 | 120 | 145 | 18 | 100 |
| Rango de edad (media) | 63-90 (78) | 51-94 (71) | 47-95 (72) | 47-95 (72) | 60-85 (72) | 42-90 (66,9) |
| Sexo (M/V) | 6/23 | 4/26 | 24/96 | 28/117 | 6/12 | 35/75 |
| Tipo de QA | I, II | I, II, III | I | II, III | I, II | I, II |
| Localización mayoritaria | Cara, CC | Cara, CC | Cara, CC | Cara, CC | Cara, CC | Cara, CC |
| Área tratada | 80cm2 | 80cm2 | Mínimo 25cm2 | Mínimo 25cm2 | 1-10QA | 8-18cm |
| FP empleado | Ninguno | P20 (Riemann & Co. A/S, Hilleroed, Denmark) | P20 | P20 | Louis Widmer F15gel | Fotoprotector de factor 30 |
| Tiempo de FP previo al FS | - | 15min | 15min | 15min | 5-15min | - |
| FS | MAL 16% | MAL 16%, MAL 8% | MAL 16% | MAL16% | MAL 16% | MAL 16% |
| Cantidad/capa de FS por área tradata | 1g | 1g | «Capa gruesa» | Capa de 1mm | Capa de 0,5-1mm | No precisada |
| Incubación del FS | 30min en lado TFDLD; 3h en lado TFDC | Retraso de 0-120min en iniciar exposición solar | Igual o inferior a 30min | Igual o inferior a 30min | 30min | Igual o inferior a 30min |
| Oclusión del FS | Sí | No | No | No | No | No |
| Horas de exposición | - | 11-18h | 8-18:30h | - | 11-16h | 9-18h |
| Duración recomendada de exposición | 2,5h | Resto del día | 1,5h vs 2,5h | 1,5 vs 2,5h | 90min si día soleado; 120min si parcialmente soleado o nublado | 2h |
| Dosis de luz | La dosis de luz eficaz total durante la exposición fue 34,2J/cm2 (rango 11,7-65,9J/cm2) | Dosis de luz efectiva media fue de 30,1J/cm2 (rango 1,2-69,8) | Dosis de luz efectiva media 1,5h:8,6Jcm2 2,5h10,2 | 100 pacientes recibieron >3,5J/cm2; 37 pacientes recibieron <3,5J/cm2 | - | - |
| Condiciones meteorológicas | Soleado/parcialmente soleado | Tres pacientes expuestos en días nublados y lluviosos | Soleado/parcialmente soleado (83%); lluvioso o nublado (17%) | Soleado/parcialmente soleado; lluvioso o nublado | >12°C, días no lluviosos | Soleado/parcialmente soleado |
| Resultados a los 3 meses | 79% de reducción de QA en el área tratada | 76,9% de reducción en el número de QA (MAL 16%); 79,5% (MAL 8%) | Tasa de respuesta media: 1,5h: 77,2%2,5h: 74,6% | Tasa de respuesta media: QAI: 75,9%QAII: 61,2%QAIII: 49,1% | Tasa de respuesta media 77% (rango 0-100%) | Porcentaje de reducción de QA: 82% |
| Dolor (escala 0-10) | 2±1,9, media de dolor máximo | 3,7±2,4: 16%3,6±2,4: 8% | 92%: 0-17,5%: 4-70,8%: 8-10 | - | Un paciente 5/10; resto 0/10 | 0,8 de media |
| Otros efectos adversos | Eritema, costras | Eritema, costras | Eritema (74%) pústulas (29%) | - | Eritema, edema, costras | - |
A: abril; ADV: Acta Dermato-Venereológica; BJD: British Journal of Dermatology; CC: cuero cabelludo; FP: fotoprotector; FS: fotosensibilizante; h: horas; min: minutos; Jn: junio; QA: queratosis actínica; M: mujer; My: mayo; Mz: marzo; NP: datos no publicados; S: septiembre; Tasa de respuesta: número de lesiones con respuesta completa dividido entre el número de lesiones tratadas en cada paciente; TFDC: terapia fotodinámica convencional; TFDLD: terapia fotodinámica con luz de día; V: varón; vs: versus.
Braathen empleó la TFDLD en el ámbito privado para tratar QA en la cara y el cuero cabelludo en un grupo de 18 pacientes59, con resultados similares.
Recientemente Shumack et al. realizaron en Australia un ensayo clínico multicéntrico, aleatorizado y controlado cuyos resultados se presentaron en el xiii Congreso anual de la Sociedad Europea de Terapia Fotodinámica (Madrid, 31 de mayo-1 de junio de 2013). La TFDLD demostró ser no inferior a la TFD convencional, mejor tolerada por los pacientes y preferida por estos y por los investigadores frente a la TFD convencional. Este estudio confirmó los resultados de las publicaciones previas realizadas en países nórdicos52,56–58, y es el primero realizado en un país con un clima muy diferente al de las investigaciones originales. En el mismo foro científico se presentaron los resultados de otros estudios sobre TFDLD realizados con un menor número de pacientes: 1) Grinblat et al. (Brasil) trataron 14 pacientes con QA I-II utilizando 1-3 sesiones de TFDLD entre las 9 y las 11:30a.m. y un tiempo de iluminación de 60-90min. Observaron mejoría de las lesiones en la mayoría de ellos; 2) Venema (Países Bajos) empleó la TFDLD para tratar a 2 pacientes con queilitis actínica, con excelentes resultados clínicos y cosméticos y muy buena tolerancia; 3) Le Pillouer-Prost (Francia) presentó los resultados de un estudio con 17 pacientes con QA I-III, 5 de los cuales habían sido pretratados con láser CO2 fraccionado. Se realizaron 1-2 sesiones de TFDLD en función del grosor de las lesiones, con resolución de la mayoría de ellas en el grupo pretratado y en 10 de los 12 pacientes del grupo sin pre-tratamiento; y 4) Enk (Israel) presentó los resultados de la TFDLD en 14 pacientes con leishmaniasis cutánea no ulcerada. Inmediatamente tras la aplicación de MAL los pacientes fueron expuestos a la luz de día en el jardín del hospital durante 2,5h. Realizando tratamientos semanales, con una media de 5 sesiones, obtuvo una tasa de curación del 86%, con mínima cicatriz residual y sin dolor.
Las principales conclusiones de los estudios más relevantes y las particularidades metodológicas de la TFDLD se discuten detalladamente en el documento de consenso de la Sociedad Internacional de Terapia Fotodinámica en Dermatología53.
Protocolo de tratamiento53,57(tabla 2)El único protocolo de tratamiento disponible actualmente ha sido propuesto por Wiegell et al.57 y se resume en la tabla 2. Teniendo en cuenta que esta modalidad de TFD se realiza por el momento fuera de indicación, el paciente deberá ser adecuadamente informado del procedimiento, de los efectos secundarios y de la eficacia del mismo, y deberá firmar el consentimiento informado pertinente. Con el fin de valorar el efecto final se tomarán fotografías basales de las zonas a tratar y podría resultar útil contar y mapear las lesiones en el área de tratamiento. En algunos casos puede ser recomendable pretratar las zonas afectadas con agentes queratolíticos tópicos. Una vez el paciente se encuentra ubicado en la sala de tratamiento se procederá a aplicar sobre todas las superficies fotoexpuestas (incluida la zona de tratamiento) un fotoprotector de factor igual o superior a 20 que no contenga filtros físicos o inorgánicos. El fotoprotector se mantendrá aplicado durante aproximadamente 15min, pasados los cuales se realizará el curetaje de las lesiones. Posteriormente se aplicará en la zona afectada una capa homogénea de MAL® crema de aproximadamente 1mm de grosor sin oclusión. El paciente deberá iniciar la exposición a la luz natural en la media hora siguiente a la aplicación de MAL. Se recomienda que dicha exposición se realice durante dos horas,, pasadas las cuales se retirará el residuo de fotosensibilizante, se limpiará la zona tratada y se protegerá el área de la luz solar durante el resto del día. Deben mantenerse medidas estrictas de fotoprotección durante al menos las 48h siguientes al tratamiento.
Protocolo de tratamiento con TFD con luz de día
| Terapia fotodinámica con luz de día. Protocolo de tratamiento | |||
| Pacientes candidatos | QA múltiples/campo de cancerización en zonas fotoexpuestas | ||
| Período de tratamiento | Todo el año en España53Abril a octubre en países nórdicos57 | ||
| Condiciones meteorológicas | Evitar en días lluviosos57 o muy nublados63 | ||
| Procedimiento | En hospital | Aplicación de un fotoprotector con FPS igual o superior a 15 en la zona a exponer | 15min |
| Curetaje de las lesiones | |||
| Aplicación de Fotosensibilizante (MAL) (sin oclusión) en la zona a tratara | |||
| Extrahospitalario | Exposición a la luz natural | 2h | |
| Retirada de los restos de Fotosensibilizante | |||
| Fotoprotección estricta: 48h | |||
| N.° de sesiones | QA: una session. En otro tipo de lesiones el número de sesiones puede variar | ||
| Seguimiento | Recomendable: revisión o contacto telefónico a las 24-48h del tratamiento para valorar el estado del paciente. Valoración de los resultados obtenidos a las 12 semanas del tratamiento | ||
TFDLD: terapia fotodinámica con luz de día; FPS: factor de protección solar; QA: queratosis actínicas.
Modificada de Wiegell et al.57
El espesor adecuado de la capa de fotosensibilizante no se ha definido con exactitud hasta la fecha. La recomendación según ficha técnica es una capa de 1mm, sin embargo Wulf et al. han realizado estudios empleando capas más finas sin observar pérdida de eficacia (Wulf HC, comunicación personal en el xiii Congreso anual de la Sociedad Europea de Terapia Fotodinámica [Madrid, 31 de mayo-1 de junio de 2013]).
Los principales candidatos a esta modalidad terapéutica son pacientes colaboradores que presenten QA múltiples (preferentemente de grado i-ii)/campo de cancerización en áreas fotoexpuestas, en quienes la TFD convencional resulta muy dolorosa. Es muy probable que progresivamente esta modalidad de TFD se utilice también para tratar otro tipo de lesiones cutáneas.
¿Cuál es la dosis de luz de día necesaria para conseguir una activación eficaz de la protoporfirina ix?La dosis de luz eficaz recibida en 2h de exposición directa a la luz natural a mediodía está muy influenciada por la situación geográfica, las condiciones meteorológicas y la época del año60. El umbral de dosis de radiación correspondiente al espectro de excitación de la Ppix a partir del cual la TFDLD sería eficaz para destruir las QA varía entre los estudios publicados (8, 6, 3,5J/cm2)53,57,58,60. Por el momento y hasta que la dosis eficaz se delimite con mayor precisión, se ha aceptado que 8/cm2 es un umbral adecuado para garantizar la eficacia del tratamiento.l60. Empleando modelos meteorológicos y mediante la instalación de dosímetros en diversos puntos geográficos se ha establecido la dosis de luz eficaz para excitar la Ppix en 2h de mediodía a mitad de cada mes en distintas latitudes53. Según estas determinaciones, en España se podrían alcanzar dosis de luz de día superiores a 8J/cm2 en cualquier mes y por tanto —en función de las condiciones meteorológicas— sería posible realizar el tratamiento en este intervalo de tiempo durante todo el año53 (tabla 3).
Dosis de luz eficaz recibida en 2h a mediodía, a día 15 de cada mes en las latitudes que corresponden a la franja geográfica española
| Latitud | Dosis de luz eficaz en 2h de exposición a la luz de día en un día despejado (J/cm2) | |||||||||||
| Meses | ||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| 50N | 13 | 21 | 31 | 40 | 46 | 48 | 47 | 43 | 35 | 25 | 16 | 11 |
| 40N | 23 | 31 | 40 | 47 | 51 | 52 | 51 | 48 | 42 | 34 | 25 | 21 |
| 30N | 33 | 39 | 47 | 52 | 54 | 54 | 54 | 52 | 48 | 42 | 34 | 31 |
España se encuentra entre las latitudes 36° (punta de Tarifa) y 43° 47′ (Estaca de Bares), latitud Norte. Los meses se representan de forma numérica (enero: 1-diciembre: 12).
Modificada de Wiegell et al.53.
El paciente debe exponerse a la luz de día en el exterior durante 2h a mediodía57. Grinblat et al. emplearon tiempos de exposición menores (60-90min), con resultados similares a los observados en los estudios multicéntricos principales57,58. Considerando que el espectro de excitación de la Ppix corresponde a la luz visible, que atraviesa el cristal, en el Hospital Molhom (Vejle, Dinamarca) se emplean recintos acristalados que atenúan la incomodidad de las inclemencias meteorológicas y protegen a los pacientes durante la exposición (fig. 2).
¿Cuál es la época del año más adecuada para realizar la terapia fotodinámica con luz de día?En España parece posible realizar el tratamiento durante todo el año en días despejados en la franja horaria de mediodía53. La temperatura puede ser un factor limitante para realizar el tratamiento, puesto que estudios in vitro y en piel de ratón han sugerido que temperaturas bajas disminuyen la producción de Ppix60–62. Además estas temperaturas dificultan la permanencia del paciente en el exterior durante la exposición. Distintos autores han recomendado un margen térmico de 10-35°C para la TFDLD60, pero cabrían variaciones en función de las características particulares del paciente y del lugar de exposición, y no existen hasta la fecha estudios que demuestren alteraciones en la eficacia del tratamiento más allá de estas temperaturas.
Wiegel et al. observaron una asociación lineal entre el índice ultravioleta (UVI) y la dosis de luz excitadora de Ppix en 2h de exposición a mediodía (11-13h), de forma que en días con un UVI superior a 3, los pacientes recibirán más de 8J/cm2 en ese horario60. Las condiciones meteorológicas influyen también en el tratamiento, puesto que la dosis de luz de día eficaz podría disminuir aproximadamente un 25% en días parcialmente soleados, un 50% en días nublados y un 75% en días lluviosos53,60. No se ha determinado el tiempo necesario de exposición en este tipo de días, y en este sentido aunque algunos autores recomiendan evitar la realización de TFDLD en días lluviosos57 y en días muy nublados, sería conveniente objetivar en mayor medida las condiciones meteológicas que deben darse para garantizar una dosis mínima eficaz63.
¿Por qué es necesario emplear un fotoprotector? ¿Qué fotoprotector es adecuado para realizar el tratamiento?La recomendación de fotoprotección tiene como finalidad más importante evitar los efectos nocivos de la radiación ultravioleta durante el tiempo de exposición a la luz solar. En los estudios realizados se han utilizado fotoprotectores con diferentes factores de protección solar: 2053,57, 1559, 30 (Grinblat) y 50 (LePillouerProst) y se han obtenido tasas similares de resolución de las lesiones. Es fundamental que dicho fotoprotector no contenga filtros inorgánicos, que además de bloquear la radiación ultravioleta, pueden bloquear la luz visible necesaria para la activación de la Ppix. La lista de fotoprotectores válidos para la realización de la TFDLD facilitada por el fabricante del fotosensibilizante (Laboratorios Galderma S.A.) incluye actualmente los siguientes productos: Bariesun SPF30/50 crema (Laboratorios Uriage), Melascreen emulsión solar SFP50 (Laboratorios Ducray), Sun Spray transparente SPF30/50 (Laboratorios Eucerin); AKN Mat SPF30/UVA13, MAX crema SPF50+/UVA38, AKN Spray SPF30/UVA13 (Laboratorios Bioderma); Gel transparente SPF30 (Laboratorios Isdin).
¿Cuáles son las limitaciones de la terapia fotodinámica con luz de día?La TFDLD resulta muy ventajosa para determinados pacientes y para dermatólogos que no dispongan del tiempo ni de la infraestructura para realizar TFD convencional. Sin embargo, presenta también ciertas limitaciones, como su difícil programación a causa de las variaciones meteorológicas y el clima de algunas zonas geográficas. En los países del Norte de Europa la radiación solar insuficiente y las temperaturas demasiado bajas limitan su realización durante el otoño-invierno. En países como el nuestro las condiciones son diferentes. Permanece sin aclarar si una irradiación muy intensa durante 2h podría suponer un riesgo añadido para el paciente. En este sentido, el reciente ensayo clínico llevado a cabo en Australia ha mostrado que es posible realizar TFDLD de forma eficaz y segura en países con elevada insolación. Otro de los inconvenientes es la falta de control riguroso en la parte ambulatoria del procedimiento, puesto que es el propio paciente quien controla la iluminación, sin que a día de hoy se sepa hasta qué punto esta variabilidad puede influir en la eficacia del tratamiento. Por otra parte, la TFDLD parece mostrar menos eficacia que la convencional en QA de grado iii, y por el momento no existen evidencias suficientes que apoyen su uso en otro tipo de lesiones cutáneas, aunque es previsible que en un futuro próximo se conozcan nuevos datos.
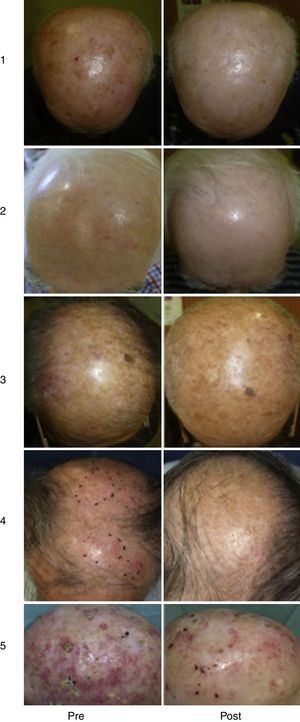
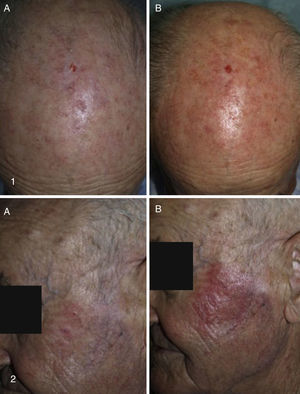
Nuestra experienciaEn el último año los servicios de dermatología de Gerencia de Gestión Integrada de Vigo (Complejo Hospitalario Universitario de Vigo [CHUVI] y del Hospital San Jorge de Huesca [HSJ]) han empleado la TFDLD en 35 (CHUVI) y 9 (HSJ) pacientes con QA múltiples grado i,ii y iii/campo de cancerización. Las lesiones se localizaban en la cara y/o el cuero cabelludo (CHUVI, HSJ) y las piernas (HSJ). Se realizó una sesión de TFDLD en la mayoría de los pacientes y 2 en algunos de ellos (HSJ). Los resultados observados (fig. 3) fueron similares a los conseguidos con la TFD convencional en QA grado i-ii e inferiores en QA grado iii. Los principales efectos secundarios tras el tratamiento fueron la inflamación del área tratada y la formación de costras, aunque fueron menos intensos de los que habitualmente produce la TFD convencional (fig. 4). La iluminación con luz de día resultó mucho menos dolorosa para los pacientes (dolor 0-3 frente a 6-10 en TFD convencional en los pacientes tratados en CHUVI, escala analógica 0-10). La mayoría de los pacientes que habían recibido con anterioridad sesiones de TFD convencional manifestaron su clara preferencia por la TFDLD. La incorporación de esta modalidad de TFD permitió agilizar el tratamiento de los pacientes y facilitar la realización del mismo a todos ellos, particularmente a los residentes fuera del núcleo urbano (CHUVI). Además, redujo considerablemente el tiempo invertido por el personal sanitario en la preparación y supervisión de la terapia (CHUVI).
Tratamiento de QA múltiples con TFDLD. Las imágenes de la columna izquierda corresponden al aspecto de las lesiones antes del tratamiento; las imágenes de la columna derecha corresponden al resultado obtenido 3 meses tras una sesión de TFDLD (casos 1-3: Gerencia de Gestión Integrada de Vigo; Complejo Hospitalario Universitario de Vigo), 8 meses tras una sesión de TFDLD y 4 meses tras 2 sesiones de TFDLD (casos 4 y 5 respectivamente, Hospital San Jorge Huesca).
La reciente introducción de la TFDLD ha constituido una importante novedad en la terapéutica dermatológica, puesto que al mismo tiempo que ha demostrado mantener el estándar de eficacia de la TFD convencional en QA, ha simplificado la técnica clásica y ha mejorado sustancialmente su tolerabilidad. La realización ambulatoria y su sencillez y comodidad en comparación con la técnica convencional han determinado que en muchos casos sea preferida por pacientes y especialistas, aunque su difícil programación en función de las condiciones meteorológicas en determinadas épocas del año y la pérdida de control del período de iluminación suponen importantes desventajas. Probablemente su utilización se extienda de forma progresiva al tratamiento de otras enfermedades cutáneas además de las QA, como ha ocurrido con la TFD convencional en los últimos años.
A pesar de la existencia de una propuesta de protocolo57 y un documento de consenso internacional53, existen diversos aspectos de la TFDLD que permanecen sujetos a cierta especulación y que deberán ser definidos a corto plazo para que la estandarización del tratamiento sea completa. La obligatoriedad de emplear un fotoprotector, la elección del factor de protección más adecuado, la cantidad y concentración idóneas del fotosensibilizante (con o sin oclusión), la dosis eficaz de luz de día exacta necesaria para la activación de la Ppix, el tiempo exacto de exposición a la luz natural en distintas franjas horarias y en condiciones meteorológicas concretas, el efecto real de la temperatura ambiente en la eficacia de la terapia y la posibilidad de emplear otros fotosensibilizantes además de MAL son algunos de ellos.
Según los datos disponibles hasta el momento España reúne unas condiciones climáticas idóneas para la realización de esta terapia durante todo el año. Con el fin de adaptar los protocolos de tratamiento internacionales existentes —basados en las particularidades de los países nórdicos— a las condiciones reales de nuestro país, un ensayo clínico que se está realizando en diferentes países europeos, entre ellos España, cuyos resultados estarán disponibles próximamente, contribuirá a establecer los parámetros óptimos para realizar TFDLD en nuestro medio.
Conflicto de interesesLa Dra. Lidia Pérez ha asistido a reuniones nacionales e internacionales sobre terapia fotodinámica invitada por Laboratorios Galderma S.A y ha participado como ponente en la i Reunión Gallega de Terapia Fotodinámica, organizada por Laboratorios Galderma S.A. La Dra. Yolanda Gilaberte ha percibido honorarios por su colaboración con Laboratorios Galderma S.A. como asesora y ponente en diversas conferencias.
Al Dr. Stephen Schumack (St. George Dermatology and skin cancer center; Kogarah, Australia), por la información proporcionada sobre el estudio multicéntrico de TFDLD realizado en Australia.
Al Dr. Beni Grinblat (Sao Paulo, Brasil), por la información proporcionada sobre los resultados obtenidos en el estudio sobre TFDLD realizado en Sao Paulo, Brasil.
A la Dra. Ann Le Pillouer-Prost (Marsella, Francia), por la información enviada sobre el estudio realizado con TFDLD en Marsella, Francia.
Al Dr. Helger Stege (Klinikum Lippe, Detmold, Alemania), por la información remitida sobre el dispositivo AK-Derm y la imagen del mismo.
Al Dr. Peter Bjerring (Hospital Molhom, Vejle, Dinamarca), por la cesión desinteresada de una imagen de su green house.