El imatinib mesilato es un inhibidor de la tirosín cinasa de administración oral que inhibe la BCR-abl, c-KIT y el platelet-derived growth factor receptor (PDGFR). Sus indicaciones fundamentales son la leucemia mieloide crónica y los tumores del estroma gastrointestinal. En Dermatología se emplea en enfermedades como el dermatofibrosarcoma protuberans, esclerosis sistémica y mastocitosis sistémica, entre otras. Es un fármaco en general bien tolerado, con la mayoría de efectos adversos leves o moderados. Los efectos secundarios dermatológicos son muy frecuentes e incluyen erupciones cutáneas inespecíficas como edema o erupciones maculopapulosas o con características clínicas distintivas (liquenoides, psoriasiformes, pustulosis exantemática aguda generalizada, síndrome de Stevens- Johnson…). Identificar y tratar correctamente estas reacciones puede ayudar a optimizar la adherencia del paciente al tratamiento y mejorar el pronóstico de su enfermedad de base.
Imatinib mesylate is a tyrosine kinase inhibitor that targets the BCR-ABL, c-kit, and PDGF (platelet-derived growth factor) receptors. Imatinib is mainly indicated for chronic myeloid leukemia and gastrointestinal stromal tumors but is also prescribed by dermatologists for dermatofibrosarcoma protuberans, systemic sclerosis, and systemic mastocytosis, among other conditions. Most adverse effects are mild or moderate and therapy is generally well tolerated. Adverse skin effects are very common and include nonspecific manifestations such as edema and maculopapular rashes or eruptions of diverse types (lichenoid or psoriasiform lesions, acute generalized exanthematic pustulosis, Stevens-Johnson syndrome, and more). Identifying and properly treating these reactions can help optimize adherence to treatment and improve the prognosis of the underlying disease.
El imatinib mesilato (Glivec®, Novartis, anteriormente llamado STI 571) es un inhibidor de la tirosín cinasa de administración oral que inhibe Bcr-abl (proteína de fusión resultado del cromosoma Philadelphia, anomalía citogenética de la leucemia mieloide crónica [LMC]), c-KIT y el platelet-derived growth factor receptor (PDGFR). En 2001 su aprobación por la FDA revolucionó el tratamiento de los pacientes con LMC y aumentó de manera significativa la superviviencia global de estos enfermos.
Posteriormente, el nilotinib (Tasigna®, Novartis) desde 2007 y el dasatinib (Sprycel®; Bristol -Myers Squibb) desde 2006, inhibidores de la tirosín cinasa de segunda generación, han completado las opciones terapéuticas en los casos de LMC intolerantes o resistentes a imatinib.
El uso de imatinib está aprobado también para el tratamiento de otras enfermedades como los tumores del estroma gastrointestinal (GIST) malignos c-Kit+no resecables o metastásicos, la leucemia linfoblástica aguda cromosoma Filadelphia+ síndromes mielodisplásicos con reordenación del gen PDGFR, síndrome hipereosinofílico y leucemia eosinofílica crónica. En cuanto a su uso en Dermatología se ha demostrado que es eficaz en ciertas enfermedades como el dermatofibrosarcoma protuberans (DFSP) inoperable o metastásico1, enfermedad injerto contra huésped esclerodermiforme2, esclerosis sistémica3, mastocitosis sistémica4 y melanomas con mutaciones c-Kit +5. En la tabla 1 se muestran las distintas dianas terapéuticas en las diferentes enfermedades en las que se usa imatinib.
Dianas terapéuticas en las diferentes enfermedades en las que se usa imatinib
| Leucemia mieloide crónica | Bcr-abl |
| Tumor del estroma gastrointestinal | c-kit |
| Síndrome hipereosinofílico | FIP1L1-PDGFRα |
| Mastocitosis sistémica | FIP1L1-PDGFRα |
| Leucemia mielomonocítica crónica | TEL-PDGFRβ |
| Dermatofibrosarcoma protuberans | COL1A1-PDGFβ |
| Melanoma | c-Kit |
Respecto a las dosis utilizadas, en la LMC en fase crónica y en los tumores GIST se usa a dosis de 400-600mg/d. En la LMC en fase acelerada y en el DFSP se indica a dosis de hasta 800mg/d.
Efectos adversos secundarios a imatinibAunque es un fármaco generalmente bien tolerado, hasta un 5,4% de los pacientes tiene que suspenderlo por sus efectos adversos6. Los efectos adversos suelen clasificarse mediante la escala del Instituto Nacional del Cáncer de Estados Unidos, que clasifica la severidad en 4 grados7. La mayoría de los efectos adversos observados tras la administración de imatinib son leves o moderados en gravedad (grado 1 o 2)8.
Los efectos secundarios de grado 1 y 2 más frecuentemente observados tras un seguimiento de 5 años en pacientes diagnosticados por primera vez de LMC y tratados con imatinib fueron edema, calambres musculares, diarrea, náuseas, dolor musculoesquelético, erupción cutánea u otras alteraciones en la piel, dolor abdominal, fatiga, dolor articular y cefalea8. En cuanto a los efectos adversos graves o de grado 3 y 4 se incluyeron neutropenia, trombocitopenia, anemia y elevación de las enzimas hepáticas9.
Respecto a otros inhibidores de la tirosín cinasa, como el nilotinib, el imatinib parece causar una mayor tasa de náuseas, diarrea, vómitos, calambres musculares y edema10. Sin embargo, el imatinib se asocia a una menor incidencia de erupción cutánea, cefalea, prurito, aumento de las transaminasas y alopecia10. Respecto a los efectos adversos hematológicos como la neutropenia, en los pacientes tratados con imatinib se observó en el 20% de los casos, mientras que con el nilotinib en el 12%. Los 2 fármacos causaron tasas similares de trombocitopenia de grados 3 y 4 y anemia10.
En cuanto al dasatinib parece que causa menos náuseas, vómitos, inflamación muscular, erupciones cutáneas, retención hidroelectrolítica y cefaleas que el imatinib11. También se observaron porcentajes similares de neutropenia grados 3 y 4 y anemia, y una mayor tasa de trombocitopenia con el dasatinib respecto a imatinib12. En la tabla 2 se muestra una comparativa del porcentaje de efectos adversos cutáneos causados por cada fármaco13.
Efectos secundarios de los distintos inhibidores de la tirosín cinasa
| Fármaco | Efectos secundarios cutáneos (% de casos de los tratados) |
| Imatinib | Edema superficial (48-65)Erupción máculo-papulosa (∼67)Cambios pigmentariosHipo/despigmentación (41)Hiperpigmentación (∼4)Erupciones liquenoides (CA)Erupción psoriasiforme/psoriasis (CA)Erupción pitiriasis rosada-like (CA)Pustulosis exantemática aguda generalizada (CA)Síndrome Stevens-Johnson (CA)UrticariaDermatosis neutrofílica (CA)Fotosensibilidad (CA)Porfiria (CA)Pseudoporfiria (CA) |
| Dasatinib | Erupción cutánea (maculosa, papulosa, exfoliativa) (11-27)Mucositis/estomatitis (16)Prurito (11)Paniculitis (CA) |
| Nilotinib | Erupción cutánea (10-28)Prurito (17-24)Xerosis cutánea (13-17)Alopecia (6) |
CA: casos aislados. Modificada de Amitay-Laish et al.13.
Por regla general, cualquier efecto adverso de grado 3 y 4 se trata interrumpiendo el tratamiento y reintroduciéndolo una vez resuelta la toxicidad a una dosis menor.
Es importante una cuidadosa valoración de los efectos adversos que experimentan estos pacientes, ya que esto influye de manera importante en la adherencia de los pacientes al tratamiento, y por lo tanto en su eficacia. Ayudar al paciente a identificar y manejar los efectos secundarios es esencial para mejorar la adherencia al tratamiento.
Efectos adversos cutáneos secundarios a imatinibLas erupciones cutáneas son uno de los efectos adversos más frecuentes del imatinib, y según algunas series ocurren de un 7 a un 88,9% de los pacientes14,15. La mayoría son leves, autolimitadas y aparecen poco tiempo después de empezar a tomar el fármaco16. En la tabla 3 se muestra la clasificación de los efectos adversos cutáneos más frecuentes en función de su gravedad7. Según un estudio son graves en el 2,3% de los pacientes tratados a dosis de 400mg/d y en un 5,3% de los tratados con 800mg/d17.
Clasificación de la severidad de las reacciones adversas cutáneas más frecuentes asociadas al uso de imatinib. Escala del Instituto Nacional del Cáncer de Estados Unidos V. 4 que clasifica la severidad en 4 grados
| Efecto adverso | ||||
| Grado | Rashmáculo-papular | Edema periorbitario | Hiperpigmentación cutánea | Hipopigmentación cutánea |
| 1 | Máculas/pápulas <10% de la superficie corporal con/sin síntomas (prurito, escozor…) | Suave y no piqueteado | Hiperpigmentación <10% de la superficie corporal; no impacto psicosocial | Hipopigmentación o despigmentación <10% de la superficie corporal; no impacto psicosocial |
| 2 | Máculas/pápulas <30% de la superficie corporal con/sin síntomas (prurito, escozor…) que limitan las actividades de la vida diaria | Edema indurado o piqueteado; indicada intervención tópica | Hiperpigmentación >10% de la superficie corporal; impacto psicosocial | Hipopigmentación o despigmentación >10% de la superficie corporal; impacto psicosocial |
| 3 | Máculas/pápulas >30% de la superficie corporal con/sin síntomas (prurito, escozor…) que limitan las actividades de la vida diaria respecto al cuidado personal | Edema asociado con alteraciones visuales; aumento de la presión intraocular, glaucoma o hemorragia retiniana; neuritis óptica; indicados diuréticos o intervención quirúrgica | --- | --- |
| 4 | --- | --- | --- | --- |
Se cree que son dosis dependientes. Un estudio señala que ocurren en el 7% de los pacientes tratados con una dosis infraterapéutica de 25-140mg/d y en el 21-88% de los pacientes tratados con una dosis de 400-800mg/d18. Este hecho, junto con el relativo bajo peso molecular del fármaco, sugiere que la toxicidad cutánea del imatinib no es mediada por un efecto inmunogénico, sino por un efecto farmacológico tóxico del fármaco.
Se han descrito distintos tipos de reacciones cutáneas tras el uso de imatinib. Pueden ser no específicas, como el exantema máculo-papuloso, edema superficial o prurito, o más raramente erupciones con características clínicas distintivas (liquenoides, psoriasiformes, pustulosis exantemática aguda generalizada [PEAG], síndrome de Stevens-Johnson [SSJ], etc.).
A continuación se describirán los efectos adversos cutáneos más frecuentes causados por imatinib.
Exantema máculo-papulosoEl exantema secundario a imatinib aparece normalmente pocos días después de iniciar el tratamiento, aunque puede ocurrir meses después del inicio del mismo. Según algunos estudios es muy frecuente y aparece hasta en el 66,7% de los pacientes unos 2 meses después de iniciar el fármaco19.
Esta erupción suele ser eritematosa, máculo-papulosa, a veces descamativa y pruriginosa (fig. 1). Se localiza en los antebrazos, el tronco, las piernas y la cara con menor frecuencia20. Ocurre más frecuentemente en pacientes que toman dosis altas (>600mg/d) del fármaco, por lo que se piensa que pueda ser una toxicidad farmacológica más que una reacción de hipersensibilidad.
La mayoría de estas erupciones cutáneas son autolimitadas y fácilmente tratables con emolientes, corticoides tópicos y antihistamínicos, por lo que el paciente puede seguir con la misma dosis del fármaco. Cuando la erupción cutánea progresa hasta hacerse eritrodérmica se considera toxicidad grado 4, y estaría indicado suspender el fármaco. En general, los casos graves suelen requerir tratamiento con corticoides orales y una interrupción del imatinib hasta que la erupción haya mejorado alcanzando el grado 1. Posteriormente se puede intentar introducir el imatinib a una dosis menor (50-100mg/d) junto con el uso de corticoides orales concomitantemente y aumentando gradualmente la dosis del fármaco20.
La dosis de corticosteroide oral recomendada suele ser inicialmente de 0,5-1mg/kg al día de prednisona o equivalente. En pacientes concretos se ha probado con éxito la desensibilización, lo que sugiere que podrían estar implicados también mecanismos de hipersensibilidad21.
En los casos muy graves no se recomienda la reintroducción del fármaco, y se indica su sustitución por nilotinib o dasatinib.
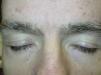
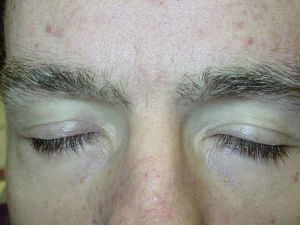
Edema superficialUno de los efectos adversos cutáneos más frecuentes es el edema superficial. Según varios estudios entre el 48 y el 65% de los pacientes tratados con este fármaco desarrollan esta complicación unas 6 semanas después de iniciar el mismo, frecuentemente asociado a ganancia de peso15. El edema es normalmente leve-moderado y se localiza en la cara, sobre todo en los párpados, acentuándose por las mañanas. El desarrollo de edema en las extremidades es mucho más raro22. Por otra parte, se ha observado retención hídrica central (derrame pleural, insuficiencia cardiaca congestiva…) en un 1-3% de los pacientes tratados con imatinib23.
Respecto a la etiopatogénesis del edema superficial se piensa que es dosis dependiente y que ocurre debido a un aumento de la presión del líquido intersticial dérmico provocada por la inhibición del PDGFR, que regula la homeostasis del líquido intersticial24.
Respecto al tratamiento la mayoría de los casos de edema superficial no requieren la suspensión del fármaco, y no es necesario ningún tratamiento específico. En algunos casos puede ser beneficiosa la limitación de la sal en la dieta y la aplicación tópica de fenilefrina al 0,25%25. En los casos de edema central está indicado el uso de diuréticos25.
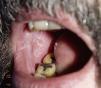
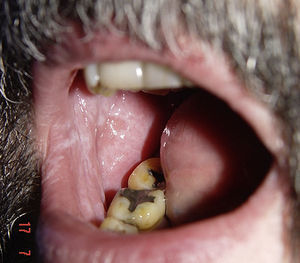
Erupciones liquenoidesSe han descrito unos 15 casos de erupción liquenoide en pacientes tratados con imatinib26–29. Las lesiones afectaban la piel y/o las mucosas (fig. 2). Estas erupciones parecen ser dosis dependientes por el hecho de que todos los pacientes estaban siendo tratados con dosis altas (>400mg/d) del fármaco. En la mayoría de los casos descritos las lesiones empezaron de uno a 3 meses después de comenzar el fármaco, aunque algunos de los enfermos las desarrollaron hasta un año después del inicio de imatinib. En la mayoría de los pacientes no fue necesario suspender el fármaco, y estas reacciones se manejaron adecuadamente con el uso de corticoides orales o acitretino30.
Trastornos pigmentariosSe han descrito varios casos de alteraciones pigmentarias debidas al uso de imatinib. Normalmente las hipopigmentaciones se manifiestan como zonas hipocrómicas o acrómicas difusas o localizadas, que normalmente remiten con una disminución o cese del fármaco31,32.
Parece ser que los pacientes con fototipos oscuros son más proclives a desarrollar este efecto adverso. Algunos estudios han mostrado una incidencia de hipopigmentación del 41% en los pacientes tratados de LMC32.
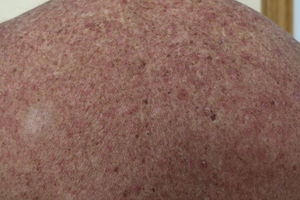
Asimismo, se han descrito casos de despigmentación del pelo33 (fig. 3).
Por otra parte, se han publicado casos de pacientes tratados con imatinib que han desarrollado hiperpigmentación cutánea, mucosa (paladar duro) y ungueal34–37. Un estudio realizado en 118 pacientes con LMC tratados con imatinib mostró que solo en 4% desarrollaron hiperpigmentación32.
En cuanto a la patogenia de estas reacciones se sabe que el imatinib inhibe el c-kit en los melanocitos, reduciendo su actividad, lo que produciría hipopigmentación37. Por otra parte, el imatinib puede causar también hiperpigmentación a través de la quelación de uno de sus metabolitos con el hierro y la melanina, mecanismo similar a la hiperpigmentación secundaria a minociclina y antipalúdicos38.
Psoriasis o erupción psoriasiformeEn un estudio realizado en 54 pacientes tratados con imatinib se han descrito 4 casos que desarrollaron una erupción psoriasiforme entre uno y 7 meses después de comenzar el fármaco15. La mitad de ellos tenían antecedentes previos de psoriasis. También se han descrito casos de psoriasis exarcebada por el fármaco39,40. Deguchi et al. describieron 3 casos de hiperqueratosis palmoplantar psoriasiforme y distrofia ungueal después del tratamiento con imatinib en pacientes sin antecedentes de psoriasis. Todos los casos mejoraron tras la suspensión o disminución de dosis del fármaco41.
Sin embargo, existe un caso publicado en el que se describe la mejoría de la psoriasis de un paciente con un tumor GIST que empezó el tratamiento con 400mg/d de imatinib42.
En cuanto a la etiopatogenia, es conocido que la psoriasis es una enfermedad en la que los linfocitos T desempeñan un importante papel patogénico. Se sabe que el imatinib es un fármaco que puede modular las señales de los linfocitos T43. Se cree que dependiendo de las circunstancias esta modulación puede ser hacia la estimulación o hacia la inhibición de los linfocitos T, provocando exacerbaciones o remisiones de la psoriasis respectivamente.
Erupción pitiriasis rosada-likeSe han descrito varios casos de erupciones similares a la pitiriasis rosada en pacientes en tratamiento con imatinib. En la mayoría de los casos la erupción apareció uno y 2 meses después de comenzar el tratamiento44.
En alguno de los casos la relación con el imatinib parece bastante probable, ya que las lesiones cutáneas (clínica e histopatológicamente compatibles) desaparecieron tras la retirada del medicamento y reaparecieron tras su reintroducción45,46.
La etiopatogenia de este efecto adverso es desconocida.
Pustulosis exantemática aguda generalizadaSe ha descrito un caso típico de pustulosis exantemática aguda generalizada causada por imatinib47.
Posteriormente se han descrito otros 3 casos atípicos, en los cuales se observaba una erupción de localización atípica entre uno y 4 años después de comenzar el fármaco48–50.
No se han descrito casos de PEAG en pacientes que recibían menos de 600mg/d de imatinib, por lo que se piensa que este efecto adverso es dosis dependiente. Su etiopatogenia no es del todo conocida.
Síndrome Stevens-JohnsonSe han descrito varios casos de SSJ en pacientes en tratamiento con imatinib51–55. Hsiao et al. describieron el caso de un paciente con LMC que desarrolló un cuadro compatible con SSJ una semana después de comenzar con el fármaco54. El cuadro se resolvió tras su retirada, pero reapareció tras la reintroducción del fármaco, por lo que el papel como causante de la erupción parece relevante.
En otros casos, sin embargo, no se observó la aparición de la erupción tras la reintroducción del fármaco a dosis menores52.
En otro de los casos publicados de SSJ en un paciente tratado con 400mg/d de imatinib, se intentó la reintroducción del fármaco a dosis de 200mg/d con reaparición de las lesiones55. En un segundo intento, con dosis de 100mg/d y 1mg/kg/d de prednisona, las lesiones no reaparecieron. Tras suspender la prednisona a las 6 semanas pudieron subir el imatinib a 300mg/d sin efectos adversos.
Respecto al manejo de estas erupciones mucocutáneas severas, en las que las lesiones reaparecen incluso con el uso concomitante de prednisona, algunos autores abogan por la desensibilización21. Pensamos que habiendo hoy en día alternativas terapéuticas como el dasatinib y nilotinib, nos parece más adecuada la suspensión del imatinib y su sustitución por uno de estos fármacos en estos casos.
Dermatosis neutrofílicasSe han descrito 2 casos de síndrome de Sweet en pacientes tratados con imatinib, en uno de ellos al menos con asociación temporal clara56,57. También se ha descrito el caso de un paciente con una hidradenitis neutrofílica ecrina secundaria a imatinib47, 2 casos de eritema nodoso58, 3 casos de paniculitis neutrofílica recurrente59–61 y un caso de foliculitis neutrofílica62.
Necrólisis epidérmica tóxicaExiste publicado un caso de una paciente con LMC que desarrolló una erupción ampollosa cutánea y mucosa muy severa después de un trasplante alogénico de médula ósea (con acondicionamiento con fludarabina y busulfán) y del tratamiento con imatinib63. La relación con imatinib es algo dudosa, ya que estaba tomando también otros fármacos y la erupción apareció tras meses en tratamiento con imatinib.
FotosensibilidadSe han publicado 2 estudios que describen varios casos de fotosensibilidad en pacientes en tratamiento de larga duración con imatinib15,64, así como un caso de dermatitis fotoinducida65.
Otras reacciones cutáneasSe han descrito casos de erupción cutánea micosis fungoide-like66, porfiria cutánea tarda67, pseudoporfiria68 y fragilidad cutánea con formación de ampollas69,70 en pacientes tratados con imatinib.
ConclusiónEl imatinib es un fármaco bien tolerado, aunque no exento de efectos adversos, alguno de ellos graves. Las reacciones adversas cutáneas son uno de los más frecuentes. En este artículo hemos realizado una revisión exhaustiva de los efectos secundarios causados por este fármaco, haciendo hincapié en los cutáneos, y exponemos las recomendaciones para su manejo. Al ser un fármaco con numerosas indicaciones, alguna de ellas dermatológicas, cada vez va a ser más frecuente observar en nuestra consulta pacientes con efectos adversos derivados de su uso. Un correcto conocimiento de estas reacciones y su manejo es de gran importancia, ya que la adherencia al tratamiento es fundamental para su eficacia en enfermedades potencialmente mortales como la LMC.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.