Las terapias biológicas representan una alternativa de indudable eficacia en la psoriasis moderada y grave. Sin embargo, existe una asociación entre el tratamiento con anti-TNF-α y la reactivación de la infección tuberculosa. La tuberculina se utiliza como herramienta para el diagnóstico de la infección tuberculosa, pero presenta una baja especificidad en pacientes vacunados con la BCG (Mycobacterium bovis bacilo de Calmette-Guérin) y una baja sensibilidad en pacientes con alteraciones de la inmunidad celular. En este sentido se han desarrollado diferentes metodologías in vitro que incorporan antígenos específicos de Mycobacterium tuberculosis para estimular células T sensibilizadas y detectar posteriormente IFN-γ liberado para el diagnóstico in vitro de la infección tuberculosa. Los resultados obtenidos hasta ahora muestran a estas como una alternativa real a la tuberculina, ya que presentan una mayor especificidad y sensibilidad. Estas técnicas, además, están demostrando un elevado valor predictivo negativo que hace que nos podamos plantear a corto-medio plazo su utilización sin necesidad de combinarla con la tuberculina.
Although there is no doubt that biologic agents are an effective alternative for the treatment of moderate and severe psoriasis, anti-tumor necrosis factor α therapy has been associated with reactivation of latent tuberculosis infection. Tuberculin skin testing (TST) is used to diagnose tuberculosis infection but it has low specificity in patients who have received the Mycobacterium bovis BCG vaccine and low sensitivity in patients with altered cell-mediated immunity. In vitro assays based on the detection of interferon γ released by T cells stimulated by specific Mycobacterium tuberculosis antigens have emerged as an option for the diagnosis of tuberculosis infection. The results to date show that they are a viable alternative to TST thanks to their higher specificity and sensitivity. Furthermore, these assays are also proving to have high negative predictive value, meaning that we might be able to use them without TST in the short to medium term.
La psoriasis es una enfermedad inflamatoria de curso crónico, que afecta a un porcentaje elevado de la población y que puede presentarse de forma severa siendo causa importante de incapacidad laboral en edades medias de la vida, comportando un importante impacto personal y socioeconómico. Las terapias biológicas, especialmente las basadas en antagonistas del factor de necrosis tumoral alfa (TNF-α), han aparecido como una opción terapéutica eficaz para esta enfermedad en aquellos casos en los que los tratamientos sistémicos clásicos son ineficaces o están contraindicados1.
Sin embargo, la utilización de terapias biológicas requiere de una evaluación previa y de una vigilancia del paciente ya que se han descrito infecciones bacterianas graves en pacientes tratados con agentes anti-TNF-α. Concretamente, requiere una consideración especial el riesgo de desarrollar tuberculosis (TB), ya que existe una asociación clara entre el tratamiento con anti-TNF-α y la reactivación de la infección tuberculosa2,3. La principal vía de infección de Mycobacterium tuberculosis (M. tuberculosis) es la llegada a los alvéolos pulmonares, donde es fagocitado por los macrófagos alveolares. Dado que M. tuberculosis es un patógeno intracelular, el bacilo consigue evitar su destrucción impidiendo la unión del fagosoma y el lisosoma, y multiplicarse en el interior del macrófago hasta posteriormente destruirlo. El macrófago infectado libera citocinas que atraen neutrófilos, linfocitos y más macrófagos, para que generen un foco inflamatorio. La respuesta Th1 es la responsable del desarrollo de la inmunidad protectora, ya que segrega TNF-α que permite la llegada de más macrófagos, y de IFN-γ que activa a los que están infectados. El TNF-α es una de las citocinas clave en el desarrollo y mantenimiento del granuloma tuberculoso y en la contención de la infección. Por lo tanto, es obligado antes de iniciar la terapia con anti-TNF-α descartar la infección tuberculosa, y por supuesto una eventual TB activa4.
Diagnóstico de la infección tuberculosaLa prueba de la tuberculina (PT) se ha utilizado durante los últimos 100 años como herramienta para el diagnóstico de la infección tuberculosa. La tuberculina se obtiene del filtrado del cultivo de M. tuberculosis esterilizado y concentrado. Actualmente está constituida por derivado proteico purificado (PPD), que consiste en una mezcla de más de 200 proteínas de M. tuberculosis. En España se recomienda emplear la tuberculina PPD RT23 con Tween 80, preparada por el Statens Serum Institute de Copenhague, a dosis de 2UT por 0,1ml, que es bioequivalente a la dosis recomendada (5UT) de la tuberculina patrón internacional, la PPD-S5.
La PT se realiza según la técnica de Mantoux, mediante la inyección intradérmica en la cara anterior del antebrazo de una cantidad constante de líquido diluyente (0,1ml) con la dosis correspondiente de tuberculina. La sensibilización del individuo se manifiesta por una reacción de hipersensibilidad retardada, que produce una induración en el sitio de la inyección, que ha de comprobarse a las 48-72h. Esta respuesta está mediada por células Th1 que migran al punto de inyección del antígeno y producen la liberación de diversas citocinas al reconocer los antígenos presentados por las moléculas del complejo mayor de histocompatibilidad (MHC) de clase ii. Posteriormente, activan a los macrófagos provocando una reacción caracterizada por la aparición de eritema e induración.
Las normativas actuales exigen recoger en la historia clínica de los pacientes los posibles antecedentes de TB y los contactos recientes con pacientes con TB para reducir el riesgo de desarrollar una TB durante el tratamiento con agentes biológicos; y realizar una radiografía de tórax para descartar una TB activa o signos radiográficos sugestivos de una antigua TB, así como realizar una PT. Si la PT es positiva, considerando una induración ≥5mm a las 72h, se considerará que el individuo está infectado. Si la induración es <5mm, se debe realizar una nueva PT 2 semanas después (booster), considerando que el paciente está infectado si la induración de la segunda tuberculina es ≥5mm 5.
El principal inconveniente de la PT radica en que la mayoría de proteínas presentes en el PPD no son específicas de M. tuberculosis, sino que las comparte con otras especies de micobacterias. Esto provoca una disminución en la especificidad de la prueba, ya que individuos sensibilizados por exposición previa a micobacterias no tuberculosas (MNT) o que han recibido la vacuna antituberculosa (Mycobacterium bovis [M. bovis] bacilo Calmette-Guérin [BCG]) también responden inmunológicamente al PPD. Además, la PT presenta una baja sensibilidad en pacientes con alteraciones en la inmunidad celular; siendo en esta clase de pacientes en los que la PT es más necesaria, ya que presentan un mayor riesgo de desarrollar TB si están infectados. Esta menor sensibilidad de la PT es de especial interés en los pacientes con psoriasis candidatos a iniciar terapias biológicas, ya que previamente han recibido fármacos inmunosupresores clásicos y que pueden tener alterada su respuesta inmune.
Técnicas in vitro basadas en la liberación de IFN-γUn método de inmunodiagnóstico basado en la cuantificación in vitro de la respuesta inmune celular puede ser una alternativa a la PT para identificar la infección tuberculosa. En este sentido, en los últimos años, se han desarrollado diferentes métodos de cuantificación de esta respuesta inmune celular utilizando diferentes antígenos micobacterianos para la estimulación de las células T sensibilizadas y para la detección in vitro de la liberación de IFN-γ. De esta forma, las células T sensibilizadas en los individuos infectados liberarán cantidades fácilmente detectables de IFN-γ tras ser estimuladas con los antígenos específicos de M. tuberculosis. Esta tecnología se ha basado en técnicas de ELISA y ELISPOT, que respectivamente han dado lugar a 2 técnicas disponibles comercialmente: QuantiFERON®-TB Gold In tube (QFN-G-IT) (Cellestis Limited, Carnegie, Victoria, Australia) y T-SPOT®.TB (Oxford Immunotec, Abingdon, Reino Unido). Ambas técnicas, aprobadas por la Food and Drug Administration (FDA), consisten en una estimulación in vitro de los linfocitos con antígenos específicos de M. tuberculosis, seguida de una detección del IFN-γ liberado mediante técnica inmunológica. El éxito de esta tecnología depende entre otros factores de los antígenos que se emplean durante la estimulación. La utilización de antígenos codificados en la región de diferencia (RD) 1, como por ejemplo ESAT-6 y CFP-10, que son antígenos secretados por el complejo M. tuberculosis y que están ausentes en la vacuna BCG y en otras MNT, parece tener una gran capacidad en la detección de individuos infectados por M. tuberculosis.
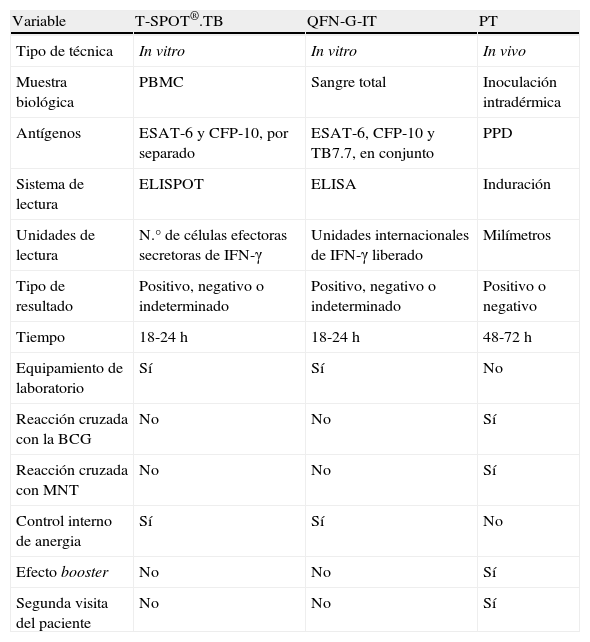
La técnica QFN-G-IT estimula los linfocitos presentes en muestras de sangre total y determina la producción de IFN-γ mediante técnica de ELISA, mientras que la técnica T-SPOT®.TB requiere una separación previa de células mononucleares de sangre periférica (PBMC, por sus siglas en inglés) para su estimulación y determina la presencia de IFN-γ mediante ELISPOT. Una de las principales diferencias entre ambas técnicas in vitro es que en el QFN-G-IT los antígenos específicos de M. tuberculosis se utilizan de forma conjunta para la estimulación de la sangre total, mientras que en el T-SPOT®.TB se emplean por separado para estimular las PBMC. Además, en el QFN-G-IT se incluye un tercer antígeno: TB7.7 (Rv2654). Este antígeno está codificado en la RD11 y también está ausente en la vacuna de la BCG y en otras MNT. En la tabla 1 se muestra un resumen de las principales características de las técnicas in vitro y de la PT.
Características de las técnicas de T-SPOT®.TB, QFN-G-IT y PT
| Variable | T-SPOT®.TB | QFN-G-IT | PT |
| Tipo de técnica | In vitro | In vitro | In vivo |
| Muestra biológica | PBMC | Sangre total | Inoculación intradérmica |
| Antígenos | ESAT-6 y CFP-10, por separado | ESAT-6, CFP-10 y TB7.7, en conjunto | PPD |
| Sistema de lectura | ELISPOT | ELISA | Induración |
| Unidades de lectura | N.° de células efectoras secretoras de IFN-γ | Unidades internacionales de IFN-γ liberado | Milímetros |
| Tipo de resultado | Positivo, negativo o indeterminado | Positivo, negativo o indeterminado | Positivo o negativo |
| Tiempo | 18-24h | 18-24h | 48-72h |
| Equipamiento de laboratorio | Sí | Sí | No |
| Reacción cruzada con la BCG | No | No | Sí |
| Reacción cruzada con MNT | No | No | Sí |
| Control interno de anergia | Sí | Sí | No |
| Efecto booster | No | No | Sí |
| Segunda visita del paciente | No | No | Sí |
PBMC: células mononucleares de sangre periférica; PPD: derivado proteico purificado; PT: prueba de la tuberculina; QFN-G-IT: QuantiFERON®-TB Gold In tube; MNT: micobacterias no tuberculosas.
Se ha descrito que las técnicas de inmunodiagnóstico in vitro son más específicas que la PT en pacientes vacunados con la BCG y que correlacionan mejor con la exposición a M. tuberculosis6–10. Asimismo, estudios publicados recientemente demuestran el valor pronóstico de estas técnicas en el desarrollo de TB activa11–14. Por otro lado, existe además una evidencia cada vez mayor de que las técnicas basadas en la detección de IFN-γ son también robustas cuando se emplean para el diagnóstico de infección tuberculosa en pacientes con déficit en la respuesta inmune celular15,16, como podrían ser los niños8,17,18, los pacientes coinfectados con el VIH19–23 y los pacientes en tratamiento con fármacos inmunosupresores24–26.
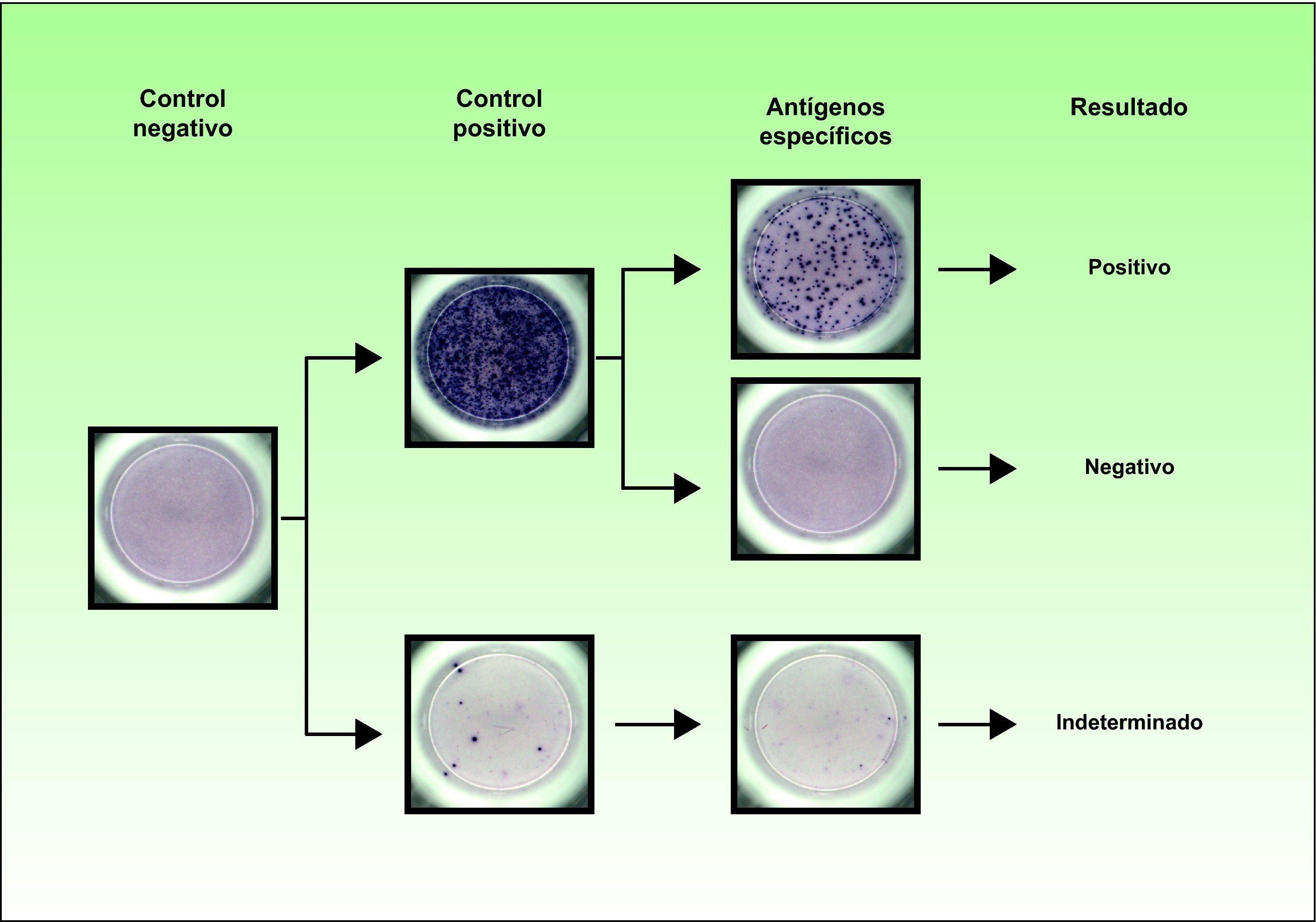
En este sentido, las técnicas basadas en la detección de IFN-γ pueden detectar ausencia de respuesta inmune ya que presentan controles internos que permiten identificar la falta de respuesta en pacientes anérgicos. Por lo tanto, un resultado negativo en el mitógeno (control positivo) y negativo frente a los antígenos específicos se ha de considerar un resultado indeterminado. Este resultado implica una falta de respuesta de las células T del paciente. Un paciente con un resultado de la tuberculina negativo y un resultado indeterminado por las técnicas in vitro podría significar que se trata de un falso negativo de la tuberculina. Por lo que respecta a los resultados indeterminados, se ha descrito que están asociados a niños menores de 5 años, inmunosupresión y una PT negativa8,27,28. En la figura 1 están representados los posibles resultados que se pueden obtener por la técnica de T-SPOT®.TB.
La técnica T-SPOT®.TB requiere una separación previa de células mononucleares de sangre periférica (PBMC, por sus siglas en inglés) para su estimulación y determina la presencia de IFN-γ mediante ELISPOT. Los antígenos específicos de M. tuberculosis, ESAT-6 y CFP-10, se emplean por separado para la estimulación de las PBMC. La presencia de células T reactivas se observa mediante la aparición de spots en el pocillo, que se cuentan de forma manual y/o con un lector automático de placas. Se considera que un resultado es positivo si la muestra presenta más de 6 spots para ESAT-6 o CFP-10 que en el control negativo, y este número es el doble que el del control negativo. El resultado de la técnica se considera indeterminado si el número de spots en el control positivo es menor que 20, y la respuesta a los antígenos específicos es negativa.
Varios estudios han permitido evaluar la utilidad de las técnicas basadas en la detección de IFN-γ para el diagnóstico de la infección por M. tuberculosis en pacientes con enfermedades inflamatoria crónicas que van a iniciar tratamientos biológicos26,29–36. Sin embargo, algunos de estos estudios se han llevado a cabo con versiones previas del QFN-G-IT; y además se ha evaluado su utilidad en el diagnóstico de la infección tuberculosa en poblaciones bastante heterogéneas (mezclando pacientes con enfermedades reumáticas, digestivas y dermatológicas), con diferentes grados de inmunosupresión farmacológica, o pacientes que ya estaban realizando tratamiento con anti-TNF-α. Todos estos factores dificultan conocer el papel de estas técnicas en el diagnóstico de la infección tuberculosa en pacientes con psoriasis candidatos a tratamiento con anti-TNF-α.
En este sentido, se han publicado recientemente estudios que exploran la utilidad de las técnicas basadas en la detección de IFN-γ en pacientes con psoriasis37–40. Estos trabajos confirman que las técnicas in vitro están menos afectadas que la tuberculina con la vacuna BCG38. Por otro lado, De Andrade Lima et al.39 observaron como la frecuencia de resultados positivos por PT, así como la induración, era mucho mayor en pacientes control (pacientes con enfermedades dermatológicas comunes, pero sin psoriasis), que en pacientes con psoriasis modeada-severa no tratados. En cambio, ni el número de resultados positivos por T-SPOT®.TB, ni el número de spots obtenidos, presentaron diferencias significativas entre ambos grupos de pacientes. Los autores concluyen que el T-SPOT®.TB es superior a la PT en el diagnóstico de la infección tuberculosa latente en pacientes con psoriasis, probablemente debido a que la desregulación inmunológica propia de la psoriasis interfiere mucho menos con la técnica in vitro.
Valor predictivo de las técnicas del IFN-γ en la progresión a enfermedadUno de los aspectos críticos para la incorporación de las técnicas in vitro en la práctica clínica radica en establecer si es seguro o no administrar profilaxis tuberculosa a pacientes que van a recibir fármacos inmunosupresores y que tienen una PT positiva y unas técnicas in vitro negativas (independientemente de la vacuna de la BCG). Se conoce muy poco acerca de la monitorización de la infección tuberculosa durante el tratamiento anti-TNF-α, y del valor pronóstico de estas técnicas en la progresión a enfermedad. A pesar de que esta cuestión no está resuelta y, por lo tanto, lo más prudente sea utilizar la PT y las técnicas del IFN-γ de forma conjunta considerando infección cuando cualquiera de las 2 técnicas sea positiva, existen resultados preliminares que apuntan a que a corto-medio plazo podamos cambiar este planteamiento37,38,40.
Laffitte et al.38 estudiaron 50 pacientes con psoriasis previamente a iniciar tratamiento con anti-TNF-α. En todos ellos se realizó PT y T-SPOT®.TB. En 28 casos ambas técnicas fueron negativas, en 12 casos fue positivo la PT, y negativo el T-SPOT®.TB, y en 10 casos fue positivo el T-SPOT®.TB (en 8 de estos casos también lo fue la PT). Ninguno de los 38 pacientes con T-SPOT®.TB negativo que no recibieron profilaxis desarrolló TB en los 4 años siguientes. Garcovich et al.37 estudiaron también 50 pacientes con PT y QFN-G-IT al inicio de la terapia con anti-TNF-α. Ningún paciente con QFN-G-IT negativo y Rx normal recibió profilaxis, y ninguno de ellos desarrolló TB en los 18 meses siguientes. También se realizaron determinaciones de QFN-G-IT durante los 12 meses siguientes al inicio del tratamiento biológico, observándose 3 conversiones a los 6 meses y 2 a los 12 meses. En 4 de estos casos fue posible pautar profilaxis y en el seguimiento posterior ninguno de ellos tampoco desarrollo TB. Finalmente, Chiu et al.40 realizaron QFN-G en 110 pacientes con psoriasis que recibieron tratamiento biológico, siendo el test positivo en 12 casos. Por diferentes motivos, únicamente recibieron profilaxis 4 de los pacientes con QFN-G positivo, y del total de pacientes, únicamente desarrolló TB un paciente con QFN-G positivo que había rechazado la profilaxis.
Resultados indeterminados y discordantes de las técnicas del IFN-γPor otro lado, el análisis del efecto de los fármacos inmunosupresores en los resultados de las técnicas inmunológicas todavía es desconocido. En este sentido, los resultados del estudio de Soborg et al.30 muestran como el tratamiento con corticoides podía afectar al resultado del QFN-G-IT, dando lugar a un mayor porcentaje de resultados indeterminados y una disminución de resultados positivos por la PT. En nuestra experiencia41, los pacientes con psoriasis presentan, tanto por T-SPOT®.TB como mediante QFN-G-IT, un mayor número de resultados positivos y un menor número de resultados indeterminados, que los pacientes con enfermedad de Crohn. Estos resultados son atribuibles a los diferentes tratamientos inmunosupresores que ya reciben los pacientes antes de iniciar los tratamientos anti-TNF-α.
Por lo que respecta a los resultados discordantes entre las técnicas de detección de IFN-γ y la PT, la mayoría de estudios los atribuyen a la vacuna de la BCG. Sin embargo, también se han observado resultados positivos por la PT y negativos por las técnicas in vitro en pacientes no vacunados con la BCG. Una posible explicación de estos resultados discordantes sería la sensibilización por MNT. De hecho, nuestro grupo ha descrito el papel que desempeñan las MNT en población pediátrica como posible factor de discordancia entre las técnicas in vitro y la PT17,42.
Áreas de desarrollo en el futuroUno de los posibles retos en el campo de las técnicas basadas en la detección de IFN-γ, sería una mejora en su sensibilidad sin que se observase una disminución en la especificidad, y al mismo tiempo, una reducción de resultados indeterminados. En este sentido, recientemente se han estudiado nuevos biomarcadores en el diagnóstico de la infección tuberculosa y la TB activa, que podrían incluir la utilización de nuevos antígenos43,44 y la detección de múltiples citocinas45–47 en nuevas generaciones de estas técnicas in vitro.
ConclusionesEn resumen, las técnicas in vitro de diagnóstico de la infección tuberculosa se muestran como una alternativa a la tuberculina, ya que presentan una mayor especificidad y sensibilidad, al no verse afectadas por la vacuna BCG ni por la sensibilización previa por MNT; y además, por estar menos afectadas por los tratamientos inmunosupresores. Aunque por el momento, priorizando la seguridad, en los pacientes con psoriasis candidatos a iniciar tratamientos anti-TNF-α resulta adecuado recomendar la determinación conjunta de ambas técnicas, dado que estas técnicas están demostrando un elevado valor predictivo negativo, es probable que a corto-medio plazo nos podamos plantear su utilización sin necesidad de combinarla con la tuberculina. Sin duda son necesarios más estudios que nos permitan tener un mejor conocimiento de estas técnicas y nos permitan diseñar estrategias personalizadas en el seguimiento de cada paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste artículo ha sido financiado por el Fondo de Investigaciones Sanitarias (PI: 10/00214). J. Domínguez es investigador financiado por el programa Miguel Servet del Instituto de Salud Carlos iii.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.