El síndrome de Nelson (SN) supone una causa infrecuente de hiperpigmentación mucocutánea generalizada, cuyas manifestaciones clínicas se derivan de la secreción excesiva de corticotropina por un adenoma hipofisario secundario a la realización de una suprarrenalectomía bilateral terapéutica. Debido a que esta intervención quirúrgica ha caído en desuso en la actualidad, su presentación es hoy sumamente rara y poco reconocible. Presentamos un caso muy grave de hiperpigmentación generalizada por SN en una paciente de 37 años.
Nelson syndrome is a rare cause of generalized mucocutaneous hyperpigmentation. Its clinical manifestations are due to excessive secretion of adrenocorticotropic hormone from a pituitary adenoma, which develops after bilateral therapeutic adrenalectomy. As this operation has fallen into disuse, Nelson syndrome is now extremely rare and difficult to recognize. We present a very severe case of generalized hyperpigmentation due to Nelson syndrome in a 37-year-old woman.
El síndrome de Nelson (SN) engloba el conjunto de manifestaciones clínicas derivadas de la secreción exagerada de corticotropina (ACTH, adrenocorticotropic hormone) por un adenoma hipofisario desarrollado tras la realización de una suprarrenalectomía bilateral terapéutica (SBT) como tratamiento de la enfermedad de Cushing3,4. Nelson describió el primer caso de esta entidad en 19581,2, y supone una causa muy infrecuente de hiperpigmentación cutánea generalizada.
Clínicamente, se caracteriza por una hiperpigmentación de la piel y las mucosas producida por la hormona estimulante de los melanocitos (MSH, melanocyte-stimulating hormone) tipo α. La elevación de los niveles de esta hormona y de la ACTH ocurre simultáneamente, ya que ambas derivan de un péptido precursor común denominado proopiomelanocortina (POMC).
Como la suprarrenalectomía bilateral es la última opción terapéutica en pacientes con enfermedad de Cushing que no han respondido a otras medidas, el SN es hoy una entidad rara5,17. Se describe un caso excepcional y muy grave de SN en una mujer de 37 años.
Caso clínicoSe trata de una mujer caucásica de 37 años de edad que se envió a nuestras consultas debido a un aumento generalizado, progresivo y muy acusado de la pigmentación cutánea y mucosa, hasta el punto de aparentar ser una persona de raza negra. No existían antecedentes personales ni familiares de interés.
Inició a los 27 años con un cuadro de cefalea intensa y diplopía atribuido, tras estudio, a la apoplejía de un macroadenoma hipofisario. Tras una hipofisiectomía transesfenoidal la paciente mantuvo niveles hormonales normales y como única clínica destacó una amenorrea secundaria de origen hipofisario.
A los 30 años de edad se le realizó un tratamiento de fertilidad, y desarrolló un síndrome de Cushing muy evidente con hiperglucemia, hipertensión arterial y fenotipo característico. Los niveles de ACTH aumentaron al mismo tiempo (1.000pg/ml). Se realizó un cateterismo de los senos petrosos que determinó que la secreción anómala de ACTH era de origen hipofisario, y se confirmó el diagnóstico de enfermedad de Cushing.
El servicio de Neurocirugía desestimó la reintervención quirúrgica, y los intentos terapéuticos mediante radioterapia estereotáctica o tratamiento hormonal sustitutivo fueron en vano a la hora de controlar la secreción exagerada de ACTH por parte del tumor.
A la edad de 31 años se optó por realizar una SBT para eliminar el efecto de la ACTH sobre las glándulas suprarrenales. Desapareció la clínica propia de la enfermedad de Cushing de forma progresiva y aumentaron los niveles de ACTH (1.500–1.800pg/ml).
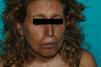
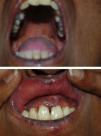
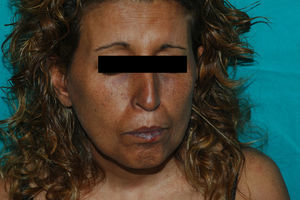
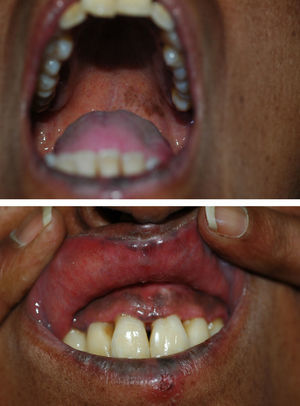
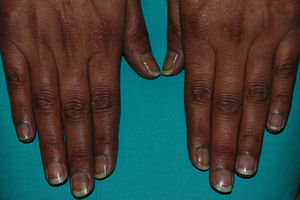
Dos meses después de la SBT, comenzó la clínica propia del SN. A la exploración física se evidenciaba una hiperpigmentación generalizada muy intensa, aún más acusada en áreas fotoexpuestas, como la cara, los brazos y la región del escote (fig. 1). Además, presentaba una coloración pardonegruzca en todas las mucosas, y era más llamativa en la semimucosa labial, las encías y el paladar duro, donde incluso aparecieron máculas marronáceas independientes (fig. 2). También había pigmentación ungueal (fig. 3).
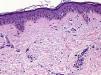
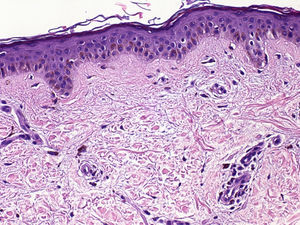
Se realizó una biopsia escisional de la zona abdominal que mostraba, al estudio histopatológico, hiperpigmentación basal acentuada y presencia de abundantes melanófagos dérmicos (fig. 4).
Al tratamiento hormonal sustitutivo con hidrocortisona (20mg/12h), levotiroxina (50μg/24h), cabergolina (2mg/7 días) y lantreótido (120mg/mes), se añadió entonces una fotoprotección solar extrema adecuada y cápsulas de ácido azelaico (AA) (500mg/8h). A los 7 meses de tratamiento, la paciente experimentó una discreta disminución de la hiperpigmentación generalizada. A pesar del tratamiento hormonal sustitutivo y de las sesiones de radioterapia estereotáctica hipofisaria que se le han realizado, los niveles de ACTH se mantuvieron en cifras superiores a 1.000pg/ml y, como consecuencia, la MSH permaneció elevada.
DiscusiónEl SN es una entidad extremadamente infrecuente (con una incidencia entre el 8 y el 42% de los pacientes suprarrenalectomizados5,7) debido a que la suprarrenalectomía bilateral se practica hoy sólo en contadas ocasiones. Es más frecuente en mujeres en la tercera y en la cuarta décadas de la vida6. El SN suele ocurrir entre uno y 4 años después de la SBT8,3, y se trata de una enfermedad originada por yatrogenia.
Supone una causa poco común de hiperpigmentación difusa de la piel y es necesario hacer el diagnóstico diferencial con otras entidades que provocan una clínica cutánea similar, especialmente con aquellas que tienen implicación hormonal (tabla 1).
Hiperpigmentación cutánea difusa: diagnóstico diferencial
| Clínica cutánea | Clínica sistémica | Tipo de pigmento | Localización histológica | Laboratorio | |
| Enfermedad de Addison | Pigmentación generalizada. Acentuada en zonas fotoexpuestas, pliegues palmoplantares, mucosas, uñas, cicatrices recientes y áreas de roce. En ocasiones vitiligo o alopecia areata | Anorexia. Pérdida de peso. Hipotensión ortostática. Dolor abdominal | Melanina | ↑Melanina en capa basal de la epidermis. Melanófagos en la dermis superficial | ↓Cortisol plasmático.↑ACTH. ↑MSH. Hipoglucemia. Hiponatremia. Hiperpotasemia |
| Enfermedad de Cushing | Similar a enfermedad de Addison pero menos acentuada. Atrofia cutánea. Estrías. Hipertricosis | Obesidad, hipertensión, osteoporosis, atrofia muscular e hipogonadismo | Melanina | Sin aumento de melanocitos. ↑Melanina en capa basal de la epidermis. Melanófagos en la dermis superficial | ↑Cortisol plasmático. ↑ACTH. ↑MSH. Hiperglucemia |
| Síndrome de Nelson | Similar a enfermedad de Addison pero más acentuada | Ausente debido al tratamiento hormonal sustitutivo | Melanina | Sin aumento de melanocitos. ↑Melanina en capa basal de la epidermis. Melanófagos en la dermis superficial | ↓Cortisol plasmático. ↑↑ACTH. ↑↑MSH. Hipoglucemia. Hiponatremia. Hiperpotasemia |
| Hipertiroidismo (enfermedad de Graves) | Similar a enfermedad de Addison pero menos acentuada y en fototipos altos. Piel caliente y húmeda. Alopecia difusa | Pérdida de peso. Ansiedad. Debilidad. Intolerancia al calor | Melanina. | Sin aumento de melanocitos. | ↑T3 y T4 ↓TSH |
| Hemocromatosis | Pigmentación grisácea. Rara afectación de las mucosas. Sin relación con fotoexposición | Pérdida de peso. Cirrosis hepática. Diabetes mellitus. Hipogonadismo | Hemosiderina | Depósitos en capa basal, macrófagos dérmicos y matriz extracelular en la dermis | |
ACTH: adrenocorticotropic hormone ‘corticotropina’; MSH: melanocyte-stimulating hormone ‘hormona estimulante de los melanocitos’; T3: triiodotironina; T4: tiroxina; TSH: thyroid-stimulating hormone ‘tirotropina’.
Su fisiopatología está bien identificada. La ACTH deriva de la POMC, que se produce en la hipófisis por la estimulación realizada sobre esta glándula por la hormona liberadora de corticotropina (CRH, corticotropin-releasing hormone) hipotalámica. Es un péptido precursor común, además, de la MSH, la hormona beta-lipotropina y la beta-endorfina 179. Al aumentar la POMC, también lo hacen todas las hormonas derivadas y, por tanto, sus efectos sobre la piel. Tanto la ACTH como la MSH (α, β y γ) incrementan la melanogénesis en los humanos. La ACTH, por contener en su molécula la secuencia de aminoácidos de la MSH, estimula la pigmentación cutánea. La MSH tipo α realiza su mecanismo de acción al unirse a los receptores de la membrana de los melanocitos, y su función biológica consiste en estimular el crecimiento y la proliferación de los melanocitos, a la vez que favorece la síntesis de melanina y la dispersión de sus gránulos, y aumenta así la pigmentación. Las otras melanocortinas, MSH tipos β y γ, poseen actividad melánica mucho más débil que la MSH tipo α.
Previamente a la SBT, el cortisol producido por las glándulas suprarrenales realiza una función supresora sobre la secreción de la CRH hipotalámica y, consecuentemente, sobre la de ACTH por la hipófisis, lo que mantiene los niveles séricos de esta hormona y de sus péptidos precursores dentro de los límites de la normalidad o ligeramente aumentados10. Al eliminarse la secreción suprarrenal mediante la cirugía, se elimina también este efecto inhibidor sobre el hipotálamo y la hipófisis, y aumentan tanto la CRH y la ACTH como sus efectos. El resultado será una hiperpigmentación generalizada y evidente del paciente no limitada a zonas fotoexpuestas, aunque será más intensa en éstas. El grado de pigmentación dependerá de los niveles de MSH tipo α y de la raza del paciente. Es importante resaltar que la hiperpigmentación tarda en aparecer y que va a estar presente tan sólo en el 42% de los casos de las series actuales7. Son características la pigmentación lineal desde el pubis al ombligo (linea nigra) y la pigmentación exagerada de las aréolas mamarias, la mucosa gingival, la superficie de extensión de los miembros y la de las cicatrices previas.
El diagnóstico se basa en la clínica cutánea, los niveles séricos elevados de ACTH y las pruebas de imagen. Los niveles de ACTH superiores a 200pg/ml se consideran diagnósticos de SN11,12.
El tratamiento actualmente es muy diverso. Como las modernas técnicas de imagen y de medición de niveles de ACTH detectan de forma temprana adenomas de tamaño pequeño, la cirugía va a suponer el primer escalón terapéutico y a la vez el más efectivo. Ya sea vía transesfenoidal o por craneotomía, su éxito dependerá del tamaño tumoral y de su extensión a estructuras vecinas (parénquima cerebral, aparato óptico, etc.). La desaparición completa del tumor con recuperación de la pigmentación normal en la mayoría de los casos se consigue en el 70–80% de las intervenciones7. Un tipo de radiocirugía estereotáctica llamada “gamma knife” ha demostrado éxito en adenomas hipofisarios refractarios a otras técnicas quirúrgicas. La radioterapia transesfenoidal también ha revelado su utilidad en el tratamiento de pacientes que tenían contraindicada la cirugía11,13. El tratamiento farmacológico eficaz no existe. Se han utilizado fármacos para disminuir los niveles plasmáticos de ACTH, como los agonistas de la dopamina (bromocriptina y cabergolina) y los análogos de la somatostatina14,15 (octeótrido y lanreótido), para reducir el tamaño tumoral, como el ácido valproico14 o la rosiglitazona, y para no alterar el ritmo circadiano16, como la hidrocortisona en 4 tomas.
El tratamiento estrictamente dermatológico es desesperanzador. En nuestro caso se optó por la administración de AA (500mg cada 8 h) por existir antecedentes de su uso en la literatura médica18,19. El AA es un ácido dicarboxílico de 9 átomos de carbono que se obtiene por la oxidación del ácido oleico con ácido nítrico. Se ha empleado en el tratamiento de los trastornos de la hiperpigmentación desde que el fármaco demostró ser, in vitro, un inhibidor competitivo de la tirosinasa, la enzima fundamental en la melanogénesis. Tiene la ventaja de carecer de toxicidad. Se ha utilizado de forma tópica y oral en diferentes entidades hiperpigmentarias, como el melasma, el lentigo maligno o el melanoma20. En nuestra paciente ha sido el único tratamiento que ha demostrado eficacia en la reducción de la pigmentación del SN sin presentar, hasta el momento, ningún tipo de efecto secundario, por lo que proponemos su consideración en estos casos y en otros cuadros de hiperpigmentación cutánea generalizada.
Conflicto de interesesDeclaramos no tener ningún conflicto de intereses.