La rosácea fulminans (RF) es una dermatosis facial grave caracterizada por la aparición súbita de pápulas, pústulas y nódulos. El embarazo se ha descrito como un posible desencadenante. Cuando se presenta en pacientes embarazadas, si no se diagnostican y tratan de forma precoz, puede presentar complicaciones graves. Aportamos un nuevo caso de RF en una paciente embarazada y analizamos las características epidemiológicas y terapéuticas y las complicaciones graves descritas en este grupo de pacientes.
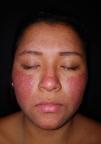
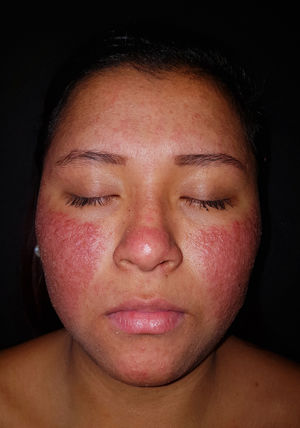
Una mujer de 20 años, gestante de 14 semanas, sin antecedentes patológicos, consultó por un brote de pústulas extensas sobre una base eritemato-edematosa, sin comedones, localizadas en las regiones malares y la frente (fig. 1) y acompañadas de febrícula. No presentaba lesiones acneiformes en otras localizaciones. Negaba la introducción de fármacos nuevos o de una fotoexposición reciente. El cultivo bacteriano de las pústulas resultó negativo y la analítica no presentaba alteraciones significativas.
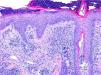
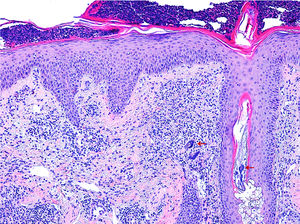
La histología (fig. 2) mostró una epidermis hiperplásica de aspecto reactivo, con colección de neutrófilos intracórneos y una dilatación infundibular del folículo piloso. En la dermis, destacaba la presencia de una ectasia vascular y de un infiltrado linfohistiocitario. También se objetivaron abundantes Demodex folliculorum. Estos hallazgos junto a la clínica fueron compatibles con una rosácea fulminans. Se administraron eritromicina 500mg/8h durante 3semanas junto con hidrocortisona y metronidazol tópicos. Posteriormente, se mantuvo el metronidazol tópico durante 3 meses, con lo que se obtuvo una resolución prácticamente completa de las lesiones.
Hasta la fecha, hemos hallado en la literatura 21 casos de rosácea fulminans en relación con el embarazo (tabla 1)1-13. La mediana de edad es de 31 años (rango 20-38 años) y la mayoría de los casos fueron diagnosticadas durante el primer trimestre de gestación (43%) por la aparición de las lesiones de unas pocas semanas de evolución. El 32% refería antecedentes de rosácea previa al embarazo. El uso de antibióticos por vía oral fue el tratamiento más extendido (95%); entre ellos, los macrólidos fueron de primera elección en el 68% de las pacientes. En un tercio de las pacientes (32%), además, se administraron corticoides sistémicos con una pauta descendente posterior. Un 18% requirió isotretinoína tras el parto por la ausencia de respuesta al tratamiento previo. En un 68% se administró tratamiento tópico, principalmente metronidazol, clindamicina o eritromicina. Entre las complicaciones graves descritas, existe un caso de muerte fetal por los efectos adversos de los corticoides (insuficiencia suprarrenal secundaria)5, un aborto voluntario por un síndrome ansioso-depresivo mayor8 y un caso de perforación ocular bilateral que requirió de un trasplante de córnea9. No se han comunicado casos de recidiva en embarazos posteriores.
Características epidemiológicas, terapéuticas y complicaciones de los casos descritos de rosácea fulminans en contexto del embarazo
| Caso | Edad | Tiempo de evolución | Momento del diagnóstico | Rosácea previa | Tratamiento | Evolución/complicaciones | Referencia |
|---|---|---|---|---|---|---|---|
| 1-5 | ND | ND | 3.er trimestre o posparto | ND | Antibiótico oral y tópicoa | ND | Massa y Su (1982) |
| 6 | 25 | Brusco | 2.° trimestre (16 semanas) | Sí | Triamcinolona intralesional, eritromicina oral 250 mg/6 h, drenaje, hidrocortisona tópica, posteriormente prednisona 60 mg/díab. Tras el parto, isotretinoína 40 mg/12 h por 20 semanas | Sin mejoría hasta finalizar el embarazo e iniciar retinoides | Marks y Briggaman (1987) |
| 7 | 23 | 4 semanas | 1.er trimestre | Sí | Eritromicina y clindamicina tópicaa | ND | Plewig et al. (1992) |
| 8 | 33 | 2 meses | 3.er trimestre | Sí | Eritromicina y clindamicina tópicaa | ND | Plewig et al. (1992) |
| 9 | 25 | 2 meses | 1.er trimestre | Sí | Eritromicina y clindamicina tópicaa | ND | Plewig et al. (1992) |
| 10 | 26 | 6 semanas | Posparto | No | Eritromicina y clindamicina tópicaa | ND | Plewig et al. (1992) |
| 11 | 35 | ND | ND | Sí | ND | Tomaba metotrexato al desarrollar RF. Presentó un brote al quedarse embarazada | Haugstved y Bjerke (1998) |
| 12 | 28 | Posparto | 1.er trimestre (12 semanas) | Sí | Eritromicina 500 mg/8 h y prednisolona 35 mg/día con posterior mantenimiento a 20 mg | Diabetes gestacional en probable relación con corticoterapia, insuficiencia placentaria y muerte fetal (insuficiencia suprarrenal secundaria) | Lewis et al. (2004) y detallado en Jarrett et al. (2010) |
| 13 | 31 | 3 semanas | 1.er trimestre (8 semanas) | Sí | Metilprednisolona 40 mg/díab, ácido fusídico, drenaje (1.er trimestre) y metronidazol tópico 0,75% (2.° trimestre) | Buena respuesta | Ferahbas et al. (2006) |
| 14 | 32 | ND | 1.er trimestre (3 semanas) | No | Macrólido oral y tópico, amoxicilina oral, metronidazol tópico. Tras el parto isotretinoína 0,5 mg/kg/día iniciado 3 meses | Embarazo mediante FIV y estimulación hormonal. Sin mejoría hasta finalizar el embarazo e iniciar retinoides | Cisse et al. (2008) |
| 15 | 35 | 4 semanas | 1.er trimestre | No | Prednisolona 30 mg/día, eritromicina 2 g/día. Tras el aborto, isotretinoína 40 mg/día | Aborto voluntario a las 12 semanas en contexto de síndrome ansioso-depresivo por las lesiones. Resolución al iniciar isotretinoína | Jarrett et al. (2010) |
| 16 | 31 | 2 meses | 1.er trimestre (8 semanas) | No | Eritromicina 2 g/día. Tras el parto, prednisona 20 mg/día e isotretinoína 40 mg/día | Mejoría parcial. Resolución tras isotretinoína más prednisona en el posparto | Jarrett et al. (2010) |
| 17 | 26 | 5 meses | 2.° trimestre (21 semanas) | ND | Eritromicina 2 g/día y prednisolona 40 mg/día | Blefaritis y queratitis con perforación ocular bilateral severa, necesidad de trasplante de córnea | De Morais e Silva FA et al. (2011) |
| 18 | 33 | 3 semanas | 1.er trimestre (11 semanas) | No | Azitromicina 500 mg/día 3 días a la semana durante un mes con reducción paulatina hasta 12 semanas (250 mg/día, 3 días/semana durante un mes, luego 500 mg/semana durante un mes) y metronidazol tópico | Rápida respuesta | Fuentelsaz et al. (2011) |
| 19 | 38 | Brusco | 2.° trimestre (14 semanas) | No | Eritromicina 500mg 2veces al día | Resolución completa tras unos meses | Haenen et al. (2015) |
| 20 | 37 | ND | 3.er trimestre (37 semanas) | No | Azitromicina y prednisonaa | Resolución completa tras el parto | Markou et al. (2017) |
| 21 | 22 | 4 semanas | 1.er trimestre (6 semanas) | ND | Amoxicilina-ácido clavulánico 1 g/día×10 días, compresas húmedas, ácido fusídico tópico durante un mes | Resolución tras un mes al acabar el tratamiento | Demir et al. (2018) |
| Caso actual | 20 | 2 semanas | 2.° trimestre (14 semanas) | No | Eritromicina 500 mg/8 h durante 3semanas e hidrocortisona y metronidazol tópico durante 3 meses | Rápida respuesta. Resolución completa a los 3 meses |
FIV: fecundación in vitro; ND: no disponible.
La RF es una dermatosis facial grave de etiología incierta. Los cambios hormonales producidos en el embarazo podrían ser uno de sus desencadenantes. En gestantes, se ha descrito la presentación con lesiones muy extensas, afectación ocular profunda e irreversible9 y un caso de trastorno psiquiátrico desencadenado por la apariencia de las lesiones8. Dado el grado de afectación de la RF, requiere de tratamientos sistémicos con frecuencia. Sin embargo, los fármacos habitualmente empleados, como los retinoides y tetraciclinas, están contraindicados en mujeres gestantes. Por ello, se considera que los macrólidos orales, como la eritromicina y la azitromicina, son la opción más segura y efectiva en esta situación. Existe más evidencia con el tratamiento con eritromicina, aunque la efectividad de la azitromicina en la rosácea también ha sido evaluada con buenos resultados, incluso con una posología más cómoda y menos efectos adversos10. Es recomendable asociar también tratamiento un antibiótico tópico por su efecto antiinflamatorio. Los corticoides sistémicos pueden llegar a ser necesarios, pero pueden producir un retraso del crecimiento intrauterino, una diabetes gestacional o una hipertensión, así como una insuficiencia suprarrenal secundaria que puede conllevar a la muerte fetal5,8.
En consideración a los casos revisados, planteamos el siguiente abordaje terapéutico: de primera línea, los macrólidos orales junto a clindamicina o metronidazol tópicos y de segunda línea, la adición al tratamiento previo de corticoides tópicos y sistémicos (dosis hasta 0,5mg/kg/día).
En conclusión, la rosácea fulminans es una enfermedad cutánea grave que puede desarrollarse durante el embarazo. Es necesario diagnosticar a estas pacientes de forma precoz para así evitar el desarrollo de lesiones extensas. De esta manera, también reducimos las complicaciones potencialmente graves al disminuir la necesidad de tratamiento con corticoides sistémicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.