Entre un 10 y un 35 % de todos los melanomas presentan regresión histológica, es decir, un área en el seno del melanoma en el que el tumor disminuye o desaparece y es sustituido progresivamente por fibrosis, con cantidades variables de melanófagos, inflamación y neovascularización. Aunque mayoritariamente se considera la presencia de regresión como un factor de mal pronóstico en el melanoma, existen varios trabajos que contradicen esta idea.
En esta revisión resumimos los principales artículos publicados sobre la influencia de la regresión en el pronóstico del melanoma y encontramos resultados muy dispares, de modo que el significado pronóstico de la regresión en el melanoma es, a la vista de los trabajos publicados, cuando menos controvertido. Pensamos que parte de las diferencias encontradas se pueden deber a la disparidad en cuanto a los criterios utilizados para definir la regresión, y por ello proponemos unos criterios histológicos que aclaren los conceptos de regresión temprana y establecida.
Between 10 % and 35 % of all melanomas show histological regression. That is, there is an area within the melanoma where the tumor retreats or disappears to be progressively replaced by fibrosis with presence of melanophages and variable degrees of inflammation, and neovascularization. Such regression is generally considered an indicator of poor prognosis in melanoma, although a number of studies contradict this affirmation.
In this review, we summarize the leading articles about the influence of regression on melanoma prognosis. The results of these studies are very inconsistent, and so the prognostic significance of regression is somewhat controversial. We believe that some of these differences can be explained by differing criteria for regression and so we propose clear histological criteria to define early and sustained regression.
Entre un 10 y un 35 % de todos los melanomas primarios cutáneos muestran regresión histológica 1, es decir, un área en el seno del melanoma en el que de forma espontánea la porción dérmica de éste disminuye o desaparece, y es sustituida progresivamente por un estroma fibroso, sin melanocitos tumorales o escasos, pero con melanófagos, linfocitos y vasos neoformados. En las fases iniciales de la regresión predomina la inflamación, de modo que abundantes linfocitos, y a veces también células plasmáticas, infiltran el melanoma de modo no uniforme. En esta fase de la regresión aún no se aprecia fibrosis, pero sí pueden aparecer ya melanófagos, y la capa basal de la epidermis suele estar vacuolada, a veces con grietas dermo-epidérmicas, y no es raro encontrar queratinocitos o melanocitos degenerados que aparecen como pequeños glóbulos eosinófilos (o cuerpos de Civatte) en la base de las crestas epidérmicas. Habitualmente, en las fases tardías, el área de regresión muestra una epidermis atrófica suprayacente que ha perdido su red de crestas y que contiene ocasionalmente algunos melanocitos no atípicos supervivientes o incluso una hiperplasia melanocítica. Puede apreciarse en ocasiones algún melanocito atípico residual en la unión. Raramente la epidermis puede aparecer hiperplásica, con hiperqueratosis e hipergranulosis. La dermis papilar en estas fases tardías se encuentra ocupada por una fibrosis evidente, con distintos grados de edema, neovascularización o vasos dilatados, melanófagos y algunos linfocitos acompañantes.
Clínicamente la regresión se aprecia como áreas de despigmentación en el interior o en la periferia del melanoma y se manifiesta con colores que varían entre blanco, rojizo, azulado y gris. La regresión suele afectar a melanomas de pacientes adultos o ancianos y es extremadamente rara en los jóvenes.
El significado pronóstico de la presencia de regresión histopatológica en un melanoma es un tema controvertido. Clásicamente se suele considerar que la regresión implica un peor pronóstico, ya que no se puede descartar que el grosor inicial del melanoma en el área regresada fuera superior al que indica el índice de Breslow medible en el melanoma restante 2. Sin embargo, en la práctica observamos que la regresión sólo afecta a melanomas delgados 3–5. Y, aunque se podría hipotetizar que ésta es la que los ha hecho adelgazar, parece que es poco probable, ya que es excepcional encontrar regresión en un melanoma nodular 5.
Por otro lado, también es posible que la regresión represente una respuesta inmune del paciente contra el tumor primario, en cuyo caso de este hecho se derivaría un cierto efecto protector para el paciente 6. En la práctica, la idea más aceptada es que la regresión histológica es un parámetro de mal pronóstico. Así, aunque en la mayoría de hospitales se indica la realización de ganglio centinela en melanomas con un índice de Breslow de 1 mm o superior, muchos centros extienden este procedimiento a aquellos melanomas con regresión histológica evidente, aunque su Breslow no alcance 1 mm. Sin embargo, existe una gran controversia en la actualidad sobre la extensión y características que deben exigirse a la regresión para que ésta se considere relevante (algunos autores mencionan que debe existir una regresión completa del componente dérmico en el 50 %, o incluso en dos tercios de la superficie horizontal del melanoma).
Significado pronóstico de la regresiónEn la actualidad se ha demostrado que el estado del ganglio centinela de un melanoma es el factor pronóstico más importante en los melanomas localizados 7,8. En un trabajo realizado en nuestro Servicio 9 estudiamos la relación entre la presencia o ausencia de metástasis en los ganglios centinelas con las características clinicopatológicas de los melanomas primarios. De forma inesperada, en nuestra serie la regresión y el infiltrado linfocitario denso se encontraban con más frecuencia en los melanomas sin metástasis en el ganglio centinela, de tal manera que ambos parámetros parecían actuar como factores «protectores». Aunque estas diferencias eran estadísticamente significativas en el estudio univariado, la significación se perdía en el análisis multivariado, en donde sólo el Breslow y el índice mitótico mantenían la significación estadística. De todas formas, debemos reconocer que pueden existir factores de confusión en relación con este resultado, ya que quizás haya más ganglios centinelas negativos en el grupo con regresión, en parte debido a que se incluyan para el estudio de ganglio centinela melanomas con un Breslow inferior a 1 mm por el hecho de tener regresión, es decir, melanomas delgados en los que de otro modo no se realizaría ganglio centinela. De todos modos, nuestros resultados nos hicieron cuestionarnos los criterios que habíamos utilizado para definir la regresión por un lado, pero por otro nos empujaron a preguntarnos también sobre la verosimilitud del mal pronóstico asociado a la presencia de regresión. Ello nos llevó a revisar la literatura para intentar buscar unos criterios histopatológicos fiables de regresión en el melanoma, y también para conocer la implicación de la presencia de regresión en cuanto al pronóstico basándonos en estudios reales, y no en intuiciones o especulaciones. Para ello seleccionamos los estudios que incluían una clara definición histológica de la regresión, con series de pacientes considerables y en los que se realizara una relación con el pronóstico (ver más adelante).
En este sentido, el estudio más destacable es el de Morris et al, quienes revisaron una serie de 1.349 melanomas cutáneos localizados, de los cuales 931 fueron sometidos a estudio del ganglio centinela 10. En éste definieron la regresión como la sustitución del tumor primario por un estroma fibroso o edematoso, hipervascularizado y con grados variables de inflamación, e incluyeron tanto los casos con regresión de menos del 50 % de la anchura total del melanoma, que denominaron regresión parcial, como los casos del 50 % o más, que denominaron regresión extensa. Ellos encontraron que el ganglio centinela era positivo más frecuentemente en los casos sin regresión (18 %) que en aquellos con regresión (10 %). Incluso cuando estratificaron sus pacientes en función del índice de Breslow no hallaron mayor riesgo de encontrar un ganglio centinela positivo en el grupo de los melanomas con regresión que en los que no la presentaban. Por otro lado, observaron que el porcentaje de recaídas en los melanomas delgados (de menos de 1 mm de Breslow) fue superior en el grupo sin regresión (6 %) que en el que sí la presentaba (1 %). La única limitación en cuanto a la interpretación de los resultados de este estudio es el pequeño número de pacientes —sólo 13— con regresión extensa, es decir en más del 50 % de la extensión horizontal del melanoma. Un estudio previo similar a éste, aunque con un número menor de pacientes, fue el de Fontaine et al 11, que estudiaron las características histológicas de 97 melanomas de los que tenían estudio del ganglio centinela. Estos autores tampoco encontraron evidencia de un riesgo incrementado de metástasis en el ganglio centinela en sus pacientes con regresión con respecto a los que no la presentaban (encontraron un 29 % de positividades en el ganglio centinela en ambos grupos). Otro estudio más reciente en la misma línea es el de Kaur et al 12, con una definición mucho más detallada de los rasgos histológicos de la regresión que los dos previos, en el que ésta se divide en tres fases (primera: con disminución del melanoma dérmico; segunda: con desaparición del melanoma dérmico y persistencia del componente juntural; y tercera: con desaparición del melanoma dérmico y epidérmico). En este trabajo estudian un grupo de 146 melanomas de los cuales conocen el estado del ganglio centinela, incluyendo aquellos con un grosor de Breslow superior a 1 mm, con un nivel IV de Clark o con presencia de regresión. Encuentran 17 ganglios centinelas positivos, de los cuales 13 corresponden a casos sin regresión y 4 a casos con regresión. Los autores concluyen que la regresión es un factor de probable buen pronóstico en el melanoma. Por el contrario, Oláh et al 2 recogieron un total de 134 pacientes con melanomas de 2 mm o menos de índice Breslow a los que les habían realizado estudio del ganglio centinela y observaron un riesgo muy superior de metástasis en el ganglio centinela en su grupo de melanomas con regresión (64 %) que en aquellos sin regresión (15 %). Es decir, encontraron que la presencia de regresión se asociaba a un riesgo mucho más elevado de desarrollar metástasis en el ganglio centinela, y concluyeron que los melanomas delgados con presencia de regresión histológica deberían considerarse como susceptibles de realización del ganglio centinela, contradiciendo los resultados de los tres artículos previamente comentados.
Por otro lado, previamente a la generalización del estudio del ganglio centinela en el melanoma, se realizaron también otro tipo de trabajos que estudiaron la posible asociación entre la presencia de regresión histológica y el potencial metastático en general y la supervivencia. Se trata esencialmente de estudios de series de melanomas delgados, pero que incluyen un porcentaje de casos metastáticos o letales. Los autores en general buscan factores clínicos o histopatológicos, o ambos, que se asocien a mal pronóstico y que, por tanto, permitan reconocer un subgrupo de pacientes de riesgo elevado dentro de los melanomas delgados. Así, Gromet et al 13 observaron que el 22 % de sus melanomas delgados —con índice de Breslow menor de 0,76 mm o nivel de Clark II— con regresión (5 de 23) metastatizaron, frente a un 2 % de metástasis en sus casos sin regresión (2 de 98), de modo que tales diferencias resultaron estadísticamente significativas. Resultados similares encontraron Guitar et al 14 en un estudio más reciente en el que compararon 43 melanomas delgados con metástasis con 42 melanomas controles sin metástasis y de similares características en cuanto a la edad, el sexo, la localización y el índice de Breslow. En este caso el 42 % de los melanomas metastáticos mostraba regresión extensa (> 50 %), mientras que sólo un 7 % de los mismos presentaba regresión parcial (< 50 %). Sólo encontraron regresión extensa en un 5 % de los melanomas no metastáticos. Slingluff et al 15 revisaron una serie de 681 melanomas con índice de Breslow menor de 0,76 mm en búsqueda de factores clínicos e histopatológicos de mal pronóstico. Observaron que el 40 % de los casos que metastatizaron mostraban regresión histológica «grave» (que definen como presencia de fibrosis marcada con ausencia casi total o total de melanocitos) frente a un 17 % de los casos no metastásicos. Y por otro lado, en el subgrupo de pacientes que les remitían sin metástasis (siempre con índice de Breslow menor de 0,76 mm) observaron que el porcentaje de supervivencia libre de enfermedad a 5 años era del 72 % en el grupo con regresión grave, frente a un 94 % en el grupo sin regresión o con regresión leve o moderada (que definen como inflamación aislada sin fibrosis o con discreta fibrosis en la dermis papilar, respectivamente). También Ronan et al 16 encuentran asociación entre regresión y mal pronóstico en una serie de 103 melanomas de índice de Breslow inferior a 0,76 mm. En este estudio le dan especial importancia al porcentaje que supone el área de la regresión con respecto al total del melanoma, ya que en su serie, de los 30 pacientes que muestran regresión sólo en 7 ésta afecta a más del 77 % del melanoma y 6 de ellos fallecen. Estos autores incluyen como regresión tanto formas inflamatorias como cicatriciales y sólo excluyen los casos con infiltrados linfocitarios sin evidencia de destrucción de melanocitos. Clark et al 17 elaboraron un modelo de predicción de supervivencia para melanomas en estadio I y encontraron que la presencia de regresión es un factor predictivo de mal pronóstico, de modo que en 90 melanomas con regresión la supervivencia a 8 años fue del 60 frente a un 77 % en 174 melanomas sin regresión. Por último, Blessing et al 18 compararon melanomas delgados (< 1,5 mm) de pacientes que habían desarrollado metástasis y/o habían fallecido, con melanomas delgados libres de enfermedad a los 6 años (controles). Ellos encontraron que 13 de los 26 casos metastásicos o fallecidos mostraban regresión frente a uno de los 40 controles, de modo que concluyen que la regresión es un factor de mal pronóstico en el melanoma.
Por el contrario, otros autores no han encontrado una relación estadísticamente significativa entre la presencia de regresión y el pronóstico del melanoma. Kelly et al 19 estudiaron la supervivencia de un total de 844 pacientes con melanoma que estratificaron en tres grupos según el índice de Breslow (menor de 0,76 mm, entre 0,76 y 1,5 mm y mayor de 1,5 mm). Pese a que la supervivencia a 5 años fue discretamente inferior en los casos con regresión en los tres grupos, las diferencias no alcanzaron significación estadística. Además las diferencias, según ellos, serían atribuibles a las divergencias en cuanto al sexo y a la localización del melanoma, ya que encontraron asociación estadísticamente significativa entre la presencia de regresión y el sexo masculino y la localización en el tronco. Este estudio, además, puso en duda los resultados del trabajo previo de Gromet et al 13, ya que reevaluó el mismo grupo de pacientes (Melanoma Clinic de la Universidad de California, en San Francisco) 7 años más tarde, y además amplió el número de sujetos estudiado, así como el tiempo medio de seguimiento, de modo que el porcentaje de metástasis en el grupo de melanomas delgados con regresión caía ahora al 7,2 % (era del 21,7 % en el estudio de Gromet et al) y ascendía en el grupo sin regresión al 3,8 % (era del 2 % en el estudio previo). Resultados similares obtuvieron McGovern et al 20, que revisaron 353 pacientes con melanomas delgados de hasta 0,7 mm de grosor para conocer la influencia de la presencia o ausencia de regresión en el pronóstico de los pacientes. Estos autores incluyeron casos de regresión temprana (inflamatoria) y tardía (o cicatricial), a diferencia de Kelly et al, que sólo incluyeron casos de regresión tardía. Encontraron que los melanomas con regresión metastatizaron con discreta mayor frecuencia que los que no la tenían (8 y 5 % respectivamente), pero la supervivencia a 10 años era en ambos grupos prácticamente idéntica. Además, este trabajo amplía e invalida los resultados de un estudio previo realizado en el mismo centro, en el que sí que se asociaba la presencia de regresión con mal pronóstico, especialmente en varones 21. Brogelli et al 3 estudiaron también la presencia o ausencia de regresión histológica en un grupo de 201 melanomas en estadio I y su posible influencia en el pronóstico, y como McGovern et al incluyeron casos con regresión temprana y tardía. Las diferencias encontradas en cuanto a supervivencia libre de enfermedad y global en los melanomas de menos de 0,76 mm de Breslow no alcanzaron significación estadística, aunque los resultados fueron de tendencia a mejor pronóstico para los casos con regresión. No pudieron evaluar la significación estadística en los melanomas de Breslow mayores de 0,76 mm, por tener en este grupo un número insuficiente de casos con regresión.
No hemos pretendido realizar una revisión sistemática de toda la literatura publicada con respecto al melanoma y a la regresión. De hecho, si realizamos una búsqueda bibliográfica en Pubmed cruzando las palabras «melanoma» y «regresión» obtendremos un total de 2.755 referencias bibliográficas (a fecha de enero de 2009). Hemos seleccionado aquellos trabajos que nos han parecido más interesantes por número de pacientes, atención a la regresión histológica y correlación con el pronóstico. Deliberadamente hemos evitado incluir en esta discusión algunos estudios con series cortas cuyos resultados son poco fiables para establecer consideraciones en cuanto al pronóstico 22,23, aquellos en los que la regresión se valoró sólo clínicamente 24,25 y otros en los que no se aclaró qué se consideraba regresión histológica 26.
En cualquier caso, es evidente que no está clara la relevancia de la regresión en el melanoma en cuanto al pronóstico, al menos con los estudios de los que disponemos hasta la fecha. Incluso, si seleccionamos las series más largas, es decir, las que incluyeron un mayor número de pacientes en los que se estudió la presencia o ausencia de regresión 10,19,20, ésta no puede ser considerada como un factor predictivo de mal pronóstico en el melanoma. Por otro lado, como muchos autores previamente, nos planteamos si las marcadas diferencias encontradas en los distintos estudios en cuanto a la relevancia pronóstica de la regresión pueden ser debidas a las diferencias en cuanto a la definición histológica de regresión; no sólo en relación con los parámetros histológicos exigibles como mínimos para definir la regresión —que como sabemos es un proceso dinámico y, por tanto, con hallazgos histológicos diferentes según la fase en que la estudiemos (ver más adelante)—, sino también con el porcentaje de afectación del melanoma por la regresión medida en su eje horizontal. Cooper et al 23 enfatizaron la falta de homogeneidad en la definición de regresión en los distintos estudios, la criticaron y consideraron que existe un grupo de melanomas en los que se puede hablar de regresión probable o incluso dudosa, que no se recogen en ningún trabajo. Ellos mismos realizaron un estudio de regresión en melanoma en el que consideraron la regresión evidente sólo si había uno o más segmentos bien definidos dentro del melanoma con una reducción marcada o una ausencia completa de melanocitos malignos en la dermis, que eran sustituidos por un grado variable de fibrosis e inflamación. No eran esenciales, pero podían aparecer también incontinentia pigmenti, células malignas degeneradas y telangiectasias, a veces con una marcada reducción o ausencia de los cambios junturales de la epidermis suprayacente a la regresión, en comparación con la epidermis vecina. Aunque sólo estudiaron 48 melanomas de Breslow de 1 mm o menor —por lo que no hemos incluido este estudio en la tabla 1— concluyeron que la regresión no tiene importancia pronóstica en la mayoría de melanomas delgados.
Resumen de estudios sobre la implicación pronóstica de la regresión en el melanoma
| Estudio | Regresión = mal pronóstico | Definición de regresión |
| Kaur et al 12; 146 casos (todos GC) | No (en cuanto a positividad del GC) | 3 fases de regresión (parcial dérmica, total dérmica y dermo-epidérmica. Cualquier extensión) |
| Morris et al 10; 1.349 casos (931 GC) | No (ni en cuanto a positividad del GC ni en cuanto a recurrencias) | Regresión tardía (extensión > o < del 50 %) |
| Fontaine et al 11; 97 casos (todos GC) | No (en cuanto a afectación del GC) | Regresión tardía (no cuantificada) |
| Oláh et al 2; 134 casos (GC). MM < 2 mm | Sí (en cuanto a positividad del GC) | Regresión tardía (sin especificar porcentaje) |
| Guitar et al 14; 85 casos. MM < 1 mm | Sí (en cuanto a la capacidad metastásica) | Regresión tardía (de mal pronóstico la regresión extensa: > 50 %) |
| Brogelli et al 3; 201 casos. MM estadio I | No (en cuanto a supervivencia libre de enfermedad y a supervivencia global) | Regresión precoz o regresión tardía (no cuantificada) |
| Blessing et al 18; 66 casos. MM < 1,5 mm | Sí (capacidad metastásica y supervivencia) | Regresión precoz o tardía (remiten a la definición de McGovern) |
| Clark et al 17; 386 casos. MM estadio I | Sí (en cuanto a supervivencia) | Regresión tardía |
| Slingluff et al 15; 681 casos. MM < 0,76 mm | Sí (capacidad metastásica y supervivencia libre de enfermedad) | Regresión precoz, avanzada y tardía (el mal pronóstico se asocia a la regresión tardía) |
| Ronan et al 16; 103 casos. MM < 0,76 mm | Sí (capacidad metastásica y supervivencia global) | Regresión «temprana», «intermedia» y «tardía (asocian mal pronóstico a un porcentaje de regresión superior al 77 %) |
| Kelly et al 19; 844 casos. MM < 0,76; 0,76-1,5; > 1,5 mm | No (en cuanto a supervivencia) | Regresión tardía (no especifican porcentaje) |
| Gromet et al 13; 121 casos. MM < 0,76 mm | Sí (en cuanto a porcentaje de metástasis) | Regresión tardía |
| McGovern et al 20; 353 casos. MM < 0,7 mm | No (en cuanto a supervivencia) | Regresión precoz (74 % de sus casos) o regresión tardía (26 %) (no especifican extensión) |
GC: ganglio centinela; MM: melanoma maligno.
Kang et al 27 describen tres fases cronológicas sucesivas en la regresión, cada una con rasgos histológicos distintivos. La regresión temprana mostraría una zona de melanoma aún reconocible en la dermis papilar y en la epidermis, con densos infiltrados linfocitarios borrando o sustituyendo algunos nidos de melanocitos. En esta fase, aunque podrían aparecer ya melanocitos degenerados, aún no se apreciaría fibrosis. En la fase de regresión intermedia encontraríamos en una zona de un melanoma aún reconocible una reducción o desaparición parcial del tumor en la dermis papilar y, a veces, en la epidermis suprayacente, remplazada por linfocitos y fibrosis. En esta fase ya se pueden encontrar algunas telangiectasias y melanófagos. Por fin, la fase tardía de la regresión mostraría una zona de reducción marcada de la masa tumoral en un melanoma aún reconocible, o una desaparición completa del tumor en esa zona, reemplazada por una densa fibrosis y grados variables de telangiectasias, melanófagos y escasos o ausentes linfocitos, bajo una epidermis adelgazada. Salvo la fibrosis, los autores no consideran imprescindible ninguno de los otros rasgos histopatológicos para el diagnóstico de esta tercera fase. En este estudio de Kang et al dos dermatopatólogos revisaron 50 casos de melanomas, 44 de ellos con regresión, para evaluar su presencia en un área acotada de cada laminilla de 2 mm y en el resto de la lesión. Estos autores encontraron una concordancia del 96 % en el área acotada y del 90 % en el resto en cuanto a la presencia o ausencia de regresión. Sin embargo, la concordancia disminuyó hasta un 86 y un 66 % respectivamente cuando se dividió la regresión en los tres subgrupos cronológicos descritos. Parece pues poco práctico para estudios dividir la regresión en tantas fases. Para evitar controversias muchos autores sólo incluyen como regresión en sus trabajos la fase más tardía de la misma, y obvian todas las fases inflamatorias previas. Quizás lo más lógico sea dividir la regresión en sólo dos fases, tal como reflejan Massi y LeBoit en su libro de diagnóstico histológico de nevus y melanoma 28. Estos autores reconocen una fase de regresión temprana o inflamatoria que denominan «melanoma en regresión» y una tardía o cicatricial a la que llaman «melanoma regresado». De este modo, se consigue tener en cuenta los melanomas en regresión en etapas precoces, y por otro se evitan excesivas subdivisiones que pueden dificultar la concordancia interobservador. Nuestra propuesta de definición de la regresión se refleja en la tabla 2.
Propuesta de criterios histológicos de regresión en el melanoma
| Disminución o desaparición de melanoma en un área definida del melanoma |
| Infiltrado inflamatorio |
| Fibrosis |
| Melanófagos |
| Neovascularización |
| Adelgazamiento epidérmico |
| Queratinocitos/melanocitos necróticos o apoptóticos |
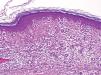
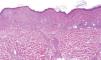
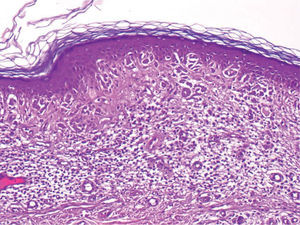
| Regresión temprana (figs. 1 y 2) |
| Disminución focal del melanoma con infiltrado inflamatorio, con o sin queratinocitos/melanocitos necróticos o apoptóticos, y posibilidad del resto de criterios histológicos, salvo la fibrosis |
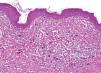
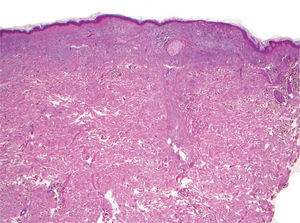
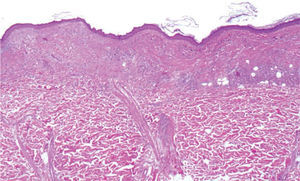
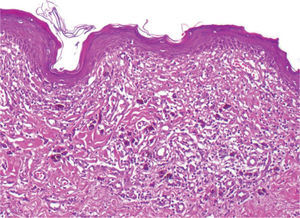
| Regresión establecida (figs. 3 y 4) |
| Franca desaparición focal del melanoma o área de fibrosis evidente, con o sin melanófagos, neovascularización y adelgazamiento epidérmico |
El hecho de considerar la regresión en su fase inflamatoria como auténtica regresión puede ser un factor de confusión en algunos estudios, sobre todo si tenemos en cuenta que la inflamación aislada —sin otros signos histológicos— que acompaña a muchos melanomas se ha demostrado como un factor de buen pronóstico, especialmente si el infiltrado linfocitario es denso 17. Por otro lado, no sólo es controvertida la definición de la regresión como ya hemos comentado, sino que además no está claro qué porcentaje de la lesión debe mostrarla para que deba ser incluido como melanoma con regresión. Así, algunos autores defienden que sólo debe definirse como melanoma en regresión aquel que tiene un 75 % o más de su extensión horizontal afectada por la regresión 28. En algunos trabajos se incluyen todos los casos que muestran algún grado de regresión y simplemente los subdividen en melanomas con regresión parcial si ésta es menor del 50 % o extensa si afecta al 50 % o más de la extensión horizontal del melanoma 10.
ConclusiónHay muchos puntos oscuros en relación con la regresión en el melanoma. Aunque está claro que la regresión en el melanoma debe iniciarse con un infiltrado inflamatorio acompañante, la mera presencia de inflamación en un melanoma no es suficiente, a la vista de nuestros conocimientos actuales, para considerar que se está iniciando un proceso de regresión. La existencia de infiltrado inflamatorio en un melanoma sólo nos informa de que se ha producido una respuesta inmunológica por parte del huésped frente al tumor. Esta respuesta podrá ser efectiva o no, según sea capaz de frenar el crecimiento del tumor o conseguir su regresión parcial o completa. Múltiples estudios han hallado que la presencia de infiltrados inflamatorios densos en el melanoma, sin otros signos de regresión, se asocia claramente con un mejor pronóstico en el melanoma 29. Nosotros también encontramos resultados que corroboran esta asociación entre infiltrados inflamatorios densos y ausencia de metástasis en los ganglios centinela 9. Se podría hipotetizar que es diferente la calidad de la inflamación en tales casos que en los que posteriormente regresan, o bien que la destrucción inicial del melanoma en regresión, inducida por el infiltrado inflamatorio, hace que se seleccionen clones de melanocitos más agresivos. En tal caso la regresión avanzada sí que implicaría peor pronóstico y, consecuentemente, ésta podría ser la causa de que encontremos resultados tan contradictorios entre los distintos estudios que hemos revisado; es decir, que la regresión tendría un significado pronóstico diferente dependiendo de la fase cronológica en la que fuera valorada: favorable en las iniciales y negativo en las avanzadas. No obstante, todo esto son sólo especulaciones y se deberían realizar trabajos que precisaran con exactitud los criterios utilizados para definir la regresión, y en el caso de incluir regresión temprana y tardía, valorar la relación con el pronóstico de ambas por separado. También sería interesante realizar estudios que caracterizaran el fenotipo de los linfocitos infiltrantes tumorales, tanto en la regresión temprana como en la avanzada, así como el microambiente inmunológico (perfil de citoquinas, presencia de células dendríticas plasmocitoides y su estado de activación) a medida que evoluciona el proceso de regresión. En este sentido, se han elaborado estudios para caracterizar la calidad del infiltrado inflamatorio en el halo nevus, con el objeto de dilucidar por qué estas lesiones regresan sin fibrosis, a diferencia de lo que ocurre en el melanoma 30. Tales investigaciones muestran resultados interesantes, como que en los nevus de Sutton los linfocitos son predominantemente CD8, mientras que en el melanoma son preferentemente CD4, así como diferencias en el perfil de citoquinas.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.