El melanoma localmente avanzado representa un estadio clínico caracterizado principalmente por la presencia de metástasis en tránsito o satelitosis, estadios IIIB o IIIC de la clasificación American Joint Committee on Cancer de 2002, y que en ausencia de metástasis a distancia, representa un acortamiento en la supervivencia del paciente y un escenario clínico de manejo complejo.
La aproximación al paciente en este estadio debe iniciarse con una reestadificación que permita descartar la presencia de metástasis a distancia, para lo que se acepta como técnica con mayor validez la tomografía por emisión de positrones-tomografía computarizada. La exéresis quirúrgica de la/s metástasis continúa siendo considerada el tratamiento de primera elección en la enfermedad localmente avanzada.
En caso de metástasis irresecables la perfusión hipertérmica del miembro aislado con melfalán con o sin factor de necrosis tumoral, proporciona porcentajes de respuesta completa del 60 %, con toxicidad sistémica y locorregional grave muy poco frecuente. La radioterapia, quimioterapia y bioquimioterapia son alternativas terapéuticas que, aunque no han sido estudiadas exclusivamente en el paciente con metástasis en tránsito, pueden tener un papel en la enfermedad localmente avanzada irresecable sin metástasis a distancia.
En cualquier caso, las opciones terapéuticas en el melanoma localmente avanzado clínico deben ser individualizadas para cada paciente y teniendo en cuenta la disponibilidad de cada una de las técnicas y la experiencia del equipo de profesionales con cada una de ellas.
Locally advanced melanoma is characterized clinically by the appearance of in-transit or satellite metastases, and is considered stage IIIB or IIIC according to the 2002 classification of the American Joint Committee on Cancer. Despite the absence of distant metastases, the management of locally advanced melanoma is complicated and the disease is associated with a reduction in overall survival.
The initial step in the approach to the patient with locally advanced melanoma involves the restaging in order to exclude the presence of distant metastases. Positron emission tomography-computed tomography is currently accepted as the most accurate restaging technique. Surgical excision of the metastases continues to be the treatment of choice for locally advanced melanoma.
In the case of unresectable metastases, hyperthermic isolated limb perfusion with melphalan with or without tumor necrosis factor has achieved complete responses in up to 60 % of patients treated, with very rare severe locoregional and systemic toxic effects. Radiation therapy, chemotherapy, and biochemotherapy are options that, even though they have not been tested in patients with only in-transit metastases, may have a role in unresectable, locally advanced melanoma without distant metastases.
In any case, therapeutic options for locally advanced melanoma should be individualized, and should take into consideration the availability of each of these techniques as well as the experience of the health care team.
El melanoma cutáneo, a pesar de su escasa incidencia, con una tasa en España de 5 a 7 casos/100.000 habitantes/año, representa el proceso neoplásico responsable de la mayor proporción de mortalidad oncológica en Dermatología 1. Sin embargo, el pronóstico del paciente con melanoma presenta un amplio rango de supervivencia dependiente del estadio clínico, y que oscila entre una supervivencia prácticamente similar a la de la población general de la misma edad para los pacientes con melanoma en estadio precoz, hasta una supervivencia inferior al 10 % a los 5 años en pacientes en estadios avanzados con metástasis a distancia 2. Existen además estadios clínicos intermedios, localizados en una determinada región corporal que presentan un acortamiento significativo de la supervivencia; se trata de casos de manejo complicado y que son incluidos dentro del concepto de melanoma localmente avanzado (MLA) que se describe en esta revisión.
Concepto de melanoma localmente avanzadoLas dificultades de manejo del paciente con MLA derivan ya de la propia definición de este concepto clínico, que se aplica de forma heterogénea en los diferentes estudios y textos sobre el tema. Inicialmente y de forma amplia, el concepto de MLA incluiría a aquellos pacientes con melanoma primario o recurrente, limitado a una región corporal, es decir, sin metástasis sistémica o a distancia; a pesar de esta ausencia de afectación a distancia, las situaciones clínicas agrupadas bajo el concepto de MLA tienen en común el mal pronóstico, con una supervivencia global significativamente acortada.
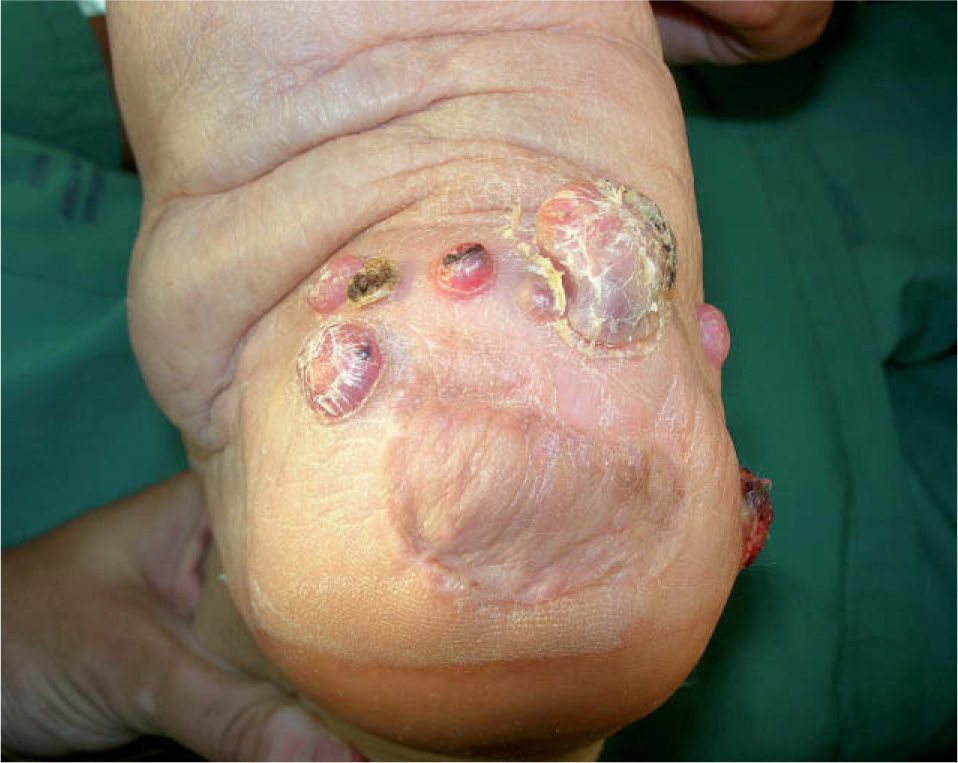
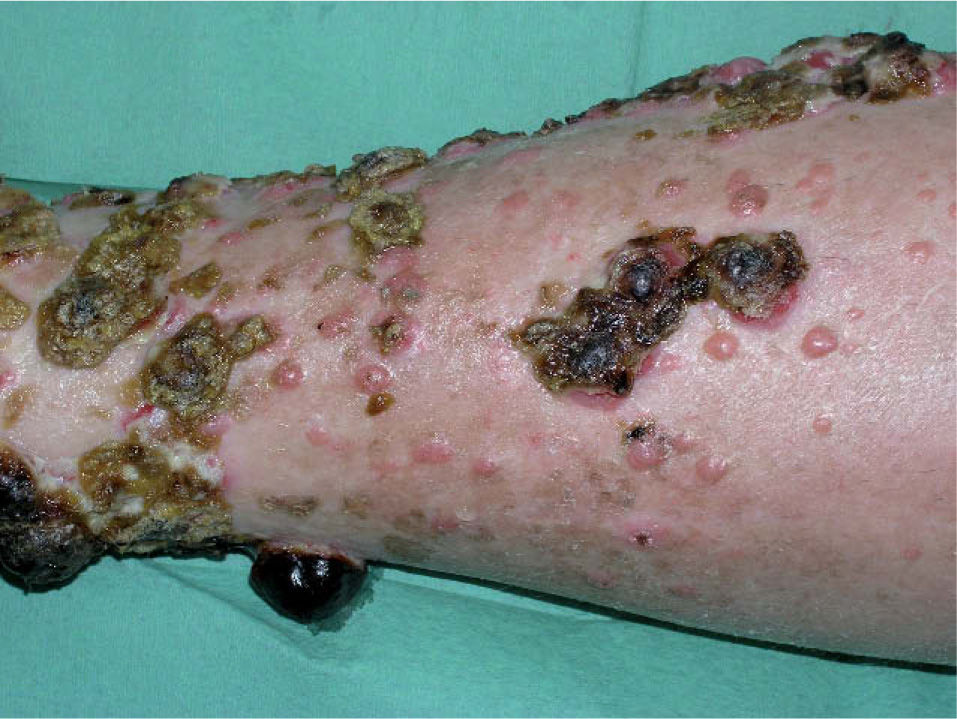
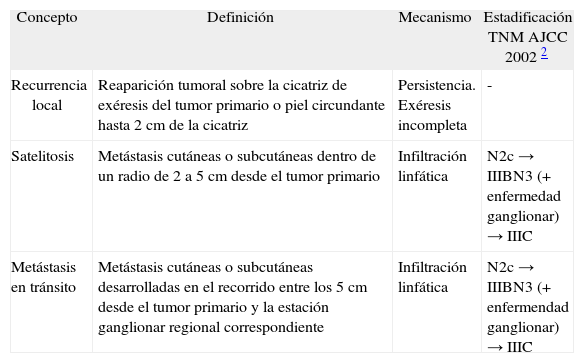
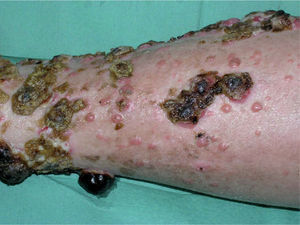
Desde el punto de vista clínico y pronóstico una primera clasificación del melanoma diferencia entre enfermedad local, enfermedad locorregional y sistémica, con supervivencias del 95 %, del 50–75 % y de menos del 25 % a los 5 años, respectivamente 2. Dentro de la enfermedad locorregional se diferencia clásicamente entre recurrencia local, satelitosis y metástasis en tránsito (tabla 1, figs. 1 y 2), escenarios clínicos que pueden acompañarse o no de enfermedad ganglionar regional correspondiente y a las que inicialmente se les atribuía diferente implicación pronóstica. Sin embargo, la más reciente clasificación del American Joint Committee on Cancer (AJCC) de 2002 2, diferencia desde el punto de vista pronóstico la recurrencia local por un lado y la satelitosis y metástasis en tránsito por otro, en tanto que la primera no ha demostrado impacto sobre la supervivencia del paciente, mientras que los otros dos escenarios, satelitosis y metástasis en tránsito, sí que son responsables en igual proporción de una mayor mortalidad. En este sentido, la clasificación de la AJCC de 2002 aclara que satelitosis y metástasis en tránsito son situaciones equivalentes desde el punto de vista pronóstico, en tanto que ambas responden al mismo fenómeno de invasión linfática por células tumorales, siendo clasificadas como N2c en caso de que se presenten en ausencia de enfermedad ganglionar (estadio IIIB), o bien N3 en caso de que se asocien a la afectación metastásica de la región ganglionar correspondiente (estadio IIIC) 2,3 (tabla 1).
Conceptos de recurrencia local, satelitosis y metástasis en tránsito
| Concepto | Definición | Mecanismo | Estadificación TNM AJCC 2002 2 |
| Recurrencia local | Reaparición tumoral sobre la cicatriz de exéresis del tumor primario o piel circundante hasta 2 cm de la cicatriz | Persistencia. Exéresis incompleta | - |
| Satelitosis | Metástasis cutáneas o subcutáneas dentro de un radio de 2 a 5 cm desde el tumor primario | Infiltración linfática | N2c → IIIBN3 (+ enfermedad ganglionar) → IIIC |
| Metástasis en tránsito | Metástasis cutáneas o subcutáneas desarrolladas en el recorrido entre los 5 cm desde el tumor primario y la estación ganglionar regional correspondiente | Infiltración linfática | N2c → IIIBN3 (+ enfermendad ganglionar) → IIIC |
AJCC: American Joint Committee on Cáncer.
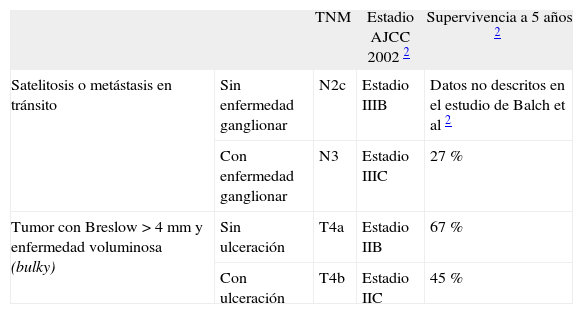
Además de las metástasis en tránsito o satelitosis también pueden considerarse dentro del concepto de MLA aquellos pacientes con tumores primarios o recurrencias locales correspondientes a T4a-4b (Breslow > 4 mm, sin o con ulceración) o tumores voluminosos —bulky en la literatura anglosajona— en tanto que se trata de situaciones clínicas localizadas con una supervivencia inferior al 50 % a los 5 años 2 (tabla 2).
Concepto de melanoma localmente avanzado
| TNM | Estadio AJCC 2002 2 | Supervivencia a 5 años 2 | ||
| Satelitosis o metástasis en tránsito | Sin enfermedad ganglionar | N2c | Estadio IIIB | Datos no descritos en el estudio de Balch et al 2 |
| Con enfermedad ganglionar | N3 | Estadio IIIC | 27 % | |
| Tumor con Breslow > 4 mm y enfermedad voluminosa (bulky) | Sin ulceración | T4a | Estadio IIB | 67 % |
| Con ulceración | T4b | Estadio IIC | 45 % |
AJCC: American Joint Committee on Cancer.
El objetivo de esta revisión se centra en el manejo del paciente con enfermedad localmente avanzada en ausencia de enfermedad metastásica a distancia, especialmente del que presenta metástasis en tránsito o satelitosis (TNM N2c y N3, estadios IIIB y IIIC de la AJCC de 2002) 2, conceptos estos que serán utilizados de forma equivalente a lo largo de este trabajo.
Incidencia y factores de riesgo del melanoma localmente avanzadoLa incidencia de metástasis en tránsito y satelitosis en pacientes con melanoma ha sido evaluada en diferentes estudios, entre los que destaca una reciente serie prospectiva de Pawlik et al 4 sobre 1.395 pacientes con melanoma; con una media de seguimiento de 4 años después de la exéresis del tumor primario y la realización de la biopsia del ganglio centinela (BGC), la incidencia de metástasis en tránsito demostrada por estos autores fue del 6,6 %. En este mismo estudio se analizaron posibles factores clinicopatológicos predictores del desarrollo de metástasis en tránsito, demostrando en el análisis multivariante que la edad, la localización en las extremidades inferiores, la positividad del ganglio centinela y el espesor de Breslow superior a 2 mm fueron factores predictores independientes (p < 0,001) para el desarrollo de metástasis en tránsito (p < 0,001). Con respecto a la discutida relación positiva entre la práctica de la BGC, independientemente del estatus patológico ganglionar, y un incremento en la incidencia de metástasis en tránsito, los autores de este estudio no encontraron relación estadísticamente significativa, por lo que sugieren que no debe considerarse la práctica de la BGC como un factor de riesgo para el desarrollo de metástasis en tránsito 4.
Además, en esta misma serie se demostró una elevada incidencia (del 57 %) de metástasis sistémicas en pacientes con enfermedad en tránsito 4; en este sentido, la positividad de la BGC, la localización subcutánea de los tránsitos frente al de ubicación cutánea, un diámetro superior a 2 cm de la metástasis, así como intervalos libres de enfermedad inferiores a un año, han sido demostrados como factores predictores de desarrollo de metástasis a distancia en el paciente con enfermedad localmente avanzada 4.
Manejo del paciente con melanoma localmente avanzadoAunque la enfermedad en tránsito presenta un pronóstico similar al de enfermedad ganglionar regional avanzada, el manejo de la primera resulta generalmente más complejo. De este modo, la enfermedad ganglionar puede ser controlada mediante una disección ganglionar adecuada, que además proporcionará recurrencias en la estación ganglionar poco frecuentes 5. Por el contrario, la enfermedad en tránsito suele requerir de un tratamiento complejo, al que en numerosas ocasiones es refractaria y suele cursar con recaídas frecuentes.
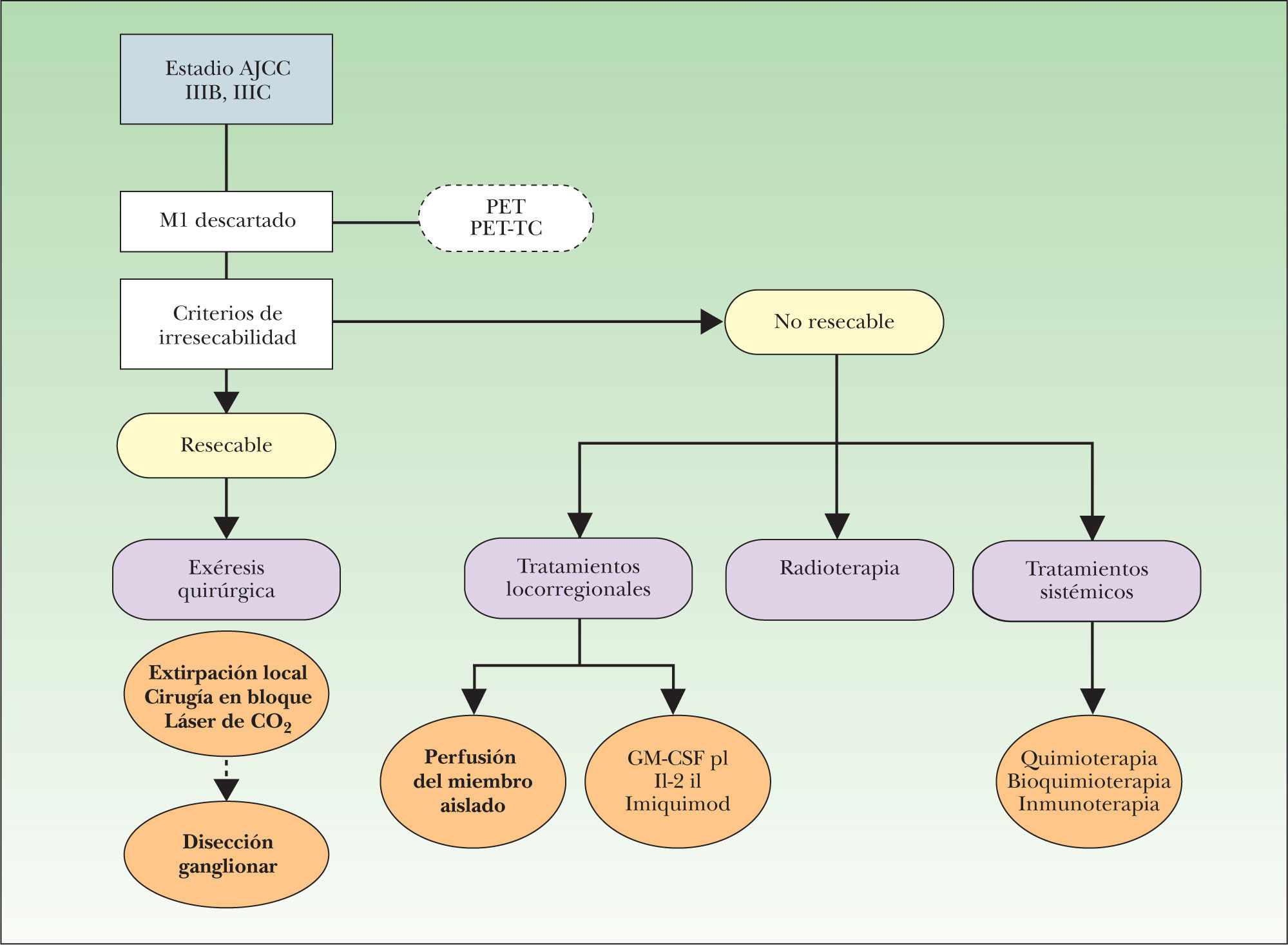
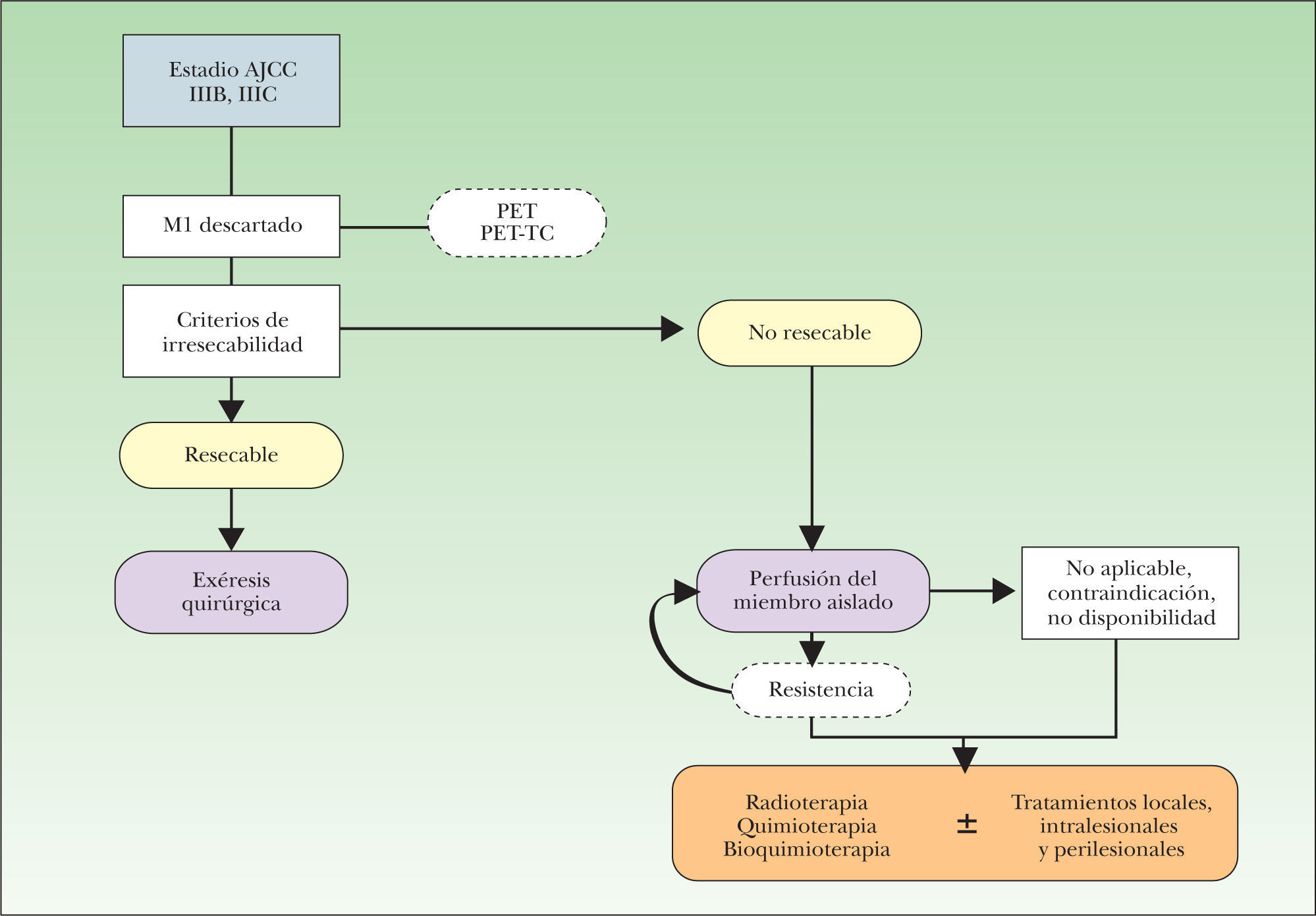
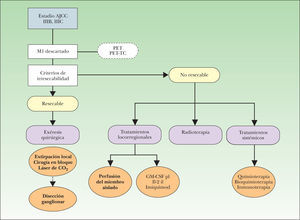
En esta revisión se describen las técnicas diagnóstico-terapéuticas actualmente disponibles para el paciente con MLA (fig. 3), un escenario clínico complejo en el que la toma de decisiones terapéuticas debe tener en cuenta dos factores esenciales: en primer lugar, que las opciones terapéuticas aplicadas al paciente con MLA no han demostrado mejorar la supervivencia, por lo que la mayor parte de los tratamientos tendrán una intención paliativa; en segundo lugar, estas alternativas terapéuticas están apoyadas en un nivel de evidencia medio-bajo, debido a la dificultad de diseñar estudios controlados aleatorizados en el ámbito del paciente oncológico. Estos factores obligan a que las decisiones sean tomadas de forma individualizada, paciente a paciente, y también en función del ámbito asistencial donde son atendidos estos sujetos.
Algoritmo inicial de manejo del paciente con melanoma localmente avanzado. AJCC: American Joint Committee on Cancer; IIIB: metástasis en tránsito y/o satelitosis en ausencia de enfermedad ganglionar; IIIC: metástasis en tránsito y/o satelitosis con enfermedad ganglionar concomitante; GM-CSF pl: tratamiento con factor estimulante de colonias granulocíticas y macrófagos en inyección perilesional; Il-2 il: tratamiento con interleucina-2 en inyección intralesional; M1: TNM correspondiente a la presencia de metástasis a distancia; PET: tomografía por emisión de positrones; PET-TC: tomografía por emisión de positrones combinada con imágenes de tomografía computarizada.
Cualquier algoritmo o protocolo de tratamiento del paciente con MLA debe estar orientado inicialmente a confirmar la situación clínica de enfermedad local o locorregional, descartando la existencia de metástasis sistémica (M0), ya que en caso contrario (M1), el paciente será tributario de un abordaje sistémico, perdiendo justificación inicial el abordaje exclusivo de la enfermedad locorregional. Una vez completada la reestadificación del paciente, y confirmada la situación de MLA, la toma de decisiones estará orientada a valorar la posibilidad de tratamiento quirúrgico de la metástasis mediante la evaluación de la resecabilidad de la misma, para que una vez que la lesión o lesiones sean consideradas como irresecables, o el paciente inoperable, se valoren otras alternativas terapéuticas, entre ellas la perfusión del miembro aislado (fig. 3).
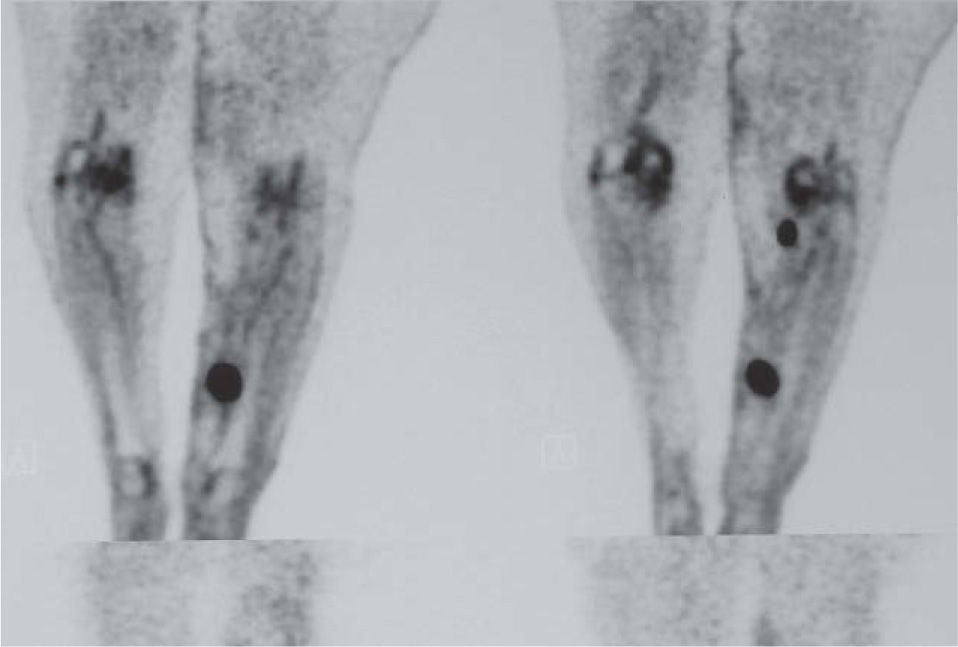
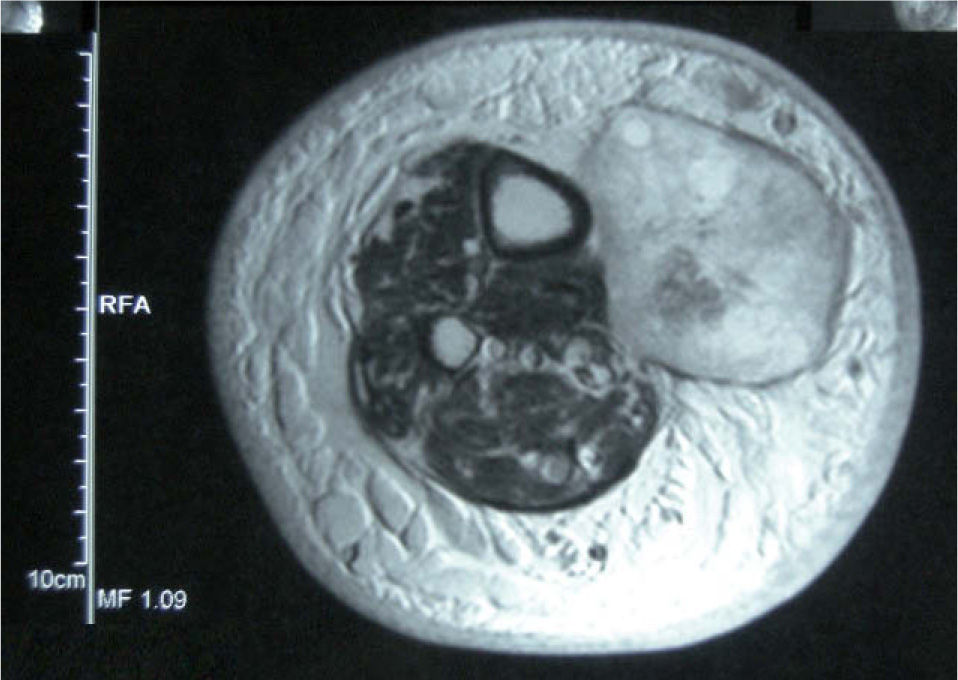
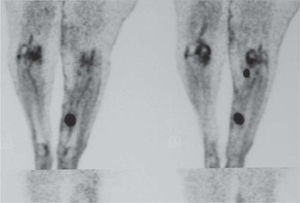
ReestadificaciónEn el paciente con MLA que desarrolla metástasis en tránsito y/o satelitosis (estadio IIIB), la tomografía por emisión de positrones (PET) con 2-desoxifluoroglucosa o la técnica combinada PET-tomografía computarizada (PET-TC) han demostrado la mejor validez para la detección de metástasis sistémicas. El estudio de Finkelstein et al 6, en el que se compararon la sensibilidad y especificidad de la PET-TC con respecto a la PET y otras técnicas de imagen convencional (resonancia magnética nuclear [RMN], TC), demostró una sensibilidad y especificidad del 92 y 94 % respectivamente para la PET-TC, superiores a las demostradas por la PET (sensibilidad: 79 %; especificidad: 87 %) y las técnicas convencionales RMN o TC (sensibilidad: 76 %; especificidad: 87 %) 6. Aunque existen estudios en los que la PET detectó metástasis con un diámetro de 3 mm 7, la validez de la PET-TC ha resultado máxima para lesiones metastásicas superiores a 10 mm 8. Esto permite que en el caso de enfermedad locorregional, la PET-TC proporcione información sobre la existencia de nódulos subcutáneos en tránsito no detectados clínicamente (fig. 4). Por lo tanto, la combinación de imágenes de PET integradas a las de TC aporta la mejor validez para la demostración de metástasis en el paciente con MLA, en tanto que la TC ayuda en la localización anatómica de las lesiones hipercaptantes demostradas mediante la PET. La reestadificación del paciente con melanoma metastásico representa, además, una indicación aceptada de la PET-TC por instituciones sanitarias de nuestro ámbito 9.
Tomografía por emisión de positrones de un paciente con metástasis en tránsito en las extremidades inferiores. Además de la lesión hipercaptante clínicamente palpable localizada en el tercio medio y distal de la pierna, la tomografía por emisión de positrones detecta un nódulo de menor diámetro en la región poplítea no detectado clínicamente.
La reestadificación del paciente con metástasis en tránsito debe incluir el conocimiento del estatus ganglionar actual. Como ha quedado descrito, entre los factores predictivos independientes del desarrollo de metástasis en tránsito o satelitosis se encuentran el espesor de Breslow superior a 2 mm y la positividad de la biopsia del ganglio centinela, lo que lleva a que la mayoría de los pacientes con metástasis en tránsito o satelitosis hayan sido previamente sometidos a BGC, e incluso disección ganglionar regional. En estos casos el estudio del estatus ganglionar queda limitado a los hallazgos clínicos y de imagen de la región ganglionar correspondiente. Sin embargo, en el estudio de Pawlik et al 4 un 4,7 % de pacientes con metástasis en tránsito presentaron un melanoma primario con un espesor de Breslow inferior a 1 mm, de lo que puede extraerse que este porcentaje de pacientes con enfermedad en tránsito no fue tributario de BGC durante el tratamiento y estadificación de la enfermedad primaria.
En aquellos pacientes con enfermedad ganglionar clínicamente evidente o detectada mediante PET, TC o ecografía, está indicada la punción-aspiración con aguja fina (PAAF) para la confirmación citológica y posterior disección ganglionar regional. En aquellos con metástasis en tránsito en ausencia de enfermedad ganglionar y en los que no se había practicado previamente BGC ni disección ganglionar, aunque no existen estudios que demuestren el beneficio de supervivencia de la disección ganglionar en este escenario clínico, los distintos grupos de investigación en este campo recomiendan igualmente practicar la disección ganglionar en todo paciente en el que se aborda el tratamiento de la metástasis en tránsito. La BGC en este estadio no aporta más información pronóstica que la ya obtenida por la situación clínica del paciente (metástasis en tránsito, N2 → IIIB), quedando fuera de indicación en esta situación clínica la práctica de BGC. La disección ganglionar en estos casos puede llevarse a cabo durante el mismo acto quirúrgico de la metastasectomía, durante la perfusión del miembro aislado o previamente a otros procedimientos no quirúrgicos.
No obstante, ante la falta de evidencia directa sobre la indicación o no de la BGC frente a la linfadenectomía profiláctica en este escenario clínico, esta decisión debe ser individualizada para cada paciente y tomada en el contexto de un comité multidisciplinar de melanoma.
ResecabilidadEn tanto que el tratamiento quirúrgico de la metástasis en tránsito o satelitosis representa la primera opción terapéutica a considerar en el paciente con enfermedad en tránsito, la valoración de la resecabilidad de la/s metástasis constituye una fase esencial de esta toma de decisiones.
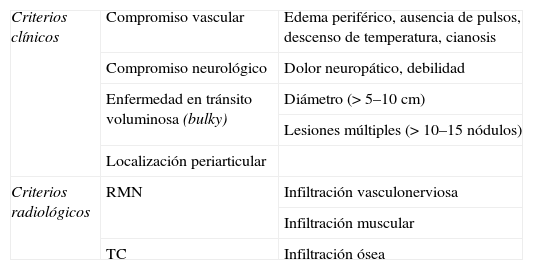
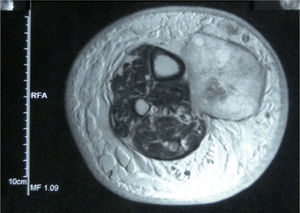
Existen criterios clínicos y radiológicos de irresecabilidad actualmente aceptados 10 (tabla 3); para la identificación de criterios clínicos de irresecabilidad se precisa una exploración física exhaustiva, que incluya la palpación en profundidad del área afectada y la comprobación de la movilidad de la lesión con respecto a los tejidos vecinos, función motora de la extremidad en la que se localice la lesión, signos de afectación neurológica y vascular y, finalmente, medición cuantitativa de las lesiones tumorales (tabla 3). La identificación de criterios radiológicos se completa mediante una RMN con gadolinio, o una TC en casos de sospecha de afectación ósea. La infiltración del paquete vasculonervioso, demostrada mediante RMN, es un criterio fundamental de irresecabilidad de una metástasis (tabla 3, fig. 5).
Criterios clínicos y radiológicos de irresecabilidad en el paciente con melanoma localmente avanzado 1
| Criterios clínicos | Compromiso vascular | Edema periférico, ausencia de pulsos, descenso de temperatura, cianosis |
| Compromiso neurológico | Dolor neuropático, debilidad | |
| Enfermedad en tránsito voluminosa (bulky) | Diámetro (> 5–10 cm) | |
| Lesiones múltiples (> 10–15 nódulos) | ||
| Localización periarticular | ||
| Criterios radiológicos | RMN | Infiltración vasculonerviosa |
| Infiltración muscular | ||
| TC | Infiltración ósea |
RMN: resonancia magnética nuclear; TC: tomografía computarizada.
A pesar de considerarse el tratamiento de primera elección, la resección quirúrgica de la metástasis en tránsito o satelitosis no ha demostrado mejorar el pronóstico final en términos de supervivencia global del paciente con melanoma. Por ello, la metastasectomía debe ser considerada en la mayor parte de los casos como una opción con intención paliativa y de mejora de la función de la extremidad afectada y de la calidad de vida del paciente.
Desde un punto de vista técnico, la resección convencional de la metástasis en tránsito o satelitosis debe ser conservadora, incluyendo los márgenes clínicamente visibles o palpables, sin necesidad de amplios márgenes de seguridad; al contrario que en el caso del melanoma primario y la recidiva local, la metástasis en tránsito y la satelitosis suelen consistir en lesiones dérmicas bien diferenciadas de la dermis perilesional y la epidermis suprayacente y, por lo tanto, bien circunscritas, lo que no hace necesario la exéresis de márgenes de seguridad amplios 3. Con respecto a otras opciones terapéuticas en el paciente con MLA, la resección de la metástasis ofrece una menor incidencia de recidiva local, inferior al 10 % en la misma localización que la recidiva extirpada, aunque con una tasa similar de recurrencia regional a lo largo del trayecto hasta la estación ganglionar correspondiente, entre el 50 y el 90 % según las series, por lo que no influye en el desarrollo posterior de recurrencias regionales 11.
Con respecto al cierre del defecto quirúrgico debe optarse, en los casos en que sea posible, por el cierre directo, la colocación de un injerto o cierre por segunda intención, debiendo evitar colgajos locales que distorsionen aún más la anatomía regional y dificulten la detección precoz de nuevas recidivas locales.
En aquellos casos en los que existen varias metástasis en tránsito o satelitosis agrupadas en una región, la resección de éstas se puede abordar de forma conjunta en lo que se conoce como resección en bloque. En pacientes en los que las metástasis en tránsito se localizan próximas a la región ganglionar correspondiente y se asocian a enfermedad ganglionar regional, será posible incluir en el bloque de resección las cadenas ganglionares regionales 3. No obstante, no existe evidencia a favor de la adecuación de este abordaje quirúrgico, por lo que debe restringirse a resecciones en bloque que no resulten excesivamente agresivas ni mutilantes para el paciente.
Actualmente la amputación del miembro afectado por el MLA es considerada sobretratamiento y, por lo tanto, ha sido abandonada; de hecho, los escasos estudios existentes tienen ya casi dos décadas, y en éstos la supervivencia demostrada en pacientes amputados no superaba el 15 % a los 5 años. No obstante, puede tener alguna indicación en casos excepcionales de tumores irresecables con hemorragia incoercible, de progresión rápida, con masas vegetantes, ulceradas, con pérdida de la función articular y en los que no es posible o han fracasado las técnicas no quirúrgicas disponibles 12,13. Además, la amputación se acompaña de complicaciones (morbilidad posquirúrgica, déficit funcional, síndrome del miembro fantasma, etc.) que deben ser tenidas en cuenta a la hora de establecer la indicación de un procedimiento quirúrgico paliativo 12.
La metastasectomía mediante láser de CO2 ha sido propuesta como una alternativa adecuada en el tratamiento del MLA, debido a la eficacia demostrada en algunos estudios y a la escasa morbilidad del procedimiento con respecto a la exéresis quirúrgica convencional 14. Sin embargo, esta eficacia se ha limitado a lesiones cutáneas superficiales y de pequeño diámetro, presentando además una tasa de recurrencia local de las metástasis tratadas con láser CO2 próxima al 50 % de los pacientes, con un intervalo libre de recurrencia corto, de entre 2 y 7 semanas 15. Por lo tanto, la metastasectomía con láser de CO2 puede estar indicada como tratamiento complementario a otras alternativas locorregionales como la perfusión del miembro aislado, la radioterapia, o incluso la quimioterapia sistémica para el abordaje de aquellas lesiones tumorales remanentes numerosas y de pequeño tamaño.
Perfusión del miembro aisladoEntre las opciones terapéuticas locorregionales en el paciente con enfermedad irresecable, la perfusión del miembro aislado (PMA) ha cobrado especial interés en los últimos años; sin embargo, se trata de una técnica en absoluto novedosa, descrita por primera vez en un trabajo de 1959, en el que el melanoma de las extremidades constituía una de sus indicaciones principales junto con otros tumores de partes blandas 16.
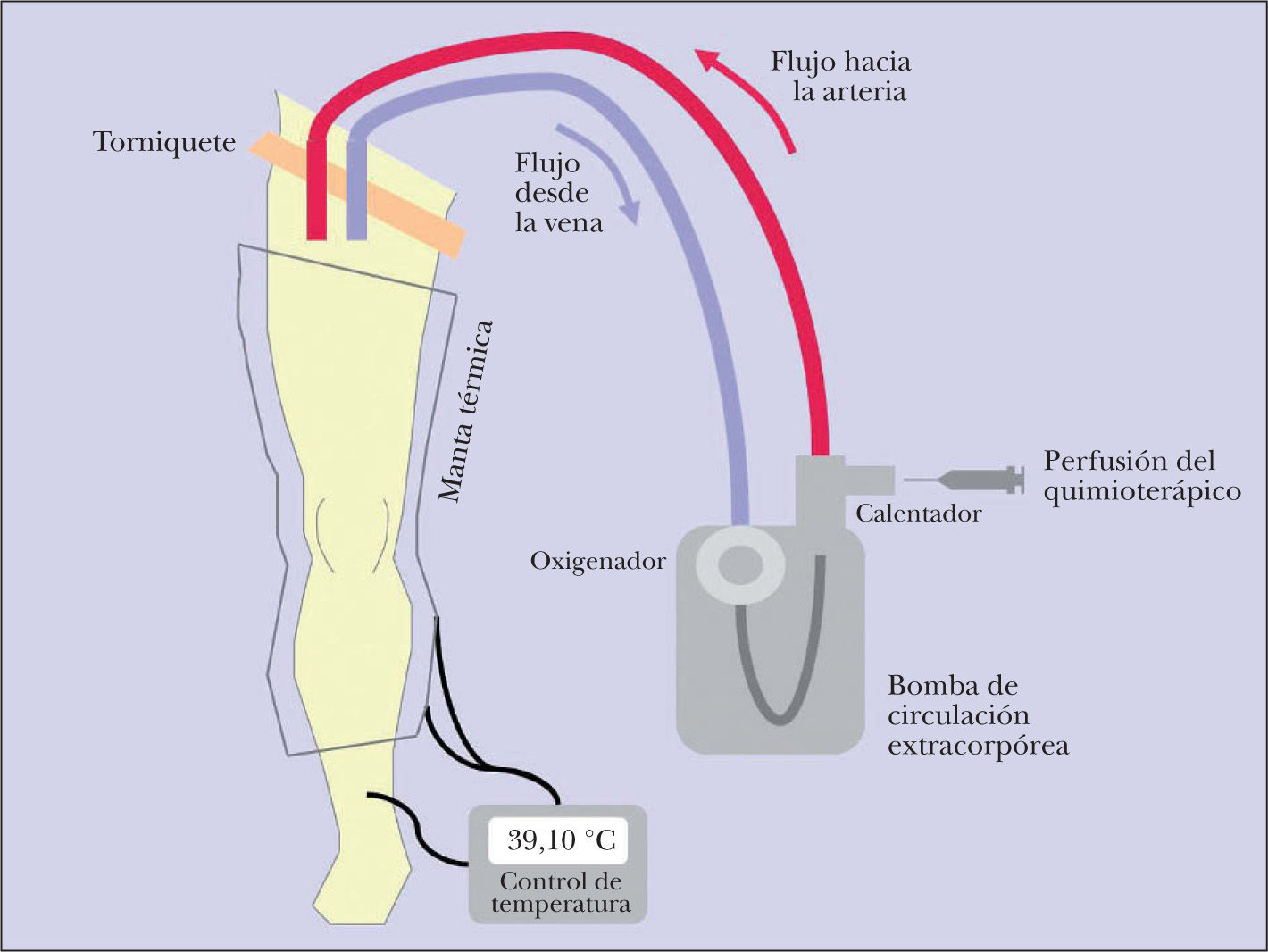
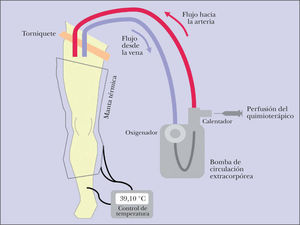
La PMA consiste en la creación de un circuito circulatorio entre la extremidad, superior o inferior, afectada por el tumor y una bomba de perfusión extracorpórea mediante la canulación de los vasos principales del miembro afecto y la compresión externa de la raíz del miembro mediante torniquete (fig. 6); con ello se consigue aislar la circulación de la extremidad de la circulación sistémica, lo que permite la administración al miembro aislado de dosis de quimioterápico hasta 10 veces superiores que las pautadas en los regímenes de quimioterapia sistémica. Los fármacos más habitualmente perfundidos son melfalán, que en la última década se está combinando con factor de necrosis tumoral (TNF) o interferón (IFN). La perfusión se desarrolla actualmente bajo condiciones de hipertermia, con lo que se mejora la liberación del fármaco y la sensibilidad de las células tumorales al mismo. La monitorización de la temperatura alcanzada en el circuito y de las fugas del quimioterápico prefundido a la circulación sistémica es esencial para evitar toxicidad grave durante el desarrollo de la técnica 17,18.
Desde un punto de vista fisiopatológico la PMA ofrece la ventaja, frente al resto de procedimientos terapéuticos locorregionales, incluida la resección de la metástasis, de actuar contra aquellas células tumorales que han alcanzado la circulación linfática de la extremidad y que aún no han desarrollado lesiones clínicas.
La PMA es una técnica compleja, prolongada y desarrollada bajo anestesia general por un equipo de cirugía cardiovascular en el seno de un equipo multidisciplinar en el que también interviene el dermatólogo de la Unidad de melanoma. Requiere, además, unas condiciones generales y locales del paciente (performance status, riesgo anestésico [ASA], comorbilidad, ausencia de enfermedad vascular periférica) que permitan considerarle como candidato adecuado a una técnica quirúrgica de elevada complejidad. Esta complejidad de la técnica, junto con la dispersión de la evidencia disponible, hace que se trate de un procedimiento con el que no cuenta la mayoría de los centros hospitalarios.
En el tratamiento del MLA irresecable los estudios disponibles sobre PMA han demostrado una mediana de respuesta completa del 60 %, parcial del 25 %, con una mediana de no respuesta del 6 %. Esta respuesta terapéutica se ha mantenido incluso después de PMA repetida para el tratamiento de recurrencias sucesivas posperfusión 19,20. En cuanto al pronóstico la supervivencia libre de enfermedad de pacientes tratados con PMA ha oscilado entre el 16 y el 53 % a los 5 años, con una mediana de intervalo libre de enfermedad regional de 16 meses. La supervivencia global de los pacientes tratados mediante PMA ha sido del 19 al 50 % a los 5 años, con una mediana de intervalo de supervivencia de 32 meses. En relación con el ciclo de quimioterápico más adecuado en perfusión, los escasos estudios comparativos existentes no han demostrado diferencias significativas entre la PMA con melfalán y con el régimen combinado melfalán-TNF. En cuanto a la toxicidad de la PMA, si bien la aparición de efectos tóxicos locales leves es frecuente, la toxicidad regional grave y muy grave (síndrome compartimental y amputación, respectivamente) se limita a menos del 5 y 1 % de los pacientes tratados, respectivamente. La toxicidad sistémica grave órgano-específica también ha demostrado en los estudios disponibles una incidencia inferior al 5 %, con una mortalidad dependiente de la técnica menor del 1 %. Estos datos permiten concluir que la PMA es una opción efectiva y segura para el tratamiento del paciente con MLA irresecable. No obstante, debe tenerse en cuenta que a pesar de la abundante evidencia sobre esta técnica, la lógica escasez de estudios controlados aleatorizados que comparen la misma con otras alternativas terapéuticas lleva a que el nivel de evidencia y grado de recomendación para estos resultados sea limitado 21.
Tratamientos locales, intra y perilesionalesEn aquellos pacientes con MLA en los que han fracasado o están contraindicadas las alternativas descritas, existen estudios que evalúan diferentes pautas de tratamiento tópico e intralesional. Sin embargo, se trata de alternativas terapéuticas basadas en una evidencia muy limitada, por lo que su efectividad real precisa ser confirmada en ensayos clínicos, o al menos en series descriptivas más amplias.
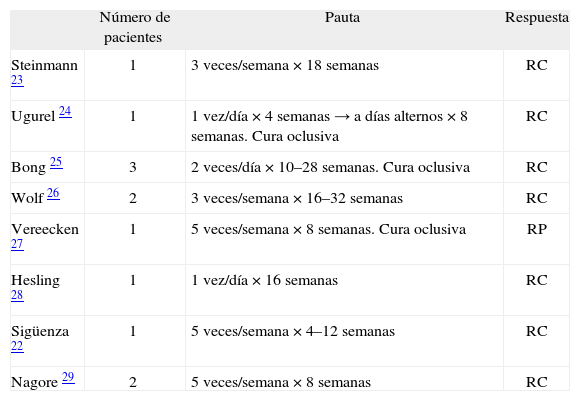
ImiquimodImiquimod 5 % tópico ha sido probado en diferentes regímenes de aplicación para el tratamiento de las metástasis cutáneas del melanoma, con respuesta completa o parcial en la mayoría de los casos publicados (tabla 4); se trata, sin embargo, de series no comparativas con tamaños muestrales escasos 22–29. Imiquimod ha sido aplicado en el paciente con MLA en combinación con otras opciones terapéuticas. Un estudio fase I/II analizó la respuesta de una cohorte de 13 pacientes con metástasis cutáneas y/o subcutáneas múltiples, a los que se aplicó imiquimod 5 % tópico diario durante 4 semanas e interleucina-2 intralesional posterior. La respuesta obtenida, sobre un total de 182 lesiones tratadas, fue de un 50 % de respuesta objetiva global, con un 40 % de respuesta completa 30.
Imiquimod 5 % tópico en el tratamiento de metástasis cutánea de melanoma
| Número de pacientes | Pauta | Respuesta | |
| Steinmann 23 | 1 | 3 veces/semana × 18 semanas | RC |
| Ugurel 24 | 1 | 1 vez/día × 4 semanas → a días alternos × 8 semanas. Cura oclusiva | RC |
| Bong 25 | 3 | 2 veces/día × 10–28 semanas. Cura oclusiva | RC |
| Wolf 26 | 2 | 3 veces/semana × 16–32 semanas | RC |
| Vereecken 27 | 1 | 5 veces/semana × 8 semanas. Cura oclusiva | RP |
| Hesling 28 | 1 | 1 vez/día × 16 semanas | RC |
| Sigüenza 22 | 1 | 5 veces/semana × 4–12 semanas | RC |
| Nagore 29 | 2 | 5 veces/semana × 8 semanas | RC |
Modificada de Sigüenza et al 22.
RC: respuesta completa; RP: respuesta parcial.
En tanto que la respuesta de las metástasis en tránsito y satelitosis es impredecible y las pautas aplicadas han sido variables, se precisan estudios controlados para confirmar el valor real del imiquimod tópico en el tratamiento adyuvante de las metástasis cutáneas de melanoma, tanto en monoterapia como asociado a otras alternativas terapéuticas.
Interleucina-2 intralesionalInterleucina-2 en administración intralesional a cada una de las metástasis cutáneas y/o subcutáneas de melanoma dos o tres veces por semana durante un periodo variable ha demostrado, en una serie prospectiva, una tasa de respuesta completa del 85 % de las metástasis tratadas, con respuesta parcial en el 6 % de las lesiones. El tratamiento fue bien tolerado, con efectos adversos leves y moderados, por lo que los autores concluyen que la inyección intralesional puede considerarse una alternativa segura y efectiva en el tratamiento del paciente con MLA 31.
Factor estimulante de colonias granulocíticas y de macrófagos perilesionalLa capacidad del factor estimulante de colonias granulocíticas y de macrófagos (GM-CSF) de inducir una potente inmunidad sistémica antitumoral, ha llevado a su administración en inyección perilesional a pacientes con metástasis cutáneas o subcutáneas de melanoma. En un estudio sobre 7 pacientes, el 70 % de los mismos presentaron un descenso en el número total de metástasis, con una supervivencia media de 33 meses. Las inyecciones perilesionales fueron bien toleradas, con eritema en el área de inyección y somnolencia leve 32.
ElectroquimioterapiaLa electroquimioterapia y la electroporación como variante de ésta, consisten en una modalidad terapéutica por la que se administra un quimioterápico intralesional, generalmente bleomicina, al mismo tiempo que se aplican sobre la superficie y espesor tumoral pulsos eléctricos breves de alta intensidad que permeabilizan la superficie celular e incrementan la incorporación del quimioterápico al interior de la célula neoplásica, sin los efectos tóxicos de la quimioterapia sistémica. La electroquimioterapia ha sido estudiada para el tratamiento local de metástasis cutáneas de melanoma. Un estudio controlado aleatorizado demostró una respuesta terapéutica en el 72 % de los pacientes tratados con electroterapia y en el 32 % de los tratados con blecomicina intralesional sin pulsos eléctricos (p = 0,005). La electroterapia fue bien tolerada en todos los pacientes aplicándose en régimen ambulatorio. Otro estudio demostró además la ausencia de toxicidad sistémica, aunque con sensación de incomodidad local durante el procedimiento en todos los pacientes, dolor local en el 75 % y espasmo muscular con mioclonía en el 25 % de los mismos. Se trata, en definitiva, de una técnica segura y efectiva como alternativa paliativa, pero actualmente disponible en escasos centros especializados 33,34.
RadioterapiaTradicionalmente, el melanoma ha sido considerado un tumor escasamente radiosensible 35. Sin embargo, en los últimos años se ha puesto de manifiesto el efecto beneficioso de la radioterapia (RT) en el control de recurrencias locorregionales y metástasis a distancia sintomáticas. Estudios in vitro han revelado el amplio rango de radiosensibilidad de diferentes líneas tumorales de melanoma, abarcando desde la total radiorresistencia hasta una radiosensibilidad completa, por lo que actualmente se tiende a considerar el melanoma como un tipo tumoral con un amplio rango de radiosensibilidad 36. Aunque se desconoce la causa de esta variabilidad, se ha propuesto la interacción de mecanismos moleculares e inmunes sobre la apoptosis en la respuesta final del tumor a la RT.
Otro aspecto de debate actual se centra en la definición del régimen de dosificación más apropiado para este tipo de pacientes. Así, para la RT paliativa Overgaard et al 37 demostraron en un estudio observacional la mayor eficacia con los regímenes hipofraccionados consistentes en dosis altas, superiores a 4 Gy, en menor número de sesiones, con lo que obtuvieron respuestas completas en el 59 % de los pacientes, frente al 33 % de respuestas obtenidas con regímenes convencionales. Estos estudios incluían un alto porcentaje de pacientes con metástasis cutáneas, entre los que se encontraban sujetos con metástasis en tránsito y/o satelitosis 37. El único estudio prospectivo aleatorizado (RTOG 83–05) 38 que comparó un esquema de hipofraccionamiento (8 Gy durante 4 fracciones) frente a un esquema convencional (2,5 Gy durante 20 fracciones) proporcionó resultados similares en cuanto a tasas de respuesta completa (24 frente a 23 %), control local y toxicidad 38. Por tanto, actualmente no es posible establecer recomendaciones definitivas con relación al mejor esquema de RT en situación localmente avanzada.
Con respecto a la RT adyuvante a la resección quirúrgica en el paciente con MLA y factores de riesgo para el desarrollo de nuevas recaídas y metástasis en tránsito (metástasis en tránsito de rápido desarrollo, Breslow del tumor primario > 3–4 mm, persistencia posquirúrgica micro o macroscópica, afectación ganglionar masiva), estudios no aleatorizados y retrospectivos han demostrado resultados favorables con recaídas locales de sólo el 4–11 % en situaciones de alto riesgo 39. Aunque, de nuevo, no existen estudios prospectivos aleatorizados; la escasa evidencia científica disponible permite concluir que la RT postoperatoria es una modalidad terapéutica a considerar para reducir la recurrencia locorregional en casos individualizados de melanoma con factores pronósticos adversos.
Quimioterapia y otras terapias sistémicasLa quimioterapia es una opción terapéutica reservada al paciente con metástasis a distancia (estadio IV de la AJCC de 2002). En general, el tratamiento sistémico del melanoma metastático (estadio IV) es considerado poco eficaz, con tasas de respuesta entre el 15 % y el 45 % 40,41. Sin embargo, se han identificado subgrupos de pacientes con mayores tasas de respuesta, entre los que se incluyen los sujetos con metástasis cutáneas y en tejidos blandos, metástasis ganglionares o con niveles normales de lactatodeshidrogenasa, circunstancias presentes en una proporción importante de pacientes con MLA 42.
Pero debe tenerse en cuenta que, aunque la quimioterapia sistémica puede estar indicada en la enfermedad locorregional resistente o no tributaria de otras alternativas, no existen estudios específicos de eficacia de ésta y/o bioquimioterapia en el paciente con enfermedad localmente avanzada. Los resultados comentados a continuación proceden de trabajos sobre pacientes con melanoma metastásico (M1), algunos de los cuales presentan además metástasis en tránsito y/o satelitosis.
Dacarbacina (DTIC), considerado el quimioterápico estándar en régimen de monoquimioterapia, aunque ha demostrado las tasas de respuesta más elevadas, no ha mostrado beneficio en cuanto a la supervivencia del paciente con melanoma metastático 41,42. Temozolamida, un profármaco que comparte metabolito activo con DTIC, pero de administración oral, ha probado tasas de respuesta y supervivencia similares a DTIC en un estudio aleatorizado en pacientes con melanoma metastásico 43. Otros fármacos que han mostrado actividad en el melanoma metastásico como fotemustina, paclitaxel y carmustina, entre otros, tampoco han demostrado resultados superiores a DTIC 42. En relación con los regímenes de poliquimioterapia, el clásico régimen de Dartmouth con DTIC, cisplatino, carmustina y tamoxifeno, considerado pauta estándar durante años, no ha demostrado en estudios aleatorizados beneficio terapéutico con respecto a DTIC en monoterapia 44.
La combinación de quimioterapia e inmunoterapia, bioquimioterapia, ha demostrado mejorar significativamente la tasa de respuestas y retrasar la recaída, pero en ningún caso ha mejorado la supervivencia global de pacientes con enfermedad sistémica en estudios aleatorizados. El esquema de bioquimioterapia más empleado, por su menor toxicidad, consiste en la administración concomitante de cisplatino-vinblastina-DTIC asociado a interleucina-2 o IFNa 45. Los estudios aleatorizados existentes no han demostrado diferencias estadísticamente significativas a favor de la bioquimioterapia con respecto a la poliquimioterapia convencional 46–48.
ConclusionesEl MLA representa un estadio clínico definido principalmente por la presencia de metástasis en tránsito o satelitosis y que se caracteriza por un claro compromiso, no sólo del pronóstico vital, sino también de la capacidad funcional y calidad de vida del paciente.
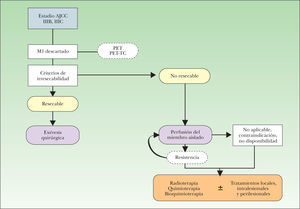
Después de la revisión de las opciones terapéuticas actualmente disponibles para este estadio clínico (fig. 7), la resección quirúrgica convencional de la metástasis, metastasectomía quirúrgica, debe continuar considerándose como el tratamiento de primera elección. En los casos de enfermedad irresecable localizada en las extremidades, la PMA representa el enfoque terapéutico que mejor tasa de respuesta proporciona, incluso en caso de recidiva posperfusión. Si la PMA está contraindicada, no está disponible o se da el caso de resistencia repetida a la misma, deberán considerarse la RT, así como la quimioterapia o bioquimioterapia, opciones que pueden combinarse con los tratamientos locales, intra y perilesionales descritos (fig. 7). No obstante, la complejidad del manejo de este estadio clínico lleva a que el paciente sea tratado con varias de las alternativas descritas en diferentes momentos de la enfermedad.
Propuesta de algoritmo de manejo del paciente con melanoma localmente avanzado. AJCC: American Joint Committee on Cancer; IIIB: metástasis en tránsito o satelitosis en ausencia de enfermedad ganglionar; IIIC: metástasis en tránsito o satelitosis con enfermedad ganglionar concomitante; M1: TNM correspondiente a la presencia de metástasis a distancia; PET: tomografía por emisión de positrones; PET-TC: tomografía por emisión de positrones combinada con imágenes de tomografía computarizada.
A partir del conocimiento actual de las diferentes opciones terapéuticas disponibles, el tratamiento del paciente con MLA debe ser individualizado para cada paciente, incorporando también como factores de decisión la disponibilidad de cada una de las alternativas y la experiencia del equipo clínico responsable del tratamiento.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.