Las metástasis son la principal causa de mortalidad en el melanoma. Las quimiocinas son citocinas quimiotácticas de bajo peso molecular que permiten la migración celular, atrayendo a células que expresan sus receptores. Como algunas quimiocinas son abundantes en órganos que son asiento común de metastasis, y sus receptores son expresados por las células tumorales, se planteó la hipótesis de que un gradiente de estas quimiocinas facilitaría selectivamente las metástasis a esos órganos. El hallazgo posterior de la producción de estas quimiocinas por las propias células tumorales, y su efecto autocrino, obliga a modular esta hipótesis. Además, muchas quimiocinas tienen efectos contrapuestos dependiendo del tipo celular sobre el que actúan (tumoral, inflamatorio/ inmunitario, endotelial), su estado funcional y otras interacciones moleculares. En el melanoma las células tumorales adquieren ventajas de la expresión de quimiocinas y receptores alterando su microambiente, estimulando la angiogénesis y evadiendo la respuesta inmune, facilitando así la progresión tumoral.
Metastasis is the main cause of death from melanoma. Chemokines are low molecular weight chemotactic cytokines that facilitate cellular migration. Thus, cells that express receptors for a given chemokine are attracted to the site of its production. As certain chemokines are found in abundance in organs that are common targets of metastasis and receptors for these chemokines are expressed by tumor cells, it was hypothesized that chemokine gradients might selectively facilitate metastasis to these organs. A later finding that these chemokines were produced by tumor cells, with evidence of autocrine effects, obliged the modification of that hypothesis. Many chemokines are also known to have opposing effects according to the type of cell they are acting on (tumor, inflammatory/immune, or endothelial cells), their functional status, or interactions with other molecules. The expression of chemokines and their receptors by melanoma cells enhances tumor progression by altering their microenvironment, stimulating angiogenesis, and inhibiting the immune response.
El melanoma es el tipo de cáncer que más ha aumentado de frecuencia en el mundo en los últimos años, y en estos pacientes el desarrollo de metástasis es el indicador más fuertemente asociado a una alta mortalidad, dada la ausencia de tratamientos claramente efectivos1. Las variaciones en la expresión de determinadas quimiocinas y sus correspondientes receptores han sido propuestas como mecanismos moleculares que intervienen de forma relevante, favoreciendo o dificultando la diseminación metastásica del melanoma2–5. La comprensión de los mecanismos moleculares que permiten la progresión tumoral en el melanoma es un paso esencial que puede permitir, en última instancia, no sólo predecir, sino intervenir de forma terapéutica para evitar dicho proceso.
Las quimiocinasLas quimiocinas son una familia de citocinas quimiotácticas de bajo peso molecular (8-17 kilodaltons) que provocan respuestas de migración celular dirigida, y que son a su vez inducidas por citocinas inflamatorias, factores de crecimiento y estímulos patógenos3,5. Se han agrupado en cuatro familias: CXC, CC, CX3C y XC, en función de la posición de las dos primeras cisteínas situadas cerca de la región aminoterminal. Se conocen hasta ahora más de 50 quimiocinas que reconocen al menos 19 receptores celulares3,5 (tabla 1). Un mismo receptor puede reconocer varias quimiocinas o ligandos, pero hay 6 receptores que reconocen un único ligando. Se considera actualmente que cualquier tipo celular puede expresar quimiocinas y/ o receptores6. La expresión de estos receptores en una célula depende de su estirpe, de la fase de diferenciación, de la concentración de quimiocinas producidas en su microambiente, de las citocinas inflamatorias y de la existencia de hipoxia local5. La unión de estas quimiocinas a sus receptores en la superficie celular conlleva una serie compleja de respuestas celulares, como la activación de varias vías de señalización celular y reorganización del citoesqueleto, que favorecen la formación de pseudópodos y permiten el movimiento celular. Los receptores de quimiocinas actúan a través de proteínas G heterotriméricas que regulan vías de transducción que incluyen MAP cinasas, fosfolipasa Cβ, fosfoinositol-3 cinasa, RAS y GTPasas de la familia Rho4,7,8. Se ha destacado la participación de RhoC en el desarrollo de metástasis9. Existen además mecanismos de colaboración entre quimiocinas y metaloproteinasas10–12.
Clasificación de las quimiocinas y sus receptores
| Familia | Receptor | Quimiocinas |
| CXC | CXCR1 | CXCL6 y 8 |
| CXCR2 | CXCL1, 2, 3, 5, 6, 7, y 8 | |
| CXCR3 | CXCL9, 10 y 11 | |
| CXCR4 | CXCL12 | |
| CXCR5 | CXCL13 | |
| CXCR6 | CXCL16 | |
| CXCR7 | CXCL11 y 12 | |
| CC | CCR1 | CCL3, 4, 5, 7, 14, 15, 16, y 23 |
| CCR2 | CCL2, 7, 8, 12, y 13 | |
| CCR3 | CCL5, 7, 11, 13, 15, 24, 26, y 28 | |
| CCR4 | CCL2, 3, 5, 17, y 22 | |
| CCR5 | CCL3, 4, 5, y 8 | |
| CCR6 | CCL20 | |
| CCR7 | CCL19 y 21 | |
| CCR8 | CCL1, 4, y 17 | |
| CCR9 | CCL25 | |
| CCR10 | CCL27 y 28 | |
| CX3C | CX3CR1 | CX3CL1 |
| XC | XCR1 | XCL1 y 2 |
Uno de los grandes enigmas de la patología oncológica en los últimos dos siglos ha residido en aclarar las causas por las que se producen metástasis selectivamente en ciertos órganos y no en otros, independientemente del flujo sanguíneo que reciben y, por tanto, de la cantidad de células neoplásicas circulantes que llegan a ellos13. Fue Stephen Paget quien, tras estudiar datos de más de 900 autopsias, demostró que las metástasis en dichos órganos no se producían por azar, sino que ciertas células tumorales (“la semilla”) tenían especial afinidad por el microambiente de algunos órganos (“el terreno”), proponiendo así en 1889 la hipótesis, todavía vigente, de la semilla y el terreno14 para explicar este fenómeno.
Además, la localización de las metástasis a distancia tiene en el melanoma valor pronóstico. Así, metástasis cutáneas, subcutáneas y de ganglios linfáticos distantes se acompañan de una mayor supervivencia que las metástasis viscerales, y en este sentido, actualmente el American Joint Commitee on Cancer (AJCC) subclasifica las metástasis en: M1a para las metástasis a distancia cutáneas, subcutáneas y ganglionares, M1b para las pulmonares y M1c para las de otras localizaciones viscerales15.
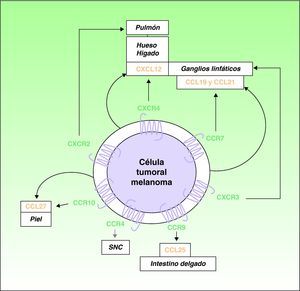
A lo largo de la última década se ha señalado el papel protagonista que desempeñan las quimiocinas y sus receptores en la diseminación neoplásica4,16. Muller et al4 encontraron una sobreexpresión de CXCR4, CCR10 y CCR7 en líneas celulares de melanoma. Dado que CXCL12, el ligando de CXCR4, se detecta de forma preferente en ganglios linfáticos, pulmón, hígado y médula ósea, estos autores postularon su papel en la distribución selectiva de las metástasis en estas localizaciones (fig. 1). Apoyando esta hipótesis se detectó la expresión de CXCR4 en metástasis subcutáneas y ganglionares de melanomas humanos, y en líneas celulares de melanoma donde facilitaban la adhesión y migración de las células tumorales merced a las interacciones con sus ligandos7. Las interacciones CXCR4 y CXCL12 son responsables de la migración celular durante la embriogénesis, de la movilización de células madre hematopoyéticas5,17, y se acepta su papel en la diseminación neoplásica4,5. Al menos una subpoblación de células neoplásicas expresa CXCR4 en muchos tipos de cáncer5. Las situaciones, como la hipoxia, que aumentan la activación del llamado “factor inducible por hipoxia”, producen un incremento en la expresión de CXCR4 en células neoplásicas18. El único ligando conocido de CXCR4 es CXCL12, una quimiocina de 68 aminoácidos que tiene propiedades angiogénicas19, promueve el crecimiento tumoral19,20 y facilita la invasión tisular incrementando la producción de varias metaloproteinasas11. En el melanoma B16, un melanoma de ratón muy bien caracterizado experimentalmente en cuanto a su potencial metastásico, las células tumorales transfectadas con CXCR4 mostraron una capacidad 10 veces mayor de desarrollar metástasis pulmonares21.
Participación de las quimiocinas y receptores en la distribución selectiva de las metástasis en los pacientes con melanoma cutáneo: las flechas gruesas negras corresponden a interacciones bien caracterizadas quimiocinas-receptor. Las flechas gruesas grises indican asociaciones potenciales no completamente caracterizadas. Las flechas curvas delgadas representan la producción autóloga de las quimiocinas (ligandos) por las propias células tumorales con efectos autocrinos.
En el melanoma es también importante el papel desempeñado por el receptor CCR7, cuyos ligandos (CCL19 y CCL21) se expresan en los vasos linfáticos dérmicos, áreas paracorticales ganglionares y vénulas de células endoteliales altas de los ganglios linfáticos22,23. Las interacciones de CCR7 con sus ligandos han sido implicadas en el desarrollo de metástasis ganglionares de melanoma en un modelo experimental en ratones23 (fig. 1). Se ha descrito asimismo la existencia de mecanismos de regulación de la expresión de los ligandos de CCR7, y en particular CCL21, en los ganglios linfáticos donde se han desarrollado las metástasis por melanoma24,25. Pero la intervención de CCL21 y CCR7 en el proceso metastático es más compleja, como comentaremos más adelante.
Es un fenómeno bien conocido que los melanomas tienen una particular tendencia a producir metástasis cutáneas. Se ha propuesto la participación en este proceso del receptor CCR10, cuyo ligando, CCL27, se expresa predominantemente en las células basales de la epidermis4 (fig. 1). Asimismo, no es infrecuente que pacientes con diseminación hematógena por melanoma tengan metástasis gastrointestinales26. CCR9 participa en el desarrollo de metástasis en el intestino delgado, donde se expresa su ligando CCL2527 (fig. 1). Recientemente se ha implicado el receptor CCR4 en las metástasis cerebrales de melanoma28 (fig. 1).
Sin embargo, se ha demostrado en los últimos años una expresión coordinada por las propias células tumorales de distintos tipos de cáncer, incluyendo el melanoma, no sólo de los receptors, sino también de las propias quimiocinas, condicionando así circuitos o bucles autocrinos en las propias células tumorales, en particular los correspondientes a CXCL12-CXCR4 y CCL21-CCR7, que desempeñan un papel esencial en el crecimiento y migración tumoral, y por tanto en una mayor agresividad de las células tumorales. Estos circuitos autocrinos estimulan la capacidad de proliferación y/ o invasión y diseminación metastásica de las células tumorales29,30.
AngiogénesisLa angiogénesis es un fenómeno esencial para el crecimiento tumoral y se correlaciona con el desarrollo de metástasis. La participación de las quimiocinas en este punto es asimismo compleja. En general, son angiogénicas las quimiocinas CXC con dominios “glu-leu-arg” (ERL), concretamente CXCL1, CXCL2, CXCL3, CXCL5, CXCL6, CXCL7 y CXCL8 (todas ellas ligandos de CXCR2), así como CXCL12 (que no tiene dominios ERL)3. Es particularmente potente como angiogénico CXCL8, cuyos receptores CXCR1 y CXCR2 se expresan en células endoteliales31. CXCL8 ejerce en buena medida su acción induciendo la producción de metaloproteinasas MMP2 y MMP9, y también del factor de crecimiento de endotelio vascular (VEGF), activando este último de forma autocrina a su receptor en las mismas células endoteliales31. Por el contrario, son anti-angiogénicas CXCL4, CXCL9, CXCL10 y CXCL113.
Respuesta inmuneLas quimiocinas actúan como mediadoras en el reclutamiento de diferentes tipos celulares en el microambiente tumoral, como linfocitos, macrófagos y neutrófilos asociados a tumores (TAM y TAN), fibroblastos, células madre mesenquimales y células endoteliales3. En este sentido ha sido importante el reconocimiento de dos tipos de TAM y TAN, los de tipo 1, antitumorales y los tipo 2, protumorales32,33. En cuanto a los linfocitos se ha propuesto que una respuesta Th1, que es mayor en melanomas en regresión34,35, tiene un efecto antitumoral, mientras que una Th2 facilita la progresión tumoral, pero la situación es más compleja. Así, por ejemplo, se pone de manifiesto con las quimiocinas CXCL10 y CXCL4, ya que ambas tienen afinidad por CXCR3 y tienen efectos opuestos. CXCL10 induce la producción por las células T de la citocina Th1 interferón-γ, mientras que CXCL4 promueve las citocinas Th2, interleucinas 4, 5 y 1336. Al parecer, CXCL10 actúa preferentemente sobre CXCR3A, mientras CXCL4 se une a la variante del mismo receptor CXCR3B36. Existen cada vez más evidencias de que las quimiocinas presentes en los tumores humanos contribuyen más en general al crecimiento tumoral, progresión e inmunosupresión que a producir una respuesta antitumoral efectiva37. Pero lo cierto es que las interacciones quimiocina-receptor en unos casos potencian y en otros dificultan la respuesta inmune. Así, la expresión de CCL27 es un importante inductor de la respuesta immune en neoplasias de células escamosas, y su inhibición contribuye a la evasión de la respuesta inmune que favorece la progresión tumoral38. De hecho, la expresión de CCL27 es más baja en metástasis de melanoma en comparación con melanomas primarios cutáneos39. Sin embargo, la sobreexpresión de CCR10, el receptor de CCL27 por células de melanoma B16, probablemente estimulada por los altos niveles de CCL27 de origen epidérmico, parece aumentar la resistencia de estas células a la respuesta inmune antitumoral, y protege de la apoptosis mediada por Fas40. De hecho, la transducción de células de melanoma B16 con CCR10, con la consiguiente producción de niveles altos de este receptor por las células tumorales, incrementa de forma notable la formación de metástasis ganglionares en ratones a los que han sido inyectadas previamente en la piel41. Asimismo, se ha descrito una expresión inmunohistoquímica de CCR10 más alta en melanomas primarios con ganglio centinela positivo que en aquellos en los que es negativo41.
También existen datos contradictorios respecto a la influencia de CXCL12 en la respuesta inmune antitumoral. La producción de CXCL12 por células neoplásicas puede disminuir la respuesta inmune frente al tumor debido a que atrae y promueve la supervivencia de células precursoras de células dendríticas (pre-DC2), que expresan CXCR4, y altera la distribución, inmunidad y estímulo de la fibrosis de las células pre-CD1, condicionando el que células dendríticas inmaduras no presenten antígenos del tumor42. Sin embargo, según otros autores43 la producción de CXCL12 por células de melanoma B16F1 modificadas genéticamente para secretar esta quimiocina, e inyectadas en ratones inmunocompetentes, tuvo como resultado que fueran rechazadas en el 50% de los casos, induciendo respuestas de memoria específicas de tumor. En este sentido, la secreción de CXCL12 por células de melanoma modificadas genéticamente atrae a linfocitos T cutáneos CXCR4-positivos en cultivos organotípicos y facilita la regresión tumoral44.
Una de las aportaciones más recientes y llamativas en este tema se refiere a CCL21. En circunstancias normales esta quimiocina es producida por las células reticulares fibroblásticas paracorticales (FRC) de los ganglios linfáticos, y atrae a ese lugar tanto a las células presentadoras de antígenos como a las propias células tumorales de melanomas, ya que ambas expresan su receptor CCR7. Se ha demostrado que las células tumorales de distintos cánceres, y entre ellos los melanomas, pueden producir CCL19 y CCL21 en situaciones de flujo intersticial lento, lo que conlleva un efecto autocrino que se ha denominado “quimiotaxis autóloga” y que potencia la migración celular en el sentido del flujo hacia los vasos linfáticos30. Cuando se comparó el comportamiento de las células de melanoma B16 con alta expresión de CCL21 con las de baja expresión, en implantes en ratones inmunocompetentes singénicos, se comprobó cómo las primeras daban lugar a tumores más grandes que las segundas, y ello a pesar de que las ricas en CCL21 atraían a más leucocitos y células presentadoras de antígenos a los tumores. Este efecto, que no se observa in vitro, depende de la reacción del huésped, ya que no se produce si los ratones son inmunodeficientes. Es decir, que una alta producción endógena por las células tumorales de CCL21 en melanomas favorece la inmunotolerancia y por tanto la mayor progresión tumoral45. Los tumores ricos en CCL21 tenían más células T reguladoras CD4+, CD25+, FoxP3+ y más TGFβ1, que favorece el cambio fenotípico de macrófagos M1 (antitumorales) a M2 (protumorales). Tenían también células inductoras de tejido linfoide (LTi), así como una red de células FRC y algunos vasos con características de vénulas de células endoteliales altas. Sin embargo, los tumores pobres en CCL21 tenían una respuesta fundamentalmente T citotóxica, con mayor producción de interferón-γ e interleucinas 2 y 445.
Supervivencia de las células tumoralesCXCL12 promueve la supervivencia de las células neoplásicas que expresan CXCR4 cuando crecen en condiciones subóptimas, como la hipoxia, que se dan con frecuencia en los cánceres18. Además, CXCL12 puede estimular la producción de metaloproteinasas, lo que facilita la invasión tisular por las células neoplásicas11. La interacción de CXCL9 con CXCR3, presente en células tumorales, también potencia su supervivencia46 y, asimismo, la migración transendotelial de células de melanoma47. De hecho, una alta expresión tanto de CXCR4 como de CXCR3 por las células tumorales de melanomas es un signo de mal pronóstico en estos pacientes48–50, aunque, por otro lado, una expresión alta de CXCR3 en los linfocitos circulantes en pacientes con melanoma en estadio III es un indicador de buena respuesta inmune antitumoral51. Además, niveles altos de CXCL10 reducen la capacidad proliferativa e invasiva de los melanomas35. Queda por aclarar el papel de CXCR7, un receptor más recientemente descrito, que liga tanto CXCL12 como CXCL11, a los que parece eliminar, y cuyo efecto en los melanomas no está aclarado3.
La acción de los ligandos de CXCR2 durante la progresión tumoral es compleja. Resulta un tanto enigmático el hecho de que la señalización de quimiocinas a través de CXCR2 induzca senescencia en las primeras fases del desarrollo tumoral, pero no en las posteriores, donde además ejerce acciones protumorigénicas, lo que quizá se deba a las alteraciones genéticas que se van sumando en las células neoplásicas52. Así, una alta expresión de CXCR1 y CXCR2 en células de melanoma les confiere un fenotipo agresivo en function de una mayor capacidad proliferativa, de migración y crecimiento tumoral53,54. También, de forma similar, se considera “bifásica” y no totalmente aclarada la participación de CCL255.
Un aspecto interesante corresponde a la situación de las células tumorales que quedan aisladas en el proceso de migración y diseminación, y que por tanto son susceptibles de sufrir un tipo especial de apoptosis denominado “anoikis”. Pues bien, CXCR4 y CCR7 permiten a estas células evitar la anoikis reduciendo la expresión del factor modificador de bcl-256.
Dianas terapéuticasLa confirmación de que la expresión de determinados receptores de quimiocinas, y sus ligandos correspondientes, condicionan el desarrollo de metástasis, ha llevado a proponer el empleo de moléculas antagonistas, bloqueadoras o inactivadoras de dichos receptores y ligandos, para evitar el proceso de diseminación metastásica del melanoma. Así, la neutralización de la interacción de algunas quimiocinas con sus receptores, como CXCL12 con CXCR4, o CCL19 y CCL21 con CCR7, evitaría previsiblemente el desarrollo de metástasis. Estudios preclínicos en melanomas y otros cánceres parecen confirmar esta hipótesis4,19,57,58. La multiplicidad e importancia de las funciones fisiológicas de las interacciones CXCL12-CXCR4 puede frenar su empleo en pacientes con melanoma. Sin embargo, CXCR4 es la diana terapéutica frente a la que más se está actuando en otros cánceres (mieloma múltiple o leucemias)3.
Existen evidencias de que la expresión de CXCL8 en melanomas funciona como un factor de crecimiento autocrino o paracrino, angiogénico y de capacidad invasiva, intervención dependiente de sus receptores, CXCR1 y CXCR2, y por tanto se consideran estos últimos como una diana terapéutica potencial31. Así, anticuerpos neutralizantes o humanizados, o moléculas inhibidoras de estos receptores (SCH-479833 y SCH-527123) inhiben, en ratones inmunodeficientes, la proliferación y crecimiento invasivo y metastático del melanoma59. No hay que olvidar que otras moléculas antagonistas para estos dos receptores (repertaxin para CXCR1, o SB-225002 y SB-332235 para CXCR2) ya se han empleado en procesos inflamatorios31.
Resulta especialmente paradójico que si una alta producción endógena de CCL21 por las células tumorales de melanomas provoca inmunosupresión, la aportación exógena de esta quimiocina produzca, sin embargo, un efecto antitumoral efectivo60. Por ello hay que ser cautos a la hora de utilizar antagonistas de CCL21, como el recientemente propuesto Chemotrap-1, que inhibe CCL21 y, a consecuencia de ello, la migración in vitro e in vivo de células de melanoma hacia los vasos linfáticos y las metástasis en tránsito61.
ConclusionesLa participación de quimiocinas y sus receptores en la progresión del melanoma es importante, compleja y dinámica, y depende tanto de características de las células tumorales como de aquellas otras presentes en el microambiente tumoral del huésped. Estas interacciones celulares y moleculares determinan si predomina un efecto potenciador que favorezca la progresión tumoral, o un efecto antitumoral, que permita la regresión o al menos la estabilización del melanoma. Por ello, se impone cautela dado el papel esencial que interacciones como CXCR4-CXCL12 desempeñan en el funcionamiento de los distintos órganos y sistemas del paciente, hasta disponer de un conocimiento más preciso de las múltiples facetas de estas interacciones. Su empleo en algunos cánceres o en procesos inflamatorios se ha iniciado, y será una fuente importante de información que permita conocer las ventajas e inconvenientes de estas manipulaciones antes de emplearlas en pacientes con melanoma.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Financiado con la ayuda FIS PI071203 del Plan Nacional de Investigación Científica, Desarrollo e Innovación Tecnológica (I + D + I), Instituto de Salud Carlos III-Subdirección General de Evaluación y Fomento de la Investigación, y la convocatoria IMPULSA de la Fundación para el Fomento de la Investigación Sanitaria y Biomédica de la Comunitat Valenciana y la Fundación Bancaja.