Presentamos un varón de 68 años, sin antecedentes personales relevantes y que no refería tomar medicación, diagnosticado de un melanoma nodular de 11mm de Breslow en la región submamaria derecha. El estudio de extensión radiológico mostraba presencia de ganglios axilares, mediastínicos e hiliares bilaterales, micronódulos bilaterales múltiples en lóbulos pulmonares superiores e inferiores que además presentaban intensa captación en la PET-TAC, lo que hacía sospechar que se tratase de lesiones metastásicas. El análisis de la mutación V600E en el gen BRAF fue positivo. Ante el diagnóstico de un melanoma metastásico estadio IV BRAF positivo se inició como primer tratamiento vemurafenib a dosis de 960mg cada 12 h. Tras casi un mes de tratamiento no se objetivó reducción de las metástasis.
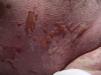
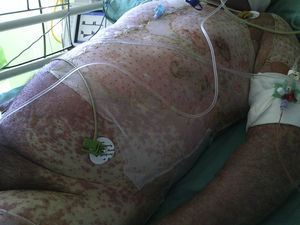
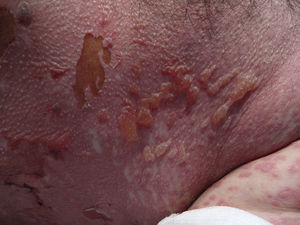
A las 4 semanas del tratamiento, el paciente acudió a Urgencias de su centro de referencia por picor y enrojecimiento en cuero cabelludo y cara. El paciente no refería síntomas previos ni fiebre. Al desnudarle se apreciaba una erupción exantemática máculo-papulosa en cuello, tronco y extremidades. El paciente fue ingresado y tratado con corticoides orales y antibioterapia. En las siguientes 48 h comenzó con disfagia, tendencia a la hipotensión arterial y reducción del ritmo de diuresis. Ante la sospecha de una reacción medicamentosa severa, el paciente fue trasladado a la Unidad de Quemados de nuestro centro. A su llegada, 72 h después del inicio de los síntomas, el paciente estaba afebril, hemodinámicamente estable y con ventilación espontánea. La exploración mostraba una afectación del 85% de la superficie corporal total con un despegamiento epidérmico del 60% así como erosiones en mucosa ocular, oral y genital (figs. 1 y 2). La frecuencia cardíaca era de 95 lpm y la saturación de O2 del 100%.
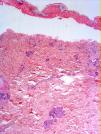
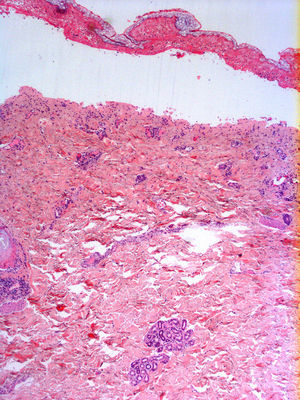
En el estudio radiológico al ingreso se observaban los hilios engrosados y adenopatías hiliares y parahiliares. No se apreciaban imágenes de consolidación. Los datos analíticos más relevantes fueron una PCR de 86, tiempo de protrombina del 60,5% y un INR de 1,25. Se realizó una biopsia que reveló una epidermis con necrosis confluente extensa y despegamiento a nivel subepidérmico. La dermis superior presentaba un infiltrado linfoplasmocitario de predominio perivascular (fig. 3). Con estos datos el paciente fue diagnosticado de necrólisis epidérmica tóxica por vemurafenib, con un SCORTEN de 3. A su llegada, se suspendió el vemurafenib y se inició tratamiento con ciclosporina a dosis de 75mg cada 12 h por vía intravenosa así como descontaminación digestiva selectiva, aporte vitamínico y nutricional, y sueroterapia. Las áreas de piel necrosadas fueron retiradas, limpiadas con suero y clorhexidina, y posteriormente cubiertas con apósitos de Biobrane® (Smith & Nephew, S.A. Sant Joan Despí, Barcelona, España).
Durante las primeras 48 h desde el ingreso en nuestro centro, las lesiones progresaron hasta afectar al 90% de la superficie corporal. Al cuarto día del ingreso, la necrólisis se detuvo y empezaron a observarse los primeros signos de reepitelización que acabó de completarse 2 semanas después.
Como complicaciones inmediatas el paciente sufrió una trombosis venosa profunda femoral y un posterior embolismo pulmonar. Respecto a las complicaciones tardías, el paciente perdió las uñas y desarrolló adherencias en ambos conductos auditivos externos y en el surco balanoprepucial. Por último, a consecuencia de la necrosis en las membranas conjuntivales, requirió un trasplante de membrana amniótica.
El paciente fue dado de alta un mes después. La ciclosporina se redujo progresivamente hasta ser suspendida por completo, a dosis de 150mg durante 5 días y 100mg otros 5 días. El paciente regresó a su centro de referencia donde ha recibido tratamiento con ipilimumab y radioterapia, con reducción de las metástasis. Hasta el momento se encuentra estable y con buen estado general.
El vemurafenib es un inhibidor selectivo de la mutación V600 del gen BRAF. Fue aprobado en 2011 por la FDA para el tratamiento del melanoma metastásico o irresecable1. La mutación BRAF se encuentra entre el 40 y el 60% de los melanomas, provocando una activación constitutiva de la vía MAP cinasa que a su vez genera un crecimiento celular descontrolado y un aumento de la proliferación celular y de la capacidad invasiva2,3.
La mayor parte de las mutaciones son V600E (sustitución de valina por ácido glutámico) aunque existen otras más infrecuentes como la V600K4.
En el estudio BRIM3 (fase III) 675 pacientes fueron aleatorizados y tratados con vemurafenib o dacarbazina, observándose una reducción del 63% del riesgo de muerte y del 74% del riesgo de progresión o muerte en aquellos tratados con vemurafenib1. Es más, los ensayos en fase I y II mostraron tasas de respuesta de hasta el 50% y una supervivencia global media de entre 14-16 meses5,6.
Sin embargo, el tratamiento con este fármaco no está exento de efectos secundarios, de los cuales la toxicidad cutánea es el más común. Los más habituales son rash, fotosensibilidad, prurito, alopecia, eritrodisestesia palmoplantar, queratosis verrucosas, queratoacantomas y carcinomas epidermoides. En cuanto al rash, afecta a casi un 40% de los pacientes, en la mayor parte de los casos es de grado 1 (leve) o 2 (moderado) por lo que no requiere suspensión del tratamiento. Solo en aquellos pacientes que presenten rash cutáneo de grado 3 (severo) o 2 intolerable se debe modificar la dosis o incluso suspender el traamiento7.
Las reacciones cutáneas severas son muy infrecuentes, de hecho, en el estudio BRIM3 se comunicó un único caso de síndrome de Steven-Johnson y otro de necrólisis epidérmica tóxica (NET)1.
No obstante, desde su comercialización han aparecido nuevos casos de toxicidad cutánea severa. Wantz et al. presentaron uno de los primeros casos de NET por vemurafenib en Europa. En este caso, el vemurafenib fue suspendido y la necrólisis se resolvió, pero la paciente falleció meses después a consecuencia del melanoma8.
Respecto al tratamiento de la NET se debe retirar el fármaco sospechoso y manejar al paciente desde unidades especializadas. No existe evidencia científica que avale el uso de tratamiento sistémico, pero en nuestro centro utilizamos ciclosporina ya que consigue detener la progresión de la erupción de forma rápida, con buena tolerancia y sin incrementar la tasa de infección o mortalidad9.
Presentamos el primer caso de NET por vemurafenib en nuestro país. Como conclusión, creemos que los pacientes que reciban este tratamiento deben ser vigilados muy estrechamente por el dermatólogo, sobre todo, prestando especial atención al desarrollo de rash cutáneo con signos de gravedad como despegamiento epidérmico o afectación de mucosas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.