La macroglobulinemia de Waldenström (MW) es una discrasia sanguínea caracterizada por la proliferación monoclonal de células linfoplasmocitarias en la médula ósea, ganglios linfáticos y bazo. Estos pacientes tienen niveles elevados en suero y depósito en tejidos de la inmunoglobulina (Ig) M, de tipo monoclonal, producida por estas células aberrantes. Presentamos el caso de un paciente afecto de MW, con lesiones cutáneas debidas al depósito de cadenas ligeras Kappa de IgM y con manifestaciones clínicas secundarias a la crioglobulinemia tipo I que el paciente tenía asociada. Discutimos los distintos proceso patológicos cutáneos provocados por la IgM en la MW.
Waldenström macroglobulinemia is a blood dyscrasia characterized by monoclonal proliferation of Bcells in the bone marrow, lymph nodes, and spleen. Patients with this disease show elevated serum levels and tissue deposition of monoclonal immunoglobulin (Ig) M produced by these aberrant cells. We present the case of a patient with Waldenström macroglobulinemia who suffered cutaneous lesions resulting from deposition of κ light chains of IgM and clinical manifestations secondary to associated type I cryoglobulinemia. We discuss the different pathological cutaneous processes caused by IgM in Waldenström macroglobulinemia.
La macroglobulinemia de Waldenstrom (WM) es una discrasia sanguínea causada por una proliferación monoclonal de células linfoplasmocitarias tipo B en la médula ósea, ganglios linfáticos y bazo1. Típicamente cursa con un incremento de los niveles de inmunoglobulina (Ig) M monoclonal en suero y en los tejidos.
Las lesiones cutáneas asociadas a esta patología son raras, y sólo aparecen aproximadamente en un 5 % de los pacientes. Estas lesiones pueden ser causadas por varios factores: infiltración de las células neoplásicas en la piel, depósito de IgM en los tejidos, alteraciones secundarias a la presencia de crioglobulinemia o pueden ser consecuencia de un síndrome de hiperviscosidad sanguínea2–6. Además, puede aparecer un grupo de miscelánea (tabla 1).
Manifestaciones cutáneas asociadas con la macroglobulinemia de Waldenstrom
|
IgM: inmunoglobulina; MW: macroglobulinemia de Waldenström.
Presentamos el caso de un paciente afecto de WM con lesiones cutáneas secundarias al depósito de cadenas ligeras de IgM, junto con otras manifestaciones clínicas debidas a la crioglobulinemia tipo I que el paciente tenía asociada. Discutimos las manifestaciones cutáneas que se pueden presentar en esta enfermedad y su patogenia, dentro del mecanismo de producción de la enfermedad linforreticular.
Caso clínicoVarón de 72 años que acudió a nuestra consulta presentando hiperqueratosis y ulceración en la cara lateral de ambos pies de 2 años de evolución. Estas lesiones venían acompañadas de disestesias en los pies y sensación de quemazón, las cuales le causaban dificultad en la deambulación. También refería sensación de obstrucción en la fosa nasal izquierda y zumbidos en los oídos. Desde hacía varios meses le habían aparecido también unas lesiones sobreelevadas de coloración pardo-rojiza en las rodillas y los glúteos. No refería la presencia de ninguna otra sintomatología sugestiva de patología sistémica.
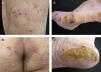
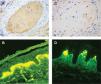
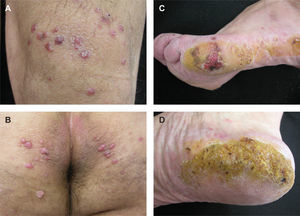
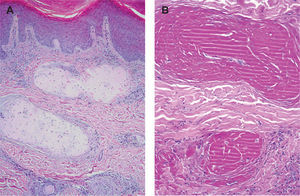
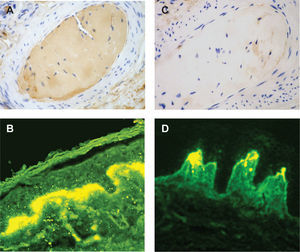
En la exploración física destacaba la presencia de pápulas pardo-rojizas en las rodillas (fig. 1A), glúteos y región perianal (fig. 1B). En la cara lateral de los pies se podían observar áreas de hiperqueratosis con ulceración, con un fondo eritematoso que seguía un patrón livedoide (figs. 1C y D). Realizamos dos biopsias cutáneas, una de las lesiones de las rodillas y la otra de la cara lateral de los pies. En la lesión de las rodillas el hallazgo más significativo era la presencia de un material hialino eosinofílico localizado en la dermis y en el tejido celular subcutáneo (fig. 2A), así como en la luz de los vasos sanguíneos en cantidad suficiente como para ocasionar su obstrucción. Este material se teñía fuertemente con la tinción de ácido periódico de Schiff (PAS) después de la tinción con diastasa (fig. 2B). La tinción con rojo Congo fue negativa. Las técnicas de inmunohistoquímica mediante inmunoperoxidasa revelaron que los depósitos de hialina se marcaban para cadenas ligeras κ (DAKO, anticuerpos policlonales, dilución 1/100.000, método de amplificación Envision) (fig. 3A), pero no con cadenas ligeras λ (fig. 3C). Al mismo tiempo, había positividad para las cadenas ligeras y para la tinción PAS en el espacio intercelular de la epidermis y en la zona de la membrana basal. Una biopsia de las lesiones de los pies reveló la presencia de un moderado infiltrado inflamatorio predominantemente neutrofílico, con evidencia de leucocitoclastia, alrededor de los vasos sanguíneos, y daño del endotelio. La inmunofluorescencia (IF) directa de las lesiones mostraba un depósito lineal de IgM (+ + +) en la membrana basal de la epidermis (fig. 3B) y depósitos discontinuos de C3 (+). En la piel perilesional la IF indirecta fue positiva de forma discontinua para IgM (fig. 3D). La IF directa fue negativa en piel no lesional. La IF indirecta mediante la técnica de salt-split-skin 1mM ClNa no reveló alteraciones valorables. Realizamos inmunoblotting usando extracto de epidermis, extracto dérmico y cultivo de queratinocitos, siendo negativa para IgG.
A. Tinción de hematoxilina-eosina en la que se observa un depósito de material amorfo esinofílico que ocluye parte de las luces vasculares y que aparece también depositado en zonas extravasculares de la dermis papilar y reticular (original ampliación x40). B. Este material amorfo se teñía fuertemente mediante ácido peryódico de Schiff (PAS) (original amplificación ×100).
Estudios de immunoperoxidasa que muestran la tinción del material amorfo con anticuerpos de cadenas ligeras κ (A), pero no con cadenas ligeras λ (C). Estudios de inmunofluorescencia directa para IgM, donde se observa un marcado depósito lineal en la unión dermoepidérmica de la piel lesional (B) y un depósito discontinuo no lineal en la piel perilesional (D) (original amplificación ×40). IgM: inmunoglobulina M.
En la analítica efectuada al paciente destacó una IgM sérica de 3.950 mg/dl (valores normales 70-150 mg/dl), y mediante inmunoelectroforesis se demostró que se trataba de una IgM monoclonal. El resto de las Ig (IgG, IgA e IgD) se encontraban dentro de los límites de la normalidad. El paciente fue diagnosticado también de crioglobulinemia tipo I y el valor de la viscosidad sérica era de 3,4 centipoises (VN: 1,6-1,95). El resto de la analítica realizada fue negativa o normal: hemograma, bioquímica general, hematocrito; anticuerpos antinucleares (ANA), anti-ADN y antígeno extraíble del núcleo (ENA), y proteínas de Bence-Jones en orina.
Una biopsia de la médula ósea reveló una proliferación de células linfoplasmocitoides características de MW. Otras exploraciones radiológicas como radiografía de tórax, ecografía abdominal y tomografía axial computarizada (TAC) toraco-abdominal fueron normales. También se realizó un estudio neurofisiológico, demostrándose una polineuropatía sensitivomotora en las extremidades inferiores.
El paciente inició un tratamiento con plasmaféresis observándose una mejoría clínica a los 4 meses, que se mantiene en la actualidad.
DiscusiónLibow et al7 clasificaron las lesiones cutáneas de la MW en dos categorías: neoplásicas (MW cutánea) y no neoplásicas. Estas últimas pueden estar asociadas al síndrome de hiperviscosidad, a crioglobulinemia, al depósito de IgM en la piel o a un grupo de enfermedades misceláneas (tabla 1).
Las lesiones cutáneas neoplásicas en la MW son las menos frecuentes en esta enfermedad. Estas lesiones cutáneas son secundarias a la infiltración de la piel por células neoplásicas linfoides. Se presentan clínicamente como placas pardo-rojizas infiltradas. Este tipo de lesiones, que no se observaron en nuestro paciente, suelen manifestarse en el transcurso de la enfermedad, aunque ocasionalmente puede ser una presentación inicial2,5,7–15.
Las manifestaciones cutáneas no neoplásicas de la MW son más variadas y aparecen con más frecuencia15–25. La mayoría son secundarias al fenómeno de hiperviscosidad y a la presencia de crioglobulinemia (tabla 1). La presentación clínica del síndrome de hiperviscosidad suele manifestarse como fallo cardíaco, cefaleas, tinnitus, alteraciones visuales y hemorragias, estas últimas debido al atrapamiento de factores de la coagulación por parte de la IgM2. Asimismo, las manifestaciones clínicas asociadas a crioglobulinemia pueden ser variadas, incluyendo glomerulopatías, neuropatías, fenómeno de Raynaud, livedo reticularis y ulceraciones cutáneas (tabla 1). Nuestro paciente presentó una crioglobulinemia tipo I asociada a la MW, con lesiones purpúricas en los pies de patrón livedoide y lesiones de vasculitis leucocitoclástica, que probablemente fueron la causa de las úlceras acrales y de la neuropatía periférica, tal y como está descrito en la literatura2–4.
Las manifestaciones cutáneas no neoplásicas de la MW también pueden ser secundarias al depósito de la paraproteína IgM en la piel (tabla 2), mostrando cuatro formas clínicas distintas. En primer lugar, en algunos pacientes con MW existen lesiones papulosas-pruriginosas asociadas al depósito de IgM en la zona de la membrana basal (ZMB)25. Los hallazgos histológicos de estos pacientes sólo muestran un infiltrado linfocitario perivascular no neoplásico. Estos pacientes pueden tener asociados anticuerpos IgM circulantes contra la ZMB.
Procesos patológicos asociados con anticuerpos IgM que afectan a la piel en la macroglobulinemia de Waldenstrom (MW)
| Referencias | Hallazgos clínicos | Crioglobulinemia | Formas histológicas | IFD de piel lesional y perilesional | IFD de piel no lesional | IFI | Microscopía electrónica | Immunoblotting |
| Whittakeret al16Wuepper et al17Gompel et al18Morita et al19 | Dermatosis ampollosa | No realizada, negativa o mixta IgM/lgG policlonal | Separación subepidérmica | Depósitos linealesde IgM a lolargo de la ZMB | Depósitos lineales de IgM a lo largo de la ZMBDébil depósito de IgM en la epidermis y en el área vascular de la dermis superficial | Anticuerpos IgManti-ZMBAnticuerpos IgM anti-ZMB que reaccionan tanto en el lado epidérmico como dérmico de la ZMB mediante la técnica de salt-split | No hecha | No hecho o negativo |
| Lipskeret al20Tichenor et al21Hanke et al22Mascara et al5Lowe et al23 | Pápulas IgM de almacenamiento (= macroglobulinemia cutis) | No hecha o negativa | Depósito amorfo eosinofílico en dermis | Depósito de IgM intercelular en la epidermisDepósito focal de IgM en dermis | No hecha | Negativa | No hecha | No hecho o negativo |
| West et al24 | Dermatosis ampollosa y pápulas IgM de almacenamiento | Negativa | Separaciónsubepidérmica y depósito de material amorfo eosinofílicoen dermis | Depósito lineal de IgM a lo largo de la ZMB | No hecha | Anticuerpos IgM anti-ZMB | Depósitosde material amorfo enla dermis superficialjusto debajo de la lámina densa | Banda de 290 KD en el extracto dérmico |
| Cobbs et al25 | Pápulas eritematosas | Negativa | Infiltración linfocítica perivascular superficial | Depósito lineal de IgM a lo largo de la ZMB | No hecha | Anticuerpos IgM-k anti-ZMB que reaccionan con el lado epidérmico y dérmico de la ZMB mediante la técnica de salt-split | No hecha | Negativo |
| Nuestro caso | Pápulas IgM de almacenamiento | Tipo I | Depósito de material amorfo en dermisInfiltración neutrofílica perivascular | Depósito lineal de IgM a lo largo de la ZMB | Negativa | Ni anticuerpos IgG ni IgM mediante la técnica de inmunofluorescencia salt-split | No hecha | Negativo para IgM |
IFD: inmunofluorescencia directa; IFI: inmunofluorescencia indirecta; Ig: inmunoglobulina; MW: macroglobulinemia de Waldenstrom; ZMB: zona de membrana basal.
En otros casos16–19, las lesiones cutáneas se asocian un depósito lineal de IgM a lo largo de la ZMB, en piel lesional y perilesional con presencia de una dermatosis ampollosa subepidérmica (tabla 2). En estos casos la IF indirecta usando la técnica de salt-split es positiva para IgM, tanto en el lado dérmico como en el epidérmico de la ZMB, o sólo en el lado dérmico. Algunos autores han sugerido que estos pacientes presentarían un penfigoide ampolloso o epidermolisis ampollosa adquirida asociada a MW. En estos casos todos los estudios de inmunoblotting o no se han realizado o han resultado negativos. Quizá en estos pacientes se estén produciendo anticuerpos IgM monoclonales, que están causando una enfermedad ampollosa autoinmunitaria, y que sean dirigidos contra antígenos de la membrana basal todavía sin identificar.
Las pápulas translúcidas eritematosas pueden aparecer asociadas a la MW, y son también llamadas pápulas de almacenamiento o pápulas IgM de almacenamiento (storage papule disease o IgM storage papules) o macroglobulinemia cutis5,20–23. Suelen aparecer en extremidades, glúteos y tronco. Los estudios histológicos de esta entidad revelan la presencia de un material homogéneo eosinofílico en la dermis, PAS positivo y rojo Congo negativo, como consecuencia del depósito de IgM en la dermis23. Estos hallazgos demuestran que probablemente se produzca una extravasación de cadenas ligeras de IgM, encontrándose estos depósitos mediante IF directa en el material amorfo de la dermis, y en espacios intercelulares de la epidermis. La IF indirecta suele ser negativa, y los pacientes no suelen presentar crioglobulinemia asociada (tabla 2). En nuestro paciente, las lesiones cutáneas eran clínica, histológica e inmunohistoquímicamente semejantes a las storage papules descritas en la MW. Sin embargo, en nuestro paciente la IF directa fue positiva sólo para IgM en el lado subepidérmico de la ZMB.
En el caso clínico descrito por West et al24 se muestran tres anormalidades histológicas relevantes: depósito de material amorfo en la dermis, alrededor de los vasos sanguíneos, así como debajo de la lámina densa de la membrana basal; dermatosis ampollosa subepidérmica (tabla 2) y, por último, la presencia de un depósito lineal de IgM en la ZMB y ocasionalmente alrededor de los vasos sanguíneos. Usando técnicas de inmunoblotting con extractos dérmicos se han encontrado anticuerpos IgM circulantes contra un antígeno proteico de 290 KD, postulándose que puede tratarse de anticuerpos frente al colágeno tipo VII, el antígeno de la epidermólisis ampollosa adquirida. La IF indirecta suele ser positiva. Nuestro paciente presentaba una acumulación de material amorfo en la dermis, tenía la IF directa positiva para IgM en la ZMB, pero en cambio no presentaba una dermatosis ampollosa subepidérmica.
Finalmente, la MW puede estar asociada con varias enfermedades con manifestaciones cutáneas como el síndrome de Schnitzler26, las dermatosis urticariales27, las enfermedades por depósitos amiloideos28, el xantoma disseminatum29 o pénfigo paraneoplásico30.
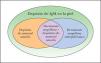
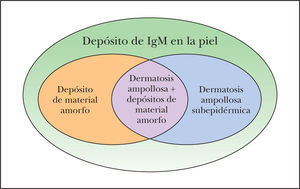
En resumen, un pequeño número de pacientes con MW desarrollará lesiones cutáneas asociadas al depósito de IgM en la piel como única manifestación, en forma de dermatosis ampollosa subepidérmica o como depósito de material amorfo en la dermis, o como ambas formas. En otros casos, los pacientes presentarán manifestaciones clínicas de ambos tipos (fig. 4). Además, sólo unos pocos pacientes desarrollarán manifestaciones secundarias a la crioglobulinemia o al síndrome de hiperviscosidad.
Los pacientes con macroglobulinemia de Waldenstrom que presentan lesiones cutáneas no neoplásicas pueden presentar diferentes tipos de manifestaciones secundarias al depósito de IgM en la piel. En unos casos pueden aparecer lesiones ampollosas subepidérmicas, en otros un depósito de material amorfo en la dermis y en otros puede asociarse a ambos tipos de manifestaciones. IgM: inmunoglobulina M.
No son conocidos los mecanismos implicados en el depósito de la IgM en la piel en algunos pacientes con MW, y por qué en algunos casos se produce ese depósito en la ZMB, causando una dermatosis ampollosa subepidérmica, y en otros únicamente depósitos de material amorfo en la dermis y en los vasos sanguíneos. Más estudios con pacientes similares son necesarios para comprender la fisiopatología de esta sorprendente manifestación clínica de la MW.