INTRODUCCION
El linfoma primario de células B de la zona marginal (LCBZM) es el linfoma cutáneo primario de células B más frecuente junto con el linfoma centrofolicular. La European Organization for Research and Treatment of Cancer (EORTC) lo incluye conjuntamente con la Organización Mundial de la Salud (OMS) dentro de los linfomas de comportamiento indolente, dado que su pronóstico es excelente, con una supervivencia a los 5 años de aproximadamente el 100 % 1. Este tipo de linfoma afecta predominantemente a pacientes de edad media y no muestra clara predilección por ningún sexo. Clínicamente suele cursar con pápulas, nódulos o placas eritematovioláceas asintomáticas, infiltradas, solitarias o múltiples, que suelen localizarse en tronco o extremidades superiores 2. En ocasiones estas lesiones se rodean de un halo eritematoso 3. Su diseminación extracutánea es rara. A pesar de su curso clínico favorable, con cierta frecuencia desarrollan recurrencias cutáneas.
En algunos casos la Borrelia burgdorferi puede desempeñar un papel en la patogenia de este tipo de linfoma. En una región de Austria con infecciones por Borrelia endémicas, se detectaron secuencias específicas de Borrelia en el 18 % de los linfomas cutáneos primarios de células B 4. En Escocia 5 se obtuvieron resultados similares. El tratamiento de elección en el caso de lesiones aisladas sería la radioterapia y/o cirugía. Otras alternativas terapéuticas serían los corticoides sistémicos o intralesionales, interleucina-2 e interferón alfa-2a, en administración intralesional o subcutánea 6. Desde hace aproximadamente 8 años se está utilizando el rituximab en monoterapia como alternativa terapéutica o incluso como terapia de primera elección 7.
Se presenta el caso de un paciente diagnosticado de un LCBZM con múltiples lesiones que presentó remisión del cuadro después del tratamiento con infusión intravenosa de rituximab.
DESCRIPCION DEL CASO
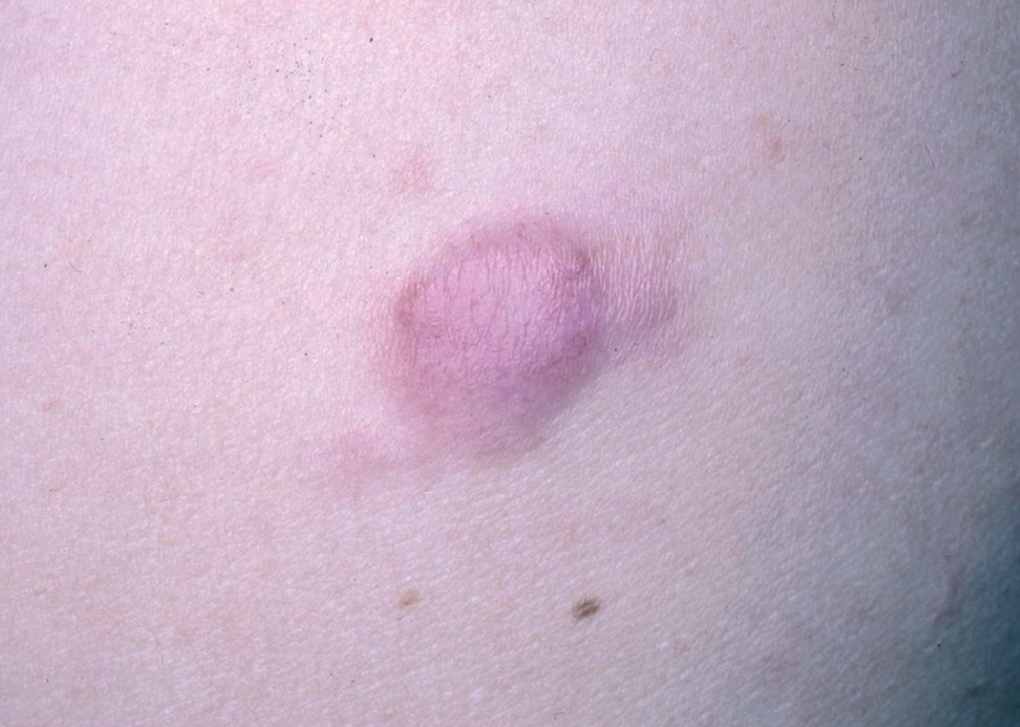
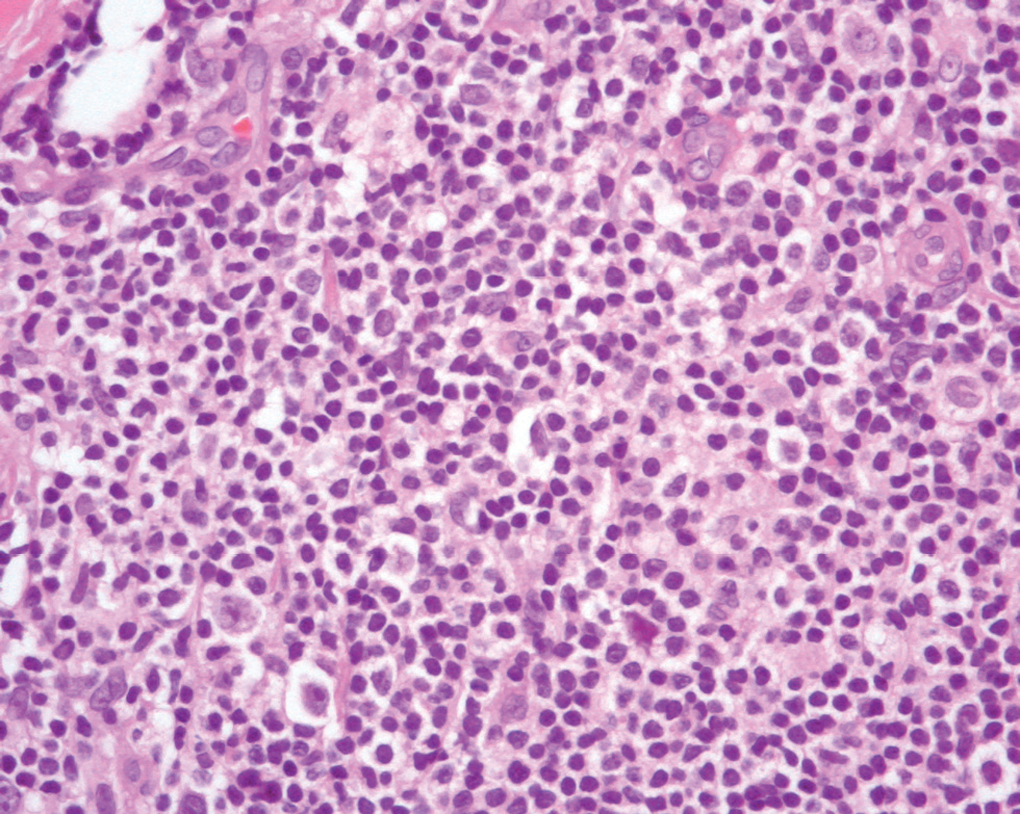
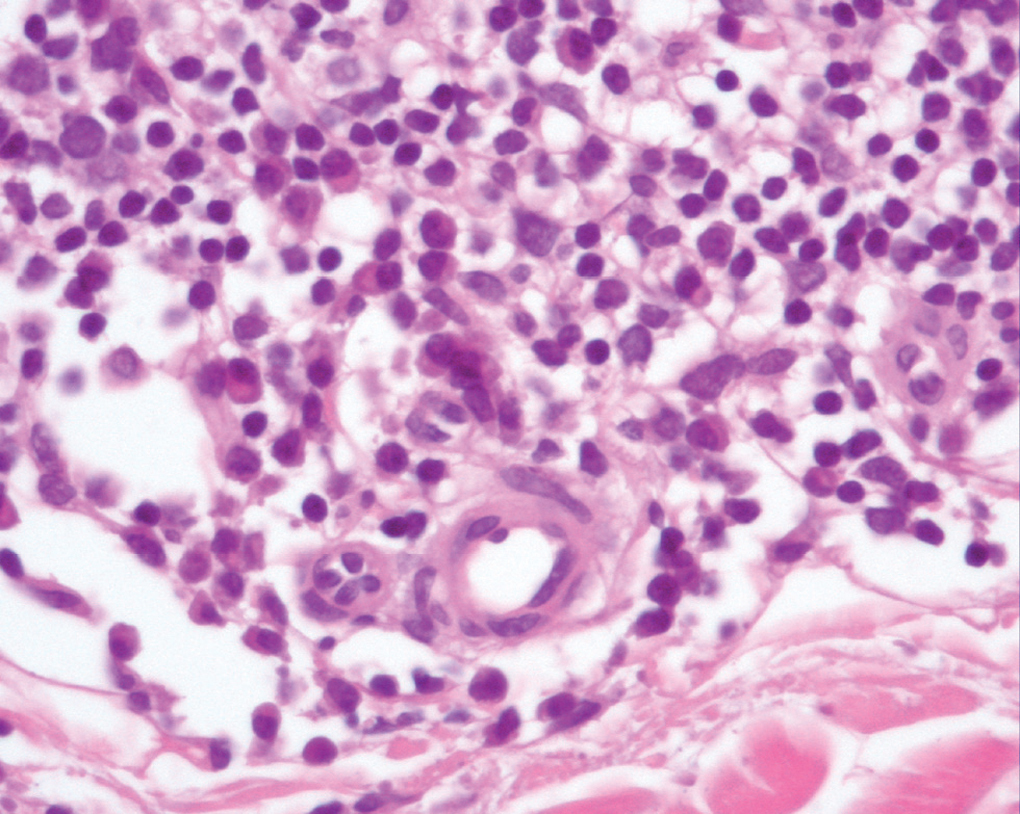
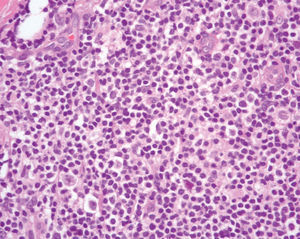
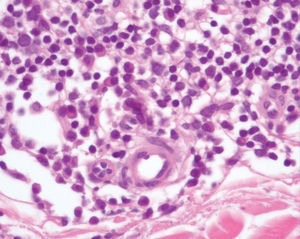
Un varón de 40 años, sin antecedentes de interés, acudió a consulta en noviembre de 1994 por un cuadro de 2 años de evolución consistente en la aparición de una placa eritemato-rosácea asintomática en costado izquierdo, que había aumentado de tamaño lenta pero progresivamente, hasta alcanzar 1,5 x 1 cm (fig. 1). Se hizo una biopsia que podía resultar compatible con linfoma cutáneo de bajo grado y la lesión remitió tras la administración de corticoides intralesionales. Se realizó un estudio de extensión que incluía hemograma, bioquímica con proteinograma, cuantificación de inmunoglobulinas, marcadores linfocitarios y tomografía computarizada (TC) toracoabdominal sin encontrarse ningún hallazgo patológico. El paciente acudió de nuevo a la consulta en septiembre de 2001 por la aparición un año antes de una lesión nodular eritematosa, pruriginosa e indurada en glúteo izquierdo que había ido aumentando progresivamente de tamaño hasta alcanzar 3 x 2 cm. En la exploración se objetivaron otras dos lesiones: una lesión redondeada de similares características y adyacente a la previa de 0,5 cm y una segunda consistente en una placa eritematosa de 0,6 cm, infiltrada a la palpación, en superficie de extensión del codo derecho. Ambas lesiones presentaban una evolución desconocida por el paciente. Se realizó biopsia de la lesión localizada en el glúteo izquierdo y el estudio histológico mostró un infiltrado linfoide de patrón nodular con afectación más marcada en dermis profunda y sin afectación epidérmica. La celularidad predominante correspondía a linfocitos de pequeño tamaño de aspecto maduro (fig. 2), entre los que se observaba, con intensidad variable en los diferentes nódulos, linfocitos de citoplasma claro con núcleo discretamente hendido. En menor cuantía se observaban linfocitos de aspecto transformado. También destacaba con mucha frecuencia la presencia de células plasmáticas en la parte periférica de los nódulos linfoides (fig. 3).
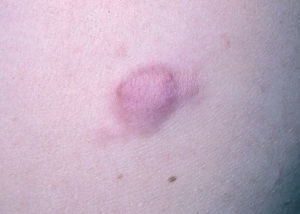
Fig. 1.--Placa eritematosa localizada en el costado izquierdo que presenta morfología anular, límites mal definidos y superficie lisa.
Fig. 2.--Proliferación linfoide de células pequeñas con ocasionales células blásticas. (Hematoxilina-eosina, x200.)
Fig. 3.--Agregados de células plasmáticas maduras en la parte periférica de los nódulos linfoides. (Hematoxilina-eosina, x400.)
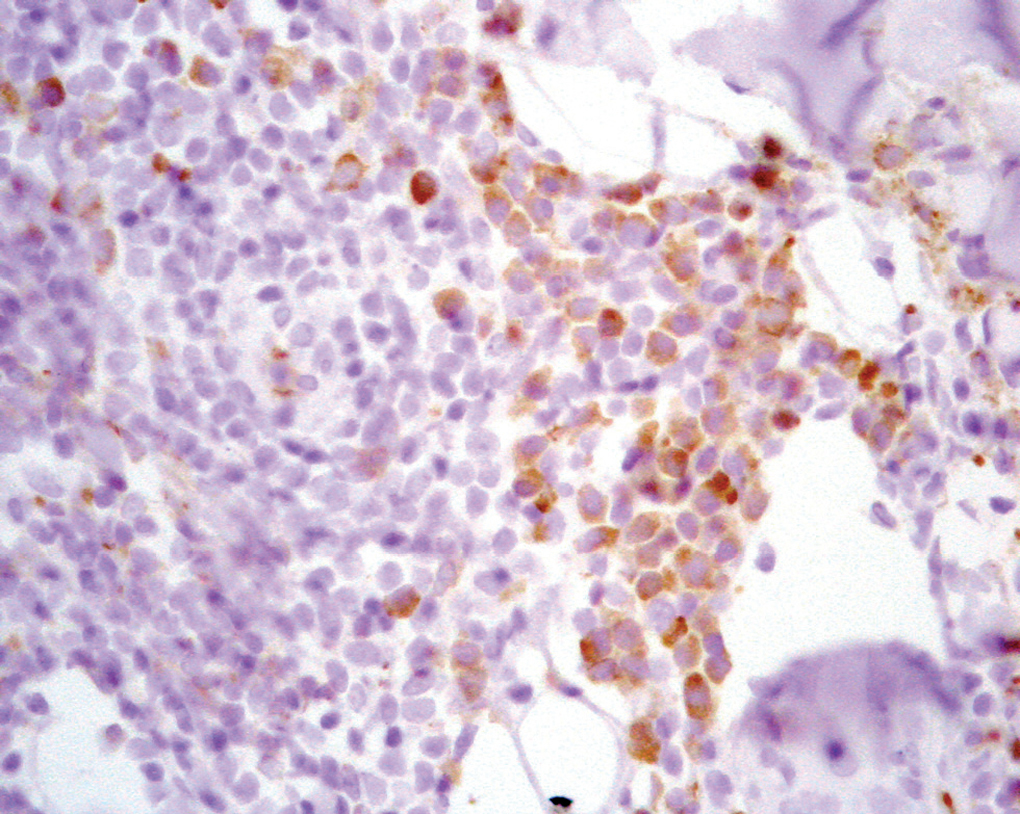
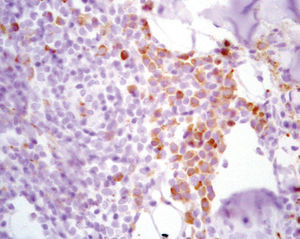
El estudio inmunohistoquímico resultó positivo para marcadores de linfocitos B (CD20, CD79a) y negativo para bcl-2, bcl-6, CD10 y CD30. Se observaron abundantes linfocitos T (CD3) acompañantes. Se comprobó monoclonalidad en las células plasmáticas con las cadenas ligeras kappa (fig. 4).
Fig. 4.--Restricción de cadenas ligeras k. (Hematoxilina-eosina, x400.)
Dentro de las pruebas complementarias realizadas, el estudio de imagen con TC cervicotoracoabdominopélvica resultó normal, al igual que el aspirado y la biopsia de médula ósea. El reordenamiento resultó negativo en sangre periférica y médula ósea y el inmunofenotipo fue normal. El estudio con reacción en cadena de la polimerasa (PCR) para detección de reordenamiento clonal linfoide sobre material congelado no detectó reordenamiento de IgH. En el estudio bioquímico presentaba β2-microglobulina y lactato deshidrogenasa (LDH) normales. Las pruebas para la detección de B. burgdorferi resultaron negativas, tanto la serología como la realización de PCR sobre muestra de biopsia congelada, al igual que las distintas serologías para virus linfotropos del grupo herpes como el virus de Epstein-Barr, citomegalovirus y virus herpes humano-8 (VHH-8). Las serologías para el virus de la inmunodeficiencia humana (VIH) y el virus de la hepatitis C (VHC) resultaron a su vez negativas, al igual que la detección de anticuerpos autoinmunes (ANA, SSA, SSB, Sm, RNP y Jo-1). Los valores de complemento estaban dentro de los límites de la normalidad. Con todos estos datos se realizó el diagnóstico clinicopatológico de LCBZM.
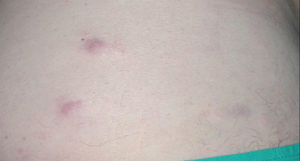
Desde el año 2001 le fueron apareciendo ocasionalmente lesiones similares a las descritas en distintas localizaciones anatómicas, entre ellas región dorsal de la espalda, extremidades superiores, glúteos y las fosas ilíaca y poplítea. Estas lesiones fueron bien controladas mediante extirpación quirúrgica hasta el año 2004, momento en el que el paciente presentó un brote de lesiones de forma diseminada. La exploración física mostraba numerosas lesiones consistentes en placas, tumores y nódulos subcutáneos de tamaño variable entre 1 y 4 cm localizados en abdomen, glúteos, superficie de extensión de codo y hombro derechos, flancos y extremidades inferiores (fig. 5). La mayor parte de las lesiones eran de morfología circular u ovalada y estaban infiltradas al tacto. Los estudio complementarios mostraron hallazgos semejantes a los encontrados en el año 2001.
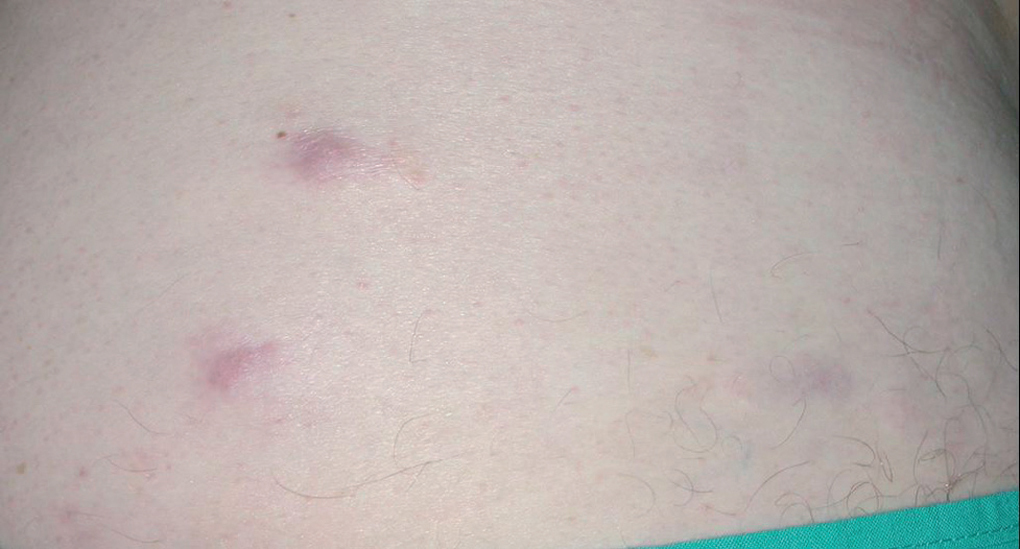
Fig. 5.--Placas y nódulos eritematosos distribuidos de forma diseminada por el abdomen.
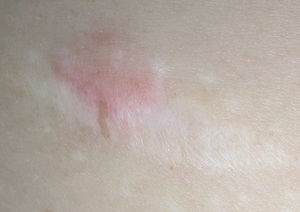
Se decidió iniciar tratamiento con rituximab dada la extensión del cuadro y la imposibilidad de poderlo controlar mediante cirugía y/o radioterapia. El rituximab se pautó en infusión intravenosa con una dosis de 375 mg/m 2 (850 mg/infusión), una vez a la semana durante 4 semanas consecutivas. Durante la primera infusión, a las 1,5 h del inicio de la misma (ritmo 250 ml/h), el paciente comenzó con prurito y tumefacción únicamente en zonas de presencia de lesiones y en las cicatrices de lesiones extirpadas previamente (fig. 6) con formación de un halo eritematoso circundante, con pequeños nódulos en periferia que no clareaban a la presión. En las posteriores infusiones no se objetivó una reacción urticariforme similar a la previa. El paciente presentó buena tolerancia al resto del tratamiento aunque esporádicamente presentó náuseas, vómitos, fiebre y subidas discretas de presión arterial tras las infusiones.
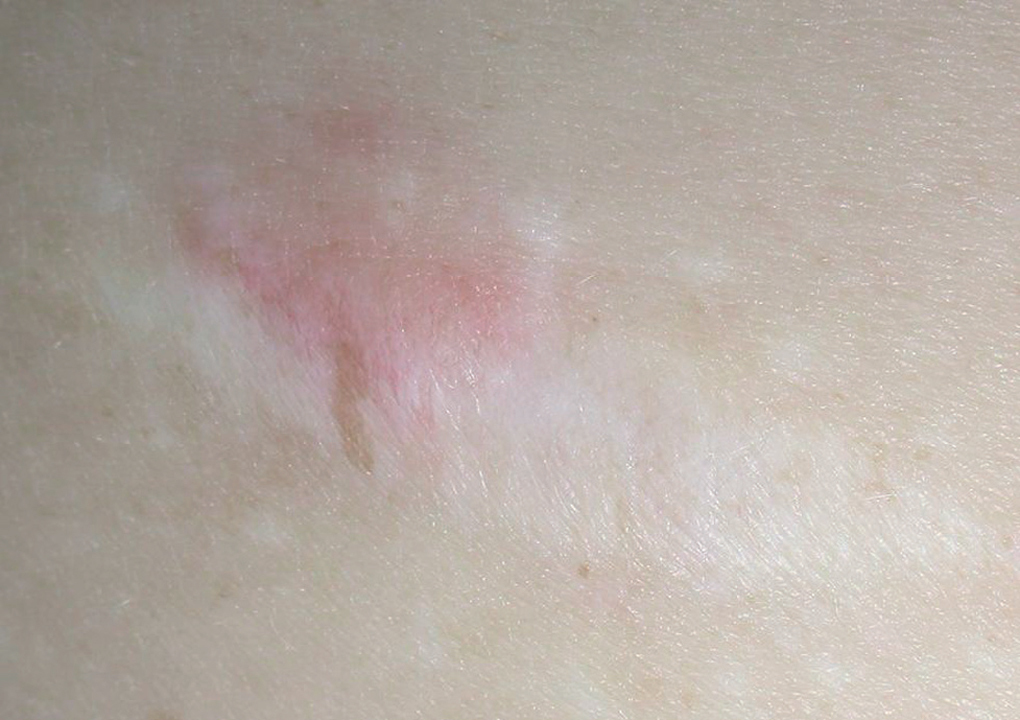
Fig. 6.--Se aprecia la presencia de un nódulo eritematoso, infiltrado al tacto sobre una cicatriz de una extirpación previa localizada en el flanco derecho.
El paciente alcanzó la remisión completa después de la primera infusión. No obstante, se completó el tratamiento hasta realizar un total de 4 infusiones.
COMENTARIOS
Los linfomas cutáneos de células B constituyen el 20-25 % de los linfomas cutáneos primarios y presentan de forma general mejor pronóstico que sus homólogos de origen ganglionar. La gran mayoría de los linfomas cutáneos primarios B son linfomas centrofoliculares y linfomas de zona marginal y probablemente sea este último grupo el que se presenta con mayor frecuencia 8. El concepto de LCBZM define un subtipo de linfomas formado por células de tipo centrocito (pequeñas con núcleo hendido), células B monocitoides y con cierto grado de diferenciación plasmocitoide (células plasmáticas y linfoplasmocitarias). Los LCBZM suelen expresar CD20, CD22 en el caso de los linfocitos B y CD79a las células plasmáticas y plasmocitoides. La detección del reordenamiento del gen de las cadenas pesadas de las inmunoglobulinas (IgH) mediante PCR demuestra una población clonal linfoide B en el 50-70 % de los casos de LCBZM 9. Ocasionalmente en la patogenia del LCBZM se han implicado virus linfotropos (virus de Epstein-Barr, citomegalovirus, VIH, VHH-8), VHC y B. burgdorferi. En este paciente el reordenamiento y las serologías realizadas resultaron negativas. Excepcionalmente, los LCBZM se asocian a enfermedades autoinmunes, pero en este caso se descartó razonablemente dicha asociación.
El rituximab, anteriormente conocido como IDEC-C2B8, es el primer anticuerpo monoclonal aprobado en 1997 por la Food and Drug Administration (FDA) para el tratamiento de linfomas no hodgkiniano de células B de bajo grado o foliculares CD20+κ10. Es una molécula quimérica anti-CD20 que presenta dos regiones: una región variable de origen murino y una región constante de origen humano IgG1k 11. La duración de la respuesta media de este anticuerpo es aproximadamente de 12 meses aunque en ocasiones se requieren reinfusiones para conseguir un periodo mayor libre de enfermedad 12. En líneas generales, la terapia con rituximab es bien tolerada. Como efectos secundarios, se observan con mayor frecuencia fiebre, escalofríos, náuseas, astenia y cefalea. Habitualmente estos síntomas ocurren entre los primeros 30 y 120 min tras el inicio de la primera infusión y suelen limitarse a la duración de la misma. En menor medida se observa hipotensión, neutropenia y trombocitopenia 13. De forma anecdótica se han descrito casos de reacción de hipersensibilidad en forma de síndrome de liberación de citocinas 14 o formación de anticuerpos humanos antimurinos en menos del 1 % de los casos 10. Además, se ha descrito en raras ocasiones una reacción urticariforme relacionada con la administración de rituximab en infusión intravenosa 13,15,16. Heinzerling et al 16 publicaron 10 pacientes con linfomas B cutáneos primarios tratados con rituximab. Uno de ellos presentó dolor punzante localizado en las lesiones cutáneas tras la infusión y otro paciente sufrió una reacción urticarial en las mismas. En este último paciente las lesiones urticariformes se localizaron en los nódulos tumorales y en las cicatrices de los tumores previamente extirpados, al igual que ocurrió en nuestro caso. Heinzerling et al no refirieron el tiempo transcurrido entre el inicio de la infusión y el comienzo de la reacción, que en nuestro caso fue de aproximadamente 1,5 h y sólo durante la primera infusión. Este cuadro es autolimitado y no requiere tratamiento. McLaughlin et al 12 presentaron un estudio multicéntrico de 166 pacientes con linfomas foliculares o de bajo grado tratados con rituximab en infusión intravenosa, de los cuales 22 (13 %) presentaron prurito y 10 (6 %), una reacción urticariforme similar a la de nuestro caso. Este tipo de reacciones se pueden prevenir aunque no evitar con la administración de premedicación con antihistamínicos y esteroides. Nuestro paciente presentó, a su vez, náuseas, vómitos, fiebre y subidas discretas de presión arterial que se fueron acentuando desde la primera hasta la última infusión. Sin embargo, la tolerancia del fármaco fue buena y no se requirió la suspensión de la medicación en ninguna de las infusiones.
En la revisión de la literatura médica podemos encontrar diversos casos de linfomas B de zona marginal tratados con rituximab, pero en pocas ocasiones corresponden a LCBZM tratado con rituximab en infusión intravenosa 17. Nuestro caso de LCBZM consiguió una remisión tumoral tras cuatro infusiones intravenosas de rituximab. La mejoría se produjo de forma notable ya desde la primera infusión, momento desde el cual se observaban lesiones menos infiltradas que progresivamente fueron evolucionando hasta desaparecer completamente. Al finalizar el tratamiento sólo se apreciaba una pigmentación residual. La aparición de una reacción urticariforme como la descrita en nuestro caso es un hecho que se constata en aproximadamente el 7 % de los casos.
Rituximab podría ser considerado como tratamiento de primera elección en este tipo de linfomas, en el caso de lesiones diseminadas, ya que la eficacia es alta y los efectos secundarios escasos y, por lo general, bien tolerados. Además, el rituximab se ha considerado como tratamiento en múltiples patologías hematológicas (mieloma múltiple, macroglobulinemia de Waldenstrom, enfermedad linfoproliferativa postrasplante, enfermedad de Hodgkin) y autoinmunes (lupus eritematoso sistémico o pénfigo vulgar) entre otros 18.