El uso de agentes bloqueadores del factor de necrosis tumoral alfa (anti-TNFα) en pacientes con hepatitis C crónica ha sido descrito en la literatura en su conjunto como seguro y eficaz. Sin embargo, no se han descrito hasta la fecha casos de primoinfección por el virus de la hepatitis C ocurridos durante el tratamiento con un biológico. Presentamos un paciente con psoriasis moderada-severa de larga evolución que, estando en tratamiento con etanercept, sufrió una hepatitis C aguda. Sin suspender el fármaco anti-TNFα recibió tratamiento con interferón pegilado, con respuesta virológica sostenida. Etanercept no interfirió de forma negativa en la evolución de la enfermedad ni en la respuesta al tratamiento antiviral.
According to the literature, the use of tumor necrosis factor (TNF) inhibitors in patients with chronic hepatitis C infection is safe and effective. There have been no reports, however, of primary infection with the hepatitis C virus during treatment with a biologic agent. We report the case of a patient with long-standing moderate to severe psoriasis who developed acute hepatitis C while being treated with etanercept. Biologic therapy was continued and the infection was successfully treated with pegylated interferon, which achieved a sustained virologic response. Etanercept did not have a negative impact on disease outcome or on response to antiviral treatment.
Existen en la literatura numerosos casos publicados de pacientes con hepatitis C crónica que han sido tratados con fármacos antagonistas del TNFα por distintos motivos. Sin embargo, no hemos encontrado casos de primoinfección por el virus de la hepatitis C (VHC) durante el tratamiento biológico. A continuación presentamos un caso de hepatitis C aguda ocurrida en un paciente con psoriasis que estaba en tratamiento con etanercept.
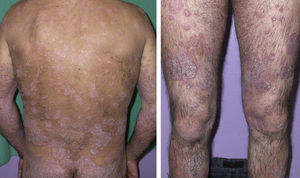
Caso clínicoVarón de 45 años con antecedentes de tabaquismo y ansiedad, que presentaba una psoriasis moderada-severa de larga evolución, tratada de forma tópica con corticoides y análogos de vitamina D desde 1999. En el año 2005 inició en nuestro servicio tratamiento con metotrexato 15mg/semana, con buena respuesta. Sin embargo, tras 6 meses experimentó un empeoramiento clínico progresivo, alcanzando un PASI de 23, decidiéndose cambiar a terapia biológica tras evaluar de forma personalizada las distintas opciones (fig. 1). En el estudio inicial presentaba un hemograma y bioquímica normales, radiografía de tórax sin hallazgos patológicos y Mantoux y serologías virales de hepatitis B, hepatitis C y virus de la inmunodeficiencia humana negativos. Con estos datos, en 2006 se instauró etanercept según la pauta habitual (50mg 2 veces/semana 3 meses y una vez/semana posteriormente), siendo el PASI de 0 tras 6 meses. En el periodo comprendido entre 2006 y 2009 sufrió varios rebrotes en relación con sucesivos abandonos de la medicación.
En uno de los controles analíticos de 2009, estando en tratamiento con etanercept, se detectó una llamativa hipertransaminasemia (GPT 710U/l, GOT 647U/l). Ante este hallazgo, sin cesar la administración del fármaco para la psoriasis, se solicitaron nuevos análisis con serologías víricas. En ellos se confirmó la elevación de enzimas hepáticas y se detectó una seroconversión para VHC, por lo que se remitió al paciente al Servicio de Medicina Digestiva. Allí se completó el estudio y se estableció el diagnóstico de hepatitis C aguda, con una carga viral de más de 10 millones de copias y genotipo 1a. Reinterrogando al paciente, no había sido sometido a transfusiones sanguíneas ni a intervenciones quirúrgicas recientemente, no había sido usuario de drogas por vía parenteral y no mantenía relaciones sexuales de riesgo. Sin embargo, se descubrió que su mujer tenía una hepatitis C crónica desconocida hasta ese momento, por lo que probablemente aquella había sido la fuente de contagio.
Manteniendo en todo momento etanercept, ante la elevación persistente de las transaminasas y de la carga viral, se inició tratamiento con interferón alfa pegilado en noviembre de 2009, obteniendo normalización de las transaminasas y respuesta virológica rápida. Paralelamente sufrió un empeoramiento de la psoriasis como efecto esperado del interferón, decidiéndose aumentar la dosis de etanercept a 100mg/semana, con mejoría parcial. El tratamiento antiviral se administró durante 24 semanas y actualmente presenta respuesta virológica sostenida. La doble dosis de etanercept se mantuvo durante todo el tratamiento con interferón y hasta un mes después de finalizarlo.
DiscusiónEl TNFα es una citoquina proinflamatoria secretada por el sistema monocito-macrofágico que está implicada en la respuesta inmunológica a las infecciones. Por ello, la administración de fármacos anti-TNFα supone un riesgo de reactivación de infecciones latentes por bacterias intracelulares (como las micobacterias) u hongos. Sin embargo, está menos clara la repercusión que pueden tener en las infecciones víricas1–3.
En las hepatitis víricas existen unos niveles elevados de TNFα y de sus receptores, tanto hepáticos como séricos1,3,4. En la hepatitis B el TNFα tiene un papel fundamental en el control de la replicación viral3. Sin embargo, en la hepatitis C los niveles elevados de TNFα se correlacionan con un mayor daño hepatocelular1. Además, esta citoquina parece estar implicada en la patogénesis de la fibrosis hepática4 que lleva a que un 20% de los pacientes con hepatitis C desarrollen cirrosis en 20 años2. Por todo ello, los anti-TNFα podrían incluso ser beneficiosos en estos pacientes1,2,4. Así, en el caso que presentamos, la administración de etanercept podría haber limitado el daño hepático producido por la primoinfección.
En cuanto al posible efecto nocivo sobre la carga viral o la progresión de la enfermedad, existen en la literatura más de 80 casos de pacientes con hepatitis C crónica tratados con antiTNFα (sobre todo etanercept) por distintos procesos autoinmunes4–9. Cabe destacar la ausencia de cambios significativos en la carga viral y en los niveles de transaminasas. Además, recientemente Paradisi et al.5 realizaron una biopsia hepática basal y otra tras 12 meses de tratamiento con etanercept en dos pacientes con psoriasis y hepatitis C y no observaron progresión histológica de la enfermedad. Por tanto, a partir de los datos existentes, la administración de antagonistas del TNFα en pacientes con hepatitis C crónica parece segura2–4. Sin embargo, no hemos encontrado en la literatura otros casos como el nuestro de infección aguda por hepatitis C durante el tratamiento con anti-TNFα. La evolución del paciente que presentamos sugiere que etanercept podría mantenerse en caso de primoinfección, sin interferir negativamente en la progresión ni en la respuesta al tratamiento con interferón, aunque harán falta más datos que confirmen esta afirmación.
Por otro lado, unos niveles elevados de TNFα podrían ser responsables de una menor respuesta de la hepatitis C al tratamiento antiviral10,11. En un pequeño estudio aleatorizado, doble ciego y controlado con placebo12, se analizó el papel de etanercept como adyuvante de interferón y ribavirina en el tratamiento de pacientes con hepatitis C crónica; se observó una respuesta mayor (negativización de la carga viral) en el grupo tratado con etanercept (63%) frente al grupo que recibió placebo (32%), de forma estadísticamente significativa. Cabe pensar que, en nuestro caso, haber mantenido etanercept durante la administración del tratamiento antiviral no solo no habría interferido negativamente en su acción, sino que incluso podría haber ayudado a alcanzar la negativización del ARN viral.
Finalmente, el hecho de que en este caso el contagio fuese por transmisión heterosexual sugiere que, aunque según las guías clínicas el riesgo de contagio por esta vía es bajo13, el tratamiento biológico podría aumentarlo. Además, queda patente la necesidad de una correcta anamnesis en estos pacientes. Al plantear el inicio de un anti-TNFα se suele incidir en la posibilidad de haber estado en contacto con alguien que padezca tuberculosis. Quizás sería interesante insistir también en otras patologías, sobre todo de familiares o convivientes, para que no pasaran desapercibidos casos conocidos de procesos infecciosos que pudieran contagiarse a nuestros pacientes durante la aplicación del tratamiento. En este mismo sentido, es importante recordar la necesidad de vacunar de hepatitis B a aquellos pacientes con serología negativa que no estén inmunizados, para evitar una primoinfección durante la administración del biológico.
En conclusión, presentamos el primer caso de primoinfección por hepatitis C durante el tratamiento con un fármaco antagonista del TNFα. Basándonos en la evolución de nuestro paciente, parece que el mantenimiento de etanercept en caso de hepatitis aguda por virus C podría ser seguro sin interferir de forma negativa en la respuesta al tratamiento antiviral, de forma similar a lo que ocurre en la variante crónica de la enfermedad. Harán falta series más amplias que confirmen esta observación.
Conflicto de interesesEl Dr. M. Armengot-Carbó ha suscrito con Pfizer un acuerdo de colaboración de publicación independiente.
El Dr. M. Velasco y el Dr. E. Gimeno han participado en ensayos clínicos, han efectuado asesorías, han recibido honorarios por conferencias, o financiación para asistir a actividades de formación con el patrocinio de: Pfizer, Abbott y Janssen-Cilag.
El Dra. R. Giner declara no tener ningún conflicto de intereses.