Los interferones son un grupo de más de 20 glucoproteínas producidas por numerosas células del organismo en respuesta a la presencia de virus, RNA de doble cadena, polipéptidos y productos bacterianos. Todos comparten la capacidad de inhibir la replicación viral y la proliferación celular, y de regular y modular las células del sistema inmunitario1. Desde un punto de vista inmunológico aumentan la expresión de moléculas de clase I y/o II del complejo mayor de histocompatibilidad (MHC) y estimulan los linfocitos asesinos naturales (NK).
Existen dos tipos de interferones: el tipo 1, que a su vez se divide en alfa, beta, omega y tao, y el tipo 2 que engloba el interferón gamma. Los principales interferones de interés en medicina son el tipo alfa, producido predominantemente por los leucocitos, el beta por los fibroblastos y el gamma por los linfocitos T (LT) y células NK. Sus principales aplicaciones en medicina son el tratamiento de las neoplasias malignas, las enfermedades virales y las enfermedades autoinmunes. El tipo 1 tiene un efecto más importante como antiviral y el tipo 2 un efecto más específico en la regulación de la respuesta inmune1.
Presentamos el caso de una mujer de 22 años con antecedentes de esclerosis múltiple diagnosticada hacía 8 meses en tratamiento con interferón beta-1a a dosis de 22 mcg subcutáneo 3 veces por semana desde hacía 3 meses. La paciente acudió a la consulta refiriendo la aparición de despigmentación alrededor de los nevi, que había comenzado a las pocas semanas del inicio del tratamiento con interferón. Por otro lado no existían antecedentes personales ni familiares de vitíligo ni presentaba halo nevi previos.
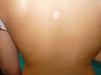
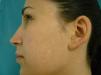
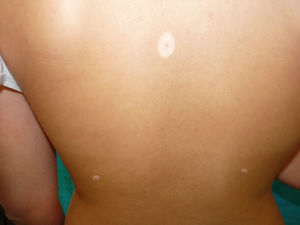
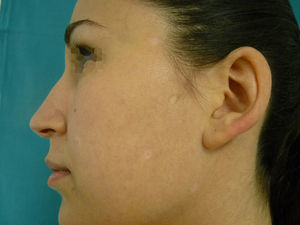
En la exploración física se observó un halo hipopigmentado acrómico en la práctica totalidad de los nevi de la paciente, en número de 15, fundamentalmente en espalda (fig. 1) y también en varios nevi intradérmicos faciales (fig. 2). Los nevi eran estables, de larga evolución y ninguno presentaba atipia clínica ni dermatoscópica.
El interferón fue bien tolerado, sin alteraciones en la función hepática o tiroidea, con control satisfactorio de la esclerosis múltiple, encontrándose en remisión.
El halo nevi expresa un fenómeno de autoinmunidad que se manifiesta como un halo hipopigmentado-acrómico alrededor del nevi que a menudo termina con la desaparición del mismo. En el estudio histológico se aparece un infiltrado linfohistiocitario contra los melanocitos. La participación del sistema inmune en la génesis de este fenómeno viene apoyada por la presencia o el incremento de los linfocitos T, fundamentalmente las células CD8 +, y las células presentadoras de antígenos en el lugar de la despigmentación 2,3. Además, la producción y activación endógena y local de interferón tipo 1 se han visto involucradas en la regresión del melanoma y de otras lesiones melanocíticas3.
El interferón beta-1b y 1a está aprobado por la FDA para el tratamiento de la esclerosis múltiple en la forma recurrente-remitente. Ha demostrado ser un fármaco modificador del curso de la enfermedad pudiendo prevenir y distanciar las exacerbaciones4. Actúa como inmunomodulador, activando las células T citotóxicas CD8+, y podría modificar la respuesta inmunitaria. Los efectos secundarios más frecuentes son las reacciones inflamatorias en el punto de inyección y los síntomas seudogripales. También se observa la elevación asintomática de enzimas hepáticos y citopenias. Raramente puede provocar diversos fenómenos de autoinmunidad tales como tiroiditis, miastenia gravis, artritis reumatoide, lupus eritematoso, fenómeno de Raynaud 4,5 y, de forma muy poco frecuente, se describe la aparición de hepatitis autoinmune5. Durante su administración pueden detectarse en ocasiones autoanticuerpos tales como antitiroglobulina y antimicrosomales de significado incierto6.
Nuestro caso representa la primera descripción que relaciona la aparición de halo nevi múltiples con el uso de interferón beta-1a. Existe un caso descrito en el que el paciente desarrolló vitíligo durante el tratamiento con interferón beta-1a y que mejoró con la suspensión del mismo7. Los autores postulan que el interferón beta 1-a podría estimular a los linfocitos CD8+ para que reconozcan proteínas derivadas de melanocitos, que se sabe juegan un papel predominante en el vitíligo. Existen también varios casos descritos de vitíligo con el uso de interferón alfa-2a8.
Aunque no se conoce la fisiopatología exacta del halo nevi y del vitíligo, las dos manifestaciones parecen tener una fisiopatología común presentándose en muchas ocasiones asociados. Varias teorías permiten sugerir que son el resultado de una respuesta inmunológica contra los melanocitos, probablemente mediados por la activación de células CD8+, tal como podría ocurrir con el uso de interferón.
En la revisión de la literatura hay dos casos documentados de aparición de halo nevi múltiples súbitos de novo por fármacos, con el uso de infliximab e imatinib9,10. El primero se desarrolló junto a un empeoramiento de una alopecia areata previa y los autores proponen que los fármacos anti-TNF inducen fenómenos de autoinmunidad entre los que incluyen la alopecia areata y los halo nevi. El segundo aparece relacionado con la inhibición de la c-kit tirosinasa.
En conclusión, nuestra paciente desarrolló halo nevi múltiples de novo a las pocas semanas del inicio del interferón. Creemos que en este caso existe una relación entre el uso de interferón y el desarrollo de halo nevi múltiples por la asociación temporal y la modificación del sistema inmune que este tratamiento induce con la activación de células CD8+, hecho importante en la fisiopatología de la aparición del halo nevi, favoreciendo fenómenos de autoinmunidad. Como ya se ha observado, el uso de interferón, no solo sistémico sino también intralesional, reduce el tamaño o elimina algunas metástasis de melanoma, probablemente por el mismo mecanismo que induce la formación de halo nevi y vitíligo, y pone de manifiesto la importancia de la inmunidad en la biología de las lesiones melanocíticas y abre el camino a posibles vías terapéuticas en el tratamiento del melanoma.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.