La psoriasis es una enfermedad inflamatoria cutánea de naturaleza inmunológica mediada por citoquinas de tipo Th1. El tratamiento con anticuerpos anti-factor de necrosis tumoral α (TNF-α) (infliximab) ha proporcionado respuestas clínicas significativas; sin embargo, los mecanismos implicados en la curación no están bien aclarados.
El objetivo del presente trabajo es evaluar las variaciones de la histología y en la expresión de marcadores de proliferación y apoptosis, en biopsias cutáneas secuenciales de pacientes con psoriasis tratados con in fliximab.
Material y métodosSe estudiaron biopsias de piel (sana y lesionada) de 3 pacientes afectados de psoriasis generalizada moderada-grave (índice de área y gravedad de la soriasis [PASI]: 35 de media) tratados con infusiones por vía intravenosa de infliximab (5 mg/kg) en las semanas 0, 2 y 6. Las biopsias se realizaron en los días 0, 14 y 28, y fueron procesadas para estudio histológico convencional e inmunohistoquímico con marcadores de apoptosis –TP53, BCL-2 y anticaspasas 3 y 8–y de proliferación celular –Ki67–.
ResultadosEl tratamiento con infliximab se asoció con una significativa mejoría clínica en los 3 pacientes (PASI medio: 21,6 a los 14 días y 13,9 a las 6 semanas), que se correlacionó con la desaparición progresiva de las lesiones histológicas, con disminución de la proliferación epidérmica. Sin embargo, no observamos imágenes de apoptosis ni obtuvimos positividad con los anticuerpos anticaspasas. La expresión de TP53 disminuyó a las 2 semanas del inicio del tratamiento, siendo similar a la piel normal a los 28 días.
ConclusionesLa respuesta clínica e histológica de la psoriasis con infliximab no se asoció a un incremento significativo en los marcadores de apoptosis evaluados.
Psoriasis is an inflammatory skin disease of immunologic nature that is mediated by T-helper-1 cytokines. Clinical response to treatment with antitumor necrosis factor (TNF) α antibodies (infliximab) has been significant; however, the mechanisms for clearance of lesions have not been elucidated. The aim of the present study was to assess variations in the histology and expression of proliferation and apoptotic markers in sequential skin biopsies of patients with psoriasis treated with infliximab.
Material and methodsWe studied skin biopsies (of lesioned and healthy skin) from 3 patients with extensive moderate-to-severe psoriasis (mean psoriasis area and severity index [PASI] score, 35) treated with intravenous infliximab infusions (5 mg/kg) at weeks 0, 2, and 6. Biopsies were taken on days 0, 14, and 28, and were processed for conventional histological and immunohistochemical study. The apoptotic markers used were TP53, B-cell lymphoma 2 protein, anticaspase 3, and anticaspase 8. The cell proliferation marker used was Ki67.
ResultsTreatment with infliximab was associated with a significant clinical improvement in 3 patients (mean PASI score, 21.6 at 14 days and 13.9 at 6 weeks), which correlated with the progressive disappearance of histological lesions with a decrease in epidermal proliferation. However, apoptosis was not observed, and the samples tested negative for anticaspase antibodies. Expression of TP53 decreased 2 weeks after starting treatment, and was similar to that in normal skin at 28 days.
ConclusionsClinical and histological response of psoriasis to infliximab was not associated with a significant increase in the apoptotic markers assessed.
La psoriasis es una enfermedad inflamatoria cutánea de naturaleza inmunológica, aunque los mecanismos etiopatogénicos no son del todo conocidos 1,2. El factor de necrosis tumoral α (TNF-α) es la principal citoquina implicada en su patogenia3, así las concentraciones séricas de TNF-α se correlacionan con la actividad de la enfermedad cutánea, y el uso de terapias con anticuerpos anti-TNF-α (infliximab) ha proporcionado respuestas clínicas significativas en pacientes con psoriasis moderada-grave4,5. Sin embargo, los mecanismos íntimos implicados en la curación clínica no están bien aclarados. Además de la acción sobre la activación y proliferación de los linfocitos T al bloquear al TNF-α, es posible que el infliximab pueda también actuar sobre la susceptibilidad de los queratinocitos a la apoptosis. En este sentido se postula que los queratinocitos de la epidermis psoriásica tienen una resistencia anormal a sufrir este tipo de muerte celular6, lo que puede contribuir a la hiperplasia epidérmica (acantosis regular) característica de la histopatología de esta enfermedad.
El objetivo del presente trabajo es evaluar en biopsias secuenciales cutáneas de pacientes con psoriasis tratados con infliximab, las variaciones en la histología convencional y la expresión de marcadores de proliferación celular (Ki67) y apoptosis (TP53, BCL-2 y anticaspasas 3 y 8), con el fin de comprobar la importancia de estos mecanismos en los efectos terapéuticos del fármaco.
Material y métodosPacientesEl estudio fue realizado en 3 pacientes, 2 hombres y 1 mujer, de 41, 58 y 27 años de edad, respectivamente, con psoriasis generalizada moderada-grave, con pérdida de respuesta al tratamiento con fármacos sistémicos y fototerapia. Estos pacientes fueron tratados con infliximab en el Departamento de Dermatología del Hospital Universitario Virgen Macarena de Sevilla. La evolución de la enfermedad desde el diagnóstico fue superior a 10 años; la puntuación del índice de área y gravedad de la psoriasis (PASI) fue de media 35, y la extensión de las lesiones al menos de un 50 % de la superficie corporal.
Los tratamientos sistémicos y la fototerapia se suspendieron un mes antes del inicio de la administración de infliximab (Remicade® viales de 100mg). La dosis utilizada fue de 5mg/kg por vía intravenosa (IV) en las semanas 0, 2 y 6 (dosis de inducción) y posteriormente cada 8 semanas (dosis de mantenimiento). Los pacientes dieron su consentimiento para el inicio del tratamiento y la toma de biopsias.
BiopsiasSe realizaron biopsias en sacabocados (de 0,6cm) de las lesiones cutáneas antes del tratamiento con infliximab (día 0), en el día 14 (previo a la infusión de la segunda semana) y en el día 28 del tratamiento con infliximab. Además, el día 0 se realizó una biopsia de piel normal, no afectada por la enfermedad. Las muestras fueron fijadas en formol tamponado al 10 % e incluidas en parafina. Se realizaron cortes histológicos de 4 micras de espesor que fueron teñidos con hematoxilina-eosina, según la técnica habitual.
Estudio inmunohistoquímicoSe realizó estudio inmunohistoquímico en cortes seriados de 4 micras de todas las muestras histológicas con los siguientes anticuerpos: TP53 (prediluido, Biomedia, USA), Ki67 (MIB-1, prediluido, Novocastra), BCL-2 (1:50, Dako), caspasa 3 (1:200, Novocastra) y caspasa 8 (1:200, Novocastra). Las técnicas de inmunoperoxidasa (complejo estreptoavidina-biotina) fueron realizadas con un sistema automatizado de inmunotinción (Ventana, Arizona, USA). Las secciones histológicas fueron teñidas con hematoxilina diluida, y la valoración microscópica semicuantitativa de las tinciones fue realizada por 2 observadores (C. Gómez Mateo y J.J. Ríos Martín) cegados con respecto al paciente y momento de la biopsia. Se utilizaron secciones de ganglio linfático como control positivo de los marcadores utilizados.
TP53 es una proteína que induce el mecanismo de apoptosis, considerada como el «guardián del genoma». Las caspasas son proteínas claves en la transducción y ejecución de la señal de apoptosis, que pueden ser «iniciadoras» (caspasa 8) o «ejecutoras» (caspasa 3). BCL-2 es una proteína anti-apoptósica.
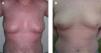
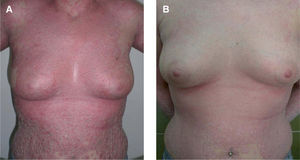
ResultadosEstudio histológicoEn paralelo con la respuesta clínica (los 3 pacientes experimentaron una mejoría significativa de las lesiones) (fig. 1A y B), las biopsias cutáneas revelaron una disminución progresiva de los rasgos histológicos característicos de la psoriasis (hiperplasia epidérmica regular, paraqueratosis, exocitosis de linfocitos y neutrófilos, dilatación vascular superficial e infiltrado inflamatorio linfohistiocitario dérmico de localización perivascular superficial) desde el día 0 hasta el día 28 (figs. 2A, 3A y 4A). En el día 28 sólo existía discreta hiperplasia epidérmica con ortoqueratosis y mínimo infiltrado inflamatorio dérmico. No se observaron imágenes histológicas de apoptosis en la epidermis (disqueratosis) en ninguna de las muestras estudiadas.
Estudio histológico de la piel afectada en el día 0 (preinfusión de infliximab). A. Lesión histológica representativa de psoriasis vulgar (hematoxilina-eosina, ×200). B. Inmunotinción con Ki67 de la epidermis, sobre todo a nivel basal (inmunoperoxidasa, ×200). C. Inmunotinción con TP53 superior al 10 % de queratinocitos (inmunoperoxidasa, ×400).
Estudio histológico en el día 14 de tratamiento. A. La sección histológica muestra una disminución de la hiperplasia epidérmica y del infiltrado inflamatorio, observándose paraqueratosis (hematoxilina-eosina, ×100). B. Discreta disminución de la inmunotinción con Ki67 con relación al día 0 (inmunoperoxidasa, ×100). C. Disminución de la inmunotinción con TP53 (menos del 5 % de queratinocitos) (inmunoperoxidasa, ×200).
Estudio histológico en el día 28 de tratamiento. A. Desaparición de la hiperplasia epidérmica y queratinización normal (hematoxilina-eosina, ×100). B. Disminución significativa de la inmunotinción con Ki67 (inmunoperoxidasa, ×100). C. Inmunotinción con TP53 en queratinocitos aislados (inmunoperoxidasa, ×100).
La inmunotinción con Ki67 fue intensamente positiva en los queratinocitos basales en las biopsias de piel lesionada antes del tratamiento (día 0), «dibujando» toda la hilera basal (fig. 2B). Se observó una discreta disminución de tinción en el día 14 (fig. 3B), mientras que en el día 28 era manifiesta la disminución de la tasa de proliferación epidérmica, similar a la obtenida en las biopsias de piel normal (fig. 4B).
Inmunotinción con TP53En las biopsias de piel normal (día 0) se observaron aislados queratinocitos con tinción nuclear (de uno a dos queratinocitos por campo de ×20), mientras que en las biopsias de piel lesionada preinfusión de infliximab la expresión de TP53 se observaba en más de un 10 % de células epidérmicas, sobre todo en los estratos más basales (fig. 2C). A los 14 días existía una disminución significativa de la tinción (menos del 5 % de queratinocitos positivos) (fig. 3C), y a los 28 días la expresión inmunohistoquímica de TP53 era similar a la de la piel no lesionada (fig. 4C).
Inmunotinción con BCL-2La inmunotinción con BCL-2 fue negativa en los queratinocitos de todas las muestras estudiadas. Sólo se obtuvo positividad en los citoplasmas de los melanocitos y en la celularidad linfoide.
Inmunotinción con caspasa 3 y 8No hemos obtenido inmunotinción con los anticuerpos anticaspasas 3 y 8 utilizados en ninguna de las muestras estudiadas, tanto de piel normal como lesionada.
DiscusiónEl tratamiento con anti-TNF-α ha demostrado ser beneficioso en pacientes con psoriasis moderada-grave4,5. En nuestro estudio hemos podido constatar mejoría clínica de las lesiones a los 14 días después de la primera infusión, con una reducción del PASI medio del 38 %. Tras la segunda infusión la reducción del PASI medio fue del 60,28 %. La mejoría, como se puede observar, fue rápida. Después de la tercera infusión (semana 6) dos de los pacientes presentaron una respuesta completa, con blanqueamiento de las lesiones. Las lesiones clínicas mejoraron en paralelo con el estudio histológico secuencial realizado.
En las muestras obtenidas a los 28 días de la primera infusión, los hallazgos morfológicos fueron inespecíficos y sólo se observaba discreto infiltrado linfocitario perivascular superficial y leve hiperplasia epidérmica irregular con ortoqueratosis. Por tanto, el bloqueo del TNF-α soluble provoca una disminución de la inflamación cutánea y una normalización en el proceso de maduración de los queratinocitos.
Uno de los mecanismos implicados en la patogénesis de la psoriasis es la supresión de la apoptosis de los queratinocitos. En este sentido, se ha demostrado recientemente la participación de proteínas inhibidoras de apoptosis tales como survivina (realiza su acción inhibiendo la apoptosis mediada por la vía de las caspasas) y el factor nuclear kappa B (NF-kB) (factor de transcripción que regula diferentes genes implicados en la apoptosis)6. Además, los queratinocitos de la epidermis psoriásica parecen tener una resistencia anormal a sufrir este tipo de muerte celular7, y algunos autores han demostrado una expresión aberrante de moléculas relacionadas con la apoptosis8-10. Por ello, la expresión de TP53 en piel con psoriasis es probablemente consecuencia fisiológica de la hiperproliferación epitelial 11,12 y no debe de ser interpretada como un incremento en el fenómeno de apoptosis.
Se ha postulado que la rápida respuesta a infliximab se debe, además de a los efectos antiinflamatorios, a un incremento en la apoptosis de los queratinocitos epidérmicos, como demostraron, valorando la expresión inmunohistoquímica de TP53 y microscopía electrónica, Krüger-Krasagakis et al13. En nuestro estudio las biopsias lesionales pretratamiento mostraron una tinción intensa en los queratinocitos basales con TP53, disminuyendo a los 14 días, probablemente en relación con la reducción de la proliferación celular inducida por el fármaco. No obstante, la inmunotinción a los 14 días era significativamente mayor a la observada en las biopsias de piel normal y en las biopsias realizadas a los 28 días. Por ello, es posible implicar al mecanismo de apoptosis de queratinocitos en la respuesta clínica e histológica de la psoriasis con infliximab, aunque no se asocie en nuestros casos a un incremento significativo de la inmunotinción con TP53, ni se hayan observado imágenes histológicas de células en apoptosis. Quizá la puesta en marcha de este mecanismo sea un suceso precoz en la resolución de las lesiones, ya que Krüger-Krasagakis et al13 demostraron un aumento de la expresión de TP53 en los queratinocitos en biopsias realizadas a los 5 días del inicio del tratamiento. En cualquier caso, en dicho mecanismo parece no estar implicada la vía de las caspasas, como también han demostrado estos autores13 para la caspasa 3.
Los resultados con Ki67 indican que la acción de infliximab ocasiona una disminución de la proliferación celular en la epidermis, que es significativa a partir de los 28 días (4 semanas). Similar conclusión obtuvieron El-Domyati et al14 estudiando la respuesta al tratamiento tópico de las lesiones de psoriasis con calcipotriol (análogo de la vitamina D3); según estos autores, este fármaco inhibe la proliferación celular induciendo apoptosis por un mecanismo independiente de TP53, como el sistema Fas/Fas-L u otros miembros de la familia de BCL-2, de igual manera que podría suceder con la administración de infliximab, aunque nosotros no evidenciamos cuerpos apoptósicos en la epidermis psoriásica, ni antes ni tras el tratamiento.
La expresión de BCL-2 en lesiones de psoriasis parece no estar relacionada con la proliferación o la resistencia a la apoptosis. No obstante, los resultados con este anticuerpo son contradictorios. En algunos estudios se ha demostrado expresión inmunohistoquímica de BCL-2 en queratinocitos basales de piel normal y no en los de piel con psoriasis15. Otros autores han demostrado una disminución del ARNm de BCL-2 en la epidermis lesionada con relación a la normal8. Sin embargo, nuestros resultados con BCL-2 son similares a los descritos por Wrone-Smith et al16, con ausencia de expresión en la epidermis normal y patológica, si bien obtuvimos tinción en los linfocitos dérmicos e intraepidérmicos en las muestras de lesiones de psoriasis y a nivel de los melanocitos.
En conclusión, con la limitación de una serie descriptiva sobre 3 casos es evidente que el tratamiento de la psoriasis con infliximab normaliza la diferenciación de los queratinocitos, la proliferación y dilatación vascular y reduce la densidad del infiltrado inflamatorio dérmico, lo que conlleva una rápida mejoría clínica de los pacientes. Por el contrario, la implicación de la apoptosis en el mecanismo de acción de infliximab, a la luz de los resultados de la literatura y los propios, dista de estar bien establecida.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.