El espesor tumoral es una variable de gran trascendencia en el manejo clínico del melanoma maligno cutáneo (MMC), ya que no solo establece el pronóstico, sino que además determina la planificación de márgenes quirúrgicos y selecciona a aquellos pacientes candidatos a biopsia selectiva de ganglio centinela. El índice de Breslow (IB) es el procedimiento histométrico estándar para la determinación del espesor tumoral del melanoma. El desarrollo de técnicas de imagen, como la ecografía cutánea (EC), plantea la posibilidad de realizar una estimación no invasiva que agiliza la instauración del tratamiento definitivo.
Objetivosa) Evaluar la EC como instrumento de medición del espesor tumoral en el MMC, y b) analizar los factores histológicos que influyen en la estimación del espesor ecográfico.
Material y métodosEstudio retrospectivo de una serie consecutiva de 79 melanomas cutáneos primarios. En todos los casos, se practicó un estudio ecográfico preoperatorio con una sonda de 15 Mhz para la determinación del espesor tumoral (EE). Se analizaron los exámenes histológicos, estudiándose el IB, además de la presencia de ulceración, regresión, infiltrado inflamatorio y nevus. Se estudian el grado de correlación y el nivel de concordancia entre los valores de EE e IB. Se estiman la sensibilidad, la especificidad y los valores predictivos de la EC en el diagnóstico de melanomas de espesor >1mm. Se analiza la relación de las variables histológicas en la determinación del EE.
ResultadosSe estudian 79 melanomas primarios, IB medio: 0,8mm (DE: 1,4). La EC evidenció un grado de correlación y un nivel de concordancia moderado con respecto al IB (coeficiente de correlación de Pearson: 0,678, coeficiente de correlación intraclase: 0,78, respectivamente). La EC mostró tendencia a sobrestimar el espesor histológico en relación con la presencia de infiltrado inflamatorio moderado-intenso y nevus, sin alcanzar significación estadística (p>0,05). La EC mostró valores de sensibilidad y especificidad, y valores predictivos positivo y negativo para el diagnóstico de melanomas gruesos (>1mm) del 82, el 80, el 54 y el 94%, respectivamente.
ConclusiónLa EC permite discriminar con bastante precisión melanomas finos y planificar márgenes quirúrgicos adecuados, pero presenta limitaciones para el diagnóstico de melanomas gruesos. Son necesarios más estudios para confirmar si determinadas características histológicas del tumor, como la presencia de infiltrado inflamatorio moderado-intenso y nevus, pueden condicionar una sobrestimación del espesor ecográfico, limitando su aplicabilidad clínica en el manejo del MMC.
Tumor thickness is of great importance in the management of cutaneous malignant melanoma (MM): this variable not only affects prognosis but is also a key factor in planning surgical margins and selecting candidates for sentinel node biopsy. Breslow depth is the standard histologic measure of thickness, but technological advances have provided imaging techniques such as cutaneous ultrasound that can potentially assess tumor thickness and enable prompt initiation of definitive treatment.
Objectivesa) To evaluate the utility of ultrasound assessment of tumor thickness in MM, and b) to analyze histologic variables that affect ultrasound assessments of thickness.
Materials and methodsRetrospective study of a consecutive series of 79 primary cutaneous MMs in which tumor thickness had been assessed by 15-MHz ultrasound before surgery. We gathered data from histology reports, studying Breslow depth and the presence of ulceration, regression, inflammatory infiltrate, and associated nevi. Correlation coefficients were calculated to evaluate the strength of association between Breslow depth and thickness assessed by ultrasound. We also calculated the sensitivity, specificity, and positive and negative predictive values of ultrasound measurement in the diagnosis of MMs more than 1mm thick. Associations between histologic variables and the overestimation of thickness by ultrasound were also analyzed.
ResultsThe 79 primary MMs studied had a mean (SD) Breslow depth of 0.8 (1.4) mm. There was moderate correlation and agreement between Breslow depth and the ultrasound assessment of thickness (Pearson correlation coefficient, 0.678; intraclass correlation coefficient, 0.78). The tendency of ultrasound to overestimate thickness was nonsignificantly related to the presence of a moderate to intense infiltrate and associated nevi (P>.05). The sensitivity of ultrasound for the diagnosis of MM over 1mm thick was 82%; specificity was 80%, and positive and negative predictive values were 54% and 94%, respectively.
ConclusionsUltrasound imaging quite correctly identifies thin MMs and can be useful for planning adequate surgical margins; however, there are limitations on its usefulness in the diagnosis of thick MMs. Additional studies are required to confirm whether certain histologic characteristics, such as the presence of a moderate to intense inflammatory infiltrate or associated nevi can lead to overestimation of thickness by ultrasound, limiting the clinical utility of this imaging technique in MM management.
El espesor tumoral es una variable de gran trascendencia en el manejo clínico del melanoma maligno cutáneo (MMC) ya que, además de establecer el pronóstico, determina la planificación de márgenes quirúrgicos y selecciona a aquellos pacientes candidatos a biopsia selectiva de ganglio centinela1.
El índice de Breslow (IB) es la medida estándar del espesor tumoral del melanoma cutáneo primario2. Al tratarse de un procedimiento histométrico, requiere una biopsia escisional cutánea preoperatoria, que además de ser un procedimiento cruento, ocasiona una demora en la instauración del tratamiento quirúrgico definitivo en 2 tiempos.
La ecografía cutánea (EC) es una técnica de imagen que permite visualizar el interior de la piel de forma no invasiva. Su aplicación en el ámbito de la dermatología ha sido motivo de estudio en los últimos años2. Aunque la mayoría de los trabajos comenzaron utilizando sondas de 20 Mhz con capacidad para medir lesiones a una profundidad de 6-8mm, muchos estudios recurrieron a sondas de menor resolución (10-15 Mhz) debido a su disponibilidad en la mayoría de los centros hospitalarios. La tendencia actual es a usar sondas de mayor resolución (75-100 Mhz), que mejoran la precisión en la medición de lesiones confinadas a la epidermis y a la dermis. En el MMC, la EC plantea la posibilidad de realizar una estimación in vivo del espesor tumoral, evitando biopsias escisionales y agilizando la planificación del tratamiento quirúrgico3–5. Recientemente, se ha estudiado la validez de la herramienta y su utilidad en el manejo clínico del MMC, obteniéndose resultados controvertidos6–12.
El objetivo del presente trabajo es evaluar la EC como instrumento de medición del espesor tumoral en el MMC. Asimismo, se analizan los factores histológicos que influyen en la estimación del espesor ecográfico (EE) del melanoma.
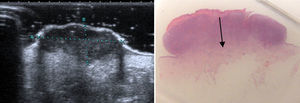
Material y métodosEstudio retrospectivo de una serie consecutiva de MMC intervenidos durante el periodo 2008-2010 en el servicio de Dermatología del Hospital Costa del Sol. En todos los casos, se realizó estudio ecográfico preoperatorio (Toshiba Aplio XG, sonda 15 Mhz), para la determinación del espesor tumoral, que fue llevada a cabo por distintos profesionales del servicio de Radiodiagnóstico del centro. El EE se calculó de forma automatizada, midiendo la máxima distancia vertical desde el eco de entrada hasta el límite inferior hipoecoico, expresado en mm (fig. 1). El espesor histológico (IB) fue evaluado por un patólogo con experiencia en dermatopatología y se determinó utilizando un micrómetro ocular, midiendo la máxima distancia entre el nivel más alto del estrato granuloso de la epidermis y el punto más profundo del tumor, expresado en mm (fig. 1). Se estudió la presencia histológica de ulceración, regresión (ausente, < 50%, > 50%), infiltrado inflamatorio (ausente, leve, moderado, intenso) y nevus asociado.
El estudio fue aprobado por el comité ético del Hospital Costa del Sol.
Análisis estadísticoSe realiza un análisis comparativo de los valores de espesor tumoral ecográfico (EE) frente al estándar de oro (IB), empleando el coeficiente de correlación de Pearson y el coeficiente de correlación intraclase (CCI), para cuantificar el grado de correlación y el nivel de concordancia entre ambas variables. Para estudiar la influencia entre las variables histológicas (ulceración, regresión, infiltrado inflamatorio y presencia de nevus) y el EE, se realiza un análisis bivariable, tomando como variable dependiente la sobrestimación del EE (+0,1mm) sobre el estándar, empleando los test de la chi al cuadrado y, en su caso, el test Fisher. Se establece el nivel de significación estadística en p<0,05. Por último, se estudian la sensibilidad, la especificidad y los valores predictivos positivos (VPP) y negativos (VPN) de la EC frente al estándar de oro para la correcta clasificación de melanomas de espesor grueso (IB>1mm), con un IC 95%.
ResultadosSe estudiaron 79 melanomas procedentes de 79 pacientes, 53% mujeres, con una edad media±desviación estándar de 56,8±16,2 años. El 42% de los melanomas se localizaron en el tronco, el 40% en las extremidades y el 18% en la cabeza y el cuello. El 45% de los tumores (n=35) fueron melanomas in situ y el 55% restante (n=44), melanomas invasivos (27 melanomas≤1mm, 17 melanomas>1mm). La media del espesor histológico (IB) de la serie fue de 0,8±1,4mm. La media del EE fue de 1,2±1,7 mm. Los hallazgos histológicos se resumen en la tabla 1.
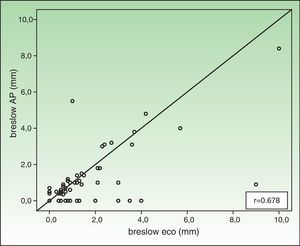
El coeficiente de correlación de Pearson del EE frente al IB fue de 0,678 (p<0,001) (fig. 2). El valor del CCI entre el EE y el IB fue de 0,78, con un IC 95% de 0,61-0,88.
El análisis bivariado evidenció una tendencia a la sobreestimación del EE, en presencia de infiltrado inflamatorio moderado-intenso y nevus, si bien dicha tendencia no resultó estadísticamente significativa (p>0,05) (tabla 2).
Relación de espesor ecográfico y variables histológicas
| No sobrestima | Sobreestima (+ 0,1 mm) | p | |||
| n | % | n | % | ||
| Regresión | |||||
| Ausente | 4 | 80,0 | 1 | 20,0 | 0,43 |
| <50% | 38 | 58,5 | 27 | 41,5 | |
| >50% | 4 | 44,4 | 5 | 55,6 | |
| Ulceración | |||||
| Sí | 2 | 33,3 | 4 | 66,7 | 0,23 |
| No | 44 | 60,3 | 29 | 39,7 | |
| Infiltrado inflamatorio | |||||
| Ausente-leve | 28 | 65,1 | 15 | 34,9 | 0,26 |
| Moderado-intenso | 18 | 50,0 | 18 | 50,0 | |
| Nevus asociado | |||||
| Sí | 10 | 43,5 | 13 | 56,5 | 0,15 |
| No | 36 | 64,3 | 20 | 35,7 | |
Los tests clásicos de sensibilidad mostraron unos valores de sensibilidad del 82%, especificidad del 80%, un VPP del 54%, y un VPN del 94% de la EC para el diagnóstico de melanomas gruesos (IB>1mm) (tabla 3).
DiscusiónEn el presente trabajo, hemos analizado la precisión de la EC como instrumento de medición del espesor tumoral en una serie consecutiva de 79 melanomas primarios. Destacamos la alta participación de melanomas in situ y mínimamente invasivos, que atribuimos al uso sistematizado de la dermatoscopia en el diagnóstico de las lesiones pigmentadas cutáneas y al desarrollo mantenido de estrategias de prevención primaria en nuestra población.
Hemos hallado un grado de correlación y nivel de concordancia entre las mediciones ecográficas e histológicas moderados, comparados con otros resultados comunicados anteriormente6–10. En general, la mayoría de los trabajos hallan un coeficiente de correlación bueno; así Tacke et al.6 encuentran un coeficiente de correlación r=0,88, sobre una muestra de 259 melanomas, con una sonda de 20 Mhz (las lesiones entre 0,55-0,95mm se clasificaron de forma incorrecta con la ecografía en el 34% de los casos y aquellas entre 1,30-1,70mm se clasificaron de forma incorrecta en el 50% de los casos). Por el contrario, Serrone et al.7 describen un coeficiente r=0,95 en melanomas > 1,51mm, encontrando el grado de correlación más bajo en lesiones <0,75mm, sobre 261 lesiones, con una sonda de 20 Mhz. Kaikaris et al.8 encuentran resultados similares, r=0,283 en melanomas de 1-2mm y r=0,869 en melanomas > 2mm con una sonda de 14 Mhz. La utilización de diferentes sondas, además de la diversidad de la muestra, con inclusión de lesiones benignas (fundamentalmente nevus)7 o exclusión de lesiones in situ9 argumentando que la ecografía no es capaz de discernir lesiones epidérmicas, dificulta la comparación entre estudios.
Al igual que otros autores han puesto de manifiesto con anterioridad, algunas características histológicas del tumor podrían alterar la estimación del EE10. Hoffman et al.11 encuentran que en el 80% de los casos de sobreestimación, la causa de la misma era la presencia de infiltrado inflamatorio. En nuestra serie, la EC mostró una tendencia a sobrestimar el espesor histológico del tumor en presencia de infiltrado inflamatorio moderado-intenso y nevus asociado, aunque no se halló significación estadística (p>0,05). Estas características histológicas actuarían como artefactos durante la valoración ecográfica del tumor, ya que la EC no permite diferenciar las células tumorales de las células inflamatorias o névicas.
El análisis de sensibilidad, especificidad, VPP y VPN de la EC para el diagnóstico de melanomas gruesos (>1mm) mostró valores del 82, el 80, el 54 y el 94%, respectivamente. Según estos resultados, la EC permitiría clasificar adecuadamente y planificar un tratamiento quirúrgico en un solo acto en aproximadamente el 80% de los melanomas. Sin embargo, la EC fallaría en la estimación del espesor tumoral y la indicación terapéutica en el 20% de los melanomas. La EC mostró una alta capacidad discriminativa de melanomas finos, mostrando en cambio mayores limitaciones en la estimación de melanomas gruesos. Algunos autores han elaborado algoritmos diagnósticos para aumentar la precisión diagnóstica en este grupo de melanomas combinando hallazgos clínicos, dermoscópicos y ecográficos, alcanzando una sensibilidad del 97% y una especificidad del 100%12.
Casi la mitad de los melanomas estimados ecográficamente como gruesos correspondían en realidad a melanomas finos (<1mm). La frecuente presentación histológica de infiltrado inflamatorio y nevus en los melanomas de nuestra serie explican estos resultados. Esta tendencia a la sobreestimación puede resolverse con sondas de mayor frecuencia, que poseen mayor poder de resolución13.
Al igual que nosotros, otro trabajo encuentra que la correspondencia entre mediciones fue particularmente buena en lesiones <1mm utilizando una sonda de 30 Mhz en una serie de 68 melanomas y esta correspondencia fue aún mayor en lesiones de la planta del pie (r=0,945)14. Machet et al.15, en cambio, encuentran dificultad para medir lesiones en la planta del pie, debido al grosor de la capa córnea, utilizando una sonda de 20 Mhz.
Nuestros resultados contrastan con los publicados en un reciente estudio prospectivo de 54 MMC, en la estimación ecográfica del espesor tumoral, que mostró valores de sensibilidad, especificidad, VPP y VPN en el diagnóstico de melanomas gruesos (>1mm) del 86, el 97, el 95 y el 91%, respectivamente16. La EC mostró una llamativa precisión diagnóstica pese a la menor resolución ecográfica de la sonda empleada por los autores (10 Mhz). Estos resultados podrían explicarse por una alta participación de melanomas histológicamente gruesos, con una mayor traducción ecográfica, en los que la presencia de otros factores histológicos no alteraría su categorización ecográfica de melanomas gruesos.
Nuestro trabajo presenta una serie de limitaciones. El pequeño tamaño muestral dificulta la interpretación de los resultados relacionados con la influencia de los hallazgos histológicos en la determinación del espesor tumoral ecográfico, de forma que no es posible establecer relaciones de causalidad entre los hallazgos histológicos y ecográficos. Es posible que la variabilidad interpersonal interfiera en las mediciones ecográficas del espesor tumoral, aunque la estandarización del procedimiento minimiza este sesgo.
Los avances tecnológicos alcanzados en el ámbito de la ecografía, como el uso de potenciadores de contraste5, y la incorporación de nuevas técnicas de microscopia in vivo, como la dermatoscopia17,18 o la microscopia confocal19, resultan alentadores y su empleo conjunto mejorará en un futuro próximo el diagnóstico preoperatorio del melanoma.
En conclusión, la EC es una herramienta de gran interés en el estudio preoperatorio del MMC. La EC permite discriminar con bastante precisión melanomas finos y planificar márgenes quirúrgicos adecuados. Son necesarios más estudios para confirmar si determinadas características histológicas del tumor, como la presencia de infiltrado inflamatorio moderado-intenso y nevus, pueden condicionar una sobrestimación del EE, limitando su aplicabilidad clínica en el manejo del MMC.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.