INTRODUCCION
El receptor del factor de crecimiento epidérmico (EGFR, HER1, erb B-1) es un receptor glucoproteico de la membrana celular con actividad tirosincinasa. Consta de tres dominios: extracelular, transmembrana e intracelular. En forma de monómero es inactivo. La unión de un ligando adecuado (los más importantes son el factor de crecimiento epidérmico [EGF] y el factor de crecimiento tumoral alfa [TGF-α]) a la región extracelular, conduce a la formación de complejos diméricos y activa la tirosincinasa (TK) de la región intracelular, lo que, mediante consumo de energía en forma de adenosintrifosfato (ATP), provoca la autofosforilación y activación del receptor. Se genera así una cascada de reacciones de segundos mensajeros implicadas en la regulación del ciclo celular, la apoptosis, la oncogénesis, la angiogénesis, etc.; y, por lo tanto, intervienen en el desarrollo y progresión metastática de ciertas neoplasias, lo que condiciona una mayor resistencia al tratamiento y un peor pronóstico del tumor 1,3,4.
En los últimos años se han sintetizado múltiples moléculas con actividad inhibidora del EGFR, entre las que destaca cetuximab (Erbitux®), erlotinib (Tarceva®) y gefitinib (Iressa®), estos dos últimos disponibles por vía oral. Cetuximab es un anticuerpo monoclonal IgG1 dimérico (combina las regiones variables de su precursor murino con regiones constantes de IgG1 humana, lo cual reduce la posibilidad de reacciones inmunológicas). Actúa bloqueando la unión del EGFR con sus ligandos naturales. Erlotinib y gefitinib son inhibidores intracelulares reversibles y selectivos de la tirosincinasa, que impiden de forma competitiva la unión del ATP celular a la enzima 1.
Los inhibidores del EGFR son en general bien tolerados. Las reacciones secundarias descritas con más frecuencia son gastrointestinales (especialmente diarrea), cuando se administran por vía oral, y cutáneas (erupciones acneiformes, alteraciones capilares, sequedad cutánea, onicopatía, etc.). Los más graves, pero muy infrecuentes, son la fibrosis pulmonar y la neumonitis intersticial 3.
El EGFR desempeña un papel fundamental en la regulación del ciclo celular en la epidermis y en el epitelio folicular 4. La interferencia sobre estas señales fisiológicas, provocada por la inhibición del EGFR, explicaría por qué los efectos adversos cutáneos son tan frecuentes, y afectando en mayor o menor grado a todos los pacientes, dependientes de la dosis, reversibles y con unas características clínicas similares. Es decir, son consecuencia biológica directa de la inhibición del EGFR y no de otro tipo de reacciones idiosincrásicas, por ejemplo, inmunológicas 2,5. La suspensión definitiva del tratamiento oncológico no suele ser necesaria para conseguir la resolución de las lesiones cutáneas.
DESCRIPCION DE LOS CASOS CLINICOS
Caso 1
Un varón de 54 años, ex fumador importante, sin otros antecedentes personales de interés, fue diagnosticado en agosto de 2000 de una neoplasia de pulmón de células grandes, pobremente diferenciada (estadio IIIB, es decir, no resecable). El paciente fue tratado con varias líneas de quimioterápicos, con mala respuesta a éstos, tanto por importante toxicidad sistémica como por la progresión tumoral sintomática. Por este motivo, en noviembre de 2004 se inició tratamiento con gefitinib a dosis de 250 mg/día por vía oral. Al cabo de unos 15 días el paciente presentó una erupción cutánea de tipo acneiforme, y fue remitido a nuestro servicio. En la exploración física destacaba la existencia de lesiones papulopustulosas centradas por folículos pilosos, de pequeño tamaño y dispersas por el tronco, con mayor afectación en la parte anterior del tórax y abdomen que en la espalda (fig. 1). El estudio anatomopatológico de una de las lesiones demostró destrucción completa del folículo piloso por un intenso infiltrado inflamatorio formado fundamentalmente por polimorfonucleares, con tendencia a la microabscesificación (fig. 2). En el cultivo de una de las lesiones creció Staphylococcus aureus, sensible a cloxacilina, amoxicilina-ácido clavulánico, cefazolina, clindamicina y eritromicina y resistente a penicilina y amoxicilina.
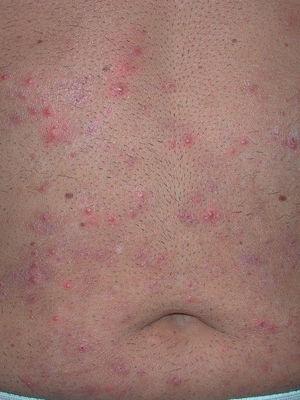
Fig. 1.--Caso 1. Lesiones pustulosas con halo eritematoso en abdomen.
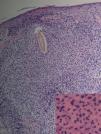
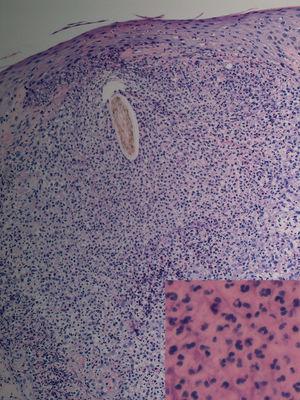
Fig. 2.--Caso 1. Destrucción completa del folículo piloso rodeado de un denso infiltrado inflamatorio compuesto por polimorfonucleares y en la parte más periférica por linfocitos e histiocitos. (Hematoxilina-eosina, *20.) En el recuadro, imagen a mayor aumento del infiltrado neutrofílico perifolicular. (Hematoxilina-eosina, x100.)
Se inició tratamiento antibiótico vía oral con amoxicilina-ácido clavulánico 875/125 1/8 h por vía oral durante 7 días y tópico con peróxido de benzoilo en gel, continuando con el mismo esquema de administración de gefitinib. Inicialmente la evolución fue buena, pero al suspender la antibioterapia, las lesiones recidivaron, aunque con menor extensión e intensidad que en el primer brote.
Teniendo en cuenta la buena respuesta oncológica que el paciente estaba presentando al uso de gefitinib y la ausencia de otra toxicidad asociada, aparte de la cutánea (mucho mejor tolerada ahora que al inicio del tratamiento), se decidió mantener su administración junto con medidas locales.
Caso 2
Una mujer de 71 años con antecedentes personales de carcinoma de mama ductal infiltrante grado II (pT1bN0M0), tratado en 1997 con cirugía conservadora, radioterapia y hormonoterapia con tamoxifeno, en remisión completa, fue diagnosticada, en marzo de 2004, de un adenocarcinoma de recto-sigma, moderadamente diferenciado, con invasión vascular, infiltración adenopática y metástasis pulmonares y hepáticas (pT3N1M1). Tras la intervención mediante resección anterior baja e ileostomía de descarga, se inició tratamiento quimioterápico paliativo con irinotecán, que se suspendió por toxicidad grave (diarrea y vómitos grado III), y se incluyó a la paciente en un ensayo clínico con cetuximab (inicialmente 732 mg con dosis posteriores de 457,5 mg/semana). A las 2 semanas de iniciar el tratamiento, presentó una erupción levemente pruriginosa papulopustulosa en cara, cuero cabelludo y tronco que fue tratada mediante aplicación tópica de peróxido de benzoilo, manteniéndose el esquema de tratamiento con cetuximab. Las lesiones evolucionaron de forma favorable, excepto en el cuero cabelludo, donde persistieron numerosas lesiones pustulosas y costrosas exudativas (fig. 3). Por este motivo, y a pesar de la buena respuesta antitumoral al fármaco, que había estabilizado las lesiones metastáticas, se decidió suspender de forma temporal la terapia con cetuximab, iniciando tratamiento sistémico con levofloxacino 500 mg/24 h por vía oral durante 7 días y tópico con peróxido de benzoilo en gel y eritromicina en solución al 4 %.
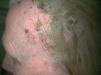
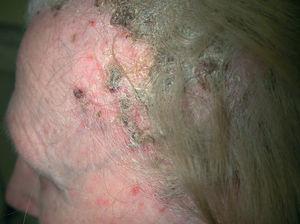
Fig. 3.--Caso 2. Intensas lesiones costroso-exudativas en cuero cabelludo.
La biopsia tomada de una lesión fue informada como compatible con foliculitis. El cultivo de una de las pústulas resultó negativo tanto para bacterias como para hongos.
La evolución de la paciente ha sido favorable, con mejoría progresiva de las lesiones y sin recidiva tras reintroducir el cetuximab a las 4 semanas, encontrándose en el momento actual prácticamente asintomática.
Caso 3
Un varón de 51 años, sin hábitos tóxicos ni antecedentes médico-quirúrgicos de interés, salvo ulcus duodenal fue diagnosticado en marzo de 2002 de un carcinoma epidermoide pulmonar, estadio IV, con afectación metastática de la glándula suprarrenal derecha. Tras varias líneas de tratamiento oncológico tanto quimioterápico como radioterápico, en mayo de 2003 se detectó progresión tumoral con afectación suprarrenal bilateral, por lo que se inició tratamiento quimiotérapico de segunda línea, con el que sólo se consiguió una escasa respuesta. Por este motivo, en enero de 2005 se comenzó a administrar erlotinib a dosis de 150 mg/día por vía oral, con buena tolerancia salvo por la aparición 1 semana después de un erupción rosaceiforme en nariz, mejillas y tercio superior de tórax, mínimamente pruriginoso (fig. 4). El resultado anatomopatológico fue compatible con una foliculitis. Los estudios microbiológicos de las lesiones resultaron negativos para hongos y bacterias. El paciente inició tratamiento tópico con peróxido de benzoilo en crema al 4 % y eritromicina en solución al 4 % sin suspender el tratamiento con erlotinib. La evolución de las lesiones cutáneas fue satisfactoria.
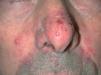
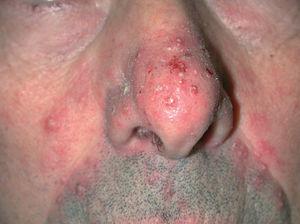
Fig. 4.--Caso 3. Lesiones pustulosas distribuidas en dorso de nariz y mejillas.
DISCUSION
Se ha descrito la aparición de erupciones cutáneas acneiformes en aproximadamente un 30 a un 78 % de los pacientes en tratamiento con inhibidores del EGFR. La frecuencia varía en función del fármaco empleado, ya que parece ser superior en el grupo tratado con cetuximab respecto al de gefitinib 6. La intensidad de la erupción se clasifica en 4 grados: grado 1, erupción eritematosa maculopapulosa de distribución acneiforme, asintomática; grado 2, igual que grado 1, pero con síntomas asociados, como prurito; grado 3, extensión de la erupción más allá de las zonas típicamente acneiformes (cabeza, espalda y tórax), o lesiones confluentes, o dolorosas; y grado 4, dermatitis exfoliativa o ulcerada 5. Generalmente, las lesiones suelen ser de intensidad leve, es decir, grados 1 y 2, y sólo en el 6-8 % de los pacientes se observan erupciones graves.
Clínicamente son lesiones de aspecto monomorfo, pápulas eritematosas y pústulas, con distribución folicular y predominio en cara (82 %), cuero cabelludo, hombros, tórax y parte superior de la espalda, siendo menos frecuente en la mitad inferior del cuerpo 2,4. No suele existir afectación palmoplantar. La aparición de lesiones más graves como vesículas hemorrágicas o costras no es habitual y se ha descrito especialmente con cetuximab 6. Las lesiones nodulares y quísticas son muy infrecuentes. La intensidad de la erupción no se ha relacionado con el tipo de tumor, el fototipo cutáneo, el sexo ni los antecedentes personales de acné o rosácea 4,6. La administración simultánea de fármacos con efectos acneiformes (como corticoides) tampoco parece producir diferencias significativas ni en la frecuencia ni en la gravedad de las lesiones respecto a los pacientes que están en tratamiento sólo con inhibidores del EGFR 6.
No se ha demostrado relación entre la gravedad de las lesiones cutáneas y la aparición de otras toxicidades importantes. Aunque se ha señalado que existe correlación entre la intensidad de la erupción y la respuesta antitumoral al tratamiento, de forma que grados intensos de reacciones cutáneas predicen una buena respuesta sistémica con supervivencias superiores 1, los datos obtenidos a partir de un estudio retrospectivo publicado recientemente no parecen apoyar esta hipótesis 7.
Las lesiones acneiformes suelen iniciarse entre los 5 y los 15 días (media de 7 días) de comenzar el tratamiento 4. La tendencia espontánea es a la estabilización y mejoría de las lesiones con el transcurso de las semanas, consiguiéndose incluso en algunos casos remisión completa sin necesidad de suspender ni modificar el tratamiento oncológico 6. La aplicación de medidas terapéuticas locales antiacné (antisépticos, antibióticos, antifúngicos, retinoides, etc.) suele ser suficiente como medida inicial 2,4. En casos especialmente intensos o con mala evolución puede ser necesario recurrir a la administración de antibióticos sistémicos y a interrupciones temporales del tratamiento (2-4 semanas). Al reintroducir el fármaco, el cuadro clínico suele ser menos intenso que en el brote inicial, por la tendencia espontánea de las lesiones a estabilizarse, por lo que los casos en los que se necesita una suspensión definitiva de la terapia son excepcionales. En todos los casos descritos en los que se ha tenido que suspender de forma permanente el tratamiento, bien por toxicidad cutánea o extracutánea inaceptable o por progresión tumoral, se ha obtenido remisión completa de las lesiones, lo que apoya el carácter reversible de la erupción 6. Las lesiones suelen curar sin dejar cicatriz 3.
Un aspecto controvertido es el tratamiento profiláctico, desde la primera hasta la última dosis, con eritromicina tópica al 4 % y ácido fusídico oral. En algunos estudios parece asociarse a una menor intensidad de las lesiones, pero para otros autores no existe un claro beneficio por lo que su uso no estaría justificado 6.
Los estudios anatomopatológicos suelen describir diferentes grados de foliculitis junto a alteraciones en la diferenciación epidérmica. Los infundíbulos foliculares aparecen hiperqueratósicos y ectásicos, rodeados por un denso infiltrado inflamatorio compuesto por linfocitos e histiocitos en profundidad y por densos infiltrados neutrofílicos en su parte más superficial 6. En lesiones más avanzadas puede observarse destrucción completa del folículo piloso, con desaparición de todas las vainas foliculares, formación de granulomas perifoliculares, edema dérmico y vasodilatación 2. Las glándulas sebáceas no suelen estar afectadas por el infiltrado inflamatorio, pero pueden ser de menor tamaño.
Los estudios microbiológicos habitualmente son negativos, tanto para hongos como para bacterias 6, pero en algunos casos se ha descrito crecimiento de componentes habituales de la flora cutánea como Staphylococcus aureus/epidermidis o Propionibacterium acnes5,8,9. En cualquier caso, este crecimiento no es el desencadenante etiopatogénico directo de la erupción, sino un factor sobreañadido.
Además de erupciones de tipo acneiforme, los fármacos inhibidores del EGFR pueden producir otros muchos efectos adversos cutáneos, como alteraciones capilares (retraso en el crecimiento, pelo más frágil, fino y curvado, tanto en cuero cabelludo como en barba y otras zonas pilosas), xerosis cutánea, afectación ungueal (en forma de eritema, tejido de granulación y paroniquia muy dolorosa, sobre todo en las manos y con menos frecuencia en los pies 2,3) y lesiones en mucosas, especialmente aftas orales y nasales 3,4. Se han descrito casos de tricomegalia asociados al tratamiento con gefitinib 10 y cetuximab 11. Otros efectos adversos cutáneos, como dermatitis seborreica, urticaria, hiperpigmentación o eritema necrolítico migratorio son menos frecuentes 1,3,12.
Se desconoce la fisiopatología de las lesiones acneiformes inducidas por los inhibidores del EGFR. La inhibición del EGFR provoca infundíbulos dilatados, hiperqueratósicos y tapones córneos, lo cual favorece además la alteración de la microflora local y puede aumentar la patogenicidad de microorganismos habituales en la piel 4,13.
El EGFR también participa en la transición de la fase de anágeno a catágeno del ciclo folicular 2,3,13. La porción inferior del folículo tiene una situación inmunológica privilegiada, ya que no expresa moléculas del complejo mayor de histocompatibilidad de tipo I (MHC-I), salvo durante la transición a fase de catágeno 4. La expresión antigénica en este momento provoca que la zona sea infiltrada por células del sistema monocito-macrófago, que reabsorben los queratinocitos apoptóticos foliculares. Esta fase es autolimitada porque el EGFR se encarga de detener la expresión de los antígenos del MCH-I cuando la involución fisiológica de la parte inferior del folículo se ha completado. La inhibición del EGFR hace persistir la expresión antigénica, manteniendo el proceso inflamatorio, hasta provocar la destrucción completa del folículo piloso, no sólo de su parte inferior. Esta anormal destrucción y necrosis folicular provoca una intensa reacción inflamatoria purulenta perifolicular, especialmente en la zona más superficial, concordante con los hallazgos anatomopatológicos descritos en algunos pacientes 4. Más difícil de explicar resultan los casos en los que existe infiltrado inflamatorio con folículos intactos, no destruidos. Se ha sugerido que se trataría de reacciones incompletas, que se deba a alteraciones en la microflora cutánea o al efecto inflamatorio directo de los fármacos, pero ninguna de estas teorías ha podido ser confirmada.