Imiquimod 5% crema (Aldara®, 3M) es un inmunomodulador de uso tópico aprobado para el tratamiento de las verrugas genitales, queratosis actínicas (QA) y carcinoma basocelular superficial (BCCS), si bien en la práctica clínica también se usa en otros procesos dermatológicos fuera de indicación. Aunque lo más frecuente son los efectos secundarios locales, también puede producir efectos sistémicos. Presentamos el caso de una paciente que presentó un eritema exudativo multiforme (EEM) coincidiendo con dicho tratamiento.
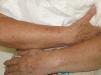
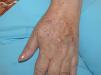
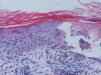
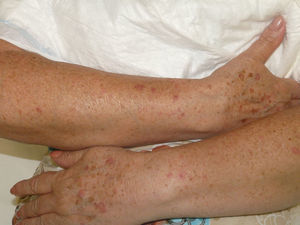
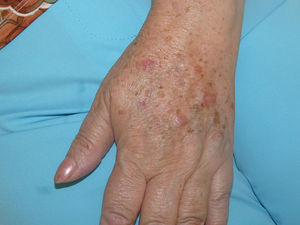
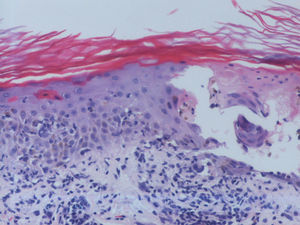
Se trata de una mujer de 66 años con antecedentes de hipertensión, síndrome depresivo y artrosis, en tratamiento desde hace años con amilorida/hidroclorotiazida, loracepam, escitalopram y dexibuprofeno. Acude a consultas por lesiones en la cara, observándose daño actínico, varias QA en el dorso nasal y el labio superior y un BCCS en la mejilla izquierda de 0,7cm. Se pauta tratamiento con imiquimod crema en todas las lesiones, siguiendo el esquema de tres veces por semana (días alternos) en las QA durante 4 semanas y 5 veces por semana 6 semanas en el BCCS. Al final de la segunda semana del tratamiento presenta en las áreas de aplicación una reacción local intensa con costras, edema y eritema que obliga a suspenderlo. A los 7 días se reinicia imiquimod, apareciendo a los 14 días lesiones en el tórax, los antebrazos, las manos y las piernas acompañadas de escozor, junto a empeoramiento de las lesiones de la cara, sensación distérmica no termometrada y malestar general. En la exploración llaman la atención amplias áreas costrosas en toda la pirámide nasal, el labio superior y la mejilla izquierda, que al levantarlas dejan erosiones, así como la presencia de varias pápulas eritematosas, redondeadas, de entre 0,5 y 0,8cm, en V del tórax y en el dorso de los antebrazos, de las manos y de las piernas, algunas con erosión central y otras con morfología en diana (figs. 1 y 2). No presenta afectación palmoplantar ni de mucosas. Niega la ingesta de fármacos distintos de los habituales, episodio previo de herpes simple u otra infección. Se realiza biopsia de una pápula, en la que se observa necrosis epidérmica, afectación de la interfase con daño de la basal e inflamación linfocitaria perivascular en la dermis papilar, compatible con EEM (fig. 3). Tras la retirada de imiquimod y la realización de curas con antibioterapia tópica, manteniendo su medicación habitual, la paciente mejora en pocos días con resolución total de la clínica general y cutánea.
Piel con hiperqueratosis, afectación de la interfase dermoepidérmica con vesiculación subepidérmica, células inflamatorias mononucleares en su interior y necrosis de la epidermis suprayacente. Se observan fenómenos locales de regeneración. Infiltrado linfohistiocitario perivascular superficial en la dermis (hematoxilina-eosina x10).
Imiquimod es un inmunomodulador tópico modificador de la respuesta inmune, con actividad antitumoral y antiviral gracias a su capacidad de estimular tanto la respuesta inmune innata como adquirida. El mecanismo exacto de acción se desconoce, pero se sabe que actúa a través del receptor Toll-like 7 y 8. Esto conlleva la secreción de citocinas proinflamatorias y antimicrobianas, fundamentalmente del factor de necrosis tumoral-α, interferón-α, y varias interleucinas (IL-6 y 8), que producen un estímulo de los linfocitos helper Th1 e inhibición de los helper Th2. Clínicamente esto se traduce en una inflamación aguda local con destrucción tumoral y de las células infectadas por el virus. Los efectos secundarios más frecuentes son locales, siendo mucho más raras las reacciones sistémicas. Es frecuente observar durante el tratamiento efectos adversos cutáneos en el área de aplicación que consisten en eritema, costras, edema, vesículas, ulceración, picor y quemazón, que después se resuelven con buenos resultados cosméticos. En cuanto a las posibles reacciones sistémicas puede aparecer un cuadro pseudogripal con astenia, fiebre, artromialgias, cefalea, náuseas y diarrea1. Se han descrito otras reacciones cutáneas locales como cambios de pigmentación (hipo e hiperpigmentación) y aisladamente aparición de lesiones tipo vitíligo con poliosis, quistes epidermoides eruptivos, empeoramiento de lesiones previas de granuloma anular, pápulas inflamatorias satélites, queratoacantomas eruptivos, aftosis, pénfigo foliáceo y pénfigo vegetante. Excepcionalmente también se han publicado casos con lesiones a distancia por exacerbación de procesos cutáneos previos como psoriasis2, eccema y pitiriasis rubra pilaris, o aparición de novo de pénfigo vulgar3, exantema morbiliforme en un inmunosuprimido4, angioedema y urticaria5,6. Incluso se han publicado reacciones no cutáneas como dolor neuropático crónico en la zona de aplicación7, espondiloartropatía y reducción de parámetros hematológicos8. Según la ficha técnica en ensayos clínicos se han reportado reacciones cutáneas alejadas de la zona de aplicación, incluyendo EEM. Postcomercialización se han notificado casos de EEM y cuadros graves cutáneos de síndrome de Stenvens-Johnson y lupus, pero no se describe el número de pacientes afectados ni los detalles clínicos de éstos. Hasta la fecha hay un solo caso comunicado similar al nuestro9, pero ninguno publicado.
En general, los efectos adversos sistémicos parecen deberse más a la liberación de citocinas de la piel a la circulación que al propio imiquimod, ya que tras su uso tópico la absorción es mínima, detectándose sólo nanogramos en sangre. Es posible que la gravedad pueda estar relacionada con la frecuencia de la aplicación, la extensión cutánea de la reacción o si se produce ulceración, por lo que en casos de lesiones extensas o muy numerosas es conveniente el uso de dosis bajas de imiquimod. En cualquier caso, tanto las reacciones sistémicas como las cutáneas presentan gran variabilidad interindividual, aun usando el mismo régimen terapéutico.
Por otro lado, se han descrito casos de EEM por contacto por numerosos alergenos como fármacos tópicos, sustancias químicas y plantas. Entre ellos están los corticoides tópicos, los antiinflamatorios no esteroideos, los parches de nitroglicerina, la povidona yodada, la para-fenilendiamina, los guantes de goma, el níquel, los herbicidas y la mezcla de fragancias. En la actualidad se desconoce la patogenia del EEM, pero parece que en estos casos sería por absorción sistémica junto a fenómenos inmunológicos con reacciones tipo iii y iv.