El eritema acral (EA) es una reacción cutánea relativamente frecuente producida por diferentes agentes quimioterápicos. Otros términos con los que se le conoce son eritrodisestesia palmoplantar o síndrome pie-mano. Se presenta como un eritema doloroso en palmas y plantas asociado a parestesias en el contexto de un tratamiento oncológico. El EA parece ser dosis-dependiente, y tanto el pico plasmático como la dosis acumulada del quimioterápico determinan su aparición. La clínica y los hallazgos histopatológicos sugieren una citotoxicidad directa de la epidermis acral por las altas concentraciones de los quimioterápicos. Los agentes más frecuentemente implicados son doxorrubicina, 5-fluorouracilo y derivados, citarabina y docetaxel.
Material y métodosSe presentan las características clínicas e histológicas de una serie de pacientes diagnosticados de eritema acral por quimioterápicos.
Se incluyeron en el trabajo todos los pacientes sometidos a quimioterapia que desarrollaron lesiones de eritema acral durante un período de tiempo comprendido entre enero de 2000 y diciembre de 2003.
Resultados y conclusiónSe encontraron 44 casos entre los 2.186 pacientes sometidos a quimioterapia, lo que supuso una incidencia del 2,01 % durante el período de estudio, y el 16,75 % de todas las lesiones cutáneas atribuidas a la quimioterapia.
El fármaco más frecuentemente relacionado fue el 5-fluorouracilo en infusión continua, y la mayor incidencia se dio en pacientes tratados con doxorrubicina liposomial. El EA fue toxicidad limitante de dosis en el 29,5% de los casos.
Los hallazgos histológicos variaron según la intensidad clínica de las lesiones, encontrando una dermatitis de interfase con necrosis de queratinocitos variable, dilatación del plexo vascular superficial y un escaso infiltrado inflamatorio.
El tratamiento más utilizado fue la piridoxina y las medidas locales como fomentos fríos, emolientes y corticoids tópicos.
Acral erythema, also known as palmoplantar erythrodysesthesia or hand-foot syndrome, is a relatively common cutaneous reaction caused by a variety of chemotherapeutic agents. It presents during cancer treatment as painful erythema and paresthesia affecting the palms and soles. It seems to be dose dependent and its appearance is determined by both the peak plasma concentration and the cumulative dose of the chemotherapeutic agent. The symptoms and histopathology findings are suggestive of direct cytotoxicity affecting the epidermis of the extremities caused by high concentrations of chemotherapeutic agents. The most commonly implicated agents are doxorubicin, 5-fluoracil and its derivatives, cytarabine, and docetaxel.
Material and methodsWe present the clinical and histologic characteristics of a series of patients diagnosed with chemotherapy-induced acral erythema.
The study included all patients who developed acral erythema lesions following chemotherapy between January 2000 and December 2003.
Resaults and conclusionsOut of 2186 patients who underwent chemotherapy, 44 cases of acral erythema were identified, representing an incidence of 2.01 % during the study period and 16.75 % of all cutaneous lesions attributed to chemotherapy.
The most commonly implicated drug was 5-fluoracil administered by continuous infusion and the highest incidence was observed in patients treated with liposomal doxorubicin. Acral erythema was a dose-limiting toxic effect in 29.5 % of cases.
The histologic findings varied according to the clinical severity of the lesions and included interface dermatitis with variable keratinocyte necrosis, dilation of the superficial vascular plexus, and limited inflammatory infiltrate.
The most commonly used treatment was pyridoxine, along with topical treatments such as cold compresses, emollients, and topical corticosteroids.
El eritema acral (EA) o síndrome pie-mano, o eritrodisestesia palmoplantar, es una reacción cutánea relativamente frecuente producida por diferentes quimioterápicos. Se cree que se trata de una reacción provocada por citotoxicidad directa del fármaco sobre la epidermis acral. Clínicamente se observa un eritema doloroso en palmas y plantas acompañado frecuentemente de parestesias. Se suele iniciar 24–48 horas después de la administración de la quimioterapia y se mantiene mientras dura el tratamiento, resolviéndose a las dos semanas de finalizarlo y repitiéndose tras nuevos ciclos.
Desde que fuera descrito en 1974 por Zuehlke, en pacientes con hipernefroma en tratamiento con mitotano1, se han publicado en la literatura numerosos casos aislados y series cortas de pacientes con EA. La incidencia según los diferentes trabajos oscila entre el 6 y el 64 % de los pacientes tratados con quimioterapia y es una causa frecuente de reducción de dosis o suspensión del tratamiento quimioterápico (toxicidad limitante de dosis).
En la práctica clínica se emplean sobre todo dos clasificaciones para graduar la intensidad de la afectación, la de la Organización Mundial de la Salud (OMS) y la de criterios de toxicidad común del National Cáncer Institute (CTC NCI), que se resumen en la tabla 1.
Clasificación clínica del eritema acral
| Clasificación OMS | Clasificación CTC NCI | ||
| Grado | Definición | Grado | Definición |
| 1 | Disestesias/parestesias, punzadas palmoplantares | 1 | Cambios cutáneos palmoplantares sin dolor (eritema, descamación) |
| 2 | Molestias al caminar o coger objetos. Eritema o edema palmoplantar sin dolor | 2 | Cambios cutáneos con dolor que no llega a interferir con la función |
| 3 | Edema y eritema dolorosos. Eritema y edema periungueales | 3 | Cambios cutáneos con dolor que llega a interferir con la función |
| 4 | Descamación, ampollas, ulceración. Dolor intenso | ||
CTC NCI: criterios de toxicidad común del National Cancer Institute; OMS: Organización Mundial de la Salud.
Presentamos el estudio de los pacientes en tratamiento quimioterápico que fueron diagnosticados de EA por quimioterapia desde enero de 2000 a diciembre de 2003 en el Instituto Valenciano de Oncología (IVO).
Material y métodosSe incluyeron en el trabajo todos los pacientes sometidos a quimioterapia que desarrollaron lesiones compatibles clínicamente con EA por quimioterápicos.
Los pacientes fueron observados en el Servicio de Dermatología, en el hospital de día o en la sala de hospitalización del IVO. Se realizó un estudio prospectivo homogéneo seleccionándose los pacientes consecutivamente, según fueron atendidos por nuestro servicio. El tiempo de estudio y seguimiento de los pacientes fue de tres años, comprendidos entre enero de 2000 y diciembre de 2003, ambos inclusive.
Este estudio se ha llevado a cabo en la Fundación IVO. Se trata de un centro monográfico dirigido a la Oncología que consta de 150 camas. Los Servicios representados en este centro son los de Oncología Médica, Oncología Radioterápica, Cirugía General, Ginecología, Urología, Otorrinolaringología y Dermatología, además de los servicios centrales de Radiodiagnóstico, Medicina Nuclear, Laboratorio y Anatomía Patológica. El IVO no cuenta con Unidad de Oncología Pediátrica, por lo que no se estudiaron niños con lesiones cutáneas secundarias a la quimioterapia. De acuerdo con los datos de la memoria de 2003 del IVO, el número de pacientes que recibe tratamiento en este hospital actualmente es de 21.936, con una afluencia anual media de 4.200 nuevos pacientes.
En todos los pacientes se realizó un examen clínico minucioso que incluyó exploración de la piel, mucosa oral y genital y faneras cutáneas. Se identificaron los agentes quimioterápicos utilizados y se determinó la localización y la gravedad de las lesiones, el inicio y la duración de la clínica y la sintomatología referida por el paciente. En casos seleccionados se efectuó una biopsia de la zona afectada.
ResultadosEpidemiologíaDurante el período del estudio encontramos 44 pacientes afectados por EA por quimioterapia entre los 2.186 pacientes sometidos a tratamiento quimioterápico. Esto supone una incidencia de 2,01 % y el 16,75 % de todas las lesiones cutáneas inducidas por la quimioterapia recogidas en este período de tiempo.
El fármaco más frecuentemente relacionado con esta erupción fue el 5-fluoruracilo (5-FU), especialmente administrado en infusión continua (22,7 % de los casos). Le siguieron en frecuencia el 5-FU en bolus (13,6 %), el docetaxel (13,6 %), la doxorrubicina liposomial (11,3 %) y la vinorelbina (9 %).
Con respecto a la incidencia, el EA fue especialmente frecuente entre los pacientes tratados con doxorrubicina liposomial (41,6 % de los tratados), 5-FU en infusión prolongada (21,7 %), citarabina (11 %) y gemcitabina (6,4 %).
En la tabla 2 se resumen los fármacos relacionados con EA en nuestra serie, relacionados con la localización y la intensidad de las lesiones según la clasificación CTC del NCI.
Casos de eritema acral en nuestra serie
| Fármaco | Epidemiología | Intensidad | Localización | ||||||
| N.° casos | % | Pacientes en tratamiento | Incidencia | G1 | G2 | G3 | Palmoplantar | PP y extra-PP | |
| 5-FU IC | 10 | 22,7 | 46 | 21,7% | 2 | 4 | 4 | 10 | 0 |
| 5-FU bolus | 6 | 13,6 | 786 | 0,7% | 1 | 4 | 1 | 6 | 0 |
| Doxorrubicina | 3 | 6,8 | 649 | 0,4% | 0 | 2 | 1 | 3 | 0 |
| Doxorrubicina-L | 5 | 11,3 | 12 | 41,6% | 0 | 3 | 2 | 3 | 2 |
| Paclitaxel | 2 | 4,5 | 127 | 1,5% | 0 | 2 | 0 | 0 | 2 |
| Docetaxel | 6 | 13,6 | 156 | 3,2% | 0 | 3 | 3 | 5 | 1 |
| Metotrexato | 3 | 6,8 | 323 | 0,9% | 1 | 2 | 0 | 3 | 0 |
| Vinorelbina | 4 | 9 | 126 | 3,1 % | 1 | 2 | 1 | 4 | 0 |
| Gemcitabina | 2 | 4,5 | 31 | 6,4% | 0 | 1 | 1 | 2 | 0 |
| Citarabina | 1 | 2,2 | 9 | 11% | 0 | 1 | 0 | 1 | 0 |
| Ciclofosfamida | 2 | 4,5 | 991 | 0,2% | 2 | 0 | 0 | 2 | 0 |
| Total | 44 | 7 | 24 | 13 | 37 | 5 | |||
5-FU: 5-fluorouracilo; G: grado; IC: infusión continua; L: liposomial; PP: palmoplantar.
Desde el punto de vista estadístico, la eritrodisestesia palmoplantar se relacionó significativamente con el 5-FU en infusión continua y con la doxorrubicina liposomial. Así mismo, con p muy cercanas al nivel de significación, encontramos relación con docetaxel, paclitaxel, gemcitabina y citarabina.
ClínicaEl cuadro clínico consistió en eritema palmoplantar de grado variable, acompañado de disestesia y dolor a la presión. Las lesiones se iniciaron entre 5 y 7 días después del tratamiento y persistían una o dos semanas. Por lo general, la continuación del tratamiento reactivó las lesiones en todos los pacientes, siendo cada vez más intensas. En la mayor parte de los casos las manifestaciones clínicas y el grado de afectación fue mayor en los últimos ciclos de tratamiento, lo que sugiere un efecto acumulativo de la toxicidad.
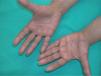
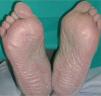
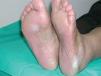
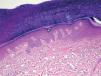
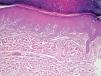
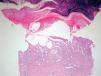
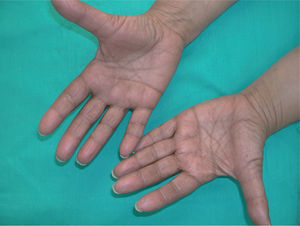
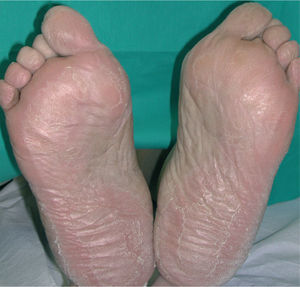
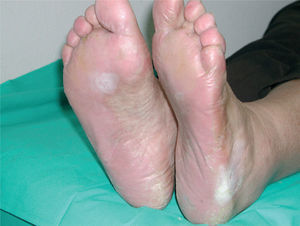
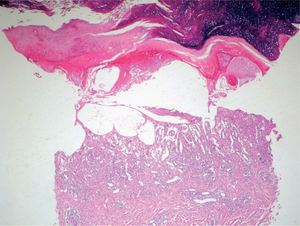
La intensidad de la eritrodisestesia palmoplantar se graduó de acuerdo con la clasificación de CTC del NCI. Esta clasificación se basa fundamentalmente en las molestias que originan las lesiones, sin tener en cuenta la intensidad de la afectación clínica. Sin embargo, encontramos una buena correlación entre la intensidad clínica y las molestias originadas por las lesiones. Los pacientes con síndrome pie-mano de intensidad G1 y G2 mostraban tan sólo eritema y descamación, con muy poco edema o fisuras (figs. 1 y 2). Los pacientes con grado 3 (13 casos) presentaban, por lo general, lesiones palmoplantares más intensas, con intenso eritema, edema, descamación y fisuración. Tres pacientes con afectación G3 desarrollaron lesiones ampollares, siendo éstas producidas por docetaxel, doxorrubicina liposomial y gemcitabina (fig. 3).
Todos los pacientes presentaban al menos lesiones palmares. Generalmente, la afectación palmar fue más precoz y más intensa en todos los casos, mientras que la plantar apareció más tarde y lo fue menos.
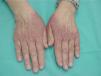
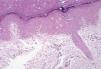
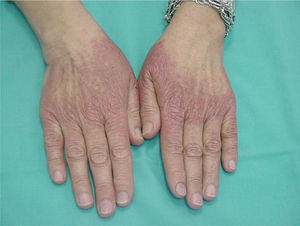
Cinco pacientes desarrollaron lesiones extrapalmoplantares asociadas al síndrome pie-mano, pudiendo denominarlo EA de localización atípica. Estos casos presentaron lesiones en el dorso de dedos y manos, talones y pabellones auriculares (fig. 4). Las lesiones consistían en eritema y descamación asociados a dolor a la presión en la zona afecta. La afectación extrapalmar en el síndrome pie-mano fue producida por docetaxel, doxorrubicina liposomial y paclitaxel.
La eritrodisestesia palmoplantar (EPP) fue toxicidad limitante de dosis en los 13 pacientes que desarrollaron afectación de grado 3 (29,5 % de los casos).
Los fármacos que indujeron de forma significativa eritrodisestesia palmoplantar limitante de dosis fueron el 5-FU en infusión prolongada, la doxorrubicina liposomial y el docetaxel.
Encontramos asociación significativa entre EA y onicolisis en 5 pacientes (11,36 %). Se trataba de sujetos con lesiones de EA G2 y G3 inducidas por adriamicina (1), docetaxel (3) y 5 fluoruracilo en bolo (1). La onicolisis fue intensa en todos y supuso un factor añadido para que el EA constituyera toxicidad limitante de dosis.
HistologíaSe obtuvieron 12 biopsias de pacientes con lesiones de EA inducidas por quimioterapia. Los hallazgos histológicos se resumen en la tabla 3.
Manifestaciones histológicas de los casos de eritema acral
| Tipo EA | N.° pacientes | Clínica | Histología |
| G1 | 2 | Eritema y descamación | Dilatación del plexo vascular superficialDegeneración hidrópica focalAusencia de infiltrado inflamatorioUn caso con siringometaplasia escamosa ecrina |
| G2 | 3 | Eritema, edema, fisuración | Dilatación vascularEdema en la dermis papilarDegeneración hidrópica focalAtipias nucleares del estrato basalQueratinocitos necróticos aisladosEscaso infiltrado inflamatorioUn caso con siringometaplasia escamosa ecrina |
| G3 sin ampolla | 3 | Eritema, edema, fisuración, descamación | Dermatitis de interfase con escasos linfocitosDegeneración hidrópica basalEdema en la dermis papilarHendiduras suprabasalesQueratinocitos necróticosUn caso con siringometaplasia escamosa ecrina |
| G3 con ampolla | 2 | Eritema, edema, ampollas | Necrosis epidérmica completa Degeneración reticular en la dermis superficial |
| Dorso de mano | 2 | Eritema, descamación, vesículas aisladas | Degeneración hidrópica basal Queratinocitos necróticos aislados Infiltrado inflamatorio liquenoide escaso |
La histología del EA por quimioterapia fue similar a la de las lesiones por citotoxicidad epidérmica de la quimioterapia. Encontramos una dermatitis de interfase con necrosis de queratinocitos en grado variable. Aparecieron así mismo alteraciones en la maduración de los queratinocitos
basales, y una asociación frecuente a siringometaplasia escamosa ecrina. A diferencia de otros cuadros de citotoxicidad epidérmica, el infiltrado inflamatorio fue muy escaso o ausente.
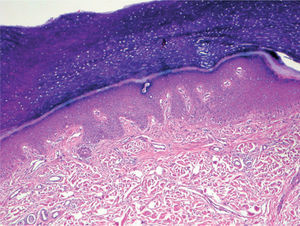
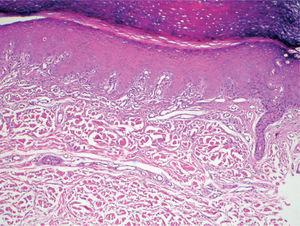
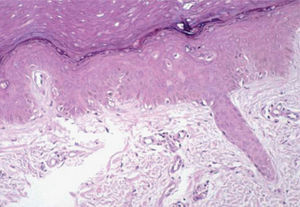
Existió una correlación clínico-patológica entre la intensidad de las lesiones del EA y la afectación histológica. Los pacientes con EPP grado 1 (G1) muestran tan sólo dilatación del plexo vascular superficial y afectación focal del estrato basal (fig. 5). Los pacientes con EPP G2 muestran dilatación del plexo vascular superficial, edema en dermis papilar, dermatitis de interfase con degeneración hidrópica basal y queratinocitos necróticos aislados (fig. 6). Los pacientes con EPP G3 muestran abundantes queratinocitos necróticos, intenso edema con despegamiento de la epidermis y dermatitis de interfase. En los casos con lesiones ampollares se produjo una necrosis completa del estrato epidérmico, con degeneración reticular de la dermis papilar (fig. 7).
En tres pacientes (25 % de las biopsias), encontramos cambios de siringometaplasia escamosa ecrina. Este hallazgo pudo verse tanto en biopsias de pacientes con afectación de grado 1 como de grados 2 y 3 (fig. 8).
DiscusiónLa incidencia del EA ha sido calculada en algunas series de casos entre el 6 y el 64 % de los pacientes tratados con diferentes regímenes quimioterápicos siendo, casi en el 80% de los casos, formas leves de reacción (grados 1 y 2)2-6. En nuestra serie la incidencia del síndrome pie-mano encontrada entre todos los pacientes sometidos a quimioterapia fue del 2,01 % (44/2.186), suponiendo la reacción cutánea por quimioterapia más frecuente después de la alopecia, la mucositis y las hiperpigmentaciones.
Se han publicado casos aislados o series cortas de EA inducido por prácticamente todos los agentes citostáticos y, en ocasiones, resulta difícil valorar la influencia real de un agente determinado debido a la frecuencia de regímenes poliquimioterápicos. Los quimioterápicos más relacionados son 5-FU y derivados, doxorrubicina, citarabina, docetaxel y metrotexato.
El 5-FU es un agente implicado frecuentemente, y hasta el 34 % de los pacientes tratados con 5-FU en forma de infusión continua y el 13 % de los tratados con 5-FU en bolus llegan a desarrollar eritrodisestesia palmoplantar4,7-9. En nuestra serie el 5-FU administrado en infusión continua fue la causa más frecuente de EA (22,7 %) y mostró una incidencia de 21,7 %. La capecitabina (Xeloda®) es un profármaco del 5-FU que se administra de forma oral y que presenta una incidencia similar de inducción de EA al 5-FU en infusión continua10-12. Debe considerarse que en la actualidad se tiende a utilizar más la capecitabina que el 5-FU, lo que hace que este fármaco se encuentre entre los causantes más frecuentes de EA.
La doxorrubicina es un agente quimioterápico ampliamente utilizado, sobre todo en regímenes poliquimioterápicos, que ha sido relacionado con el síndrome piemano13-15. La doxorrubicina liposomial (Caelix®, Doxyl®) es una formulación de la doxorrubicina en liposomas de polietilenglicol con una menor toxicidad hematológica y cardiológica y con una menor frecuencia de alopecia. Sin embargo, la toxicidad dermatológica, principalmente el EA, es mucho más frecuente y su incidencia alcanza el 40 % de los pacientes16-22. En nuestra serie la doxorrubicina liposomial fue el agente quimioterápico con mayor incidencia de EA (41,6 % de todos los pacientes tratados con este agente lo desarrollaron). En la actualidad la doxorrubicina liposomial está siendo ampliamente utilizada en tumores de mama, ovario y sarcomas.
La citarabina es otro de los fármacos más ampliamente relacionados con el EA, sobre todo con la variedad ampollosa23-26. En nuestra serie, sin embargo, el único caso encontrado de EA en relación con la citarabina no fue ampolloso, por lo que no podemos confirmar esta relación.
El cuadro clínico del EA es prácticamente superponible en todos los pacientes cualquiera que sea el agente causal. Se caracteriza por la aparición de eritema, edema e incluso ampollas en palmas y plantas asociadas a molestias en forma de parestesias, dolor y escozor. Suele iniciarse a partir de las 48 horas de la administración de la quimioterapia y, en la mayor parte de los pacientes, las molestias locales preceden a las lesiones cutáneas. La afectación palmar suele ser más intensa que la plantar y las lesiones con frecuencia son más evidentes en pulpejos y zonas de apoyo. Las lesiones persisten una o dos semanas, empeorando con cada ciclo de quimioterapia, y el cuadro se resuelve tras la retirada del tratamiento o la reducción de la dosis27.
En la práctica clínica se emplean diferentes clasificaciones para graduar la gravedad del EA; las dos más utilizadas para definir la gravedad del EA son las de la OMS y el NCI que se resumen en la tabla 1. La clasificación de la OMS se basa en el grado de afectación clínica y la del NCI (la utilizada en este trabajo) en la intensidad de las molestias originadas. Por lo general, y así lo hemos observado en este trabajo, la intensidad de las molestias se correlaciona con el aspecto clínico de las lesiones, sugiriendo una buena correlación entre ambas clasificaciones.
El EA puede aparecer en zonas atípicas, como el dorso de manos y pies, talones, codos o incluso pabellones auriculares28, cara29 o genitales30. Se ha descrito la aparición de necrosis falángica distal como manifestación grave del EA por doxorrubicina liposomial22. En nuestra serie encontramos 5 casos en los que las lesiones afectaban preferentemente a la cara dorsal de manos y pies y a los talones (11,36 % de los casos). En estos casos los agentes quimioterápicos relacionados fueron doxorrubicina liposomial (2), paclitaxel (2) y docetaxel (1). Esta asociación entre taxanos y doxorrubicina liposomial con lesiones de EA extra-palmoplantar encontrada en nuestra serie no ha sido previamente descrita. Sin embargo, la revisión de la literatura ha permitido encontrar casos muy similares a los de nuestros pacientes producidos, igualmente, por taxanos y doxorrubicina liposomial31-33.
En nuestra serie hemos encontrado 5 casos de EA asociado a onicolisis, siendo esta asociación estadísticamente significativa en nuestra serie, especialmente en lesiones de
EA de grado 3. La onicolisis fue especialmente frecuente en los casos graves de EA, se acompañó en muchos casos de lesiones periungueales y fue producida especialmente por docetaxel.
El EA constituye una causa importante de toxicidad limitante de dosis. En nuestra serie fue la causa de reducción de dosis o retirada del tratamiento en el 29,5 % de los casos. El 5-FU en infusión continua, el docetaxel y la doxorrubicina liposomial fueron los más relacionados con estas formas más graves de EA. Se trata de la toxicidad cutánea más frecuentemente limitante de dosis en tratamientos quimioterápicos, de hecho actualmente se considera el EA como la toxicidad limitante de dosis más importante en tratamientos como la doxorrubicina liposomial y la capecitabina oral.
No se conoce con exactitud el mecanismo patogénico del EA inducido por quimioterapia. Inicialmente, debido a las similitudes clínicas e histológicas con la enfermedad injerto contra huésped, se pensó que se trataba de una enfermedad autoinmune. Se sugirió que los quimioterápicos inducían cambios en los receptores de la superficie celular que desencadenaban la reacción autoinmune34. Sin embargo, en la actualidad, la hipótesis más probable y aceptada es que la eritrodisestesia palmoplantar es una reacción adversa directa del agente citostático sobre las células epidérmicas. Esto es debido a la relación de la dosis con la intensidad de las lesiones18,35,36 y a los hallazgos histopatológicos comunes a otras entidades producidas por citotoxicidad directa sobre la epidermis37. En esta línea hemos encontrado en nuestro trabajo diferentes evidencias que sostienen este mecanismo de citotoxicidad directa:
- 1.
Correlación entre la intensidad de las lesiones y la dosis, tanto la dosis acumulada como el pico plasmático alcanzado en cada tratamiento.
- 2.
La reducción de la dosis del tratamiento o su retirada en los casos más graves condujo invariablemente a una mejoría o a la desaparición de las lesiones.
- 3.
Los hallazgos histológicos son similares a otras reacciones inducidas por citotoxicidad directa.
- 4.
Asociación estadísticamente significativa del EA con la onicolisis, lesión típica de citotoxicidad directa.
No existe una explicación clara de la distribución palmoplantar típica de esta reacción, y parece aceptable la existencia de factores físicos que la justifiquen. El estrato córneo grueso, el gradiente de temperatura, la anatomía vascular, el alto índice divisional, la ausencia de glándulas sebáceas, la abundancia de glándulas ecrinas y las papilas dérmicas anchas son factores característicos de palmas y plantas que pueden justificar esta localización. Algunos estudios sugieren una respuesta inmune especial a nivel de las glándulas ecrinas, favorecida por la excreción sudoral del agente citostático. Así, se ha demostrado una expresión
anómala de ICAM-1 en las células del ducto excretor ecrino en pacientes con EA, lo que favorece la presencia de linfocitos NK para originar citotoxicidad directa38.
No disponemos de series extensas de pacientes que describan los hallazgos histopatológicos del EA de forma sistemática. Por el contrario sí que existen evaluaciones histológicas de muchos casos clínicos aislados, o series cortas que muestran hallazgos similares a los observados en otras reacciones por citotoxicidad directa epidérmica de quimioterápicos5,20,39-48. Estas reacciones se caracterizan por una dermatitis de interfase, acompañadas de un infiltrado escaso y un grado variable de necrosis epidérmica37. De la revisión de la literatura se puede concluir que en la epidermis se aprecia degeneración hidrópica de la membrana basal, necrosis aislada de queratinocitos basales y atrofia relativa del estrato espinoso, apreciándose, en ocasiones, alteraciones en la maduración de los queratinocitos, aberraciones nucleares, mitosis atípicas o células multinucleadas. En la dermis se observa dilatación vascular, edema de dermis papilar y un infiltrado escaso en la unión dermo-epidérmica. En algunos casos se han descrito cambios en las glándulas ecrinas, en forma de siringometaplasia escamosa ecrina5,38,42,48-50. Los resultados de nuestra serie permiten diferenciar una gradación de las manifestaciones histológicas del EA, que se corresponden con la intensidad clínica de las lesiones. Así, las reacciones leves (grado 1 y 2 de la OMS o grado 1 y 2 del NCI) muestran tan sólo a nivel epidérmico queratinocitos necróticos aislados en la capa basal, junto a algunas imágenes nucleares atípicas, y en las reacciones graves (grados 3 y 4 de la OMS y grado 3 del NCI) existe destrucción de la totalidad de la capa basal epidérmica, llegándose a formar vesículas e incluso necrosis epidérmica completa.
El principal diagnóstico diferencial histológico del EA debe realizarse con la enfermedad injerto contra huésped aguda34, que puede también semejarse clínicamente u ocurrir simultáneamente al EA, haciendo el diagnóstico más complicado. La aparición en pacientes que reciben trasplantes alogénicos de médula ósea, la localización típica inicial en la cara y zona torácica superior, la posibilidad de afectación de múltiples localizaciones, la afectación interna y el curso agresivo de la enfermedad de injerto contra huésped permiten diferenciar ambas entidades51.
La reducción de la dosis, la prolongación del intervalo de administración del fármaco y, en última instancia, la retirada del mismo son las únicas medidas terapéuticas que han demostrado amplia eficacia en la eritrodisestesia palmoplantar.
Varios son los tratamientos propuestos en algunos de los casos aislados y series pequeñas publicados (tabla 4), siendo necesarios estudios prospectivos, aleatorizados y controlados para demostrar su eficacia11.
Tratamiento del eritema acral
| Medidas generales | Tratamiento específico |
| Reducción de dosis, prolongación del intervalo de administración, retirada del fármaco | Piridoxina (5-fluorouracilo, doxorrubicina, doxorrubicina-L,docetaxel, etopósido) |
| Elevación de la extremidad | Enfriamiento de manos y pies (docetaxel, doxorrubicina-L) |
| Fomentos fríos | Corticoides orales (5-fluorouracilo, doxorrubicina-L, metotrexato) |
| Evitar trabajo manual y deambulación excesivos | Corticoides tópicos (5-fluorouracilo, doxorrubicina-L, cisplatino, docetaxel) |
| Emolientes | Dimetilsulfóxido 99 % tópico (doxorrubicina-L) |
| Antibióticos tópicos | Vitamina E (capecitabina, docetaxel) |
| Analgésicos |
Se ha obtenido alivio sintomático mediante el cuidado de las heridas para prevenir infecciones, elevación de los miembros para reducir el edema, fomentos fríos, emolientes, antibióticos tópicos y analgésicos11,28,52. El enfriamiento de manos y pies durante la administración de la quimioterapia se ha utilizado con éxito parcial en la prevención del EA inducido por docetaxel53, y puede reducir la gravedad y la frecuencia del EA asociado a doxorrubicina liposomial21. Parece también aconsejable no realizar trabajo manual intenso ni caminar en exceso y evitar el calor local.
Los corticoides tópicos potentes han sido empleados con diferente éxito, obteniéndose mejores resultados si se administran conjuntamente con frío local y emolientes16,29,54-57.
Los corticoides sistémicos pueden ser útiles en algunos casos y han sido utilizados con éxito para el tratamiento y prevención del EA asociado a 5-FU, doxorrubicina liposomial, bleomicina y metotrexato. Se han utilizado la prednisona (1mg/kg/día)56,58, la dexametasona (8mg/12 horas)17, la betametasona (1,5mg/día)49 o metilprednisolona intravenosa (1mg/kg/día)51 desde un día antes y hasta 4 días después de la administración de la quimioterapia.
La piridoxina (vitamina B6) parece ser el tratamiento más útil. En nuestra serie permitió en muchos casos la continuidad del tratamiento, sin necesidad de reducir la dosis del agente causal. Se ha utilizado con éxito a dosis de 300–500mg/día para la prevención del EA asociado a 5-FU, docetaxel, etopósido y doxorrubicina8,35,57,59,60. Un ensayo clínico sobre un modelo canino demostró que la piridoxina retrasa la aparición del EA y reduce su gravedad durante la quimioterapia con doxorrubicina liposomial61. Se desconoce su mecanismo de acción y se ha propuesto que podría regenerar las fibras nerviosas lesionadas62.
El tratamiento con dimetilsulfóxido tópico al 99 %, 4 veces al día durante 14 días, se ha propuesto como una alternativa en el eritema acral producido por doxorrubicina liposomial63.
Recientemente ha sido utilizada la vitamina E en varios pacientes afectos de eritrodisestesia palmoplantar por regímenes quimioterápicos con capecitabina-docetaxel, obteniéndose mejoría en todos ellos y pudiéndose continuar la quimioterapia12.
Conflicto de interesesDeclaramos no tener ningún conflicto de intereses.