La influencia del virus del papiloma humano (VPH) en el desarrollo de carcinoma cutáneo no melanoma es un tema controvertido. VPH-β es el género más frecuente relacionado con el desarrollo de cáncer de piel.
ObjetivosAnalizar la prevalencia y espectro de los tipos de VPH presentes en piel tumoral y piel sana perilesional en pacientes inmunodeprimidos y pacientes inmunocompetentes, así como evaluar la influencia de diferentes factores clínicos en la prevalencia del VPH en cáncer de piel.
MétodosSe determinó la presencia de VPH en 120 muestras mediante PCR nested y posterior secuenciación. Se tomó biopsia de piel de 30 pacientes trasplantados renales y de 30 pacientes inmunocompetentes con cáncer cutáneo tanto de zona tumoral como de piel sana perilesional. Se registraron las variables potenciales de confusión. Los datos fueron analizados utilizando análisis de regresión logística multivariado.
ResultadosADN del VPH fue detectado en 44/60 (73,3%) de las muestras de pacientes inmunodeprimidos y en 32/60 (53,3%) de las muestras de pacientes inmunocompetentes (OR ajustada 3,4 [1,2-9,6]). Al comparar la presencia de VPH en los 2 grupos entre piel tumoral y piel sana perilesional la presencia de VPH en piel sana perilesional fue mayor que en piel tumoral. El género más frecuente aislado fue el VPH-β.
ConclusiónUn amplio espectro de tipos de VPH, la mayoría del género β, se encuentran en la piel de pacientes trasplantados e inmunocompetentes con cáncer cutáneo.
The influence of human papillomavirus (HPV) on the development of nonmelanoma skin cancer (NMSC) is a topic of debate. HPV types from the beta genus (HPV-β) have been most frequently associated with the development of skin cancer.
ObjectivesTo analyze the prevalence and range of HPV types in NMSC lesions and healthy perilesional skin in immunodepressed and immunocompetent patients and to evaluate the influence of various clinical factors on the prevalence of HPV in skin cancer.
MethodsNested polymerase chain reaction and sequencing were used to detect HPV in 120 NMSC samples obtained by biopsy from 30 kidney transplant recipients and 30 immunocompetent patients. In all cases, a sample was taken from the tumor site and the surrounding healthy skin. Potential confounders were assessed and the data analyzed by multivariate logistic regression.
ResultsHPV DNA was detected in 44 (73.3%) of the 60 samples from immunodepressed patients and in 32 (53.3%) of the 60 samples from immunocompetent patients (adjusted odds ratio, 3.4; 95% CI, 1.2-9.6). In both groups of patients, HPV was more common in healthy perilesional skin than in lesional skin. HPV-β was the most common type isolated.
ConclusionWe found a wide range of HPV types (mostly HPV-β) in the skin of kidney transplant recipients and immunocompetent patients with skin cancer.
El virus del papiloma humano (VPH) es un conocido factor de riesgo para el desarrollo de cáncer de cuello de útero1,2. También es reconocida su implicación en la etiopatogenia del carcinoma epidermoide de las mucosas (vulva, pene, ano), o en el carcinoma epidermoide de cabeza y cuello (faringe)3. Sin embargo, su papel en el desarrollo del cáncer cutáneo no melanoma (CCNM) es más discutido. Los estudios realizados para valorar la implicación del VPH en la oncogénesis cutánea son muy dispares, en parte debido a las diferencias en los métodos utilizados para la detección y tipificación del VPH, el tipo de muestra analizada, así como la falta de inclusión de potenciales factores de confusión para el riesgo de cáncer de piel, sobre todo aquellos relacionados con la exposición solar.
De acuerdo con la actual clasificación taxonómica4, la familia Papillomaviridae está compuesta por 16 géneros, que se identifican con las letras griegas (alfa, beta, gamma, etc.). Cada género incluye una o varias especies, que van numeradas, y dentro de cada especie encontramos los tipos, subtipos y variantes. En la tabla 1 se muestra la clasificación del VPH del género beta. La relación entre VPH y el cáncer de piel se ha sustentado en varias premisas como la asociación epidemiológica observada entre las verrugas y los carcinoma epidermoides cutáneos (CEC) en pacientes con epidermodisplasia verruciforme5, la coexistencia de signos histológicos de infección viral y displasia epitelial en una misma biopsia6,7 o la identificación de ADN del VPH en muchos CCNM8,9. En un principio se intentó extrapolar los mecanismos identificados en los VPH mucosos oncogénicos para determinar cuáles serían las estrategias o mecanismos moleculares de los VPH-β (y VPH-γ) para inducir carcinogénesis cutánea. Sin embargo, se comprobó que las vías de actuación de los tipos cutáneos son diferentes, bastante más complejas y posiblemente en colaboración con otros cofactores como la radiación ultravioleta (UV) o la inmunosupresión. De estudios moleculares realizados en cultivos celulares se desprende que las dianas principales de los VPH-β se centran en mecanismos antiapoptóticos y en el bloqueo de las vías protectoras de la integridad del genoma encargadas de reparar el daño provocado por la radiación UV. En este sentido, se ha observado que los VPH-β 8 y 20 tienen la capacidad de bloquear la acción de las proteínas proapoptóticas BAK y BAX10, cuya acción es similar pero independiente de la p53. Así mismo, se ha identificado otra proteína (proteína XRCC1) reparadora de dímeros de timidina inducidos por la radiación UV, que puede ser interceptada por algunos VPH-β como el HPV811. Las proteínas VPH E6 y E7 son oncoproteínas codificadas por el virus. Estudios recientes han examinado el papel de estas proteínas en la transformación a CEC en pacientes trasplantados. Se han encontrado transcripciones E6/E7 en VPH8, 9 y 15 en queratosis actínicas y CEC, sugiriendo un papel activo de VPH en la patogenia de estas lesiones12. Además se ha descubierto que los VPH8 y VPH5 tienen una capacidad inhibitoria sobre la interleucina-8 que participa en la estimulación de una respuesta inmunitaria que controla aquellas células dañadas por la radiación UV13.
Clasificación taxonómica del virus del papiloma humano (VPH) del género beta
| Género | Especie | Tipo | Otros tipos | Comentarios |
| Beta | 1 | VPH-5 | VPH-8, 12, 14, 19, 20, 21, 25, 36, 47, 93 | Lesiones cutáneas. Comúnmente asociado a lesiones en epidermodisplasia verruciforme (EV) o pacientes inmunodeprimidos.Normalmente lesiones benignas, pero también asociado a lesiones malignas, incluso en pacientes inmunocompetentes |
| 2 | VPH-9 | VPH-15, 17, 22, 23, 37, 38, 80 | Lesiones cutáneas. Comúnmente asociado a lesiones en EV o pacientes inmunodeprimidos.Normalmente lesiones benignas, pero también asociado a lesiones malignas, incluso en pacientes inmunocompetentes | |
| 3 | VPH-49 | VPH-75, 76 | Lesiones cutáneas benignas | |
| 4 | VPHcand92 | – | Lesiones cutáneas premalignas y malignas | |
| 5 | VPHcand96 | – | Lesiones cutáneas premalignas y malignas |
Sin embargo, la falta de resultados consistentes de ADN del VPH en el cáncer de piel, el frecuente hallazgo de VPH en la piel normal y la falta de identificación de un grupo de «alto riesgo» de VPH en el cáncer de piel cuestionan el papel del VPH en el desarrollo de CCNM.
En el presente estudio tratamos de determinar la prevalencia y el espectro de los tipos de VPH en piel tumoral y piel sana perilesional de pacientes trasplantados renales y pacientes inmunocompetentes, así como evaluar la influencia de diferentes factores clínicos en la prevalencia del VPH en el cáncer cutáneo.
MétodosDiseño del estudio y pacientesSe determinó la presencia de ADN de VPH en muestras tumorales y piel sana perilesional de pacientes inmunodeprimidos e inmunocompetentes. Se estudiaron un total de 60 pacientes (30 trasplantados renales y 30 inmunocompetentes) remitidos desde la consulta de nefrología a la consulta de dermatología del Hospital Universitario Doctor Peset de Valencia, para la valoración de lesiones sospechosas de CCNM durante el periodo comprendido entre enero de 2010 a enero de 2012. El estudio fue aprobado por el Comité de Ética del Hospital. Se obtuvo consentimiento informado de todos los pacientes.
Los pacientes fueron entrevistados por medio de un cuestionario estructurado para recopilar información relativa a las variables potenciales de confusión: edad, sexo, fototipo (según la clasificación de Fitzpatrick), exposición solar ocupacional (considerándola alta cuando el paciente trabajaba o había trabajado la mayor parte de su jornada laboral al aire libre), así como historia pasada o actual de verrugas y queratosis actínicas.
Las características de los pacientes se muestran en la tabla 2.
Características de los pacientes inmunodeprimidos e inmunocompetentes
| Pacientes inmunodeprimidos (n=30)N.o/total (%) | Pacientes inmunocompetentes (n=30)N.o/total (%) | p-valor | |
| Edad-años (media±DE) | 69,57±7,61 | 72,53±12,57 | 0,247 |
| Sexo | |||
| Mujer | 14/30 (46,6) | 16/30 (53,3) | 0,605 |
| Varón | 16/30 (53,3) | 14/30 (46,6) | |
| Exposición solar ocupacional | |||
| Alta | 10/30 (33,3) | 15/30 (50,0) | 0,190 |
| Baja | 20/30 (66,7) | 15/30 (50,0) | |
| Localización de la muestra | |||
| Zona fotoexpuesta | 22/30 (73,3) | 16/30 (53,3) | 0,108 |
| Zona no fotoexpuesta | 8/30 (26,7) | 14/30 (46,7) | |
| Fototipo | |||
| I/II | 24/30 (80,0) | 22/30 (73,3) | 0,754 |
| ≥III | 6/30 (20) | 8/30 (23,6) | |
| Queratosis actínicas | 23/30 (76,7) | 20/30 (66,7) | 0,390 |
| Verrugas | 10/30 (33,3) | 8/30 (26,7) | 0,573 |
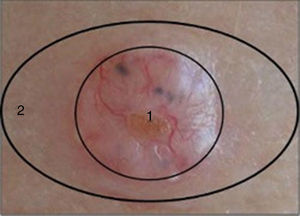
Se obtuvieron 2 biopsias de cada paciente de la siguiente manera: después de la extirpación de la lesión sospechosa se tomó una biopsia punch de 3mm del centro de la lesión (muestra tumoral) y otra biopsia punch de 3mm del extremo del huso de la misma pieza quirúrgica libre de lesión (piel sana perilesional) (fig. 1). Las biopsias se almacenaron en fresco a –80°C en criotubos individuales hasta su procesamiento. El resto de la pieza quirúrgica fue fijada en formol al 10% y embebida en parafina para su diagnóstico histopatológico. Se obtuvieron un total de 120 biopsias: 60 de pacientes trasplantados (30 biopsias de piel tumoral y 30 de piel sana perilesional) y 60 de pacientes inmunocompetentes (30 pacientes de piel tumoral y 30 de piel sana perilesional).
Las muestras tumorales de pacientes inmunodeprimidos e inmunocompetentes se componían de 30 lesiones en cada grupo: 7 CEC, 10 CEC in situ y 13 carcinomas basocelulares (CBC).
Las muestras de piel eran consideradas de áreas fotoexpuestas si se recogían de las áreas de la cara, la nuca o el cuello, la zona anterior del tórax, la parte superior de la espalda, el dorso del antebrazo o la región pretibial.
Método de deteción virus del papiloma humanoLa extracción del ADN y tipificación del VPH se llevó a cabo según el método descrito por Harwood et al.14. Para la extracción de ADN de las muestras se utilizó el kit Maxwell 16 FFPE Tissue LEV DNA purification kit®. La identificación de los distintos tipos de VPH se llevó a cabo mediante PCR nested y posterior secuenciación. Se emplearon 100ng de ADN para la amplificación en un volumen final de 25μl (para las 2 amplificaciones) con 3,5mM de MgCl2, 10mM Tris HCL, 50mM KCL, 0,1% tritón X-100, 0,2mM de cada uno de los deoxinucleótidos trifosfato, 0,75μM de cada cebador, DMSO al 5% y 1,25 U Taq DNA polimerasa (Promega®). Desde la primera a la segunda amplificación se traspasaron 2,5μl. La primera amplificación constó de 45 ciclos de amplificación de 94°C de desnaturalización (1,5min), 50°C de apareamiento (1,5min) y 72°C de extensión (1,5min). La segunda amplificación constó de 30 ciclos de amplificación de 94°C de desnaturalización (1,5min), 50°C de apareamiento (1,5min) y 72°C de extensión (1,5min). Los cebadores utilizados en la primera amplificación corresponden a los descritos en la literatura con nombre FAP59 y FAP6415, con posiciones situadas en los nucleótidos 5.981 a 6.001 (iniciador cadena directa, FAP59) y 6.458 a 6.436 (iniciador cadena complementaria, FAP64). Los cebadores utilizados en la segunda amplificación corresponden a los descritos en la literatura con nombre FAP 6085F y FAP6319R16, con posiciones situadas en los nucleótidos 6.085 a 6.104 (iniciador cadena directa, FAP6085F) y 6.319 a 6.296 (iniciador cadena complementaria, FAP6319R). La posición de estos primers está referida al genoma de VPH8. La detección del amplificado de 235 pares de bases se realizó en gel de agarosa al 3%. El amplificado fue purificado mediante columnas (Purelink®, Invitrogen). La reacción de secuenciación se llevó a cabo en un volumen final de 10μl mediante BigDye Terminador v3.1 Cycle sequencing kit® (Applied Biosystems) en las condiciones descritas por el fabricante. El perfil de amplificación empleado fue de 25 ciclos con 10seg a 94°C, 10min a 50°C y 2min a 60°C. Una vez finalizada la reacción de secuenciación esta fue purificada mediante alcoholes (etanol al 100% y al 70%) y el producto final se resuspendió en formamida desionizada. El producto final fue secuenciado en ABI PRISM® 310 (Applied Biosystems) y se analizó la secuencia en la base de datos del NCBI usando el algoritmo blast-n.
Análisis estadísticoLas variables categóricas se describen como frecuencias y porcentajes y las variables continuas como media y desviación estandar (DE). Las diferencias en la distribución de las variables entre los grupos fueron evaluadas con la prueba Chi-cuadrado (χ2) o prueba exacta de Fisher para las variables categóricas y el análisis de la varianza (ANOVA) para los datos continuos. Odds ratio (OR) e intervalos de confianza (IC) al 95% fueron calculados; OR se estimó también ajustada a la exposición solar ocupacional, fototipo y localización de la muestra. Se utilizó el análisis de regresión logística múltiple para identificar las variables de forma independiente asociadas a la presencia de VPH en las muestras de piel. Los análisis se realizaron con el paquete estadístico SPSS, v. 19. La significación estadística se fijó en p<0,05.
ResultadosVirus del papiloma humano en pacientes inmunodeprimidos y pacientes inmunocompetentesEl ADN del VPH fue detectado con mayor frecuencia en pacientes inmunodeprimidos en comparación con los pacientes inmunocompetentes. El VPH fue detectado en un total de 44 de las 60 muestras (73,3%) en pacientes trasplantados, frente 32 de las 60 muestras (53,3%) en pacientes inmunocompetentes, siendo estas diferencias significativas (OR ajustada 3,4 [1,2-9,6]). Al comparar los distintos géneros de VPH el más prevalente fue el VPH-β, aunque no encontramos diferencias significativas en la prevalencia de VPH entre pacientes inmunodeprimidos e inmunocompetentes (tabla 3).
Distribución del virus del papiloma humano (VPH) en pacientes inmunodeprimidos e inmunocompetentes
| InmunodeprimidosLesión y perilesión (n=60) n.o (%) | InmunocompetentesLesión y perilesión (n=60) n.o (%) | OR (95% IC) | OR* (95% IC) | |
| Algún VPH | 44 (73,3) | 32 (53,3) | 2,4 (1,1-5,2) | 3,4 (1,2-9,6) |
| VPH-α | 0 | 1 (1,7) | - | - |
| VPH-β | 34 (56,6) | 26 (43,3) | 1,8 (0,9-3,8) | 1,5 (0,6-3,9) |
| Especie | ||||
| Beta-1 | 14 (23,3) | 16 (26,7) | 0,8 (0,4-1,9) | 0,5 (0,1-1,7) |
| Beta-2 | 11 (18,3) | 4 (6,7) | 3,1 (0,9-10,5) | 1,8 (0,4-8,4) |
| Beta-3 | 7 (11,7) | 5 (8,3) | 1,5 (0,4-4,9) | 1,0(0,9-1,2) |
| Beta-4 | 1 (1,7) | 0 | - | - |
| Beta-5 | 1 (1,7) | 1 (1,7%) | 1,0 (0,1-16,4) | 0,8 (0,1-18,9) |
| VPH-γ | 5 (8,3) | 1 (1,6) | 5,4 (0,6-47,4) | 9,8 (0,9-101,9) |
| VPH-1 | 1 (1,6) | 0 | - | - |
| VPH-6 | 1 (1,6) | 0 | - | - |
| VPH-10 | 1 (1,6) | 0 | - | - |
| VPH no clasificable | 2 (3,3) | 2 (3,3) | 1,0 (0,1-7,3) | 1,4 (0,1-17,7) |
Se detectó ADN del VPH con mayor frecuencia en piel sana perilesional que en piel tumoral, tanto en pacientes inmunodeprimidos como en inmunocompetentes. Al comparar los distintos géneros de VPH entre piel tumoral y piel sana perilesional el género VPH-β, en concreto la especie β-1 fue el más prevalente, pero no se encontraron diferencias entre los grupos.
La tabla 4 muestra las tasas de detección de ADN del VPH y OR ajustada para las muestras de los pacientes inmunodeprimidos (lesión y perilesión) y pacientes inmunocompetentes (lesión y perilesión). Ajustamos la OR al fototipo, exposición solar y localización de la muestra.
Detección de ADN del virus del papiloma humano (VPH) en piel lesional y piel sana perilesional en pacientes inmunodeprimidos e inmunocompetentes
| Género | Pacientes inmunodeprimidos | Pacientes inmunocompetentes | OR* | (95% IC) | ||
| Lesión (n=30) n.o (%) | Perilesión (n=30) n.o (%) | Lesión (n=30) n.o (%) | Perilesión (n=30) n.o (%) | Lesión versus perilesióna | Lesión versus perilesiónb | |
| Todos los géneros | 24 (80,0) | 20 (66,7) | 14 (46,7) | 18 (60,0) | 0,4 (0,1-1,5) | 0,4 (0,1-1,7) |
| α-papiloma virus | - | - | 1 (3,3) | - | - | - |
| β-papiloma virus | ||||||
| Todos VPH-β | 17 (56,7) | 17 (56,7) | 13 (43,3) | 13 (43,3) | 1,0 (0,3-3,9) | 1,1 (0,3-4,2) |
| Especie | ||||||
| Beta- 1 | 9 (30,0) | 5 (16,7) | 9 (30,0) | 7 (23,3) | 2,1 (0,6-7,4) | 1,4 (0,5-4,5) |
| Beta-2 | 6 (20,0) | 5 (16,7) | 3 (10,0) | 1 (3,3) | 1,3 (0,3-4,6) | 3,2 (0,3-32,9) |
| Beta- 3 | 1 (3,3) | 6 (20,0) | 0 (-) | 5 (16,7) | 0,1 (0,1-1,2) | - |
| Beta- 4 | 1(3,3) | - | - | - | - | - |
| Beta- 5 | 1(3,3) | 1 (3,3) | - | - | - | |
| γ-papiloma virus | ||||||
| Todos VPH-γ | 3 (10,0) | 2 (6,7) | - | 1 (3,3) | 1,5 (0,2-10,1) | - |
| VPH-1 | 1 (3,3) | - | - | - | - | - |
| VPH-6 | - | 1 (3,3) | - | - | - | - |
| VPH-10 | 1 (3,3) | - | - | - | - | - |
| No clasificable VPH | - | 2 (6,7) | - | 2 (6,7) | - | - |
Los tipos VPH del género β fueron los más frecuentes, encontrándose en 34/60 (56,5%) de las muestras de pacientes inmunodeprimidos y en 26/60 (43,3%) de las muestras de pacientes inmunocompetentes. Dentro del género VPH-β la especie VPH-β1 fue la más prevalente, siendo el tipo más frecuente el VPH-20, aunque sin encontrarse diferencias significativas entre los grupos. Solo detectamos una muestra de VPH-α en un paciente inmunocompetente. VPH-γ mostró una fuerte asociación a pacientes inmunodeprimidos, aunque sin alcanzar significación estadística. En 6 determinaciones la PCR para VPH fue positiva de forma débil, no pudiéndose secuenciar al tener poca cantidad de ADN viral. Se detectaron 4 muestras de VPH no clasificados en Genbank (tabla 4).
Se detectaron infecciones mixtas (por múltiples tipos de VPH) en 29 de las 120 determinaciones, siendo más frecuentes en pacientes inmunodeprimidos (17/60) que en inmunocompetentes (12/60).
Factores de riesgoLos pacientes inmunodeprimidos e inmunocompetentes fueron similares en edad y sexo. Tampoco difirieron significativamente con respecto a la exposición solar, localización del tumor, fotototipo o historia de verrugas o queratosis actínicas. La localización del tumor en áreas fotoexpuestas fue la única variable asociada de forma significativa a un mayor riesgo de VPH en pacientes inmunodeprimidos. En pacientes inmunocompetentes la exposición ocupacional alta, la localización en áreas expuestas y el fototipo bajo fueron significativamente más frecuentes en los pacientes positivos para el VPH. En pacientes inmunodeprimidos el riesgo de positividad del VPH también fue mayor en pacientes con queratosis actínicas y verrugas, pero las diferencias no fueron estadísticamente significativas (tabla 5).
Factores de riesgo para el virus del papiloma humano (VPH) en pacientes inmunodeprimidos e inmunocompetentes
| Pacientes inmunodeprimidos | Valor p | Pacientes inmunocompetentes | Valor p | |||||
| VPH positivo | VPH negativo | OR | VPH positivo | VPH negativo | OR | |||
| Edad (media±DE) | 71,5±8,1 | 67,6±6,5 | 1,1 (0,9-1,2) | 0,32 | 73,1±12,6 | 72,0±12,9 | 1,0 (0,9-1,7) | 0,80 |
| Sexo | ||||||||
| Mujer | 7 (35,0%) | 7 (70,0%) | 1,0 | 0,070 | 9 (64,3%) | 7 (43,8%) | 1,0 | 0,08 |
| Varón | 13 (65,0%) | 3 (30,0%) | 4,3 (0,8-22,2) | 5 (35,7%) | 9 (56,3%) | 0 (0,1-1,9) | ||
| Exposición solar ocupacional | ||||||||
| Baja | 12 (60,0%) | 8 (80,0%) | 1,0 | 0,25 | 4 (28,6%) | 11 (68,8%) | 1,0 | 0,03 |
| Alta | 8 (40,0%) | 2 (20,0%) | 2,7 (0,5-15,9) | 10 (71,4%) | 5 (31,3%) | 5,5 (1,2-26,4) | ||
| Localización de la muestra | ||||||||
| Zona no fotoexpuesta | 2 (10,0%) | 6 (60,0%) | 1,0 | 0,01 | 2 (14,3%) | 12 (75,0%) | 1,0 | 0,01 |
| Zona fotoexpuesta | 18 (90,0%) | 4 (40,0%) | 13,5 (1,9-93,2) | 12 (85,7%) | 4 (25,0%) | 18,0 (2,8-117,7) | ||
| Fototipo | ||||||||
| ≥III | 3 (15,0%) | 3 (30,0%) | 1,0 | 0,31 | 1 (7,1%) | 7 (43,8) | 1,0 | 0,02 |
| I-II | 17 (85,0%) | 7 (70,0%) | 2,4 (0,4-15,1) | 13 (92,9%) | 9 (56,3) | 10,9 (1,1-103,9) | ||
| Queratosis actínicas | ||||||||
| No | 4 (20,0%) | 3 (30,0%) | 1,0 | 0,42 | 7 (50,0%) | 6 (37,5%) | 1,0 | 0,37 |
| Sí | 16 (80,0%) | 7 (70,0%) | 1,7 (0,3-9,8) | 7 (50,0%) | 10 (62,5%) | 0,6 (0,1-2,6) | ||
| Verrugas | ||||||||
| No | 12 (60,0%) | 8 (80,0%) | 1,0 | 0,25 | 10 (71.4.0%) | 12 (75,0%) | 1,0 | 0,57 |
| Sí | 8 (40,0%) | 2 (20,0%) | 2,7 (0,4-15,9) | 4 (28,6%) | 4 (25,0%) | 0,4 (0,2-6,1) | ||
PH positivo o negativo se refiere a VPH detectado o no detectado respectivamente en el total de las muestras (lesión y perilesión).
Recogimos las muestras de 60 lesiones tumorales: 30 de pacientes inmunodeprimidos (7 CEC, 10 CEC in situ y 13 CBC) y 30 de pacientes inmunocompetentes (7 CEC, 10 CEC in situ y 13 CBC). La presencia de VPH fue más frecuente en CEC in situ tanto en pacientes inmunodeprimidos como en inmunocompetentes, detectándose en 8/10 (80%) de los CEC in situ en pacientes inmunodeprimidos y en 6/10 (60%) de los CEC in situ de los pacientes inmunocompetentes. La menor prevalencia de VPH la encontramos en los CBC, tanto en inmunodeprimidos como en inmunocompetentes, aunque estos resultados no alcanzaron significación estadística (tabla 6).
Prevalencia del virus del papiloma humano (VPH) en lesiones tumorales
| Total | VPH positivo (%) | p-valor | |
| Pacientes inmunodeprimidos | 30 | 20 (66,7) | |
| CEC | 7 | 5 (71,4) | |
| CEC in situ | 10 | 8 (80,0) | |
| CBC | 13 | 7 (53,8) | 0,39 |
| Pacientes inmunocompetentes | 30 | 14 (46,7) | |
| CEC | 7 | 4 (57,1) | |
| CEC in situ | 10 | 6 (60,0) | |
| CBC | 13 | 4 (30,8) | 0,31 |
CBC: carcinoma basocelular; CEC: carcinoma epidermoide.
En este estudio se ha examinado una población de pacientes inmunodeprimidos e inmunocompetentes para identificar la prevalencia y el espectro de los tipos de VPH presentes en el tejido tumoral y en la piel sana perilesional. La mayor prevalencia de VPH encontrada en pacientes inmunodeprimidos frente inmunocompetentes concuerda con otros artículos publicados previamente. En el estudio de Harwood et al.17 se compara por la técnica de PCR degenerada la prevalencia de VPH en 148 muestras: 85 muestras de pacientes inmunodeprimidos (44 CEC, 24 CBC y 17 lesiones premalignas: queratosis actínicas o CEC in situ) y 63 de pacientes inmunocompetentes (22 CEC, 30 CBC y 11 lesiones premalignas) encontrando una mayor prevalencia de VPH en las lesiones de los pacientes inmunodeprimidos en comparación con los pacientes inmunocompetentes (82 frente 36%; p<0,001).
Al comparar la prevalencia de VPH entre piel tumoral y piel sana perilesional la presencia de VPH ha sido mayor en piel sana perilesional que en piel tumoral, tanto en pacientes inmunodeprimidos como en inmunocompetentes, aunque estos resultados no han alcanzado significación estadística. La alta prevalencia de ADN del VPH en piel sana perilesional, tanto en pacientes inmunodeprimidos como en inmunocompetentes, concuerda con los hallazgos de estudios anteriores que sugieren que el ADN del VPH se encuentra ampliamente distribuido en la piel de la población general18,19. Estudios realizados en personas inmunocompetentes han encontrado ADN del VPH en 67-74% de los pelos arrancados19,20 y en el 69-80% de los frotis de piel21. Estos estudios, junto con nuestros datos, sugieren que la presencia de ADN de VPH es generalizada en piel de apariencia normal. En otros estudios, en cambio, se detectó ADN del VPH con mayor frecuencia en piel tumoral que en piel sana. En el estudio de Forslund et al.22 se comparó la presencia de VPH en CCNM, queratosis actínicas y piel sana del mismo paciente, hallándose una prevalencia de VPH mayor en la piel tumoral que en la piel sana, y llegaron a la conclusión que la especie VPH-β2 se asociaba a CEC. En nuestro estudio no determinamos la presencia de VPH en queratosis actínicas y la mayoría de tumores incluidos fueron CBC. En este punto debemos puntualizar que la mayoría de trabajos relacionan la infección del VPH con el CEC23. Los trabajos que intentan buscar una asociación entre infección por VPH y CBC son menores24,25, y la gran mayoría no encuentran una asociación estadísticamente significativa.
No hemos encontrado diferencias significativas en el espectro de tipos de VPH entre las 2 poblaciones, si bien el género VPH-β fue el más prevalente, sobre todo la especie VPH-β1. Datos similares se muestran en otros artículos26, aunque muchos de estos trabajos se basan en la clasificación taxonómica clásica de VPH en: mucosos, cutáneos o asociados a epidermodisplasia verruciforme (EV)27. Según la clasificación de Villiers de 20044 (que clasifica los VPH en 16 géneros) los tipos anteriormente clasificados como VPH-EV ahora se incluyen en el género β: VPH-β1 y VPH-β2. En el estudio de Asgari et al.8 la especie más prevalente fue VPH-β2, aunque en este estudio, como en el nuestro, el tipo más frecuente detectado fue el VPH-20 (perteneciente a VPH-β1).
Las muestras de áreas fotoexpuestas mostraron mayor prevalencia de ADN del VPH tanto en pacientes inmunodeprimidos como en inmunocompetentes. Nuestro estudio apoya la teoría de la importante interacción de la luz UV y la presencia de VPH. La radiación UV también se asoció con CCNM en pacientes VPH-beta positivos en el estudio de Bouwes Bavinck et al.28. Al estudiar los posibles factores de confusión solo la localización del tumor en áreas fotoexpuestas se asoció con un mayor riesgo de VPH en pacientes inmunodeprimidos. En pacientes inmunocompetentes la exposición solar ocupacional alta, la localización del tumor en áreas fotoexpuestas y el fototipo bajo también se asociaron con un mayor riesgo de VPH de forma significativa. El importante papel de la radiación UV también se refleja en otros trabajos como el de Forslund et al.22, donde el ADN del VPH también se asoció de forma significativa con la exposición al sol, tanto en piel tumoral como en piel sana.
Al comparar la presencia de VPH en las muestras tumorales la presencia de VPH fue mayor en los CEC in situ que en los CEC o CBC, tanto en pacientes inmunodeprimidos como inmunocompetentes. Este hallazgo coincide con los estudios que sostienen la teoría de que el VPH en el cáncer de piel se detecta con mayor frecuencia en las lesiones más precoces como los CEC in situ y queratosis con displasia, sugiriendo que la influencia del VPH se centraría fundamentalmente en las etapas iniciales de la carcinogénesis cutánea, más que en la perpetuación tumoral29,30. En nuestro trabajo, si bien no determinamos la presencia de VPH en queratosis actínicas, la presencia de queratosis actínicas o verrugas se asoció a mayor riesgo de VPH en pacientes inmunodeprimidos, aunque estos resultados no alcanzaron significación estadística, seguramente por el tamaño muestral limitado.
Los datos obtenidos en este estudio ponen de relieve las diferencias potencialmente importantes en la prevalencia de VPH de pacientes inmunodeprimidos e inmunocompetentes, apoyando la compleja interacción entre VPH, la exposición a la radiación UV y el estado de inmunosupresión. La mayor prevalencia de VPH encontrada en piel sana perilesional sugiere que el ADN del VPH se encuentra ampliamente distribuido en la población general. Si bien no hemos encontrado correlación entre la presencia de VPH y el cáncer de piel hemos de tener en cuenta que se trata de una serie pequeña, de carácter informativo y que se necesitan estudios más amplios para valorar la implicación del VPH en el cáncer de piel.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses
Manifestamos nuestro agradecimiento al Servicio de Anatomía Patológica y Microbiología del Hospital Universitario Doctor Peset (Valencia) por su colaboración en la elaboración del presente trabajo.