El carcinoma epidermoide cutáneo (CEC) es la segunda neoplasia cutánea más frecuente y su incidencia está aumentando en las últimas décadas. La mayoría de los tumores se van a resolver con cirugía, pero alrededor de un 5% van a presentar metástasis locales y a distancia; esta proporción será mayor en algunos CEC que presenten determinados factores denominados de alto riesgo: tamaño tumoral (mayor de 2cm), profundidad de invasión (superior a 2mm), nivel de Clark (IV o superior), invasión perineural, invasión linfovascular, el grado de diferenciación (tumores pobremente diferenciados), tipo histológico (desmoplásico, adenoescamoso, enfermedad de Bowen invasiva o el CEC que aparece sobre un proceso inflamatorio crónico), inmunosupresión, infección por el virus del papiloma humano (VPH), localización en zonas de alto riesgo (pabellón auricular, mucosa labial), expresión de ciertos genes tumorales, o una inadecuada resección del tumor. La séptima y última clasificación TNM de la American Joint Committe on Cancer (AJCC) ha incluido algunos de estos factores de riesgo obteniendo de esta forma un mejor estadiaje. Realizamos una revisión de todos los factores de mal pronóstico del CEC y analizamos la nueva clasificación de la AJCC, así como las opciones terapéuticas del CEC de alto riesgo.
Cutaneous squamous cell carcinoma (cSCC) is the second most common form of skin cancer and its incidence has increased in recent decades. Most cSCCs are successfully treated by surgery, but local and distant metastases develop in approximately 5% of cases; this proportion is higher in certain forms of cSCC with high-risk factors, namely: tumor size >2cm, depth >2mm, Clark level ≥IV, perineural invasion, lymphovascular invasion, poor differentiation, certain histologic subtypes (desmoplastic or adenosquamous carcinoma, invasive Bowen disease, or a cSCC arising in areas of chronic inflammation), immunosuppression, human papillomavirus infection, high-risk anatomic location (pinna of the ear, labial mucosa), expression of certain tumor genes, and inadequate tumor resection. The latest TNM (tumor, lymph node, metastasis) classification of cSCC published by the American Joint Committee on Cancer (AJCC) in the seventh edition of its Cancer Staging Manual now incorporates several of these risk factors to improve disease staging. We review all the factors currently considered to be markers of poor prognosis in cSCC and analyze the new AJCC classification and the different treatment options for high-risk cSCC.
El carcinoma epidermoide cutáneo (CEC) es la segunda neoplasia cutánea más frecuente después del carcinoma basocelular y su incidencia ha aumentado de forma considerable durante los últimos 20 años. Estudios epidemiológicos predicen un mayor incremento en la próxima década1–4. En España se estima una tasa anual de entre 72 por 100.000 habitantes para las mujeres y 100,8 por 100.000 habitantes para los varones5. La mayoría de los CEC están localizados y se resuelven habitualmente mediante la extirpación quirúrgica u otros procedimientos locales4,6,7. No obstante, existe un subgrupo de CEC con un comportamiento biológico más agresivo, que muestran gran tendencia a la recidiva local, a la diseminación linfática y en ocasiones, a la invasión de órganos distantes. El porcentaje de CEC primarios que metastatizarán es variable según las distintas series, habitualmente inferior al 5%. Éste será mayor en los CEC de alto riesgo8, que según los autores puede oscilar entre el 152 y el 38%1. Debido al aumento de la incidencia de este tipo de cáncer y el mal pronóstico en un subgrupo de pacientes, es importante el conocimiento de los factores de riesgo de los CEC para el desarrollo de recidivas locales y metástasis.
Se define como CEC de alto riesgo aquellos CEC que tienen un riesgo de recidiva, metástasis ganglionares y/o a distancia mayor del 5%, en base a las características del tumor y factores del propio paciente9. Recientemente se ha publicado la séptima edición de la clasificación TNM de la American Joint Committe on Cancer (AJCC) de los carcinomas cutáneos no melanomas6,10. Las clasificaciones previas no eran adecuadas para estadificar a los pacientes con CEC. Actualmente, además del tamaño tumoral (mayor de 2cm) se consideran otros datos importantes como la profundidad de invasión (superior a 2mm), el nivel de Clark (IV o superior), la localización (pabellón auricular, mucosa labial) o el grado de diferenciación (tumores pobremente diferenciados)6,10. Si un tumor cumple dos o más de los criterios de «alto riesgo» pasaría a formar parte de una T superior del que le correspondería por el tamaño y como consecuencia tendría peor pronóstico (tablas 1 y 2). Otras modificaciones importantes de esta edición es que separa el CEC del resto de carcinomas cutáneos no melanoma, ya que el comportamiento de este tipo de tumor es distinto del carcinoma basocelular o del tumor de Merkel; lo que se pretende con esta separación es proporcionar una mejor aproximación pronóstica y por lo tanto, terapéutica. También se excluyen ciertas localizaciones específicas como los CEC de párpado, pene y vulva. Los autores argumentan que la mayoría de los CEC aparecen en la cabeza y el cuello4. El de párpado se engloba dentro de los tumores oftalmológicos y el de pene y vulva se separa de la clasificación por su íntima asociación con el virus del papiloma humano (VPH) y distinto comportamiento biológico10. Con la séptima edición TNM de la AJCC se logra una mejor predicción del pronóstico del CEC, sin embargo, hay otros factores de alto riesgo no incluidos en esta clasificación y que conllevan una mayor tasa de recidiva y metástasis. El objetivo de este trabajo es revisar los factores relacionados con el CEC de alto riesgo y cuál es la influencia en el pronóstico y en el manejo terapéutico.
Clasificación actual del TNM según la American Joint Committee on Cancer (AJCC), de la séptima edición
| 1.1 Tamaño del tumor | |
| Tx | El tumor primario no se puede localizar |
| T0 | No existe evidencia del tumor primario |
| Tis | Carcinoma in situ |
| T1 | Carcinoma de menos de 2cm en su diámetro mayor de extensión con menos de dos factores de riesgoa |
| T2 | Carcinoma de más de 2cm en su diámetro mayor o tumor de cualquier tamaño con más de dos factores de riesgoa |
| T3 | Invasión tumoral del maxilar, mandíbula, órbita o hueso temporal |
| T4 | Invasión tumoral ósea o extensión perineural en la base craneal |
| 1.2 N: afectación de ganglios linfáticos | |
| Nx | Los ganglios linfáticos regionales no pueden ser valorados |
| N0 | No existen metástasis en los ganglios linfáticos regionales |
| N1 | Metástasis en un único ganglio linfático ipsilateral al tumor de 3cm o menos en su mayor dimensión |
| N2 | Metástasis en un ganglio linfático ipsilateral al tumor, mayor de 3cm en su diámetro mayor pero menor de 6cm. o múltiples ganglios ipsilaterales que no excedan los 6cm o múltiples ganglios bilaterales o contralaterales no mayores de 6cm |
| N2a | Metástasis en un ganglio linfático ipsilateral al tumor, mayor de 3cm en su diámetro mayor, pero menor de 6cm |
| N2b | Múltiples ganglios ipsilaterales que no excedan los 6cm |
| N2c | Múltiples ganglios bilaterales o contralaterales no mayores de 6cm |
| N3 | Metástasis en un ganglio linfático mayor de 6cm en su diámetro mayor |
| 1.3 M: metástasis a distancia | |
| M0 | No metástasis a distancia |
| M1 | Metástasis a distancia |
Clásicamente el tamaño del tumor, entendido como diámetro horizontal mayor, se ha correlacionado con mayor tasa de recurrencias locales, de metástasis regionales y con una menor superviviencia. De hecho, era la única variable que se tenía en cuenta para determinar la T hasta la última clasificación de la AJCC (tabla 1)1. Esta importancia del tamaño tumoral se confirma tanto en estudios con análisis univariantes como multivariantes10. El límite del tamaño tumoral a partir del cual los tumores tienen mayor tendencia a metastatizar se ha establecido en varios trabajos en 2cm. Así, tumores mayores de 2cm tienen el doble de probabilidad de recurrir y tres veces más de metastatizar que aquellos menores1,6,10–13. No obstante, no debemos ignorar la posibilidad de que tumores menores de 2cm puedan metastatizar, como se ha observado en un estudio prospectivo con 266 pacientes con CEC de cabeza y cuello metastásico donde la mayoría de los pacientes tenían tumores con tamaño inferior a 2cm9. Por ello es necesario valorar otros factores para determinar el riesgo de metastatizar del CEC2.
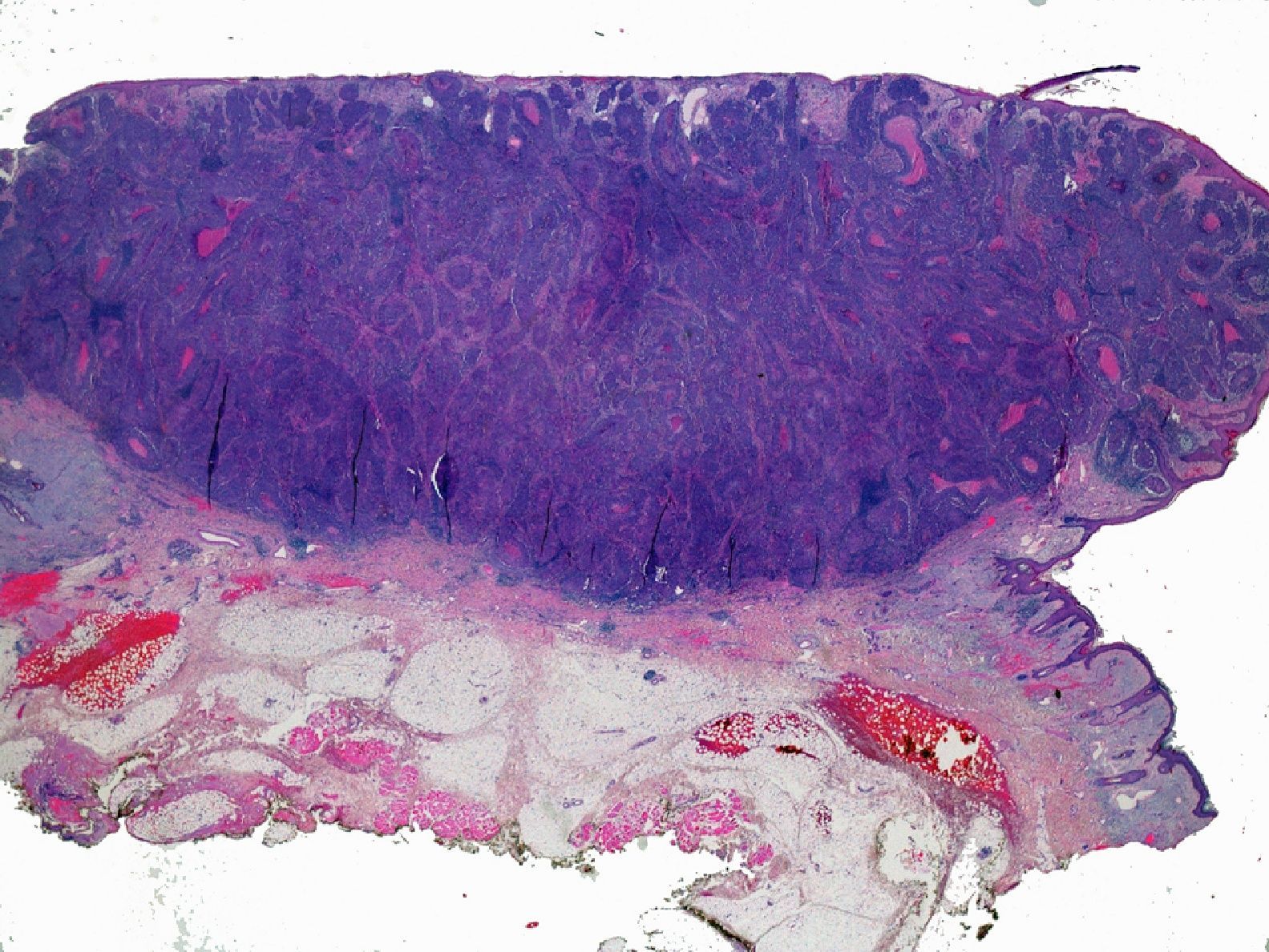
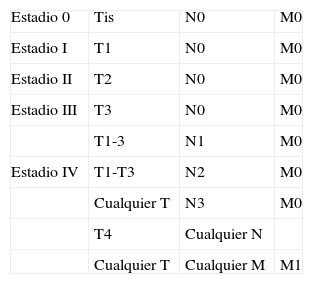
ProfundidadLa profundidad o el grosor tumoral se define como la zona de mayor invasión por el tumor medida en milímetros y sería el equivalente al Breslow en el melanoma14 (fig. 1). Un aspecto importante es cómo se mide la profundidad del CEC, que no es tarea sencilla, debido a que en muchas ocasiones se presenta como una lesión ulcerada en el centro o de aspecto crateriforme. Además, los criterios entre patólogos pueden ser variables. En 2008 Branscht et al. estudiaron en 615 pacientes con CEC una serie de variables, entre ellas la profundidad del tumor, y el riesgo de metástasis11. Concluyeron que los CEC menores de 2mm presentaban un riesgo de recidiva o metástasis prácticamente nulo. En los tumores de entre 2,1 y 6mm el riesgo aumentaba hasta el 4%, y si el tumor era mayor de 6mm de profundidad hasta un 16% presentaban metástasis. Veness et al. no observaron metástasis en los CEC menores de 2mm. Sin embargo, el 17% de los tumores de entre 2 y 4mm y el 83% de los tumores mayores de 4mm desarrollaron metástasis15.
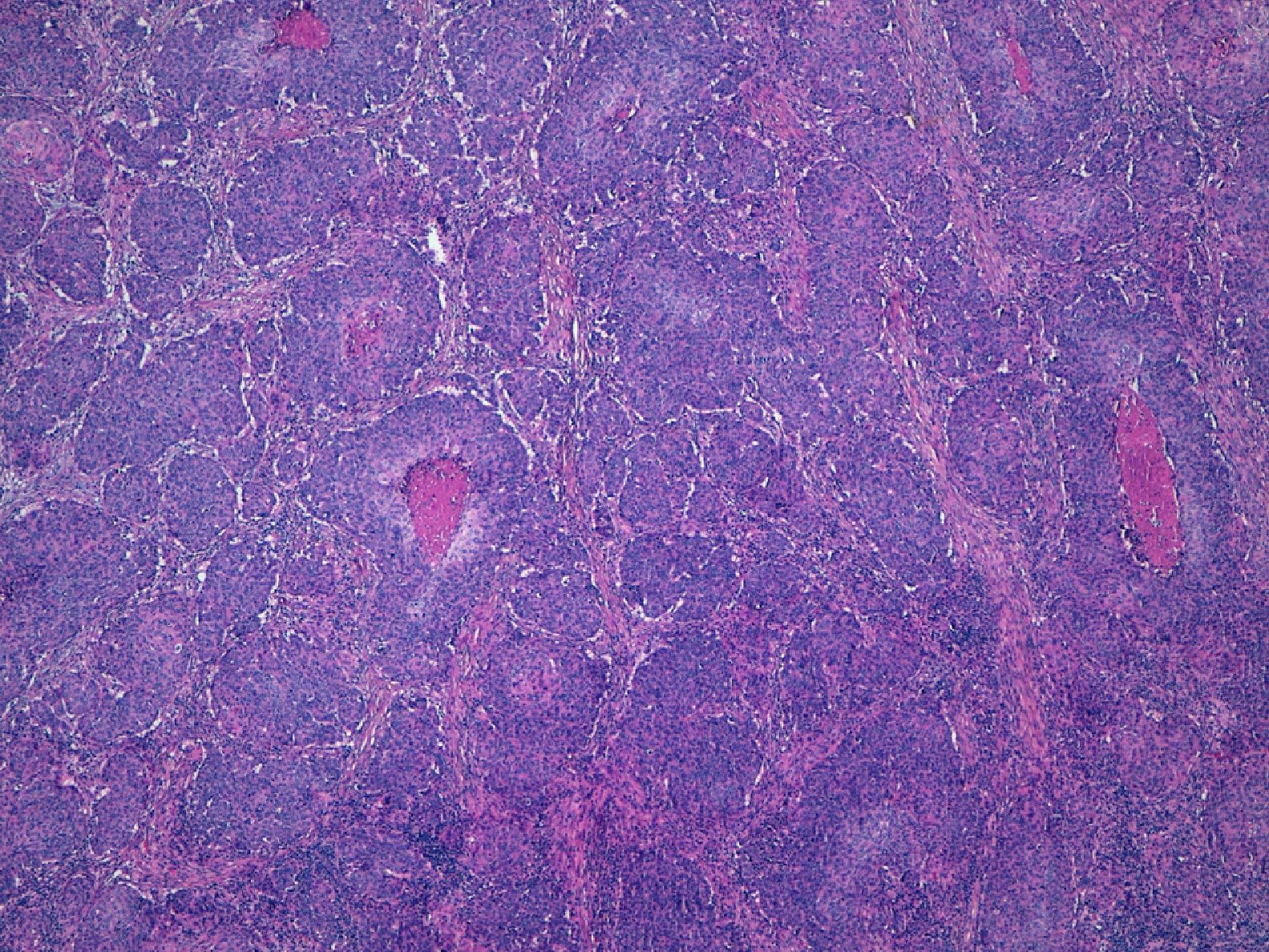
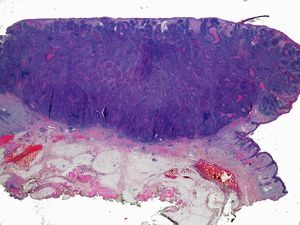
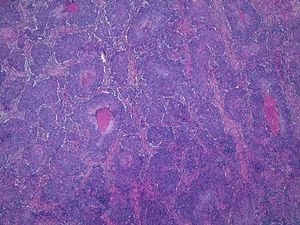
Por otra parte, la invasión de estructuras en profundidad o el nivel de Clark es importante en aquellas localizaciones donde la dermis y el tejido celular es más fino. Por ejemplo, un CEC en el pabellón auricular con el mismo grosor que uno en la espalda será más agresivo. Clayman et al. observaron que los CEC con nivel de Clark superior a IV tenían peor pronóstico4 (fig. 2).
El grosor del tumor y el nivel de invasión en profundidad son factores pronósticos importantes del CEC. Ambas variables han sido incluidas en la última edición de la AJCC como factores de alto riesgo (tabla 1.1). En la última clasificación de la AJCC también se ha incluido la infiltración ósea del maxilar, mandíbula, órbita o hueso temporal, como T3 y la invasión de la base del cráneo como T4 (ésta última tiene peor pronóstico pues implica invasión ósea y perineural)10.
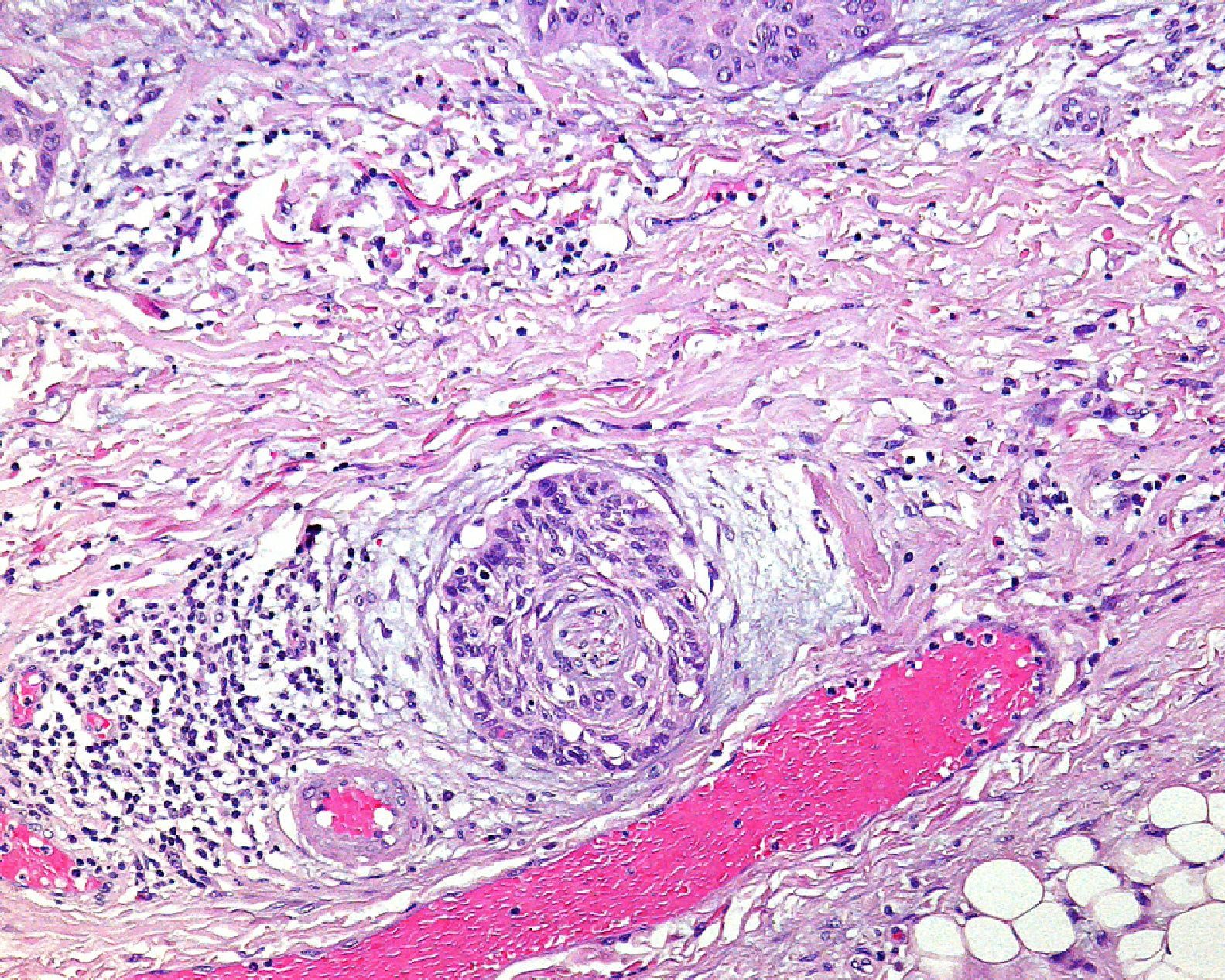
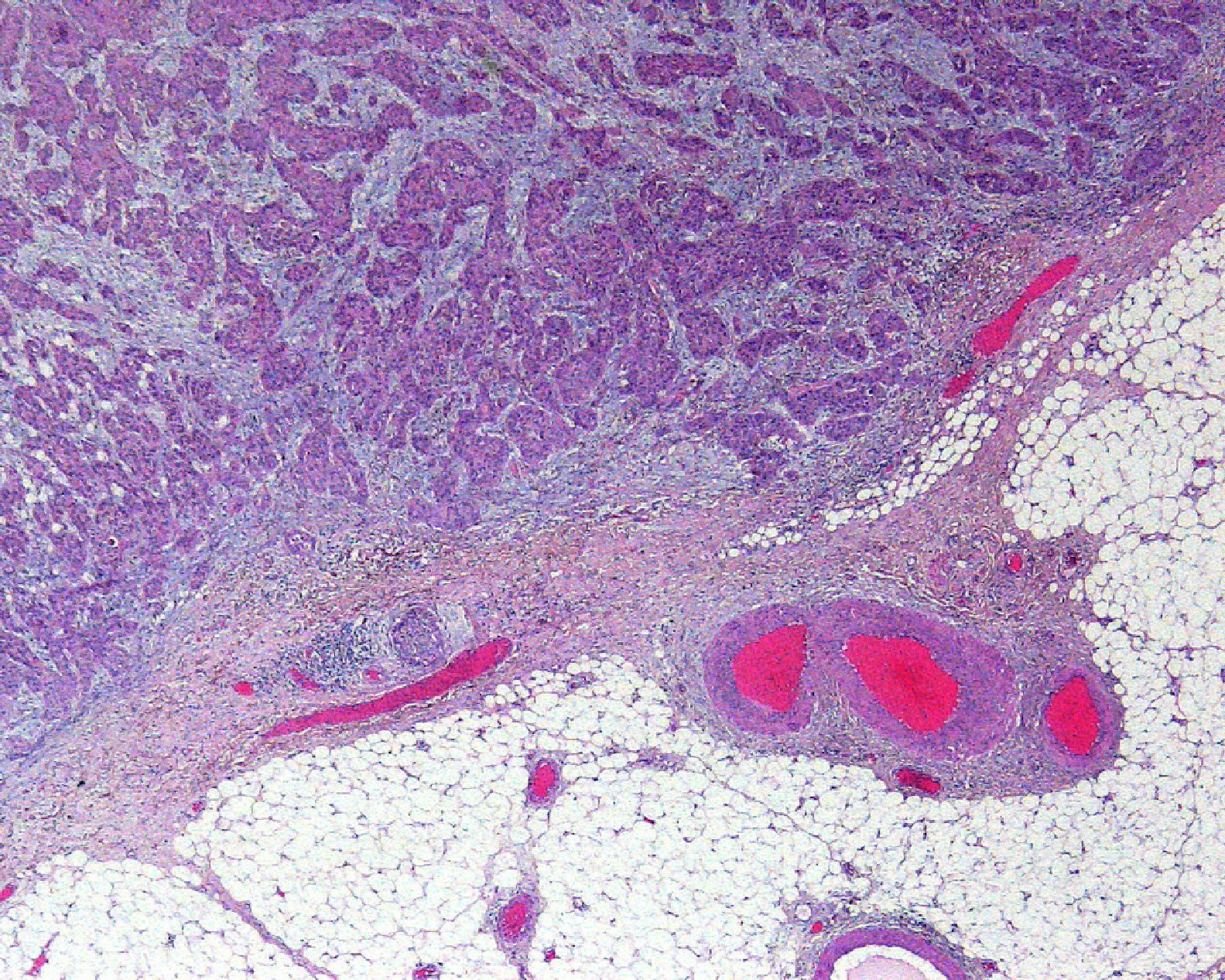
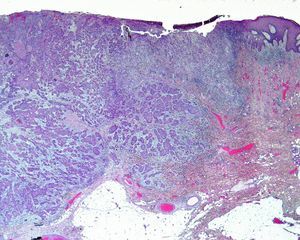
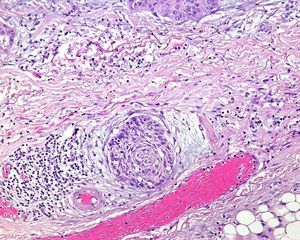
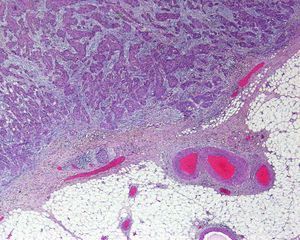
Invasión perineuralSe define como la situación en la que las células del tumor se disponen alrededor de una vaina nerviosa y se diseminan a través del nervio, ya sea hacia la zona superficial o profunda16,17 (fig. 3). Se produce en el 5-10% de los CEC. La invasión perineural del tumor puede ser clínica o anatomopatológica y se ha asociado a una mayor tasa de recidivas y/o de invasión de ganglios16 incluso a una disminución de la supervivencia4 (fig. 4). Cuando la invasión es clínica los síntomas pueden ser paresias, parestesias, dolor o disestesias; la invasión histológica se aprecia en el estudio de la muestra una vez extirpada; ambos factores se asocian a una peor evolución. La explicación a este fenómeno es la diseminación del tumor a través de los nervios que se observa de forma parcheada. La invasión perineural se ha relacionado con una menor diferenciación del CEC, mayores tamaños tumorales y mayores tasas de recurrencia. Todos los estudios coinciden en que la invasión perineural es un factor de mal pronóstico10: los CEC con invasión perineural tienen un riesgo significativo superior de recidiva local, metástasis a distancia y muerte específica asociada a la enfermedad que los CEC sin invasión perineural18. Recientemente, Ross et al. han demostrado que la invasión perineural de nervios con un diámetro mayor de 0,1mm se asociaba a metástasis19. Por ello, la invasión perineural de nervios con un diámetro menor de 0,1mm no lo considerarían factor de riesgo, aunque se precisan más estudios sobre este aspecto.
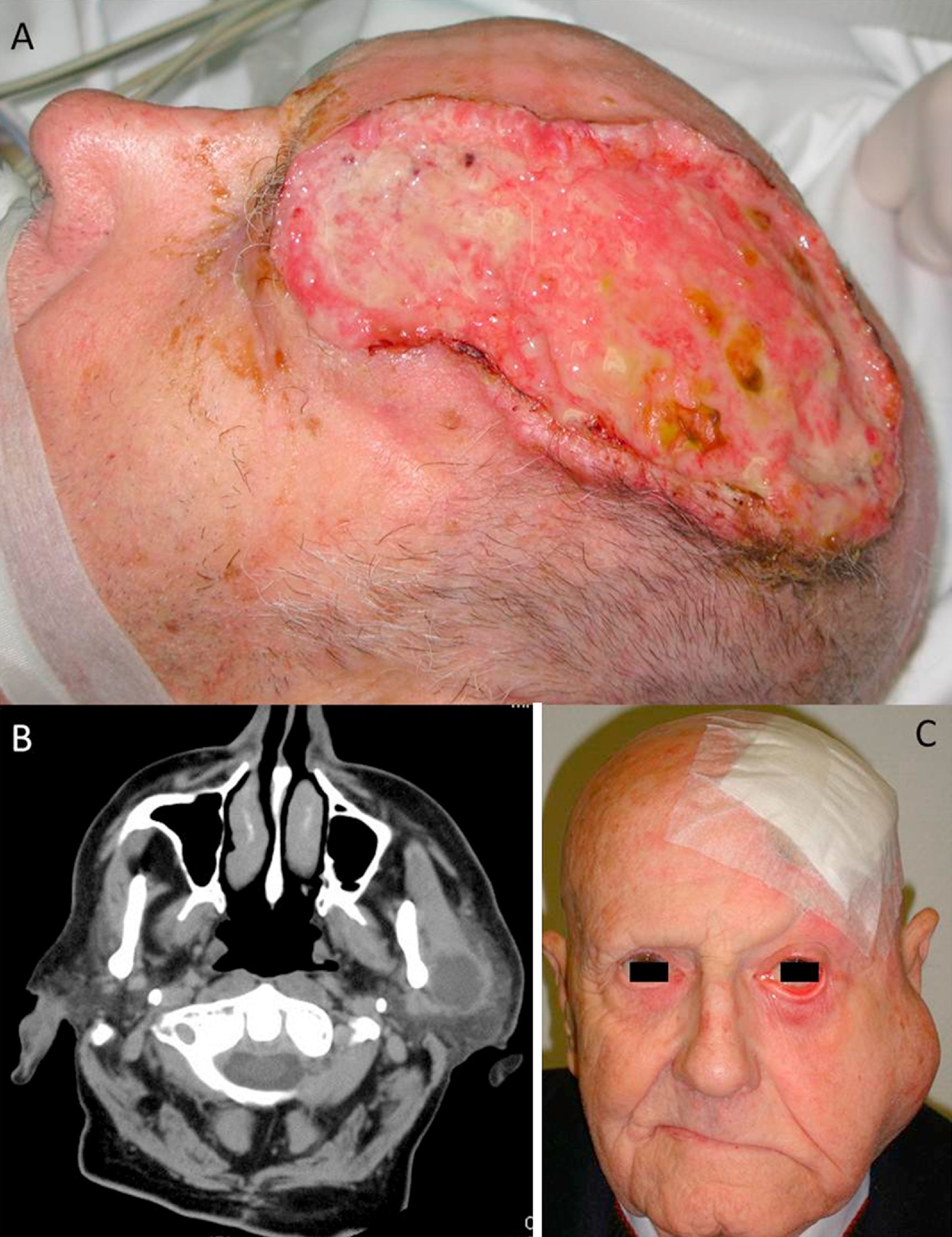
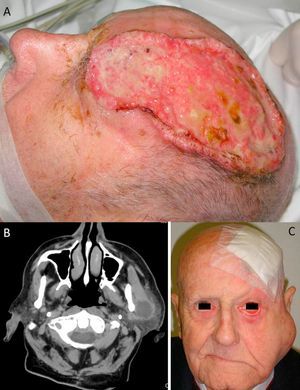
A) Carcinoma epidermoide cutáneo (CEC) de gran diámetro en la zona frontoparietal izquierda de un paciente, este CEC tiene varios factores de alto riesgo como son el tamaño, la profundidad, un nivel Clark V (invade periostio) y pobre diferenciación. B) Imagen del mismo paciente con metástasis parotídeas de CEC visualizables en la tomografía axial computarizada. C) Imagen del mismo paciente intervenido del CEC, con metástasis parotídea ipsilateral y con parálisis facial asociada, debido a la invasión del VII par craneal por el CEC.
Los CEC con invasión linfovascular tienen un mayor riesgo de metástasis regionales. En un estudio se observó que el 40% de los pacientes con metástasis linfáticas tenían invasión linfovascular frente al 8% de los pacientes sin enfermedad metastásica y que además era un factor predictivo de metástasis en el análisis multivariante20. La invasión vascular produce una diseminación a través de la vía hematógena. Las zonas de metástasis más frecuentes son los pulmones, el hígado, el hueso, el cerebro o la piel12. Sin embargo, a diferencia de la invasión perineural, la invasión linfovascular no se considera en la mayoría de los trabajos, y por ello no se incluye en la última clasificación de la AJCC10.
Tipo histológicoExisten diversos tipos histológicos del CEC y no todos presentan el mismo comportamiento. Cassarino et al. realizaron una revisión de los distintos tipos histológicos y la mayor o menor tendencia a metastatizar de los mismos21,22. Consideran de mayor agresividad el desmoplásico, el adenoescamoso, la enfermedad de Bowen invasiva y el que denominan de novo, que es el que aparece sin lesión precursora previa tipo queratosis actínica, sino sobre una cicatriz o inflamación crónica22,23.
Posteriormente Yanofsky et al. realizan una nueva revisión de los tipos histológicos y coinciden en considerar el CEC de novo y el desmoplásico como lesiones tumorales de alto riesgo24. También mencionan el CEC de células claras. Esta variante histológica es poco frecuente, por lo que resulta difícil determinar estadísticamente su potencial metastásico. Sin embargo, estos autores observan que tiende a presentar invasión perineural y perivascular; y definen aquellos CEC que presentan «células tumorales aisladas infiltrando» como tumores con comportamiento más agresivo. Otros tipos de CEC, sobre todo el más frecuente, que es el que aparece sobre queratosis actínica (97%), tienen un comportamiento más benigno. Dentro de éstos, dividen los que se originan de una queratosis actínica hipertrófica o proliferativa que son los que pueden presentar un comportamiento más agresivo22,23.
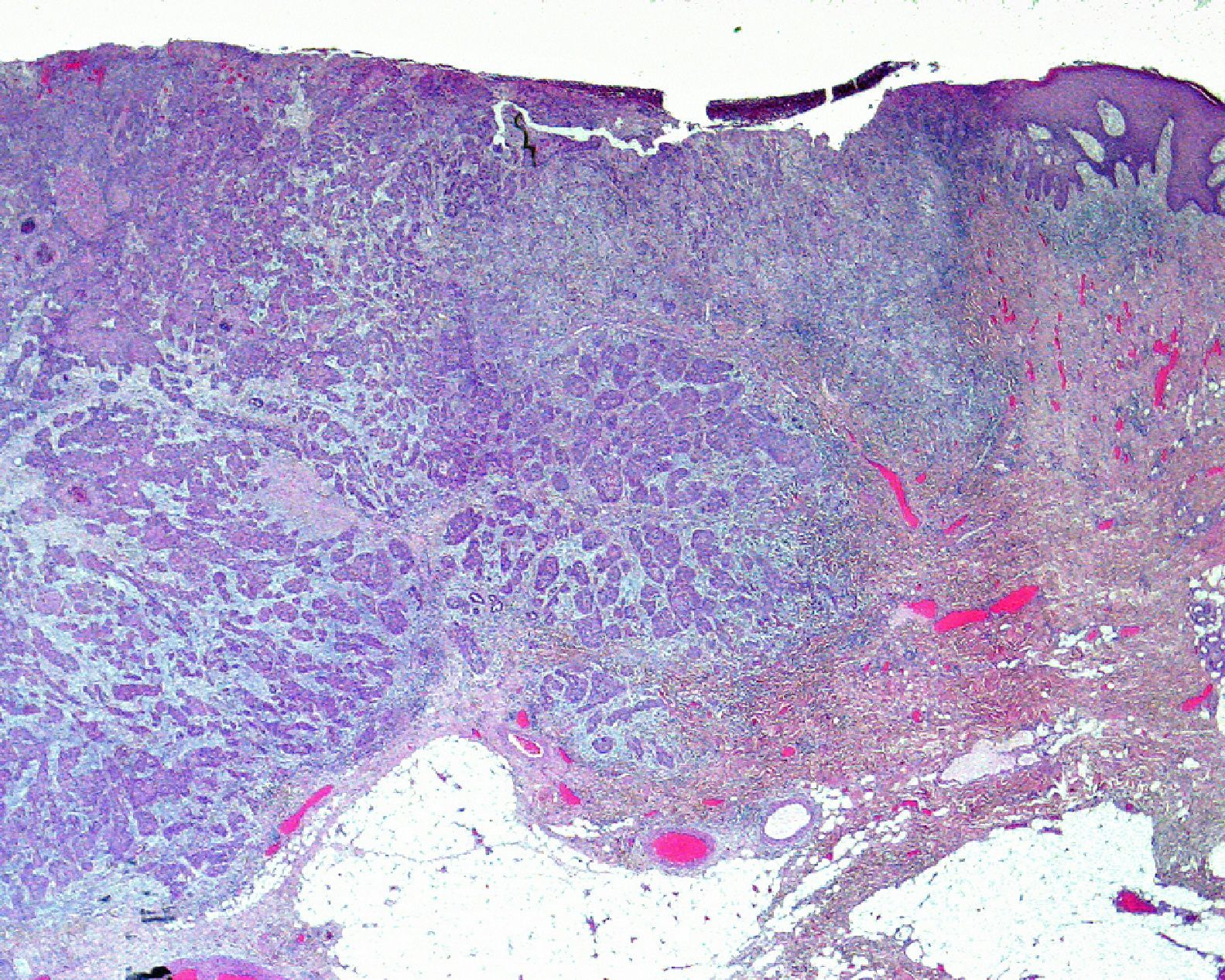
Hay que destacar, que sea del tipo histológico que sea el CEC, se debe también determinar el grado de diferenciación del tumor. Según la clasificación de Broders, los CEC se pueden dividir en grado I cuando el tumor tiene más del 75% de sus células diferenciadas; grado II sería cuando éstas comprenden entre el 50 y 75% del tumor, grado III cuando las células diferenciadas están entre el 25 y 50% y grado IV cuando son menos del 25%21. En la práctica habitual dividimos los CEC en bien diferenciados, moderadamente diferenciados o pobremente diferenciados. Lógicamente, son estos últimos los que presentan un comportamiento más agresivo1,6,10,22. Según la AJCC se considera un CEC pobremente diferenciado cuando presenta necrosis, invasión profunda, alta actividad mitótica y pobre diferenciación con células de morfología espiculada. Son varios los estudios que han probado una mayor tendencia a metastatizar de los CEC pobremente diferenciados4,13 (fig. 5). Por lo tanto, se debe realizar una adecuada clasificación histológica del tumor para determinar el riesgo asociado al mismo22. La séptima clasificación de la AJCC incluye el que el tumor sea pobremente diferenciado como un factor de mal pronóstico10.
InmunosupresiónLos pacientes inmunosuprimidos, especialmente los receptores de trasplante de órgano sólido como riñón o corazón presentan con mayor frecuencia CEC y además con un comportamiento mucho más agresivo que el de la población general15,17. Farasat et al., en la última clasificación de la AJCC recomiendan tener en cuenta esta variable, aunque no se haya incluido, pudiendo expresarse como una «I» al lado del estadiaje10. Si la proporción de carcinomas basocelulares frente a CEC en la población general es de 4:1 esta tendencia se invierte en los pacientes trasplantados de órgano sólido1, siendo de 1:1,8 a 1:15, según las series10,17. El hecho de que presenten menos carcinomas basocelulares puede estar explicado porque los pacientes que presentan CEC y basocelulares se ha demostrado que presentan una menor probabilidad de desarrollar carcinomas basocelulares. Aunque este hecho ocurre cuando se comparan pacientes con CEC y carcinoma basocelular con pacientes que presentan solo carcinomas basocelulares, sin considerarse la inmunosupresión25.
La probabilidad de desarrollar un CEC depende también del tipo de trasplante. Los trasplantados de corazón tienen mayor probabilidad de presentar CEC que los de riñón y éstos, más que los de hígado9. Parece que esta tendencia está en relación con la mayor inmunosupresión que se utiliza en los trasplantados de corazón, con respecto a los de riñón y por último, los menos inmunosuprimidos serían los trasplantados de hígado10,12. Posiblemente el estado de inmunosupresión permite un mayor avance del tumor. Sin embargo, recientemente se ha postulado que el VPH pueda jugar un papel en la oncogénesis de los CEC en estos pacientes, precipitando su desarrollo26,27.
Pero los pacientes inmunosuprimidos no solo van a presentar una mayor tasa de CEC, sino que estos van a ser más agresivos y con tendencia a metastatizar. Se han descrito porcentajes de metástasis de aproximadamente un 12,9% en estos pacientes1.
La inmunosupresión asociada a la infección por el VIH no se relaciona con el desarrollo de CEC de alto riesgo, a excepción del CEC perianal, donde la infección por VPH juega un papel oncogénico crucial. Los pacientes con leucemia linfática crónica desarrollan CEC más agresivos y recurrentes. Generalmente tienen factores de alto riesgo como diámetros mayores de 2cm, invasión perineural o tumores pobremente diferenciados28.
Infección por el VPHA diferencia que en el CEC de mucosas, en el que el VPH ha demostrado una relación causal clara, dicha relación no se ha probado claramente en el CEC. Hay diversos tipos de VPH, el alfa es el que se encuentra en mucosas y el que se relaciona con el carcinoma de cérvix, entre otros. El betaVPH es el relacionado con el CEC1,29. Se ha observado en diversos estudios que los pacientes inmunosuprimidos presentan más genotipos de VPH que los pacientes inmunocompetentes, aunque la incidencia es alta también en estos últimos. Se estima que el 90% de los CEC de inmunosuprimidos y el 50% de los pacientes inmunocompetentes están infectados por betaVPH26,29. En pacientes ancianos también se ha observado infección por un mayor número de serotipos de VPH, probablemente por la inmunosupresión relativa asociada a la edad o la llamada inmunosenescencia29. Según las series de pacientes, el serotipo más frecuente fue el 23, en otras series el 8 y el 526, aunque se pueden asociar otros serotipos30. Dependiendo de la zona geográfica los serotipos pueden variar31. La relación del VPH y la mayor agresividad del CEC no ha sido probada. Las mutaciones en el gen EVER1 y EVER2 se asocian con mayor riesgo de presentar VPH y más probabilidad de desarrollar CEC31.
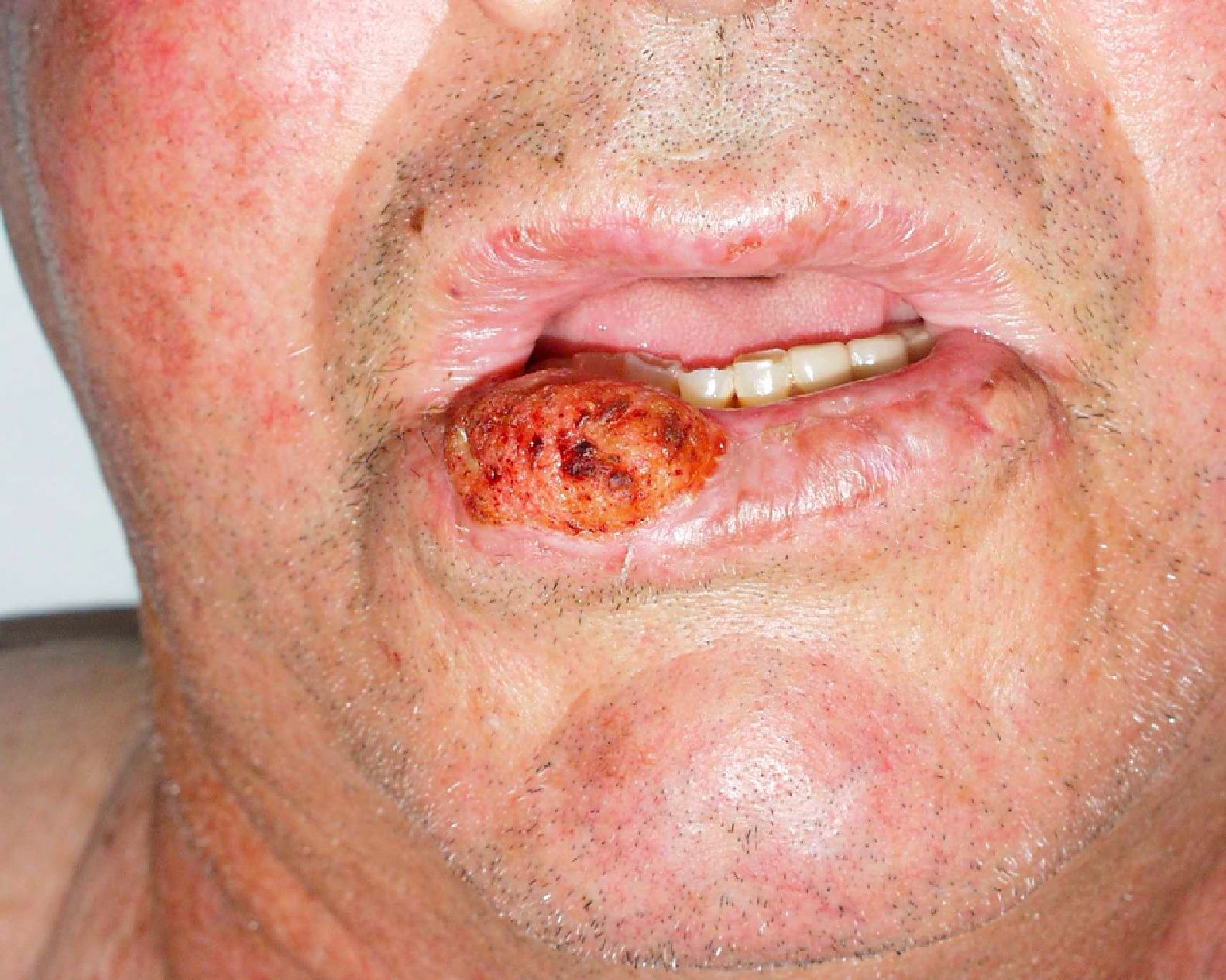
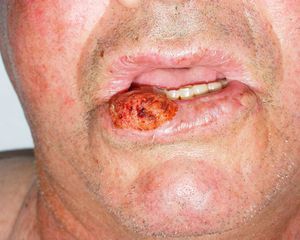
Zonas de alto riesgo y zonas de drenajeRecientemente, en la séptima clasificación de la AJCC se han especificado dos localizaciones anatómicas de alto riesgo: el labio y el pabellón auricular10. Si la proporción de CEC que metastatizan suele ser del 2-6% en estas localizaciones aumenta hasta el 14-16%32, por lo que empeora el estadio10. Clásicamente se atribuía a que son zonas ricamente inervadas y vascularizadas, con poco tejido subcutáneo, lo que facilitaría la invasión de estructuras profundas y la rápida diseminación (fig. 6). Sin embargo, en un estudio prospectivo Branscht et al. no observaron mayor porcentaje de metástasis ni recidivas de CEC en labio respecto de otras localizaciones, lo que sí acontecía con el CEC en el pabellón auricular11. Otros autores añaden el cuero cabelludo, sobre todo en los pacientes con alopecia androgenética, como una zona de alto riesgo por tratarse de una localización con daño actínico crónico33. Los CEC que asientan sobre procesos inflamatorios crónicos, lo que algunos autores denominan CEC de novo tienen un comportamiento más agresivo13. Se han definido sobre multitud de procesos crónicos: cicatrices de quemaduras, úlceras crónicas, lupus eritematoso, fístulas de osteomielitis crónica, lepra, hidradenitis supurativa, granulomas inguinales, eritema ab igne, poiquilodermia congénita, epidermólisis ampollosa distrófica, poroqueratosis de Mibelli, necrobiosis lipoidica, liquen escleroatrófico, lupus vulgar incluso sobre quistes epidérmicos23,34. La tasa de metástasis de estos CEC es de hasta el 38% según algunos autores, y además, en muchas ocasiones se retrasa el diagnóstico1. Los CEC de zonas que drenan a la parótida, que por orden de frecuencia son: mejilla, pabellón auricular, sien, frente y cuero cabelludo, son de peor pronóstico35 (fig. 7). Diversos autores han demostrado que las metástasis parotídeas se relacionan con un peor control de la afección y que la presencia de adenopatías metastásicas cervicales empeora el pronóstico más que las adenopatías parotídeas aisladas. Por ello, propusieron una clasificación que diferenciase entre metástasis parotídeas (P) y metástasis cervicales (N)32,36. Las metástasis parotídeas son predictores de una mala evolución, pero si también hay afectación cervical, el pronóstico empeora. En la práctica habitual esta clasificación no se utiliza y no ha sido incluida en la última actualización de la AJCC10.
Los CEC que han sido inadecuadamente extirpados, con márgenes histológicos afectados por el tumor o muy ajustados; o aquellos que pese a tener márgenes libres en el estudio histológico tienden a recidivar, se asocian a un peor control de la patología1,4,17. Un tumor con márgenes afectos puede recidivar en un 50%15 y por lo tanto, también metastatizar. Los márgenes predeterminados de extirpación del CEC no están bien establecidos. Al menos deben ser de 2-4mm, y mayor en tumores más profundos17. Oddonne et al. reportaron que un 57% de los pacientes con metástasis ganglionares de su estudio tenían CEC con márgenes afectados por el tumor o muy ajustados (menos de 2mm)8. En otro estudio, el 51% de los pacientes que desarrollaban metástasis ganglionares tenían una lesión primaria recurrente15. Por lo tanto, un tumor inadecuadamente extirpado, ya sea con márgenes afectos o muy próximos al borde debe considerarse como un tumor con elevado riesgo de recidiva.
Expresión de genes tumorales y marcadores genéticosDiversos marcadores histológicos y genéticos se asocian con un comportamiento más agresivo del CEC. El receptor del factor de crecimiento epidérmico (EGFR), supone un factor de mal pronóstico, y los tumores que lo expresan son más agresivos35,37; sin embargo, representa una posible diana terapéutica, ya que el bloqueo de esta vía ha demostrado aumentar la supervivencia. Existen otras proteínas que, expresadas en el CEC se asocian a mal pronóstico: el STAT 3 se ha asociado a una pobre diferenciación; la E-caderina, a metástasis linfática, el CD44 se asocia con el CEC recurrente y el Ets-1 parece que está implicado en la patogenia del CEC invasivo1.
Manejo del carcinoma epidermoide de alto riesgoEl primer paso en el tratamiento de los CEC de alto riesgo es identificarlos empleando los factores descritos previamente (tabla 3). Sin embargo, no existe ningún modelo pronóstico para el CEC en el que podamos determinar el riesgo individual de metástasis y muerte con seguridad y confianza, lo que complica las decisiones a tomar y justifica la falta de uniformidad en el tratamiento28.
Resumen de los factores de alto riesgo asociados al carcinoma epidermoide cutáneo
| - Tamaño (diámetro mayor de 2cm) |
| - Profundidad (mayor de 2mm) |
| - Invasión perineural |
| - Invasión linfovascular |
| - Tipo histológico (desmoplásico, adenoescamoso, enfermedad de Bowen invasiva o el CEC que aparece sobre un proceso inflamatorio crónico) |
| - Grado de diferenciación (tumores pobremente diferenciados) |
| - Inmunosupresión del paciente |
| - Infección por VPH |
| - Zonas de alto riesgo (pabellón auricular, mucosa labial) |
| - Zonas de drenaje |
| - Lesiones inadecuadamente extirpadas o con tendencia a la recurrencia |
| - Expresión de genes tumorales |
CEC: carcinoma epidermoide cutáneo; VPH: virus del papiloma humano.
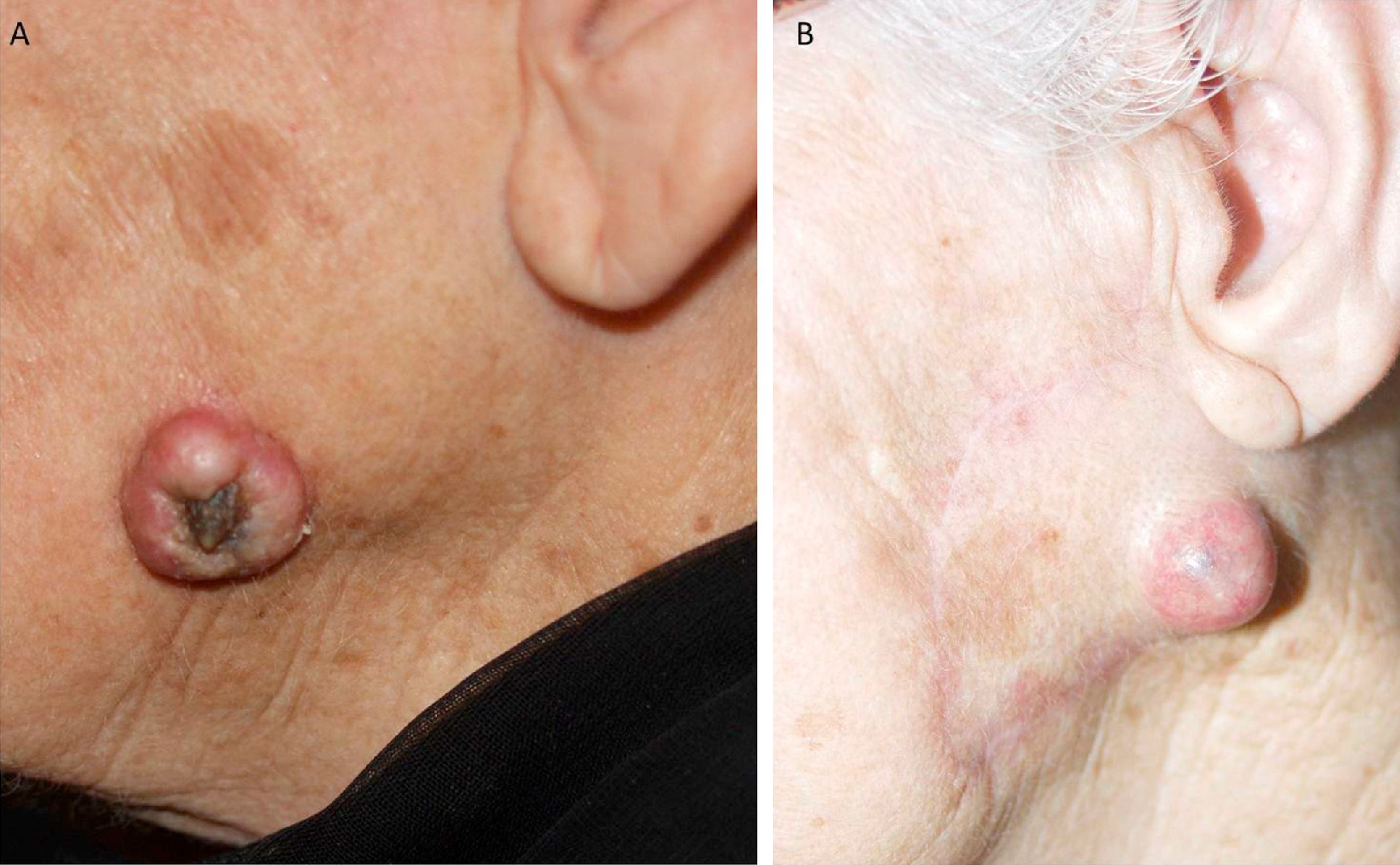
El número de factores que determinan si un CEC es de alto riesgo es motivo de debate. Para la mayoría de los autores, la presencia de uno solo de todos ellos ya es suficiente. Sin embargo, hay autores que abogan por dos o más factores15. Aun así, la mayor parte de los pacientes se presentan con CEC que tienen varios factores de alto riesgo (fig. 8).
La mayoría de las metástasis de CEC aparecen entre el primer y segundo año del diagnóstico inicial1. No obstante, algunos estudios describen presentación de las metástasis más tardía (hasta en los primeros 5-10 años)7,12. Habitualmente se detectan las metástasis linfáticas regionales después de haber recibido tratamiento para el tumor primario y no de forma concomitante8. La diseminación a ganglios linfáticos locorregionales constituye el 80% de las metástasis. La diseminación a órganos sólidos a distancia se realiza de forma preferente a pulmón, hígado, cerebro, piel o hueso8.
Los CEC son más frecuentes en cabeza y cuello, por lo que habitualmente las metástasis regionales se desarrollarán en la parótida y/o ganglios cervicales4,32. La distribución de las adenopatías en tumores en otras localizaciones dependerá de la localización del tumor; así, en extremidades superiores e inferiores se localizarán en axilas e ingles, respectivamente; y en los localizados en el tronco es variable.
El tratamiento de elección de los CEC con factores de alto riesgo es la cirugía micrográfica de Mohs38 o la cirugía estándar con márgenes suficientes para que los bordes quirúrgicos estén libres de infiltración neoplásica. Una vez intervenido, el paciente debe seguir revisiones periódicas para descartar recurrencias locales o a distancia. Se ha propuesto realizar técnicas de imagen periódicas y revisiones clínicas cada 4-6 meses a los pacientes con CEC de alto riesgo. No existe consenso ni estudios suficientes que confirmen la necesidad de realizar radioterapia adyuvante, biopsia del ganglio centinela o linfadenectomía profiláctica18,39,40.
Estadiaje del tumorAntes de realizar cualquier tratamiento, debe hacerse un examen riguroso para descartar adenopatías regionales. En caso de existir, hay que confirmar que se trata de metástasis mediante una punción aspiración con aguja fina o biopsia excisional28.
En la detección de la extensión tumoral subclínica los estudios de imagen radiológicos constituyen el método de elección; sin embargo, no se ha establecido cuál es la prueba de imagen más adecuada ni qué subgrupo de pacientes requerirían dichos estudios. La ecografía de los ganglios cervicales es una técnica barata y de alta sensibilidad, recomendada por diversos autores para el seguimiento de los CEC, sobre todo los de alto riesgo11,41. Además, puede ser una herramienta útil en el despistaje y seguimiento de los pacientes con CEC de alto riesgo de cabeza y cuello ya que los ganglios son habitualmente superficiales28. En general, la tomografía axial computarizadaes más útil para detectar la existencia de necrosis ganglionar central, extensión extracapsular, invasión de la base del cráneo o afectación del cartílago42. Por el contrario, la resonancia magnética es más sensible en los tumores neurotrópicos, definición de planos tisulares y en la diferenciación de tejidos conectivos densos del músculo43. La tomografía por emisión de positrones es recomendable emplearla en la detección de metástasis en áreas necrosadas, fibrosas o postradioterapia por lo que se emplea después de la cirugía o la radioterapia, para determinar enfermedad persistente o recurrente y el grado de ésta44.
Valoración del estado inmuneOtro aspecto importante a tener en cuenta es la evaluación del estado inmune del paciente, especialmente en receptores de trasplantes de órganos sólidos que tienen un elevado riesgo de desarrollar CEC recurrentes y metastáticos8,13,15,45. La disminución de la inmunosupresión se ha asociado con un descenso en la formación de nuevos CEC y mejoría de la evolución del CEC agresivo28. Por ello, en pacientes inmunosuprimidos que presenten CEC, se recomienda valorar disminuir la inmunosupresión; esto debe llevarse a cabo de forma multidisciplinar, entre el equipo de trasplante u oncológico y el dermatólogo. Hay que tener en cuenta, que la inmunosupresión en monoterapia conlleva menor riesgo que los pacientes multitratados. Por otra parte, los nuevos agentes inmunosupresores, como el sirolimus, se asocian con menor incidencia de desarrollo de CEC cuando se compara con los inhibidores de la calcineurina28.
Otro factor claramente relacionado es la exposición solar, ya que estos pacientes poseen menos mecanismos reparadores ante un daño actínico tanto agudo como crónico, por lo que la alta fotoprotección debe ser una medida obligada en estos pacientes. Incluso una revisión dermatológica periódica dada la mayor tendencia a desarrollar tumores cutáneos y el diagnóstico precoz son la herramienta más eficaz para tratarles31.
Cirugía estándar y cirugía micrográfica de MohsA pesar de que existen diversas opciones terapéuticas de los CEC de alto riesgo, la extirpación quirúrgica completa, con márgenes histológicos libres de neoplasia, continúa siendo el mejor tratamiento. Otras alternativas como la crioterapia, electrocoagulación, tratamientos tópicos (imiquimod, 5-fluoruracilo, retinoides tópicos) o terapia fotodinámica1,46 no se recomiendan para el CEC que tenga factores de alto riesgo.
Debemos realizar una adecuada extirpación quirúrgica de la lesión tumoral, con márgenes, entre 4 y 10mm, dependiendo del tamaño del tumor1,11. En lesiones tumorales menores de 2cm de diámetro, el 95% se resuelven con un margen de 4mm; sin embargo, los tumores mayores requieren al menos 6mm o más de margen para alcanzar bordes libres1. Sin embargo, en estos casos es preferible realizar cirugía micrográfica de Mohs.
La cirugía micrográfica de Mohs es el tratamiento de elección de los CEC de alto riesgo. Aunque las tasas de curación son más altas que con la cirugía estándar, éstas decrecen en los tumores mayores de 2cm en diámetro, pobremente diferenciados o recurrentes. No existen estudios comparativos entre la cirugía de Mohs y la cirugía estándar en el tratamiento de los CEC de alto riesgo. Otra indicación de esta cirugía sería los CEC con infiltración perineural. En los CEC con invasión ósea, afectación por contigüidad de la glándula parótida, metástasis en tránsito o extensión a lo largo de ramas nerviosas mayores, la cirugía de Mohs no es útil para obtener una extirpación completa del tumor y se requiere un abordaje multidisciplinar19.
Biopsia del ganglio centinelaNo existe consenso sobre la realización de la biopsia selectiva del ganglio centinela (BGC) a los pacientes con CEC de alto riesgo. Con esta técnica podemos evitar linfadenectomías profilácticas innecesarias y detectar micrometástasis, con lo que el paciente se beneficiaría de un tratamiento precoz, es decir, de una linfadenectomía cuando clínica o radiológicamente todavía no se habría detectado enfermedad metastásica ganglionar. La BGC presenta mucha menor morbilidad que la linfadenectomía, sin embargo hasta la fecha no existen estudios prospectivos comparativos entre la realización de BGC y linfadenectomía profiláctica, que serían necesarios para determinar si esta nueva técnica aumenta la supervivencia47. Diversos autores recomiendan realizar este procedimiento a pacientes con CEC pobremente diferenciados, mayores de 4cm, recurrentes, CEC sobre lesiones inflamatorias crónicas o cicatrices, originados en el labio o pabellón auricular y en pacientes inmunodeprimidos40. Pero otros autores lo amplían a cualquier paciente con CEC que presente factores de alto riesgo35.
Linfadenectomía profilácticaLa linfadenectomía profiláctica consiste en extirpar las adenopatías cervicales ipsilaterales cuando el tumor es N0, definido clínicamente o por técnicas de imagen. Algunos autores la recomiendan en presencia de factores de alto riesgo1. En un estudio realizado por Veness se observó que hasta en un 24% de pacientes sin evidencia de adenopatías clínicamente en los que se realizó linfadenectomía profiláctica presentaban metástasis locales17. Pero determinar cuándo realizar la intervención únicamente por presentar factores de alto riesgo es controvertido33 ya que es una intervención quirúrgica agresiva, con una importante morbilidad asociada y los pacientes que presentan CEC de alto riesgo suelen tener una edad avanzada y comorbilidades, lo que limita aún más su indicación.
RadioterapiaLa radioterapia es una opción de tratamiento para el CEC de alto riesgo. En estos tumores los resultados suelen ser inferiores a la cirugía y su empleo se limita por la imposibilidad de confirmar los márgenes, especialmente en tumores de gran tamaño o que invaden en profundidad. Se reserva para pacientes de edad avanzada con tumores inoperables. Sin embargo, en algunas localizaciones, como el labio inferior, la respuesta es similar al tratamiento quirúrgico y los resultados funcionales y cosméticos pueden ser superiores17.
Radioterapia adyuvanteEl tratamiento adyuvante con radioterapia se ha empleado en algunos pacientes con carcinomas epidermoides de alto riesgo, especialmente en aquellos con invasión perineural, márgenes quirúrgicos positivos (o no determinados) o metástasis en tránsito. No existen estudios randomizados comparando el beneficio de la adyuvancia de la radioterapia a la cirugía frente al tratamiento quirúrgico en monoterapia18, por lo que es controvertido el beneficio de esta técnica aunque son diversos autores los que la recomiendan17,18,35.
Los CEC con invasión perineural significativa (diámetro de los nervios superiores a 0,1mm) tienen unos porcentajes más altos de recurrencia, incluso cuando han sido extirpados con márgenes quirúrgicos libres. En estos casos la radioterapia adyuvante estaría indicada, aunque su utilidad no ha sido claramente establecida19. En aquellos casos con invasión perineural cuya resección quirúrgica completa no sea posible se deberá tratar con radioterapia aunque el pronóstico es desfavorable39. También se ha empleado radioterapia adyuvante en CEC con márgenes quirúrgicos afectos o no determinados, pero el riesgo de recurrencia local, regional o a distancia es superior que cuando los márgenes están libres de infiltración neoplásica28.
QuimioterapiaHoy en día disponemos de quimioterápicos que han demostrado un aumento de la supervivencia en pacientes con CEC de alto riesgo o localmente avanzados. En pacientes inmunosuprimidos los retinoides orales disminuyen el número de CEC y recidivas, por lo que su uso en pequeñas dosis está indicado en aquellos pacientes que presenten varios CEC de alto riesgo45,46. La capecitabina oral, o su forma activa, el 5 fluoruracilo oral, han demostrado ser efectivos para el tratamiento del CEC localmente avanzado1; la asociación de este fármaco con interferón alfa subcutáneo durante 2-3 semanas se ha utilizado también con buenos resultados; incluso la combinación de retinoides orales con interferón alfa subcutáneo28,46. Otros fármacos que presentan buenos datos preliminares son los que actúan por la vía del bloqueo del EGFR, un receptor expresado en los CEC más agresivos46 como gefitinib, que se ha utilizado en algunos ensayos, demostrando una mayor supervivencia en CEC. Dichos fármacos se utilizan en otros carcinomas como el de pulmón o el colorrectal demostrando aumentar la supervivencia. Cetuximab, actúa también por esta vía y se han observado resultados positivos con su utilización solo o en asociación a 5 fluoruracilo y cisplatino, y ha demostrado mejorar el pronóstico en pacientes con CEC localmente avanzado, asociado o no a radioterapia46,48–50.
ConclusionesLa definición de CEC de alto riesgo no está bien establecida. Se define como CEC que tiene un riesgo de recidiva, metástasis ganglionares y/o a distancia mayor del 5%. Esto va a estar determinado por la presencia de unos factores denominados de alto riesgo. Recientemente se ha modificado la séptima y última clasificación para el CEC de la AJCC, se han añadido factores que influyen en una peor evolución con lo que se logra un mejor estadiaje y pronóstico de los pacientes. Pero existen otras variables que han demostrado estar asociados a peor evolución y que no se han incluido. Hemos resumido los factores asociados al CEC de alto riesgo, que son tamaño tumoral (mayor de 2cm), profundidad de invasión (superior a 2mm), nivel de Clark (IV o superior), invasión perineural, invasión linfovascular, el grado de diferenciación (tumores pobremente diferenciados), tipo histológico (desmoplásico, adenoescamoso, enfermedad de Bowen invasiva o el CEC que aparece sobre un proceso inflamatorio crónico), inmunosupresión, infección por VPH, localización en zonas de alto riesgo (pabellón auricular, mucosa labial), expresión de ciertos genes tumorales, o una inadecuada resección del tumor.
Respecto al manejo terapéutico del CEC de alto riesgo debemos detectar los factores asociados, realizar un adecuado estadiaje y valorar el grado de inmunosupresión. Tratar quirúrgicamente el tumor, ya sea con márgenes suficientes o preferiblemente con cirugía de Mohs. Se debe considerar la realización de biopsia de ganglio centinela o linfadenectomía en determinados casos, aunque no existe consenso sobre si la realización de biopsia de ganglio centinela aumenta la supervivencia. Diversos autores recomiendan realizar este procedimiento a pacientes con CEC pobremente diferenciados, mayores de 4cm, recurrentes, CEC sobre lesiones inflamatorias crónicas o cicatrices, originados en el labio o pabellón auricular y en pacientes inmunodeprimidos, pero otros autores lo amplían a cualquier paciente con CEC que presente factores de alto riesgo. La radioterapia o radioterapia adyuvante también puede ser útil en determinadas ocasiones y la quimioterapia, que se utiliza en algunos casos de CEC con diseminación a distancia presenta buenos resultados.
Por lo tanto, es muy importante identificar a los pacientes que presenten CEC de alto riesgo para realizar un seguimiento más estrecho, una detección precoz de recidivas y metástasis y un tratamiento más agresivo para disminuir la morbimortalidad asociada a esta enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.