El tratamiento de las úlceras, incluyendo su forma más frecuente, las úlceras en las piernas, es un motivo de consulta frecuente para el dermatólogo. En los últimos años se han producido importantes avances en el campo del tratamiento de las úlceras, como el concepto de la úlcera crónica como un proceso inflamatorio con implicación de citoquinas proinflamatorias y déficits de factores de crecimiento, o la teoría de la cura húmeda que ha originado la aparición de gran variedad de apósitos. La presente revisión intenta actualizar los conocimientos del lector en la cura de las úlceras en general y de las úlceras en las piernas en particular, con especial hincapié en los nuevos apósitos y en las terapias avanzadas para los casos refractarios.
Ulcers are a frequent cause of dermatologic consultation, and most correspond to leg ulcers. Major advances in the treatment of ulcers have occurred in recent years as a result of research that has led to new concepts such as the consideration of the chronic ulcer as an inflammatory process involving proinflammatory cytokines and deficits of growth factors. Furthermore, studies into the use of the wet dressing have led to the appearance of a wide variety of new dressings. The aim of this review is to update the reader's knowledge of the treatment of ulcers in general and of leg ulcers in particular, with a detailed description of the new dressings available and of the new therapies for use in refractory cases.
Es lógico comenzar esta revisión con una definición del concepto úlcera. Para el dermatólogo consiste en una pérdida de integridad de la piel que afecta por lo menos a la dermis y es causada por un proceso patológico. Cuando el origen es traumático, en castellano la denominamos herida, distinción que no existe en inglés. Además, se prefiere denominar ulceración cuando es un proceso agudo y conservar el nombre de úlcera para procesos crónicos1. Por lo tanto, hablar de úlcera crónica es algo redundante. Otra cuestión es el concepto de cronicidad. Algunas revisiones basan el concepto en un periodo determinado de tiempo, pasado el cual se habla de «herida crónica» (traduciendo del inglés chronic wound), periodo que oscila entre 4-12 semanas2. Sin embargo, el concepto más aceptado es hablar de úlcera cuando ésta no cura en el tiempo esperado, presentando una escasa tendencia a la cicatrización3,4. Nos vamos a referir en concreto a las úlceras en las piernas, patología en la que el dermatólogo, a nuestro juicio, debe tener un papel mucho más protagonista, como ya ocurre en el resto del mundo. No olvidemos que dermatólogos como Falanga o Eaglstein han hecho contribuciones fundamentales en el campo de la cicatrización de las heridas y en el concepto moderno de cura, mientras en nuestro país casi ningún dermatólogo participa en congresos de heridas crónicas y la industria farmacéutica ha dado la espalda a nuestra especialidad. Esto ha provocado que nos hayamos perdido los apasionantes avances en este tema realizados en los últimos 15 años. Afortunadamente, compartimos esta opinión con otros dermatólogos5. En cuanto a la frecuencia de las úlceras en las piernas, existen multitud de trabajos sobre el tema, pero muy pocos en población española. En un metaanálisis de varios estudios en diferentes países, se encontró que la prevalencia en la población adulta oscila entre 0,12-1,1%6. Esto concuerda con el primer estudio de prevalencia nacional, que encontró que esta era del 0,16%7. Lo verdaderamente preocupante es que se calcula que sólo el 50% recibe tratamiento adecuado y un 25% no tiene un diagnóstico etiológico8. Esto ocasiona un gasto sanitario que, en EEUU, se estima de 7.000 millones de dólares al año y 1.391.496 consultas en Atención Primaria en España9.
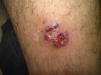
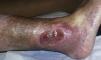
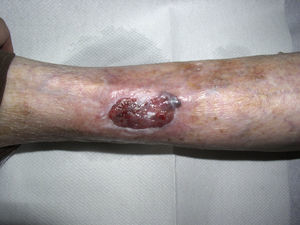
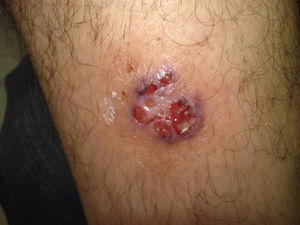
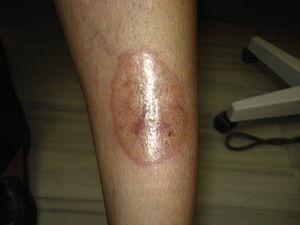
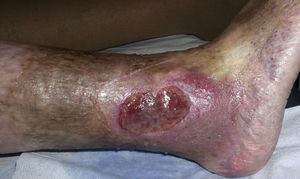
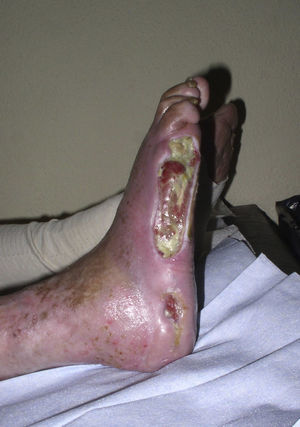
Diagnóstico diferencial de las úlceras en las piernasEl diagnóstico diferencial de las úlceras en las piernas es muy amplio y está recogido en la Tabla 1. Partiendo de la premisa según la cual, independientemente de la calidad de la cura que hagamos, el tratamiento de la causa es fundamental para la curación de una úlcera, diagnosticar esta correctamente es imprescindible. En la práctica diaria, cuando un paciente acude con una úlcera en una pierna a su médico de familia, lo más frecuente es que se derive al paciente a enfermería sin una mínima evaluación. La mayoría de las úlceras de las piernas son de origen vascular, con un 85% de los casos, incluyendo las venosas (60%), arteriales o combinaciones de ambas. El 5% son de origen neuropático (fundamentalmente en pacientes con diabetes), con lo que nos quedan un 10% de casos cuya causa es fundamentalmente dermatológica, incluyendo vasculitis, infecciones, tumores (fig. 1), pioderma gangrenoso (fig. 2), necrobiosis lipoídica (fig. 3), etc.
Causas de úlceras en las piernas
| Insuficiencia venosa |
| Oclusión arterial |
| ○ Arteriosclerosis |
| ○ Tromboembolismos |
| ○ Émbolos por colesterol |
| ○ Tromboangeitis obliterante |
| Alteraciones en la microcirculación |
| ○ Fenómeno de Raynaud y esclerodermia |
| ○ Hipertensión (úlcera de Martorell) |
| ○ Aumento de viscosidad sanguínea (paraproteinemias, leucemias, etc.) |
| Lesiones físicas o químicas |
| ○ Úlceras por presión |
| ○ Traumatismos, quemaduras |
| ○ Agentes corrosivos (escleroterapia) |
| Infecciones |
| ○ Bacterianas: ectima, ectima gangrenoso, gangrena gaseosa, fascitis necrotizante, ántrax, carbunco, sífilis, úlcera de Buruli, lepra, lupus vulgar tuberculoso, chancro tuberculoso |
| ○ Víricas: herpes crónico, úlceras por citomegalovirus |
| ○ Parásitos y hongos: leishmaniasis, pie de Madura, esporotricosis |
| Úlceras neuropáticas |
| ○ Diabetes y otros procesos con disminución de la sensibilidad (siringomielia, tabes dorsal, etc.) |
| Vasculitis |
| ○ Vasculitis leucocitoclástica, PAN |
| Enfermedades hematológicas |
| ○ Anemia de células falciformes, trombocitemias, macroglobulinemia de Waldeström, mieloma |
| Alteraciones de la coagulación |
| ○ Síndrome antifosfolípido, déficit de factor v, xiii, de antitrombina iii, proteína C o S, púrpura fulminans |
| Tumores cutáneos |
| ○ Carcinoma basocelular, carcinoma epidermoide, linfomas, sarcomas |
| Úlceras por fármacos |
| ○ Hidroxiurea, extravasación de citostáticos |
| Enfermedades cutáneas |
| ○ Pioderma gangrenoso, necrobiosis lipoídica, paniculitis, eritema indurado, lupus eritematoso cutáneo |
| Enfermedades metabólicas |
| ○ Diabetes, déficit de prolidasa, calcifilaxia, calcinosis cutis, porfiria cutánea tarda, hiperoxaluria |
| Miscelánea |
| ○ Cromosomopatías: síndrome de Klinefelter (xxy), xyy |
| ○ Artritis reumatoide |
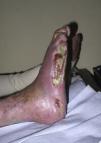
El dilema más frecuente en la práctica diaria es distinguir entre una úlcera en la pierna de origen venoso (fig. 4) o arterial (fig. 5), para lo que podemos basarnos en los datos de la Tabla 2.
Diagnóstico diferencial úlcera venosa vs arterial
| Úlcera venosa | Úlcera arterial | |
| Localización | Región supramaleolar | Dorso de pie, dedos |
| Aspecto | Bordes excavadosFondo sangrante | Bordes planosFondo liso |
| Piel perilesional | PigmentaciónDermatitis | Piel pálida, fríaPérdida de anejosDistrofia ungueal |
| Dolor | EscasoMejora en decúbito con extremidad elevada o con terapia compresiva | ImportanteEmpeora en decúbito o durante la deambulación |
| IPTB | > 0,8 | > 0,60,8-0,6=mixtas |
IPTB: índice de presión tobillo-brazo.
Independientemente del origen de la úlcera, debemos realizar una evaluación mínima, y, en ocasiones, completar con una evaluación más específica.
Evaluación mínima de un paciente con úlcera en la piernaAnamnesisDebemos recoger la patología de base del paciente (hipertensión arterial, diabetes, enfermedad arteriosclerótica, enfermedad trombótica), así como los fármacos que toma y pueden afectar a la cicatrización o ser la misma causa de la úlcera (hidroxiurea, anticoagulantes, citostáticos, antiinflamatorios no esteroideos, colchicina, corticoides, y otros inmunosupresores). El tiempo de evolución de la úlcera, los tratamientos previos y los episodios de úlcera precedentes también son de interés. Las úlceras de larga evolución en pacientes de edad muy avanzada pueden presentar un problema de senescencia celular (ver más adelante). La presencia de dolor y su ritmo ayudan a diferenciar entre úlceras de origen venoso o arterial. Las úlceras venosas empeoran en aquellas circunstancias que aumentan la presión venosa, como la bipedestación estática, y se alivian con las que la disminuyen, como la deambulación, reposo con elevación o terapia compresiva. El dolor arterial aparece en reposo o durante deambulación.
Exploración físicaUna primera maniobra necesaria es palpar los pulsos pedios como primera evaluación de un posible componente arterial. Posteriormente debemos interesarnos por el estado de la piel perilesional de la úlcera de cara a, por un lado, obtener datos sobre el diagnóstico (presencia de varices, de lipodermatosclerosis, hiper o hipopigmentación, signos de vasculitis, signos de necrobiosis lipoídica, etc.), y por otro, para apreciar complicaciones que necesitan de terapia como presencia de dermatitis, o signos de celulitis. Centrándonos en la úlcera en sí, debemos constatar su localización, profundidad, estado del borde (macerado, esclerosado, sugestivo de carcinoma, ampolloso, sugestivo de pioderma gangrenoso, etc.), presencia de tejido no viable (necrosis), cantidad y calidad del exudado, presencia o no de tejido de granulación, y, por último, su tamaño.
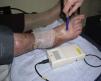
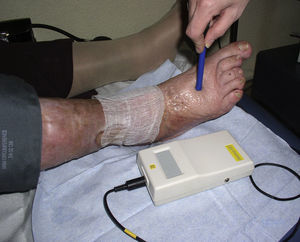
Cálculo del índice de presión tobillo-brazoDebe realizarse en todos los pacientes, mediante el uso de un doppler de mano (fig. 6). Sin detallar toda la técnica, consiste en obtener la presión sistólica en la arteria pedia o tibial posterior y dividirla por la de la arteria radial. Si es en torno a 1 se considera normal, y podemos realizar terapia compresiva si es una úlcera de origen venoso; si es menor a 0,6 se considera que la úlcera es arterial y la compresión está contraindicada. Si está entre 0,6 y 0,8 podemos usar sistemas inelásticos (ver más adelante).
LaboratorioEn todos los casos debemos realizar una analítica básica para descartar hipoproteinemia y anemia, circunstancias que junto a hipovitaminosis C, A o E pueden relacionarse con cicatrización retardada.
Evaluación específicaLaboratorioSegún la sospecha diagnóstica, debemos realizar diferentes determinaciones de laboratorio como anticuerpos antinucleares, factor reumatoide, anticuerpos antifosfolípidos, serología luética, alteraciones hematológicas, estados protrombóticos por déficit de antitrombinaiii, factor v de Leiden, proteína S o C, cariotipo para descartar xxy o xyy, etc.
CultivoLo incluimos en la evaluación específica porque no debe realizarse de forma rutinaria. Las indicaciones concretas se recogerán más adelante. El «gold standard» es el cultivo cuantitativo mediante biopsia o aspiración, que permite no sólo averiguar la causa de la infección, sino medir el número de unidades formadoras de colonias por gramo de tejido. En la práctica se usa más el cultivo cualitativo, mediante toma de hisopo estéril. Si escogemos este método, debemos limpiar previamente la úlcera con suero, evitar tomar la muestra del tejido necrótico y hacer, por lo menos, dos tomas.
BiopsiaDebe realizarse cuando se sospeche un tumor o enfermedades diagnosticables histológicamente como vasculitis, pioderma gangrenoso, necrobiosis lipoídica, etc. También debe realizarse cuando una úlcera no evoluciona apropiadamente tras un tratamiento correcto y un plazo prudencial, por ejemplo unos 3 meses, lo que nos permitirá descartar diagnósticos no sospechados como una malignización (úlcera de Marjolin), detectar la presencia de biofilms o realizar un cultivo cuantitativo. La más útil es realizar una toma del borde y otra del lecho de la úlcera.
Ultrasonografía doppler (o eco-doppler)Debería realizarse en todos los pacientes con úlcera venosa, ya que nos dará una información muy valiosa sobre la afectación del sistema venoso superficial, perforantes o profundo y la existencia de reflujo, obstrucción o ambos. Fundamental para valorar la posibilidad de remitir al cirujano vascular10.
Resonancia magnética nuclear11Será útil para descartar la sospecha de una osteomielitis subyacente, especialmente frecuente en los diabéticos, donde tiene una especificidad casi del 100% y una sensibilidad del 90%, muy superior a la radiografía convencional. También está sustituyendo a la arteriografía para evaluar la circulación arterial en casos de índice de presión tobillo-brazo (IPTB) muy bajo o muy alto (angiorresonancia).
Otras exploraciones como venografías, ultrasonografía intravascular, etc., creemos que deben dejarse al criterio del cirujano vascular en casos seleccionados.
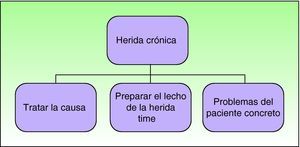
TratamientoEl algoritmo de tratamiento recogido en la figura 7 es válido para cualquier tipo de úlcera. El primer paso es tratar la causa de la úlcera, si es posible. Una vasculitis recibirá, lógicamente, tratamiento inmunosupresor adecuado, un tumor, cirugía, una úlcera venosa, terapia compresiva, una úlcera en el pie de un diabético deberá recibir tratamiento ortopédico para evitar el apoyo directo, etc. Además hay que tener en cuenta aspectos generales del paciente como el estado de nutrición, problemas sociales añadidos, estado psicológico, todos muy importantes para la cicatrización de la herida. Diversos estudios relacionan las situaciones de estrés, con niveles altos de adrenalina, con una cicatrización retardada12,13, mediante la activación, entre otros mecanismos, de los receptores β-adrenérgicos presentes en los queratinocitos, abriendo la puerta a un posible uso clínico de los beta-bloqueantes en estos pacientes, aunque su papel en este campo todavía está en estudio14.
La cuestión fundamental a tratar en esta revisión, y que es válida para cualquier herida crónica independientemente de su localización, es la de la preparación del lecho de la úlcera. Es decir, crear el medio adecuado para que la úlcera cicatrice lo más rápidamente posible. Desde los trabajos de Winter15 en 1962, sabemos que un medio húmedo acelera la cicatrización16. Este descubrimiento inició una auténtica revolución y la aparición de apósitos cada vez más sofisticados, además de un potente sector de la industria farmacéutica, dirigido casi exclusivamente al personal de enfermería. Desde los primeros apósitos consistentes en films de poliuretano, con escasa capacidad de retención del exudado, a los apósitos disponibles en la actualidad, quedan recogidos junto con sus indicaciones en la tabla 3, teniendo en cuenta que no están enumerados todos, sino los que el autor maneja habitualmente.
Principales tipos de apósitos e indicaciones
| Nombres comerciales | Indicaciones | Comentarios | |
| Hidrocoloides | Varihesive gel control®Comfeel® | Úlceras con escaso exudadoNecesidad de desbridamiento autolítico | Formación de gel maloliente y pseudopurulento |
| Espumas | Perma foam® Tielle®, Biatain®, Allevyn®Mepilex®, VersivaXC® | Úlceras moderada-mente exudativas | Cómodas para el paciente |
| Alginatos | Sorbsan®, Urgosorb® Algosteril® | Úlceras muy exudativasÚlceras sangrantes | Ajustar al tamaño de la úlcera |
| Hidrofibras | Aquacel® | Úlceras muy exudativas | Apósitos más absorbentes |
| Extrafinos | Silicona:Mepitel®Hidrocoloides:Varihesive extrafino®Urgotul® | Úlcera epitelizandoZonas donantesEpidermólisis ampollosaNeurodermitis | |
| Hidrogeles | Varihesive hidrogel®Nu-gel® Purilon®Hidrosorb®Normlgel® | Úlceras secasDesbridamiento autolítico | Necesitan apósito secundario |
| Apósitos con plata | Espumas: Mepilex Ag®Biatain Ag®Hidrofibras: Aquacel Ag®Carbón activado: Actisorb plus®Mallas: Atrauman®, Acticoat® | Úlceras infectadas o con colonización críticaPresencia de biofilms | Usar tiempo limitado |
| Otros | Miel: Melmax®Carga iónica: Trionic®Ibuprofeno: Biatain-ibu®Captadores de MMP: Promogran®Inhibidores de MMP, estimuladores de TIMP: Cátrix® | Úlceras refractarias al tratamiento |
El acrónimo TIME fue acuñado por Falanga et al17 para agrupar todos los aspectos que tenemos que analizar ante cualquier úlcera, de cara a tomar las decisiones adecuadas y preparar el lecho para su cicatrización.
- -
T. Tissue removal. Eliminar el tejido no viable (necrótico) es necesario para disminuir el riesgo de infección y para eliminar células senescentes, enzimas proteolíticas como las metaloproteasas (MMP), cuya función excesiva, especialmente de las MMP-2 y 9, afecta a la cicatrización18, así como la matriz extracelular corrupta19. El primer paso es limpiar la úlcera. Para ello basta con irrigar con suero fisiológico, de forma suave. No debemos emplear antisépticos clásicos de forma rutinaria, como clorhexidina, peróxido de hidrógeno o povidona yodada, ya que son tóxicos para los queratinocitos y fibroblastos in vitro. Aunque es un punto todavía controvertido, se acepta su uso de forma puntual cuando interese disminuir la carga bacteriana de la úlcera20. Sin embargo, en estas ocasiones es más aconsejable usar productos con capacidad antibacteriana menos tóxicos como apósitos con plata, cadexómero yodado o polihexanida (tabla 4). Tras la limpieza, la presencia de tejido necrótico debe hacernos escoger alguno de los métodos de desbridamiento de los que disponemos (tabla 5). Si la cantidad de tejido necrótico es alta, el método de elección por su rapidez es el desbridamiento quirúrgico con tijeras o bisturí. Una excepción puede ser la úlcera arterial, ya que la isquemia aumenta el riesgo de infección, aunque en casos seleccionados puede realizarse en quirófano. En caso de escara en el talón o la nuca de origen isquémico, lo mejor es dejar la escara y no usar la cirugía. En este caso y en otros donde descartemos el desbridamiento quirúrgico, usaremos el enzimático. El más usado en España es la pomada de colagenasa. Es un método lento y poco selectivo, sobre todo en el caso de la papaína, además de causar algo de dolor. En caso de escaras muy secas, debemos incidir con bisturí las mismas para facilitar la penetración de la pomada2. El desbridamiento autolítico consiste simplemente en mantener un ambiente húmedo en la úlcera de manera que los macrófagos del paciente vean facilitada su labor de eliminar restos necróticos. De indicación en casos de material necrótico escaso o como mantenimiento. Si el lecho de la úlcera está seco, debemos aportar humedad extra, por ejemplo mediante el uso de hidrogeles21. Otros métodos de desbridamiento menos usados quedan comentados en la tabla 6.
Tabla 4.Antisépticos no tóxicos aptos para úlceras crónicas
A. Cadexómero yodado: Iodosorb® - Libera lentamente yodo - Dolor en el 5% de los casos al aplicar - Precaución en niños y enfermedad tiroidea - Presentaciones en polvo, gel y placa B. Polihexanida: Prontosan® - Presentaciones en gel y solución Tabla 5.Métodos de desbridamiento
Tipo Características Enzimático Lento, inespecíficoEn escaras grandes hacer cortesPuede doler Quirúrgico Rápido, inespecíficoDe elección en escaras grandesNo en talones o nuca Biológico (usando larvas de Phaenicia sericata) Muy específicoNo disponible en España MecánicoGasas wet to drySistemas de aspiración InespecíficoDoloroso Autolítico Específico, lentoDe elección si hay esfacelos escasos Tabla 6.Hipótesis de cronicidad de las úlceras
Teoría Enfoque terapéutico Carga bacteriana alta o formación de biofilms Apósitos con plata, lactoferrina en gel, terapia de presión negativaInhibidores del quorum sensing Matriz extracelular desorganizada o corrupta Piel artificialAmelogenina Actividad excesiva de las metaloproteasas Apósitos captadores de metaloproteasasColágeno en polvo Disminución de factores de crecimiento Aplicación de factores recombinantesPlasma rico en plaquetasTerapia génica Actividad excesiva de citoquinas proinflamatorias Bloqueo de las citoquinas implicadas (anti-TNF, etc.) Células de fenotipo senescente Tratamientos con células madre - -
I. Infection control. Casi el 100% de las úlceras están contaminadas por bacterias, que no se replican y cuya presencia no altera la cicatrización, por lo que realizar cultivos rutinarios no tiene sentido. Se habla de colonización cuando las bacterias se replican, sin invadir tejidos adyacentes ni provocar signos de infección, pero alterando la cicatrización. El punto en que el número de bacterias empieza a provocar esto se conoce como colonización crítica. Debemos sospechar que una úlcera está alcanzando este punto en las siguientes circunstancias: el tejido de granulación se vuelve friable, grisáceo o ausente, la úlcera aumenta el grado de exudación sin edema acompañante, el olor del exudado es muy malo, el dolor aumenta frente a otras curas, o simplemente cuando la úlcera no mejora a pesar de un tratamiento correcto. La infección de la úlcera aparece cuando la cantidad de las bacterias supera las 100.000 por gramo de tejido y suele venir acompañada de otros signos como fiebre, adenopatías, celulitis o exudado purulento. Sólo en caso de sospecha de colonización crítica o infección debe realizarse una toma para cultivo, preferiblemente cuantitativo como se comentó anteriormente, y tratamiento de forma puntual con antisépticos no tóxicos y antibioterapia oral empírica a la espera del antibiograma. Como ocurre con los antisépticos clásicos, la mayor parte de los expertos desaconseja el uso de antibióticos tópicos. En los últimos años, se ha debatido mucho sobre los mecanismos por los que las bacterias alteran la cicatrización en ausencia de infección clínica. Actualmente la opinión mayoritaria es que se debe a la presencia de biofilms22. Los biofilms son comunidades de bacterias agregadas y cubiertas por una matriz extracelular de polisacáridos que las protege contra los antibióticos y contra la inmunidad del paciente. Desde estos biofilms, las bacterias pueden producir sustancias que inhiben la proliferación de los queratinocitos como los lipopolisacáridos de Pseudomona aeruginosa23, o provocar la acumulación de polimorfonucleares y sus MMP24. Los biofilms se están implicando en varios procesos patológicos además de las heridas crónicas como en la formación de la placa bacteriana dental, la otitis media crónica, la fibrosis quística o la prostatitis crónica25. La manera en que las bacterias se comunican para iniciar la expresión de genes que determinan la síntesis de la matriz se denomina quorum sensing y está siendo motivo de una intensa investigación de cara a inhibir dicha comunicación. La demostración de la presencia de biofilms en una úlcera puede hacerse mediante biopsia26, apreciándose en un 60% de las úlceras crónicas en mayor o menor grado27, frente a un 6% de las agudas. La cuestión es, cuando se sospecha o confirma la presencia de biofilms en la úlcera, ¿qué hacemos? A la espera del desarrollo de inhibidores del quorum sensing, se ha demostrado que el desbridamiento, el cadexómero yodado, la lactoferrina en gel, los apósitos con plata, la terapia de presión negativa e incluso la miel tienen actividad contra los biofilms28.
- -
M. Moisture balance. Como se comentó anteriormente, siguiendo los postulados de la teoría de la cura húmeda, debemos escoger un apósito que retenga parte del exudado en el lecho de la úlcera, pero evitando que el borde de la misma se macere. Tal y como podemos apreciar en la tabla 4, disponemos de varias familias de apósitos en la actualidad, para una úlcera no complicada:
- a.
Hidrocoloides. Se basan en la presencia de tres hidrocoloides como carboximetilcelulosa sódica, pectina y gelatina. Son apósitos adhesivos y bastante oclusivos, por lo que no se aconseja su uso en úlceras infectadas y son sólo moderadamente absorbentes, por lo que se pueden usar en úlceras ligeramente exudativas o cuando interese estimular al máximo el desbridamiento autolítico. Una característica de esta clase de productos, que limita su uso, es la formación de un gel viscoso, pseudopurulento y maloliente, que, si no se conoce, puede provocar la impresión de infección. Actualmente han sido desplazados por las espumas.
- b.
Espumas de poliuretano. Han desplazado a los hidrocoloides en las úlceras ligera o moderadamente exudativas, no porque sean más eficaces, sino porque son más cómodos. Consisten en una mezcla de poliuretanos y acrilatos con otras sustancias de manera que poseen una capa externa hidrofóbica y una interna hidrofílica y absorbente. Existen formas adhesivas y no adhesivas. Son semioclusivos, por lo que pueden emplearse en úlceras infectadas.
- c.
Alginatos. Están compuestos por alginato sódico extraído de algas pardas. Tienen una gran capacidad absorbente, por lo que se emplean en úlceras muy exudativas, y propiedades hemostáticas, por lo que son muy útiles en pacientes anticoagulados, con úlceras sangrantes o tras realizar un desbridamiento. Se deben recortar según la forma de la úlcera ya que pueden macerar el borde y al no ser adhesivos necesitan frecuentemente un apósito secundario.
- d.
Hidrofibras. Son apósitos formados por microfibras de carboximetilcelulosa pura. Son los más absorbentes y se usan en las úlceras más exudativas. Tampoco son adhesivos ni impermeables, por lo que precisan un apósito secundario.
- e.
Hidrogeles. Se trata de preparados con alto contenido en agua más sistemas microcristalinos de polisacáridos y polímeros sintéticos. Disponibles en presentación en gel o láminas, tienen una mínima capacidad absorbente y se usan más bien en úlceras secas o para facilitar el desbridamiento autolítico. La presentación en gel, la más usada, necesita un apósito secundario.
- f.
Otros apósitos a tener en cuenta son los secuestradores de las MMP, aunque su eficacia in vivo aún está por demostrar, los apósitos con miel, las espumas e hidrocoloides extrafinos útiles en úlceras epitelizando o en zonas donantes de injertos, las láminas de silicona, etc.
En cualquier caso, es imposible revisar todos los apósitos disponibles y cabe destacar la pobreza de los estudios en que se sustentan para recomendar su uso29.
Otro aspecto a precisar es el tamaño del apósito y el tiempo entre cura y cura. Menos en el caso de los alginatos, en los que el tamaño debe ajustarse al de la úlcera por su tendencia a macerar el borde de la misma, el resto de apósitos debe tener un tamaño varios centímetros superior al de la úlcera. El tiempo entre cambio y cambio variará en función de lo exudativa que sea la úlcera. Debemos evitar que la burbuja de exudado desborde el apósito, en cuyo caso deja de ser efectivo. En general, con un apósito lo suficientemente absorbente podemos dejar la cura 2-3 días antes de cambiarla.
- a.
- -
E. Edge of the wound. El borde de la úlcera debe encontrarse en condiciones óptimas para la cicatrización30. Eso incluye evitar que se macere usando una pasta al agua en el borde de las úlceras muy exudativas, desbridar los bordes de la misma en caso de que estén esclerosados (frecuente en las úlceras de mucho tiempo de evolución y en las neuropáticas de los diabéticos), de manera que introducimos una herida aguda en una úlcera crónica de cara a acelerar la cicatrización. Si apreciamos una dermatitis en la piel de alrededor deberemos pautar un corticoide tópico. Este también resulta muy útil en los casos de presencia de tejido de granulación exuberante, que sobresale por encima de los bordes de la úlcera, de manera que aplicándolo en 2-3 curas se consigue aplanar en todos los casos.
Es este apartado nos referiremos a la posibilidad de ayuda farmacológica a la cicatrización y a la terapia compresiva que debe acompañar a una úlcera venosa.
- a.
Fármacos en el tratamiento de las heridas crónicas. La ayuda de los fármacos disponibles actualmente es escasa. La pentoxifilina parece acelerar la cicatrización de las úlceras de origen venoso cuando se administra junto a terapia compresiva31. El efecto fibrinolítico, antitrombótico o la inhibición de la producción de citoquinas proinflamatorias son algunos de los mecanismos farmacológicos que pueden explicar este efecto. Otros fármacos con una hipotética utilidad como la aplicación tópica de ácido retinoico a concentraciones de 0,025-0,05% en el tejido de granulación para estimular la angiogénesis32, o los beta-bloqueantes para bloquear el efecto de la adrenalina asociada al estrés en la migración de los queratinocitos33, tienen poca base para recomendarse de forma general.
- b.
Terapia compresiva. Es el tratamiento de primera elección en las úlceras venosas de las piernas34. No realizarla, siempre que no exista contraindicación, resulta en una cicatrización retardada de la úlcera de origen venoso. Sus funciones son reducir el edema, reducir la distensión del sistema venoso superficial, reforzar el efecto sobre el sistema venoso profundo de la bomba muscular gemelar e incluso reducir la presencia de citoquinas proinflamatorias en el exudado35. Hay que distinguir entre la terapia de contención, usando vendajes inelásticos o short-stretch, que únicamente impiden la expansión de la zona gemelar durante la deambulación, de manera que no serán útiles en pacientes encamados, sin ejercer presión en reposo, y la verdadera terapia compresiva usando sistemas elásticos, que ejercen una presión que sigue la Ley de Laplace, según la cual la presión que se ejerce sobre una estructura cilíndrica es proporcional a la tensión externa aplicada e inversamente proporcional al radio de la estructura (P=T/r). Antes de realizar terapia compresiva debemos realizar un doppler para establecer el IPTB; si este es menor a 0,6 no debemos realizar terapia compresiva sin consultar antes a un cirujano vascular. Si está entre 0,6 y 0,8 sólo podemos emplear sistemas inelásticos, y si es mayor a 0,8 podemos realizar compresión, salvo que sea mayor de 1,2, ya que, en ese caso, especialmente en diabéticos, debemos sospechar calcificación y pedir una angiorresonancia. Existen dos maneras de realizar la terapia compresiva: mediante vendaje elástico o mediante medias elásticas. Para que cualquiera de los sistemas sea válido para cicatrizar una úlcera, debe ejercer una presión de más de 35-40mmHg sobre el tobillo. Dentro de las vendas elásticas, podemos optar por un vendaje convencional, siempre con una capa de venda de algodón sobre la piel, o un sistema multicapa, que aporta ya diferentes tipos de vendas a colocar en un orden determinado (de 2 a 4 capas) para garantizar la presión adecuada. Este último sistema es más caro, pero más fácil de colocar realizando la presión correcta y más efectivo a nuestro juicio. El inconveniente de las vendas es que el paciente tiene que llevarlas hasta la siguiente cura y requiere personal entrenado para realizar la compresión adecuada. La media elástica tiene la ventaja de que el paciente se puede quitar la venda por la noche y aplicarla por la mañana, antes de empezar a deambular, aunque requiere una cierta habilidad y fuerza física. No obstante, existen sistemas tipo «calzador» que permiten colocar las medias con más facilidad. Las medias elásticas pueden clasificarse en función de la presión que realizan. En las úlceras activas están indicadas las de compresión fuerte o grado III (presión entre 25-40mmHg) y para prevenir recurrencias las de compresión mediana, normal o grado II (presión entre 18-25mmHg). Si existe deformidad del miembro tipo «botella de cava», por la coexistencia de una lipodermatoesclerosis, debemos aplicar varias capas de venda de algodón en la parte más estrecha hasta convertir la pierna en un cilindro y luego aplicar venda elástica, ya que en estos casos la media elástica no tiene utilidad11. En un metaanálisis de Cochrane se estableció que la realización de compresión es más eficaz que no realizarla y que los sistemas multicapas superan a los de una capa simple36.
A pesar de un diagnóstico y tratamiento correctos, incluso en unidades de úlceras crónicas, entre un 10-20% de las úlceras no evolucionan favorablemente. No existe un motivo aceptado globalmente para esta situación pero existen varias hipótesis, recogidas en la tabla 6. Algunas de estas cuestiones, como la presencia de biofilms, ya han sido tratadas anteriormente. A continuación comentaremos brevemente alguna de dichas hipótesis y las posibles terapéuticas que de ellas se derivan.
Actividad excesiva de las metaloproteasasEn cualquier proceso de cicatrización, la presencia de MMP, así como de sus inhibidores (TIMP), en el momento y la cantidad adecuados es imprescindible para procesos tan importantes como la remodelación del colágeno, la angiogénesis o la epitelización. Diversos trabajos en ratones y humanos han mostrado la presencia de una excesiva cantidad de MMP en las úlceras crónicas de diferente etiología, si bien las MMP implicadas varían, entre aumento de MMP-1 y 8 con disminución del TIMP-137, aumento de MMP-1, 2, 8, 9 y 14 con disminución de TIMP-2 en úlceras de pie diabético38 o aumento de MMP-9 y disminución del TIMP-1 en úlceras por presión39. El mecanismo por el cual la presencia de una cantidad excesiva de MMP puede dificultar la cicatrización no está claro pero podría incluir una excesiva degradación del colágeno o una inactivación de factores de crecimiento. Gran parte de las MMP son producidas por células inflamatorias, por lo que su presencia en exceso podría ser un fenómeno secundario a la inflamación excesiva de las úlceras crónicas. De hecho, el factor de necrosis tumoral-alfa (TNF-α) es capaz de activar las MMP e inhibir los TIMP35, como se comentará más adelante. A partir del descubrimiento del posible papel de las MMP en las úlceras crónicas, se ha planteado su inhibición como posible tratamiento. Un bloqueo completo no es deseable dado que estas enzimas tienen un papel fisiológico fundamental en la cicatrización. El enfoque actual es intentar eliminar un posible exceso, mediante el uso de apósitos con capacidad de secuestrar MMP, aunque su utilidad está por establecer. En este punto también puede comentarse el posible uso del colágeno en polvo. Es un tratamiento empleado desde hace más de 30 años en úlceras crónicas. Aunque su utilidad inicialmente se explicaba por la estimulación de la actividad de fibroblastos y queratinocitos, trabajos recientes han demostrado que también actúan estimulando los TIMP e inhibiendo las MMP40.
Déficit de factores de crecimientoNumerosos factores de crecimiento intervienen en el proceso normal de cicatrización como FGF, EGF, HGF, PDGF o TGF-β41. Sus funciones son, en general, facilitar la proliferación de las células responsables de la cicatrización, por lo que su defecto la dificultaría, pero algunos como el TGF-β parece actuar inhibiendo la epitelización, con lo cual el problema podría ser su presencia en exceso. Sus funciones se solapan en algunos casos y aparecen de forma secuencial en el proceso de cicatrización, por lo que deben estar presentes en la cantidad y momento adecuados para que la herida cure. De momento, el único factor de crecimiento usado en la clínica es el PDGF, empleado en las úlceras del pie diabético, con un beneficio discreto si lo comparamos con su coste. Otros enfoques son huir del uso de factores de crecimiento de forma aislada, usando fuentes de varios de ellos como el plasma rico en plaquetas42, y buscar formas más efectivas de administrarlos como terapia génica usando vectores virales o sistemas transitorios como liposomas43. Los estudios con ratones knock-out, deficientes genéticamente en cada uno de los factores de crecimiento, está permitiendo conocer la importancia de cada uno de ellos y permitirá en un futuro cercano diseñar estrategias más efectivas usando estos factores44.
Aumento de citoquinas proinflamatoriasOtro fenómeno típico de las úlceras crónicas es un aumento en la cantidad de citoquinas proinflamatorias como IL-1, IL-6 o TNF-α45. Si como parece intuirse en diversos estudios la presencia en exceso de estas citoquinas tiene un efecto deletéreo en la cicatrización, podrían incluirse las úlceras crónicas entre las enfermedades inflamatorias y beneficiarse de los avances en este campo con los fármacos biológicos. El TNF-α es la citoquina que ha despertado más interés en este campo. Por un lado tiene efectos beneficiosos para la cicatrización como favorecer la síntesis de colágeno y la proliferación de fibroblastos cuando se encuentra en cantidades bajas, pero en cantidades más altas parece inhibir la síntesis de colágeno, la angiogénesis y aumenta la función de las MMP46. De hecho se encuentran cantidades de TNF-α 100 veces mayores en úlceras venosas que no curan comparadas con heridas agudas, además de disminuir conforme la úlcera cura con terapia compresiva35. Incluso se está planteando el TNF-α como diana terapéutica en estos pacientes. En un estudio se disminuyó la citotoxicidad para los fibroblastos del fluido de heridas crónicas empleando etanercept47 y en otro se usó en 14 úlceras de diferente etiología infliximab tópico curando en 8 semanas 5 de las 14 y mejorando un 75% otras 448. Aunque el empleo de estos fármacos en pacientes con riesgo de infección como los pacientes con úlceras debe considerarse con suma cautela. Quizás podamos ser más específicos en el bloqueo de la acción del TNF-α en estos casos dado que los efectos nocivos en la cicatrización parecen mediados por el receptor p55 y no por el p75. De hecho los ratones carentes de receptor p55 presentan una cicatrización acelerada de las heridas49.
Senescencia celularLos diferentes tipos celulares están programados para replicarse un número determinado de veces, tras lo cual entran en una situación denominada senescencia celular, en la que ya no pueden replicarse, deteniéndose el ciclo celular en G1 y acumulando ciertos marcadores como la β-galactosidasa asociada a la senescencia (SA-β-gal). Esta situación se considera irreversible y condicionada a nivel genético por la longitud de los telómeros. Diversos estudios han mostrado un aumento de células senescentes en las úlceras crónicas, sobre todo fibroblastos, pero también queratinocitos, células endoteliales y macrófagos50. La presencia de estas células senescentes afectaría de forma dramática a la capacidad de cicatrización de la úlcera y la haría refractaria a tratamientos como los factores de crecimiento, ya que dichas células no responden a ellos. La importancia real de este fenómeno todavía está por establecer, pero justificaría el empleo como fuente de células no senescentes de células madre, entre otras posibles estrategias30,44.
En este punto también podemos considerar el uso de microinjertos o de piel artificial obtenida por ingeniería tisular. El uso de injertos autólogos obteniendo piel donante del paciente y depositándola en la úlcera es un método usado desde el siglo xix. En nuestra opinión, el hecho de que la zona donante supone una nueva herida con nuevas posibles complicaciones, debe hacer reservar esta posibilidad a casos refractarios en ausencia de signos de infección o colonización crítica. Aun en la mejor de las situaciones, el porcentaje de prendimiento de estos injertos oscila entre el 15-50%51. En realidad algunos autores se plantean si estos injertos no actúan como fuentes «groseras» de células madre. Algo similar podemos decir sobre la piel artificial. Una revisión de todos los tipos de sustitutos cutáneos excedería las posibilidades de este artículo, aunque existen algunas publicaciones excelentes sobre el tema52. La impresión del autor es que son materiales muy interesantes en aquellos casos en los que es preciso un aporte rápido de «piel» como en los grandes quemados, pacientes con necrólisis epidérmica tóxica o en pacientes con epidermólisis ampollosa, pero que en pacientes con úlceras crónicas sólo han demostrado ser ligeramente superiores a los apósitos tradicionales, siendo mucho más caros. En cualquier caso, futuros ensayos clínicos tienen que definir su utilidad.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.