El amiloide es un material proteináceo que se deposita en los tejidos en una gran variedad de situaciones clínicas; en la piel puede ser hallado con o sin afectación sistémica concomitante. La amiloidosis cutánea primaria localizada designa a aquellas amiloidosis con afectación exclusivamente cutánea, sin afectación a otros niveles. Las formas más comunes dentro de este grupo son la amiloidosis macular y el liquen amiloideo. La amiloidosis nodular es extremadamente infrecuente y mantiene importantes diferencias clínicas, pronósticas, histológicas y patogénicas con respecto a las variantes macular y liquenoide.
Presentamos un nuevo caso de amiloidosis cutánea primaria localizada nodular con placas y nódulos diseminados, que no desarrolló afectación sistémica tras tres años desde el debut de las lesiones.
Amyloid is a proteinaceous material that is deposited in the tissues in a large variety of clinical contexts; in the skin it can be found with or without concomitant systemic disease. Primary localized cutaneous amyloidosis encompasses those amyloidoses restricted to the skin without involvement of other systems. The most common forms within this group are macular and lichen amyloidosis. Nodular amyloidosis is extremely rare, and there are notable differences in clinical presentation, prognosis, histology, and pathogenesis between this entity and the macular and lichenoid variants.
We report a new case of nodular primary localized cutaneous amyloidosis with disseminated plaques and nodules in which no systemic disease developed in the 3 years following the appearance of the lesions.
La amiloidosis no es una sola enfermedad, sino que con este término se hace referencia a un conjunto de cuadros que comparten la característica común del depósito anómalo extracelular de amiloide, un material proteináceo fibrilar, en los tejidos, con propiedades tintoriales y físico-químicas en común, tales como la congofilia, birrefringencia verde manzana bajo luz polarizada y configuración laminar p plegada con cristalografía de rayos X1,2; todo ello independientemente del contexto clínico o proceso patológico relacionado. La clasificación de la amiloidosis se hace de acuerdo con las características clínicas del paciente y la naturaleza de los depósitos de amiloide1 (tabla 1). Las formas cutáneas primarias (macular, liquenoide y nodular) y secundarias localizadas1,3 son las que con mayor frecuencia se presentan al dermatólogo. Pero es sin duda la amiloidosis cutánea primaria localizada nodular (ACPLN) la más infrecuente, con menos de un centenar de casos recogidos en la literatura.
Clasificación de la amiloidosis: clínica y naturaleza del amiloide
| Clínica | Proteína amiloide |
| Sistémica | |
| Primaria | AL |
| Asociada a mieloma | AL |
| Secundaria | AA |
| Heredofamiliar | |
| Fiebre mediterránea familiar | AA |
| Síndrome de Muckle-Wells | AA |
| Polineuropatía amiloidótica familiar | Transtirretina |
| Asociada a hemodiálisis | 02-microglobulina |
| Localizada | |
| Limitada a un órgano | |
| Pulmón, laringe | AL |
| Asociada a diabetes mellitus | Amilina |
| Tiroides | Precalcitonina |
| Cerebral/enfermedad de Alzheimer | Proteína precursora de amiloide |
| Cerebral/hereditaria | Cistatina C |
| Cutánea primaria | |
| Nodular | AL |
| Amiloidosis macular | Queratina alterada |
| Liquen amiloideo | Queratina alterada |
| Cutánea secundaria | |
| En el seno de tumores cutáneos | Queratina alterada |
AA: amiloide A; AL: amiloide L.
Presentamos a continuación un caso de ACPLN en una mujer de 30 años, con múltiples lesiones localizadas fundamentalmente en tronco, genitales y pliegues inguinales y axilares. Tras tres años de evolución no se ha evidenciado un trastorno subyacente asociado a las lesiones existentes.
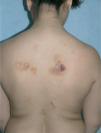
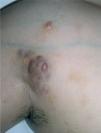
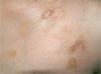
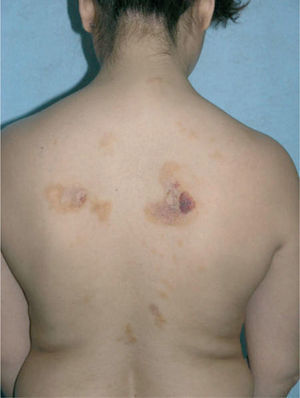
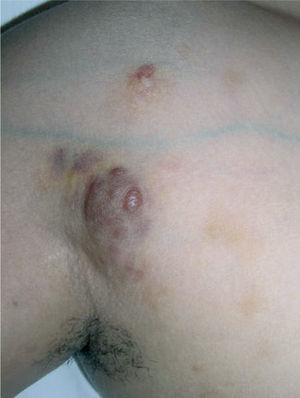
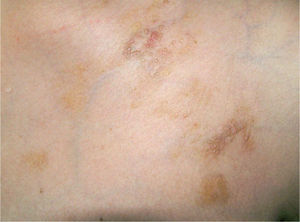
Caso clínicoSe trata de una mujer de 30 años, natural de Colombia, sin antecedentes familiares o personales destacables, salvo episodios repetidos de bronquiolitis en la infancia que se habían resuelto totalmente al llegar a la adolescencia. Fue referida a nuestras consultas para valoración de varias lesiones cutáneas asintomáticas que habían ido apareciendo progresivamente en los dos años previos y que no remitían con diversos tratamientos tópicos pautados. Las lesiones se habían iniciado en los pliegues inguinales, pliegues axilares y la cara interna de muslos, y paulatinamente habían aumentado de tamaño, al tiempo que otras nuevas aparecieron en la espalda, región preesternal, el abdomen inferior y la vulva. Por otro lado, la paciente conservaba un buen estado general, y no se constató ninguna otra sintomatología adicional. En la exploración física se objetivó la presencia de lesiones maculopapulosas confluyentes en placas de morfología lineal y redondeada, de tamaño variado, que oscilaban desde varios milímetros hasta 6 u 8 cm de diámetro, con bordes bien delimitados, aunque irregulares, y superficie lisa o rugosa según la localización. Las lesiones experimentaban una clara discromía, predominando en algunas un color marrón-amarillento y en otras una tonalidad eritematopurpúrica con áreas de color piel semejante a la piel adyacente (fig. 1). En las localizaciones de inicio se mostraban más infiltradas al tacto, con un aspecto más nodular (fig. 2). En la región preesternal y supraclavicular también se podían apreciar pequeñas pápulas hemisféricas brillantes, de color piel y superficie lisa, con tendencia a disponerse de forma anular (fig. 3). A lo largo del tiempo de seguimiento pudimos comprobar la sucesiva aparición de nuevas lesiones en abdomen, borde de implantación frontal del cuero cabelludo y hueco poplíteo.
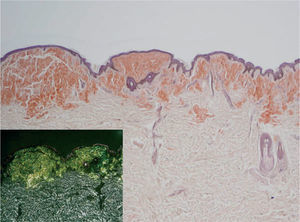
Se realizó biopsia de tres de las lesiones más representativas, que reveló hallazgos histológicos similares. A pequeño aumento se visualizaba un material débilmente eosinófilo homogéneo, con hendiduras, que sustituía a las fibras de colágeno y fibroblastos normales y provocaba una expansión nodular de la dermis reticular y papilar, además de extenderse de forma focal al tejido celular subcutáneo y disponerse alrededor de los anejos. Además, asociado a lo anterior, existía un infiltrado inflamatorio perivascular constituido fundamentalmente por células plasmáticas. Con tinción de Rojo Congo, los depósitos mostraron un color rojo-anaranjado intenso al microscopio óptico (que se mantuvo tras el tratamiento de la muestra con permanganato potásico) y una birrefringencia verde manzana bajo luz polarizada (fig. 4). Tinciones inmunohistoquímicas para amiloide AA resultaron negativas, y las realizadas para detectar cadenas ligeras kappa y lambda fueron débiles e inespecíficas (cadenas kappa) y más intensas (cadenas lambda), respectivamente. Los estudios complementarios practicados, incluyendo electrocardiograma, hemograma, electrolitos, coagulación, función hepática y renal, p2-microglobulina, velocidad de sedimentación globular (VSG), electroforesis en suero y orina, radiografía de tórax, serie ósea y ecografía abdominal, fueron normales o no significativos a lo largo de todo el tiempo de seguimiento, destacando únicamente un aumento policlonal de las inmunoglobulinas (Ig)G (2.430 mg/dl). La biopsia de médula ósea no reveló ninguna anormalidad; por último, una biopsia rectal no consiguió tampoco demostrar la presencia de amiloide.
DiscusiónLa amiloidosis cutánea primaria es una forma de amiloidosis localizada, con afectación exclusiva de la piel, que se subdivide a su vez en tres tipos: macular, liquenoide y nodular4. Las formas macular y liquenoide son las más comunes y se caracterizan por el depósito de un tipo de amiloide en dermis papilar que parece derivado de los queratinocitos adyacentes1,5. Pero es sin duda la ACPLN la forma de amiloidosis cutánea primaria localizada más infrecuente6-8, con menos de un centenar de casos recogidos en la literatura. Tiene lugar habitualmente en mujeres en la sexta o séptima décadas de la vida9, aunque series más recientes informan de una mayor proporción de hombres afectados6.
Clínicamente se presenta como nódulos o placas infiltradas, únicas o múltiples, redondeadas u ovaladas, bien delimitadas, de coloración marrón o amarillenta y superficie brillante, que en ocasiones aparecen atróficas, anetodérmicas o ampollosas, probablemente por la destrucción de las fibras de colágeno y elastina10. Por orden decreciente de frecuencia, las lesiones se localizan en miembros inferiores, cabeza, tronco y miembros superiores6,7, reportándose también casos esporádicos en lengua11 y genitales9,12. No es extraño encontrar una VSG elevada, así como unos niveles de β- y γ-globulinas elevados6. Además, algunos autores han establecido una asociación de la ACPLN con el síndrome de Sjógren13-15 y la diabetes mellitus16.
La clave del diagnóstico histológico de la ACPLN es la presencia de grandes masas hialinas y eosinófilas de amiloide que se extienden desde la dermis papilar y reticular hasta el tejido celular subcutáneo. Además, los depósitos pueden verse rodeando anejos, vasos sanguíneos y células grasas1. El amiloide dérmico depositado en la ACPLN es de tipo AL (cadenas ligeras de Ig), tal y como lo demuestra la presencia de cadenas ligeras lambda y/o kappa en dichos depósitos, mediante análisis inmunohistoquímicos17. Todos estos hallazgos pueden ser indistinguibles de los propios de la amiloidosis sistémica primaria o asociada a mieloma6,7, pero no se objetivan en las formas sistémicas secundarias o heredofamiliares, caracterizadas por el depósito de una proteína no Ig distintiva denominada AA (proteína amiloide A)1.
Estudios de reordenamiento genético practicados en varios pacientes han identificado un clon de células plasmáticas productoras de amiloide en la piel de una lesión nodular, sin indicios de proliferación clonal de plasmáticas en la médula ósea18. Por ello, algunos autores sugieren que esta variedad debe ser considerada como un plasmocitoma extramedular, estando el amiloide producido por las células plasmáticas locales; sin embargo, se desconoce el mecanismo por el que estas células secretan localmente amiloide19-22.
La ACPLN sólo puede ser distinguida de ciertos tipos de amiloidosis sistémica después de realizar una cuidadosa exploración física y un exhaustivo estudio de extensión que descarte la presencia de depósitos extracutáneos de amiloide7. En el caso de nuestra paciente, la inmunoelectroforesis en orina y suero, serie ósea, radiografía de tórax y ecografía abdominal, así como la biopsia rectal y de médula ósea realizadas, no permitieron detectar depósitos extracutáneos de amiloide o un trastorno hematológico subyacente; tan sólo se evidenció un significativo aumento policlonal de las IgG, algo que con relativa frecuencia ocurre en esta patología6, como se ha comentado anteriormente. Algunos autores han recomendado la gammagrafía con amiloide sérico P (ASP), un precursor del amiloide P contenido en todos los depósitos de amiloide, por ser un método no invasivo, con una aceptable sensibilidad y especificidad, que podría poner de manifiesto una afectación multiorgánica en pacientes diagnosticados de ACPLN23. No obstante, su utilidad diagnóstica sigue siendo evaluada en el momento actual24.
El riesgo de progresión a amiloidosis sistémica es incierto, ya que la mayoría de casos de ACPLN corresponden a casos aislados o series cortas de pacientes, de las que resulta difícil extrapolar conclusiones. Brownstein y Helwig25 recogieron treinta y nueve casos de amiloidosis cutánea primaria localizada, de los que diez correspondieron a ACPLN; cinco de ellos (50%), tras un período de seguimiento de hasta ocho años, permanecieron estables, sin desarrollar otra sintomatología. El resto de casos (50%) evolucionaron con el tiempo hacia formas sistémicas. Sin embargo, Woollons y Black6 encontraron que sólo uno de los quince casos que recogieron de ACPLN (7 %) desarrolló amiloidosis sistémica tras 23 años de seguimiento; aunque un 40 % de los pacientes de este estudio a largo plazo presentó paraproteinemia al diagnóstico, la gammapatía permaneció estable durante todo el tiempo de seguimiento.
El manejo terapéutico de la ACPLN es difícil, y no existe un tratamiento que claramente demuestre una mayor eficacia frente a los demás6. Se han propuesto diversos tratamientos en un intento de mejorar la apariencia cosmética de las lesiones, como la escisión quirúrgica26, láser CO227,28, crioterapia5, dermoabrasión29, curetaje y electrocoagulación5,30, y más recientemente láser de colorante pulsado31. No obstante, la tasa de recurrencia en este tipo de amiloidosis es alta, ya que a diferencia de la amiloidosis macular y el liquen amiloideo, el depósito de amiloide llega hasta la dermis reticular y el tejido celular subcutáneo6.
Tras completar en este momento tres años de evolución desde el inicio del cuadro, creemos que el diagnóstico más apropiado para esta paciente es el de ACPLN. Habitualmente se presenta como nódulos y placas únicos o en escaso número; las formas diseminadas, como nuestro caso, son más infrecuentes y dificultan el manejo terapéutico. Dado que el pronóstico de esta entidad no está claro, lo recomendable es un seguimiento periódico, clínico y analítico, con el fin de comprobar que no existe afectación a otros niveles.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.