La celulitis y la erisipela son infecciones localizadas de partes blandas que se desarrollan como resultado de la entrada de bacterias a través de una barrera cutánea alterada. Es una entidad de presentación relativamente frecuente y su diagnóstico precoz es clave para el tratamiento oportuno del paciente, por lo que debemos estar instruidos en su clínica, diagnóstico y alternativas de tratamiento. En este trabajo, se realiza una revisión de la literatura y actualización en el tema que incluye: manifestaciones clínicas, factores predisponentes, microbiología, diagnóstico, tratamiento y complicaciones. Además, se realiza una revisión de la situación bacteriológica actual en Chile.
Cellulitis and erysipelas are local soft tissue infections that occur following the entry of bacteria through a disrupted skin barrier. These infections are relatively common and early diagnosis is essential to treatment success. As dermatologists, we need to be familiar with the clinical presentation, diagnosis, and treatment of these infections. In this article, we provide a review of the literature and update on clinical manifestations, predisposing factors, microbiology, diagnosis, treatment, and complications. We also review the current situation in Chile.
La celulitis y la erisipela son infecciones agudas localizadas de partes blandas que ocurren como resultado de la entrada de bacterias a través de una barrera cutánea alterada. Son entidades frecuentes: se estiman unos 200 casos por cada 100.000 personas cada año1 y representan hasta un 10% de los ingresos hospitalarios2. Comprometen las extremidades inferiores (EEII) en el 70-80% de los casos y ocurren con igual frecuencia en hombres y en mujeres. La celulitis se presenta generalmente en individuos de edad media y adultos mayores, mientras que la erisipela se da en edades extremas de la vida3.
Manifestaciones clínicasLa erisipela compromete la dermis superficial y los vasos linfáticos superficiales, produciendo una placa eritematosa, sobreelevada, firme y bien delimitada, con aumento de la temperatura local, y dolorosa a la palpación. La localización más frecuente es la cara.
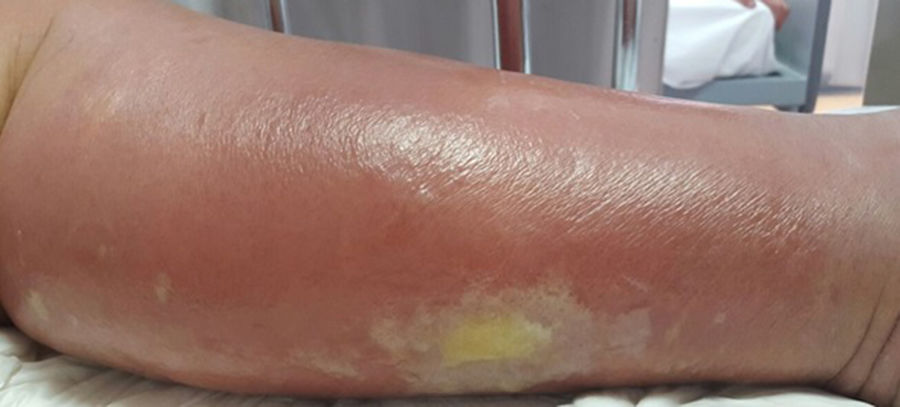
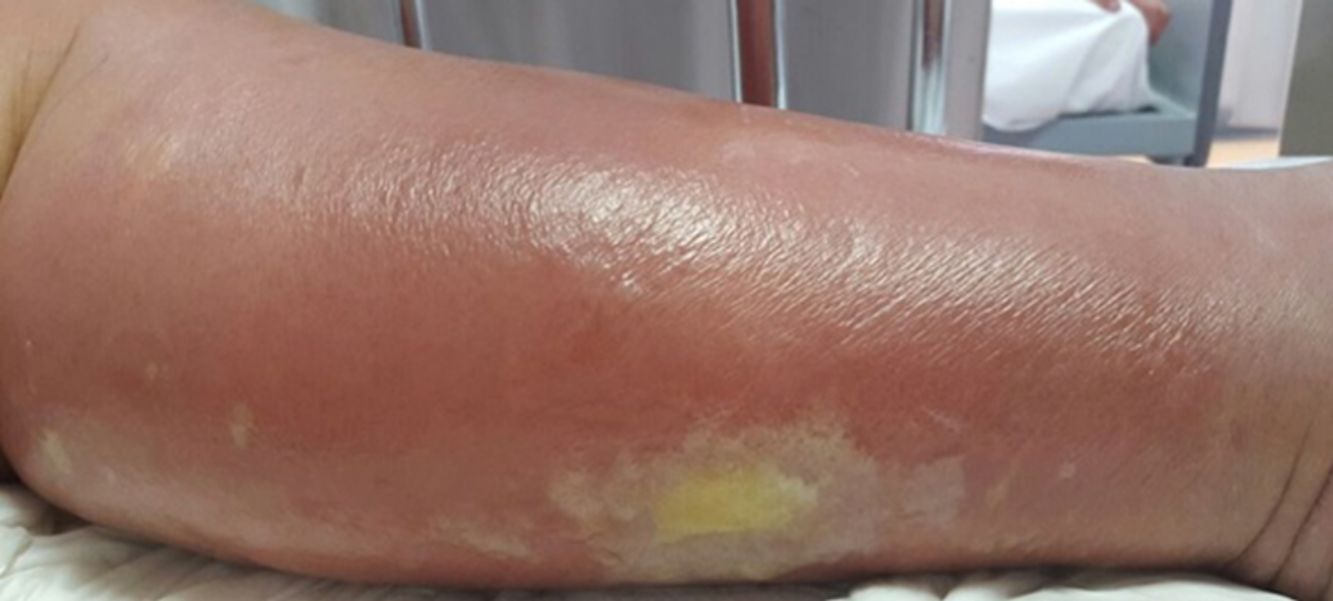
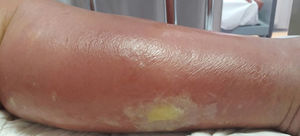
La celulitis compromete la dermis reticular y la hipodermis y puede generar daño linfático permanente. El área afectada se caracteriza por aumento de temperatura, edema, dolor y eritema, tiene bordes irregulares, pero puede respetar áreas de piel en un patrón impredecible4. Pueden aparecer ampollas (fig. 1), ampollas hemorrágicas y pústulas, que pueden evolucionar a úlceras o coalescer formando lagos de supuración superficial5. La localización más común es en EEII.
Algunos pacientes pueden presentar síntomas sistémicos, probablemente secundarios a la respuesta inflamatoria e inmunológica ante las toxinas estreptocócicas. Una minoría desarrolla sepsis severa, gangrena local o fascitis necrosante.
En la práctica clínica es difícil distinguir ambas, e incluso pueden coexistir ambos procesos. Algunos clínicos, sobre todo en Europa, consideran que son sinónimos (erisipela correspondería a una celulitis superficial)6. Por lo tanto, en esta revisión consideraremos que el término de celulitis incluye a las erisipelas.
Factores predisponentesLocales- -
Intertrigo interdigital: principal puerta de entrada clínicamente evidente. El reservorio bacteriano suele ubicarse en los espacios interdigitales, colonizados por Streptococcus o por Staphylococcus aureus7,8. El 77% de los pacientes con celulitis tienen una puerta de entrada: una infección fúngica superficial9 puede ser esa puerta hasta en un 50% de ellos.
Las dermatomicosis son un factor de riesgo significativo para celulitis (OR 2,4; p<0,001); como son individualmente tiña interdigital de los pies (OR 3,2; p<0,001), tiña plantar de los pies (OR 1,7 p=0,005) y onicomicosis (OR 2,2 p<0,001)10.
- -
Disrupción cutánea previa: ulceración, trauma, edema, radioterapia o dermatosis11.
- -
Insuficiencia venosa: dermatitis de estasis, úlceras venosas y linfedema.
- -
Linfedema-disección de ganglios linfáticos (cirugía de cáncer de mama)12-anormalidades linfáticas.
- -
Celulitis previa: un episodio de celulitis en EEII tiene una tasa de recurrencia anual de 8-20% en los siguientes 1-3 años, especialmente en el mismo lugar13.
- -
Safenectomía previa: la infección puede ocurrir precozmente poscirugía o hasta años después (promedio de 8-10 meses)6.
- -
Ubicación: el área pretibial predispondría a episodios recurrentes13.
- -
Obesidad: se asocia a insuficiencia venosa, drenaje linfático alterado, aumento de la fragilidad cutánea e higiene deficiente.
- -
Otros: tabaco (factor de riesgo para recurrencias), diabetes mellitus, alcoholismo, inmunosupresión e historia de cáncer. Se ha descrito susceptibilidad genética6,12,14.
La celulitis resulta de la invasión bacteriana directa a través de la barrera cutánea alterada, con compromiso variable de tejido blando. Excepcionalmente la causa es una bacteriemia desde otro sitio de infección, sobre todo en inmunosuprimidos.
A pesar de la gran heterogeneidad en los estudios que intentan definir la microbiología, se asume que, en una celulitis de EEII típica, Staphylococcus aureus causa aproximadamente el 10% de los casos y varias cepas de Streptococcus (principalmente Streptococcus betahemolítico grupo G, seguido del grupo A) causan entre el 75 y el 80%15,16. Estos producen varias toxinas tales como estreptocinasa y ADNsa B,lo que puede generar una marcada reacción inflamatoria. Pocos casos serían causados por infección simultánea de los anteriores, por gramnegativos o por Enterococcus.
En erisipela, los hemocultivos fueron positivos para Streptococcus del grupo G como el germen más frecuentemente aislado, seguido de SGA17.
Se deben sospechar agentes causales inusuales en los siguientes escenarios:
- -
Diabéticos con úlceras crónicas: sospechar anaerobios y gramnegativos18.
- -
Crépitos o secreción grisácea de mal olor: sospechar anaerobios (Clostridium perfringens, Bacteroides fragilis, Peptostreptococcus spp. y Prevotella spp.). Estos casos requieren desbridamiento quirúrgico y antibióticos15.
- -
Tras la disección de ganglios linfáticos pélvicos: sospechar Streptococcus agalactiae19.
- -
Inmunocomprometidos, enfermedades reumatológicas, daño hepático crónico, síndrome nefrótico: sospechar gramnegativos, Streptococcus pneumoniae20 y Criptococcus neoformans (con casos anecdóticos)21.
- -
Exposiciones especiales: en mordeduras de perros y gatos sospechar Capnocytophaga canimorsus y Pasteurella multocida (celulitis rápidamente progresiva, en general con linfangitis); en mordeduras humanas o lesiones de puño, Eikenella corrodens22; en climas tropicales, ingesta de mariscos e inmersión en agua de mar, Vibrio vulnificus23; si inmersión en agua fresca y contacto con sanguijuelas, Aeromonas spp.; si manipulación de pescado o carne cruda, Erysipelothrix rhusiopathiae (erisipeloide)24.
- -
Niños con celulitis periorbitaria-orbitaria: en recién nacidos y menores de 3 meses sospechar Streptococcus betahemolítico grupo B; en menores de 5 años, Streptococcus pneumoniae y Haemophilus influenzae B (disminución de su incidencia con la introducción de la vacuna); en mayores de 5 años, Staphylococcus aureus y Streptococcus betahemolítico grupo A25.
- -
-Niños con celulitis perianal: sospechar Streptococcus betahemolítico grupo A26.
El diagnóstico se basa en las manifestaciones clínicas. El recuento de glóbulos blancos, VSG y PCR generalmente están elevados, pero valores normales no descartan el diagnóstico. Los hemocultivos son positivos en<5% de los casos y se solicitan solo en aquellos pacientes que presentan toxicidad sistémica, inmunosupresión o enfermedad muy extensa6,27,28. Infecciones purulentas como pústulas y abscesos deben ser drenadas y cultivadas. Otra aproximación para determinar la causa es la detección de respuesta inmunológica sistémica a los antígenos del Streptococcus (A, C y G) mediante la detección de anticuerpos antiestreptolisina O, antideoxirribonucleasa B y antihialuronidasa; se encuentra evidencia de infección estreptocócica reciente hasta en el 70% de los casos de celulitis de EEII29.
TratamientoMedidas generalesManejo de factores predisponentes, elevación del área afectada, hidratación de la piel (restauración de la barrera cutánea).
Medicamentos antiinflamatorios- -
Antiinflamatorios no esteroideos (AINE): el uso de ibuprofeno 400 miligramos (mg) cada 6 h por 5 días asociado a los antibióticos podría ayudar a la resolución más rápida de la celulitis30. Cabe destacar que los AINE pueden enmascarar una infección necrosante profunda.
- -
Corticoides: agregar prednisolona por 8 días al tratamiento con penicilina lograría una resolución más rápida, cambio más precoz del antibiótico intravenoso al oral, menor duración de la hospitalización y eventualmente menor tasa de recurrencia durante un año de seguimiento31.
Estos hallazgos requieren corroborarse con más estudios.
AntibióticosEl tratamiento de la celulitis son los antibióticos sistémicos, ya sea por vía oral o parenteral. Varias guías europeas recomiendan el uso de penicilina (PNC) como tratamiento estándar, asumiendo que el principal agente patógeno es el Streptococcus. Sin embargo, existen pocos estudios que permitan confirmar este abordaje.
Con el tratamiento antibiótico, los patógenos mueren rápidamente, liberando toxinas y enzimas que serían responsables del aparente empeoramiento clínico inicial caracterizado por mayor inflamación cutánea y fiebre, lo que no debe confundirse con fallo del tratamiento6. Se suele observar mejoría clínica en las primeras 24-48 h y hasta 72 h postinicio de tratamiento antibiótico.
La mayoría de los pacientes desarrollan celulitis leves y pueden tratarse con antibióticos por vía oral. Los antibióticos parenterales se recomiendan en pacientes con signos de toxicidad sistémica, inmunocomprometidos, con eritema rápidamente progresivo o persistencia o progresión de síntomas a las 48-72 h a pesar de la terapia estándar. Los recién nacidos y menores de 5 años, quienes presentan más frecuentemente celulitis periorbitaria y orbitaria, en general requieren hospitalización y terapia intravenosa32. La clasificación utilizada por Eron considera la gravedad de las señales locales y sistémicas y síntomas de infección, además de la presencia de inestabilidad clínica y de comorbilidades. Esta clasificación ayuda a tomar decisiones para evaluar hospitalización, tratamiento antibiótico y su vía de administración (tabla 1)33.
Clasificación de Eron para pacientes con infección de piel y tejidos blandos
| Clasificación | Características del paciente |
|---|---|
| 1 | Afebril y sano (aparte de celulitis) |
| 2 | Febril y con compromiso del estado general, pero sin comorbilidades inestables o sin compromiso del estado general, pero con una comorbilidad que podría complicar la infección |
| 3 | Apariencia tóxica o, al menos, una comorbilidad inestable o en riesgo de amputación del miembro afectado |
| 4 | Sepsis/SIRSa, o con infección que amenace la vida, por ejemplo fascitis necrosante |
La duración de la terapia debe ser individualizada. Generalmente se recomiendan 5 días en pacientes con celulitis no complicadas y hasta incluso 14 días en infecciones severas o de lenta respuesta a tratamiento26.
Para alérgicos a la PNC, la recomendación habitual es eritromicina o clindamicina.
El Manual de antibioterapia y control de infecciones para uso hospitalario de la Facultad de Medicina de la Pontificia Universidad Católica propone como primera línea el tratamiento con un gramo de cefazolina cada 8h intravenoso y pasar a 500mg de cefadroxilo cada 12 h vía oral hasta completar 10-15 días para celulitis y 7-10 días para erisipela34.
El abordaje recomendado actualmente para seleccionar el esquema antibiótico depende de la presentación clínica de la celulitis: purulenta y no purulenta5,29.
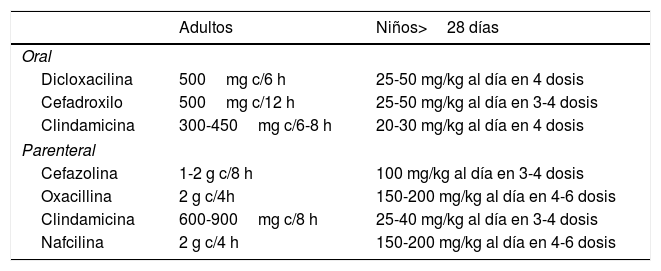
Celulitis no purulentaSon celulitis que se presentan sin exudado purulento y sin abscesos asociados. Deben ser tratadas con terapia empírica que cubra Streptococcus betahemolítico y Staphylococcus aureus meticilinsensible (tabla 2).
Tratamiento empírico para celulitis no purulentas (excluye SAMR)
| Adultos | Niños>28 días | |
|---|---|---|
| Oral | ||
| Dicloxacilina | 500mg c/6 h | 25-50 mg/kg al día en 4 dosis |
| Cefadroxilo | 500mg c/12 h | 25-50 mg/kg al día en 3-4 dosis |
| Clindamicina | 300-450mg c/6-8 h | 20-30 mg/kg al día en 4 dosis |
| Parenteral | ||
| Cefazolina | 1-2 g c/8 h | 100 mg/kg al día en 3-4 dosis |
| Oxacillina | 2 g c/4h | 150-200 mg/kg al día en 4-6 dosis |
| Clindamicina | 600-900mg c/8 h | 25-40 mg/kg al día en 3-4 dosis |
| Nafcilina | 2 g c/4 h | 150-200 mg/kg al día en 4-6 dosis |
En los casos con infección no complicada, sin manifestaciones sistémicas ni comorbilidades, podría indicarse monoterapia con trimetoprim/sulfametoxazol; su eficacia sería comparable a la de la clindamicina35.
En neonatos generalmente se requiere hospitalización e inicio de terapia empírica parenteral con vancomicina+cefotaxima o gentamicina (cobertura de Streptococcus betahemolítico grupo B, otros grupos y Staphyloccocus aureus meticilinrresistente [SAMR])29.
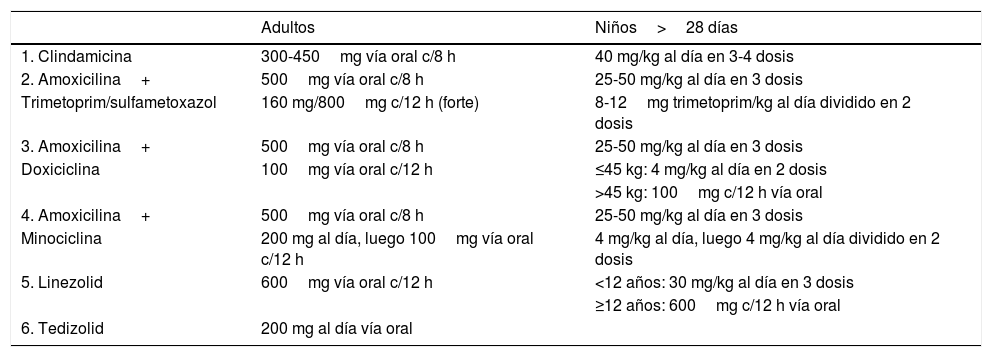
Las opciones terapéuticas si se sospecha Streptococcus betahemolítico+SAMR están descritas en la (tabla 3).
Tratamiento empírico para celulitis por Streptococcus betahemolítico+SAMR
| Adultos | Niños>28 días | |
|---|---|---|
| 1. Clindamicina | 300-450mg vía oral c/8 h | 40 mg/kg al día en 3-4 dosis |
| 2. Amoxicilina+ | 500mg vía oral c/8 h | 25-50 mg/kg al día en 3 dosis |
| Trimetoprim/sulfametoxazol | 160 mg/800mg c/12 h (forte) | 8-12mg trimetoprim/kg al día dividido en 2 dosis |
| 3. Amoxicilina+ | 500mg vía oral c/8 h | 25-50 mg/kg al día en 3 dosis |
| Doxiciclina | 100mg vía oral c/12 h | ≤45 kg: 4 mg/kg al día en 2 dosis |
| >45 kg: 100mg c/12 h vía oral | ||
| 4. Amoxicilina+ | 500mg vía oral c/8 h | 25-50 mg/kg al día en 3 dosis |
| Minociclina | 200 mg al día, luego 100mg vía oral c/12 h | 4 mg/kg al día, luego 4 mg/kg al día dividido en 2 dosis |
| 5. Linezolid | 600mg vía oral c/12 h | <12 años: 30 mg/kg al día en 3 dosis |
| ≥12 años: 600mg c/12 h vía oral | ||
| 6. Tedizolid | 200 mg al día vía oral |
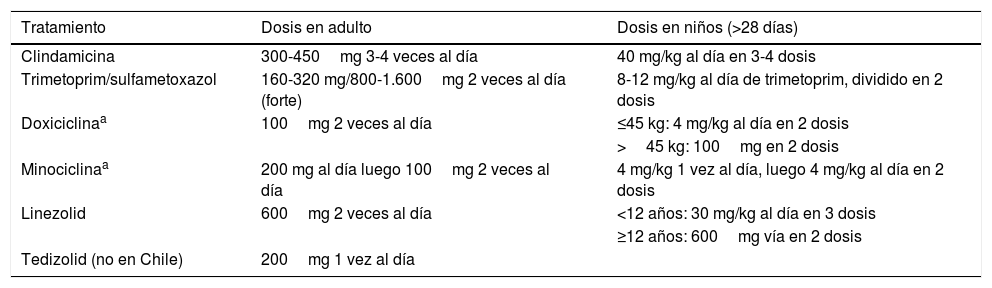
Son celulitis asociadas a exudado purulento, en ausencia de absceso drenable. Ante la presencia de pus, se asume que la causa es atribuible a Staphylococcus aureus.
Estas infecciones deben ser tratadas con terapia empírica que cubra SAMR mientras se esperan los resultados del cultivo. Esto debido al aislamiento de hasta un 59% de SAMR en este tipo de celulitis36. Se recomienda no usar quinolonas por alta resistencia (tablas 4 y 5).
Tratamiento vía oral para celulitis por SAMR-AC
| Tratamiento | Dosis en adulto | Dosis en niños (>28 días) |
|---|---|---|
| Clindamicina | 300-450mg 3-4 veces al día | 40 mg/kg al día en 3-4 dosis |
| Trimetoprim/sulfametoxazol | 160-320 mg/800-1.600mg 2 veces al día (forte) | 8-12 mg/kg al día de trimetoprim, dividido en 2 dosis |
| Doxiciclinaa | 100mg 2 veces al día | ≤45 kg: 4 mg/kg al día en 2 dosis |
| >45 kg: 100mg en 2 dosis | ||
| Minociclinaa | 200 mg al día luego 100mg 2 veces al día | 4 mg/kg 1 vez al día, luego 4 mg/kg al día en 2 dosis |
| Linezolid | 600mg 2 veces al día | <12 años: 30 mg/kg al día en 3 dosis |
| ≥12 años: 600mg vía en 2 dosis | ||
| Tedizolid (no en Chile) | 200mg 1 vez al día |
Tratamiento vía parenteral para celulitis por SAMR-AC
| Tratamiento | Dosis de adulto |
|---|---|
| Vancomicina | 15-20 mg/kg dosis cada 8-12 h (máx 2 g/dosis) |
| Daptomicina | 4 mg/kg 1 vez al día; si bacteriemia: 6 mg/kg una vez al díaa |
| Tigeciclina | 100 mg al día por una vez, luego 50mg c/12 h |
| Linezolid | 600mg 2 veces al día |
Una infección por SAMR adquirido en la comunidad (AC) se define como cualquier infección por SAMR diagnosticada en un paciente ambulatorio o dentro de las 48 h de hospitalización y que no presente los siguientes factores de riesgo asociados: hemodiálisis, cirugía, hospitalización durante el año anterior, presencia de una sonda permanente o de un dispositivo percutáneo al momento del cultivo o aislamiento previo de SAMR37.
Estas cepas se caracterizan por tener mayor virulencia, rápida duplicación y diseminación, producir frecuentemente exfoliatinas y enterotoxinas, además de no ser multirresistentes (solo son resistentes a los betalactámicos). Además, más del 90% de los casos de SAMR-AC tienen la capacidad de producir la leucocidina de Panton-Valentine, una citotoxina que provoca destrucción de los leucocitos y necrosis tisular, lo que facilita la producción de abscesos.
Clínicamente debe sospecharse en casos refractarios a tratamiento, formas agresivas, enfermedad sistémica, recurrencias, episodio previo de infección por SAMR, factores de riesgo para SAMR y en pacientes que hayan viajado a zonas endémicas.
Las manifestaciones pueden incluir infecciones de piel y partes blandas muy diversas, desde celulitis hasta neumonía necrosante rápidamente progresiva o sepsis severa38.
Los factores de riesgo para colonización por SAMR son: hospitalización reciente, pacientes institucionalizados, tratamiento antibiótico reciente, infección por VIH, hombres que tienen sexo con hombres, uso de fármacos inyectables, pacientes en hemodiálisis, encarcelamiento, servicio militar, compartir agujas, cuchillas de afeitar u otros objetos afilados, compartir material deportivo, diabetes, estancia prolongada en centro hospitalario y crianza de cerdos39. Se recomienda considerar cobertura adicional para SAMR-AC en pacientes con factores de riesgo para infección por este agente y en poblaciones en las que la prevalencia de este sea mayor al 30%29,40,41.
En Chile se ha observado un aumento de la incidencia de SAMR-AC38,42,43.
Durante los años 2017 y 2018 se está desarrollando en la Universidad Católica un protocolo de investigación con la finalidad de medir la presencia de SAMR en alumnos de Medicina; los resultados preliminares serán publicados prontamente.
Existen antibióticos nuevos como telavancin, tedizolid, dalbavancin y oritavancin que podrían ser una opción para tratar infecciones de piel y tejidos blandos, incluyendo celulitis por SAMR29,44,45. Telavancin fue aprobado por la FDA en 2009 y ha demostrado no ser inferior a la vancomicina, pero tiene mayor riesgo de nefrotoxicidad45.
La FDA en 2014 aprobó el uso de tedizolid y dalbavancin. Tedizolid es una oxazolidinona con actividad contra bacterias grampositivas, incluido SAMR. Una dosis diaria de tedizolid oral no sería inferior a linezolid cada 12h44.
Dalbavancin es un lipoglicopéptido de segunda generación que se administra una vez a la semana y cubre SAMR45.
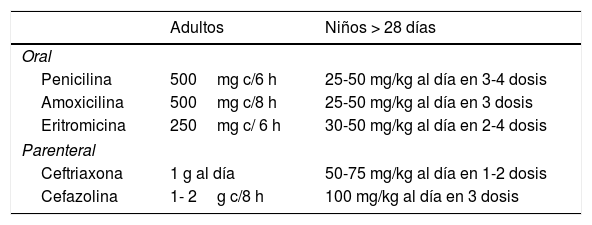
ErisipelaEn aquellos pacientes en los que se puedan diferenciar manifestaciones clásicas de erisipela, se recomienda cobertura solo para Streptococcus betahemolítico29 (tabla 6).
Tratamiento de la erisipela
| Adultos | Niños > 28 días | |
|---|---|---|
| Oral | ||
| Penicilina | 500mg c/6 h | 25-50 mg/kg al día en 3-4 dosis |
| Amoxicilina | 500mg c/8 h | 25-50 mg/kg al día en 3 dosis |
| Eritromicina | 250mg c/ 6 h | 30-50 mg/kg al día en 2-4 dosis |
| Parenteral | ||
| Ceftriaxona | 1 g al día | 50-75 mg/kg al día en 1-2 dosis |
| Cefazolina | 1- 2g c/8 h | 100 mg/kg al día en 3 dosis |
A pesar de que la mayoría de los casos de celulitis son tratables exitosamente con antibióticos, se pueden producir complicaciones a largo plazo.
Las complicaciones más frecuentes son:
- -
Edema persistente: hasta en uno de cada 10 pacientes hospitalizados46.
- -
Úlceras venosas.
- -
Recurrencia: entre el 25 y el 46% de los pacientes hospitalizados presentan episodios recurrentes de celulitis en los primeros 3 años46,47, mientras que aproximadamente el 11% de los tratados ambulatoriamente presentan una recurrencia al año de seguimiento3.
La fascitis necrosante es una infección de piel y tejidos blandos que es rápidamente progresiva y destructiva, con una mortalidad de hasta un 50% de los casos48. Puede simular una celulitis con extenso eritema de la piel, aunque la piel inicialmente puede no estar comprometida. Se presenta con dolor desproporcionado a hallazgos clínicos, edema, necrosis de la piel, ampollas, entumecimiento cutáneo, fiebre o crépitos. Es importante reconocer esta entidad, dado que requiere tratamiento pronto con antibióticos y manejo quirúrgico con desbridamiento48,49.
Celulitis recurrenteEn casos de celulitis recurrente se propone iniciar tratamiento antibiótico supresivo en aquellos pacientes con celulitis recurrente más factores predisponentes que no puedan corregirse29,50.
Dentro de las opciones de profilaxis propuestas en la literatura están: PNC benzatina intramuscular (1.200.000 UI mensual 600.000 UI en pacientes con peso ≤27kg), PNC vía oral (250-500mg 2 veces al día), profilaxis para infección estafilocócica con clindamicina (150mg al día, inusualmente necesaria en niños).
Pacientes con IMC ≥ 33, múltiples episodios previos de celulitis o linfedema tendrían peor respuesta a profilaxis51.
Algunos clínicos recomiendan guiar la decisión con el resultado de test serológicos para Streptococcus betahemolítico: ASO, anti-ADNsa B o antihialuronidasa (los 2 últimos son más confiables que el ASO postinfección cutánea por Streptococcus betahemolítico grupo A)52.
Desde el 2012 está disponible el protocolo de la revisión Cochrane Interventions for the prevention of recurrent erisipelas and cellulitis, sin resultados publicados a la fecha53.
ConclusionesEs fundamental reconocer las manifestaciones y factores predisponentes en el abordaje de la celulitis. Proponemos buscar y tratar las posibles puertas de entrada, como la tiña de los pies y la interdigital.
Es importante conocer los algoritmos de abordaje, ya que esto permitirá orientar el tratamiento de manera precoz y más efectiva, considerando que el abordaje terapéutico debe ser integral para lograr una terapia efectiva.
Por último, debemos identificar y tratar precozmente las complicaciones y recurrencias, seleccionando a aquellos pacientes candidatos a iniciar tratamiento antibiótico supresivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.