La infección por el virus del molusco contagioso es un problema común en la consulta dermatológica; así, en un estudio realizado en Madrid en el año 1993, el 0,3 % de los pacientes derivados al dermatólogo desde atención primaria estaba afectado por esta patología 1 . En la población general y por medio de análisis de inmunoabsorción ligado a enzimas (ELISA), la seropositividad global alcanza niveles del orden del 25 % 2 , con dos picos de incidencia, infantil y adulto joven. El molusco contagioso es un virus miembro de la familia de los Poxvirus que se transmite por contacto directo piel a piel o por fomites. Es común el autocontagio, con la aparición de numerosas lesiones, así como el contagio entre familiares. La infección en huéspedes inmunocompetentes sigue un curso autolimitado, y se resuelve sin terapia específica en el plazo de 2 a 4 años. Por este motivo, una actitud coherente en el tratamiento de esta infección consistiría en no aplicar ningún tratamiento; sin embargo, la preocupación de padres y cuidadores por motivos estéticos o epidemiológicos (limitar los contagios) origina la demanda de tratamiento.
No existe terapia antiviral específica para el virus del molusco contagioso (VMC) y aunque se ha usado el cidofovir con éxito en pacientes infectados por el virus de la inmunodeficiencia humana (VIH), los métodos destructivos, fundamentalmente curetaje y crioterapia, son los que se utilizan con más frecuencia. Ambas modalidades, aunque muy eficaces, ven limitada su aplicación por el dolor y el trauma emocional que suponen, pues la mayoría de los casos corresponden a la población pediátrica.
La cantaridina, un vesicante obtenido del extracto de escarabajos del orden Coleoptera , se ha utilizado de forma tradicional fundamentalmente como abortivo y como afrodisíaco. En dermatología se ha empleado desde la década de 1950 para el tratamiento de las verrugas vulgares y de las infecciones cutáneas por molusco contagioso. Un reciente artículo3 ha llamado la atención sobre la utilidad de esta terapia como tratamiento de aplicación indolora y elevada eficacia en las infecciones por VMC en niños, zanjando así una larga polémica sobre el cociente riesgo/beneficio en el uso tópico de la cantaridina4 .
El estudio de Silverberg et al3 y la ausencia de estudios sobre el tema en la literatura dermatológica europea nos animó a probar la eficacia y seguridad de la aplicación tópica de la cantaridina para tratar las lesiones de molusco contagioso en nuestra área.
MATERIAL Y MÉTODOS
De forma prospectiva, de enero a diciembre del año 2001, se incluyeron 28 pacientes sucesivos con infección por VMC en un protocolo de tratamiento específico con cantaridina tópica. El servicio de farmacia del hospital proporcionó una solución de cantaridina al 0,7 % obtenida al mezclar 52,5 mg de cantaridina Acopharma con 7,5 ml de colodión flexible. La cantaridina se aplicó utilizando una jeringa de insulina, que permitía aplicar con precisión una pequeña gota de colodión en la lesión de molusco contagioso, minimizando el contacto con la piel sana perilesional. Se recomendó no tratar más de 30 lesiones por sesión y evitar la aplicación en lesiones perioculares. Los pacientes, o sus padres, según la edad, recibieron instrucciones de lavar las lesiones con agua abundante 4 a 6 h después de la aplicación, o antes si sentían molestias o comenzaba a aparecer la vesiculación. Asimismo se recomendó el uso de povidona yodada o soluciones de clorhexidina con el fin de evitar la sobreinfección.
A las 3 o 4 semanas se realizaban visitas de control, repitiéndose la terapia si no habían cedido todas las lesiones o si habían aparecido otras. El protocolo incluía recabar datos demográficos de los pacientes, tiempo de evolución de la dermatosis, número y distribución de lesiones, número de tratamientos y respuesta, tolerancia y efectos secundarios. Al final de la última visita se realizó una encuesta de satisfacción.
RESULTADOS
Se incluyeron 28 pacientes, 15 mujeres y 13 varones. Las edades oscilaron entre los 3 y los 43 años, distribuidas en dos grupos de edad, 21 niños con menos de 12 años (media: 6) y 7 adultos con más de 20 años (media: 29). El tiempo de evolución de las lesiones osciló entre 3 semanas y 2 años (media: 5,7 meses).
El número total de lesiones tratadas en un paciente determinado varió entre 1 y 53, con una media de 16 lesiones. Las localizaciones más frecuentes fueron el tronco (11 casos) y las extremidades (ocho en las superiores y ocho en las inferiores). Las lesiones se localizaban en genitales-ingles en 6 casos; en cuatro, en axilas, y en tres, en cara o cuello.
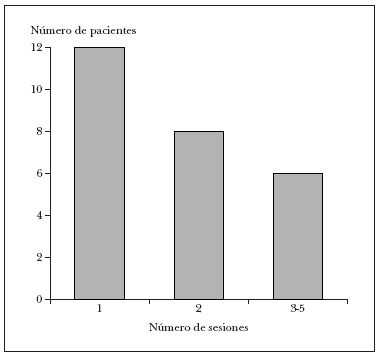
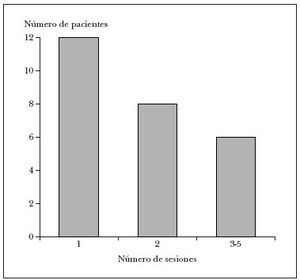
Dos pacientes se perdieron en el seguimiento tras la primera revisión y en los 26 restantes se pudo constatar la curación, y precisaron entre 1 y 5 tratamientos (media: 1,96 sesiones de aplicación de cantaridina). Así, 12 pacientes (46 %) requirieron una única sesión de aplicación de cantaridina; 8 pacientes (31 %), dos sesiones, y sólo seis precisaron (23 %) entre tres y cinco sesiones (fig. 1).
Fig. 1.Número de sesiones de tratamiento requeridas para la curación total (sólo 6 de 26 pacientes requirieron más de dos sesiones).
En relación a los efectos secundarios, el 93 % (26/28) experimentó vesiculación, y en el 73 % (19 de 26 casos) hubo inflamación, que fue generalmente leve (14/19). El tratamiento provocó síntomas en una tercera parte de los casos; así, el 33 % experimentó prurito (9/28) y el 36 %, dolor leve (molestia 10/28). Se produjo hipopigmentación leve en 10 de 28 casos, pero en ningún caso se observó cicatrización. El grado de satisfacción con el tratamiento realizado en ningún caso fue bajo o muy bajo, siendo alto o muy alto para el 88 % (23/26) de los pacientes, para el 87 % (20/23) de los padres y para el 81 % (22/27) de los médicos. Los casos en que se obtuvieron resultados menos satisfactorios fueron los que precisaron mayor número de revisiones (algunos hasta seis) para la curación. Estos casos se relacionaron con presencia de numerosas lesiones, presencia de lesiones en pliegues (axilas o ingles), lo cual facilitaba el autocontagio y la recidiva, así como la existencia de antecedentes de atopia.
DISCUSIÓN
Las opciones de tratamiento del molusco contagioso son limitadas y ninguna de ellas es idónea. La más comúnmente empleada por su elevada eficacia y prácticamente nulas secuelas físicas es el curetaje, pero presenta una secuela de carácter psíquico, ya que puede ser dolorosa y ocasionar un trauma emocional en los pacientes. Se han comunicado buenos resultados con una oclusión previa con EMLA 30 min antes del cure-taje, lo que minimiza el dolor5 . La aplicación de crioterapia también resulta dolorosa, y al provocar vesiculación facilita la infección posterior. La irritación inducida por los retinoides tópicos facilita la desaparición de las lesiones, pero tiene poca eficacia y no está exenta de leves efectos secundarios. La cimetidina se ha empleado con eficacia como inmunomodulador en una serie de 13 niños6 , pero ésta no ha sido confirmada en estudios posteriores. El cidofovir ha conseguido buenos resultados en pacientes infectados por el VIH7,8 pero no se ha probado en niños sanos y su precio también limita su uso. Podofilotoxina e imiquimod9 son opciones también válidas, pero su eficacia limitada en relación al curetaje o cantaridina; tienen la ventaja de ser aplicadas por el paciente en casa por lo que pueden ser también una válida opción10 .
La cantaridina es producida de forma natural por escarabajos pertenecientes al orden Coleoptera , familia Meloidae , de los que el más común en nuestro medio es Cantharis vesicatoria o Lytta vesicatoria ; este escarabajo de llamativo color verde esmeralda se encuentra en Europa y en el Norte de Asia. Son conocidos en la literatura inglesa como blister beetle o Spanish fly , pero en España reciben el nombre vulgar de escarabajos aceiteros o curillas. Existen más de 1.500 especies de escarabajos productores de cantaridina, con extensa distribución mundial, incluyendo Mylabris spp. y Epicauta spp. La cantaridina se encuentra en todos los líquidos corporales de estos escarabajos11 ; la producen los machos de la especie como mecanismo de defensa ante predadores y se transfiere a la hembra durante la cópula. Se trata de un terpenoide incoloro e inodoro (anhídrido exo-1,2-cis -dimetil-3,6-epoxihexahi-dro-ftálico), que al ser aplicado a la piel induce la aparición de vesículas. De ahí el nombre común de este tipo de escarabajo (blister beetle)12 . Se ha descrito una dermatosis vesiculobullosa estacional por contacto con el escarabajo, y hay un interesante trabajo publicado de dermatosis autoprovocada13 .
Se ha usado el cuerpo seco de estos escarabajos, conocido como mylabris , por la medicina tradicional china durante más de 2.000 años como producto tópico para el tratamiento de forúnculos, hemorroides, úlceras y escrofuloderma, y por vía oral como abortivo y agente anticanceroso14 .
La observación de congestión pélvica en la mujer y priapismo en el varón tras la ingestión oral de la cantaridina, le ha dado una gran reputación y popularidad en todo el mundo como afrodisíaco. Aunque es poco común, se han descrito casos de intoxicaciones incluso con resultado de muerte por este uso15 .
La cantaridina tiene una estructura simple; recientemente se ha conseguido su síntesis de forma sencilla16 . La cantaridina es absorbida por las capas lipídicas de las membranas celulares epidérmicas, de forma que su aplicación sobre la epidermis resulta en la activación y/o liberación de serina proteasas neutras que provocan la degeneración de la placa desmosómica, con separación de los tonofilamentos17 . Este proceso condiciona la aparición de acantólisis y, por tanto, de vesículas intraepidérmicas, y este tipo de lesiones se curan sin dejar cicatriz.
Asimismo, la cantaridina es un potente y selectivo inhibidor de la proteína fosfatasa 2A, lo que puede explicar sus efectos inotrópicos en tejido cardiaco humano18 . El hecho de que la cantaridina induzca inflamación sin que se involucre proceso inmunológico alguno, la ha hecho útil para probar las propiedades antiinflamatorias de algunos fármacos19 . Su potente acción como inhibidor de proteína fosfatasa ha condicionado su uso en el estudio de vías bioquímicas como la esteroidogénesis20 . El supuesto efecto afrodisíaco se relaciona con sus propiedades vesicantes y, por tanto, irritativas sobre el tracto urogenital durante su excreción. El incremento del flujo sanguíneo en el área genital origina priapismo en el varón, y congestión pélvica en la mujer21 .
La cantaridina es un significativo tóxico para los seres humanos en concentraciones cercanas a las requeridas para obtener cualquier efecto irritativo. Los casos de envenenamiento, algunos de ellos mortales, como resultado de la ingestión de cantaridina no son excepcionales22 .
Los síntomas de envenenamiento por cantaridina incluyen: quemazón oral, náuseas, hemorragias del tracto gastrointestinal superior, lesión renal, convulsiones y cardiopatía 23,24 . Debido a la alta toxicidad de la cantaridina se recomienda no utilizar preparados que la contengan por vía oral con fines medicinales 25 . Una dosis de 10 mg de cantaridina pura causaría la muerte, mientras que un envenenamiento con 1 mg no tendría este resultado. En los preparados comerciales habituales en polvo existiría un 0,6 % de la sustancia y, así, la dosis fatal sería de 1,5 a 3 g de polvo. A veces se utiliza tintura de cantaridina, con lo cual una dosis de 200 ml resultaría mortal.
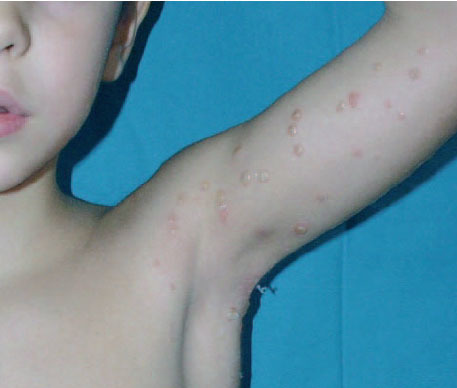
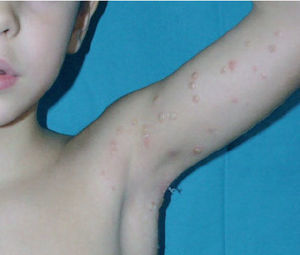
Fig. 2.Vesiculación de las lesiones de molusco contagioso tras la aplicación de cantaridina.
En la actualidad, la cantaridina se utiliza en la investigación biomédica, donde tiene un importante papel por su potente acción inhibidora de algunas fos-fatasas19,20 . Entre sus potenciales usos, posiblemente el más importante sea el de agente anticanceroso. Su actividad se ha constatado frente a distintos procesos neoplásicos, siendo un potente inhibidor del crecimiento de células de carcinoma hepatocelular26 . A pesar de ello, su utilización clínica se encuentra limitada por su elevada toxicidad renal, lo que está llevando al desarrollo de derivados como la norcantaridina27 , también con actividad anticancerígena, e incluso estimulación de médula ósea, pero con nula o baja toxicidad renal28 .
La cantaridina se utilizó en EE.UU. ampliamente por dermatólogos desde la década de 1950 para el tratamiento de molusco contagioso29 y verrugas vulgares30 . En 1970 fue retirada del mercado por la existencia de alternativas más seguras, pero en 1998, la Food and Drug Administration (FDA) la readmitió para «uso tópico administrado en la clínica por el pro-fesional»31 .
Se ha publicado una serie de 300 niños con molusco contagioso tratados tópicamente con cantaridina al 0,7 % 3 . Los tratamientos se repetían a intervalos de 2-4 semanas hasta la total desaparición de las lesiones, y resultaron muy efectivos, pues fueron necesarias de media sólo 2,1 aplicaciones para obtener la curación total del 90 % de los niños y una gran mejoría en el 8 %. Nuestros resultados concuerdan con éstos, ya que la media de tratamientos necesarios para la desaparición total de las lesiones fue de 1,96. El 46 % sólo requirió una sesión; el 31 %, dos, y el 23 %, entre dos y cinco. Es inherente a la propia terapia la aparición de vesiculación (fig. 2) en el área tratada, que aparece a las 24-48 h de la aplicación y en el 90 % de los casos, pero la inflamación que la acompaña suele ser discreta, de forma que sólo se considera molesta (dolor o prurito leves) en un tercio de los casos. Estas molestias se inician entre 4 y 6 h después de la aplicación de la cantaridina.
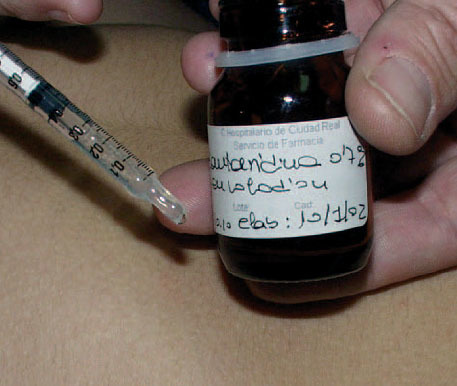
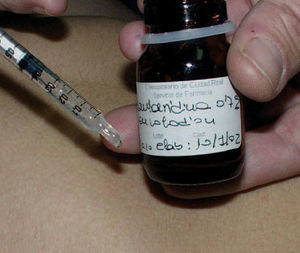
Fig. 3.Aplicación de cantaridina con una jeringa de insulina.
Las complicaciones son excepcionales si el uso es correcto, es decir, si se aplica únicamente en la lesión y se retira con agua abundante y jabón en 2 a 6 h. Otros autores aconsejan la aplicación con un simple palillo 32,33 o con un bastoncillo de algodón 3 , pero nosotros hemos tenido muy buen resultado utilizando una jeringa de insulina, lo que permite tratar numerosas lesiones aplicando una pequeña gota sobre éstas (fig. 3) sin necesidad de reintroducir el aplicador en el recipiente. Las curación de las lesiones vesiculocostrosas se producen entre 4 y 7 días, y no dejan cicatriz, aunque es común la hipopigmentación postinflamatoria. Destaca que los efectos secundarios más llamativos se observan cuando se aplica en flexuras, localización donde es mucho más frecuente la recidiva por autocontagio.
No se aconseja aplicarla en mucosas y en ningún caso en la conjuntiva o en el borde libre del párpado; si se tratan lesiones genitales se debe ser especialmente cuidadoso aplicando mínimas cantidades 30 . Siempre debe ser aplicado por el médico en la consulta ya que, si el uso es incorrecto, puede originar importantes reacciones ampollosas 32 y la ingesta accidental puede ser mortal. Aun así es destacable que en 1971 un fabricante comunicase que tras la venta de más de 1.500.000 ml de una solución de cantaridina al 0,7 % para el tratamiento de las verrugas vulgares y en un periodo de 10 años no se hubiera comunicado ningún caso de toxicidad sistémica 34 .
Correspondencia:
Guillermo Romero. Castillo de Caracue, 30. 13197 Ciudad Real. España. gromeroa@meditex.es
Recibido el 13 de abril de 2004. Aceptado el 8 de septiembre de 2004.