La dermatitis atópica (DA) incluye formas graves que pueden ser refractarias a varios tratamientos sistémicos. Mofetil micofenolato (MMF) ha demostrado ser útil en pacientes con formas graves de DA y produce menos efectos secundarios que el tratamiento a largo plazo con ciclosporina o corticosteroides orales.
ObjetivosValorar la eficacia y los efectos adversos del MMF en pacientes con DA grave del adulto refractaria a otros tratamientos sistémicos en nuestra Unidad de Alergia Cutánea.
MétodosRealizamos un estudio retrospectivo de 8 pacientes con DA grave del adulto tratados con MMF. Analizamos las características basales y los tratamientos previos utilizados por los pacientes, así como los resultados y efectos secundarios obtenidos tras el empleo de MMF.
ResultadosCinco pacientes tratados con MMF presentaron mejoría en la cuarta semana de tratamiento. Además, en 5 de 8 pacientes se consiguió una clara mejoría de la DA a largo plazo. En uno de ellos se logró una remisión de la DA, lo que permitió la retirada de MMF y después de 4 meses sin tratamiento permanece estable y sin recaídas. Los cuatro restantes siguen con terapia de mantenimiento. Tres pacientes continuaron con brotes agudos frecuentes de DA a pesar de haber mantenido el tratamiento con MMF entre 16-72 semanas. Todos los pacientes toleraron el tratamiento con escasos efectos secundarios.
ConclusionesMMF puede ser una opción eficaz en pacientes seleccionados con formas graves de DA. Aunque MMF no produce una respuesta tan rápida como la que se obtiene con ciclosporina o con corticoides orales, permite un tratamiento mantenido, con buen control clínico y escasos efectos secundarios.
Atopic dermatitis (AD) includes severe forms that can be refractory to various systemic treatments. Mycophenolate mofetil (MMF) has been found to be useful in patients with severe forms of AD and to have fewer side effects than long-term treatment with oral corticosteroids or cyclosporine.
ObjectivesTo evaluate the efficacy and adverse effects of MMF in patients seen in our skin allergy unit with severe adult AD refractory to other systemic treatments.
MethodsWe performed a retrospective study of 8 patients with severe adult AD treated with MMF, analyzing the baseline characteristics, previous treatments used by the patients, and the outcome and adverse effects of treatment with MMF.
ResultsFive patients treated with MMF showed improvement in the fourth week of treatment. In addition, 5 of the 8 patients presented a clear, long-term improvement in their disease. Remission of AD occurred in 1 patient, making it possible to discontinue MMF; this patient remains stable with no relapses after 4 months without treatment. The other 4 patients continue on maintenance therapy. Three patients continued to have frequent acute outbreaks of AD despite treatment with MMF for 16 to 72 weeks. All patients tolerated the treatment and there were few adverse effects.
ConclusionsMMF can be an effective option in selected patients with severe forms of atopic dermatitis. Although the response is not as rapid as with oral corticosteroids or cyclosporine, it can be used for maintenance treatment with good clinical control and few adverse effects.
La dermatitis atópica (DA) es una enfermedad inflamatoria crónica que afecta a un 2-17 % de la población. Los corticoides e inmunomoduladores tópicos con frecuencia controlan las formas leves. Sin embargo, las formas graves suelen necesitar la utilización de corticoides orales o inmunosupresores tales como azatioprina y ciclosporina, que tienen importantes efectos secundarios que pueden limitar su uso a largo plazo. Por este motivo, al igual que con la psoriasis, se impone la necesidad de establecer una terapia rotatoria entre las diferentes opciones terapéuticas, combinándolas de forma individual según el paciente.
Mofetil micofenolato (MMF) es un inmunosupresor utilizado en personas trasplantadas que actúa selectivamente sobre los linfocitos suprimiendo la síntesis de novo de purinas. Aunque no está aprobado por la Food and Drug Administration (FDA) para el tratamiento de la DA, se ha mostrado su eficacia en diferentes publicaciones, y con menos efectos adversos a largo plazo que con los corticoides orales o con ciclosporina 1.
Presentamos nuestra experiencia en 8 pacientes con formas graves de DA tratados con MMF.
Sujetos y métodoDurante los últimos 18 meses hemos atendido en nuestra Unidad de Alergia Cutánea a 25 pacientes con DA grave del adulto. En este grupo se seleccionaron 8 pacientes con DA grave tratados con MMF. La gravedad fue valorada según el índice SCORAD 2 y definida por una puntuación superior a 50. Todos los pacientes habían recibido tratamientos tópicos con corticoides sistémicos o inmunosupresores, que habían fracasado o experimentado efectos secundarios. Realizamos un estudio retrospectivo analizando las características basales, los resultados y los efectos secundarios observados.
En tres pacientes utilizamos una dosis de inicio de MMF de 500mg/12 horas, pero dada la respuesta lenta y la buena tolerancia decidimos aumentar la dosis de inicio en los otros 5 pacientes a 750mg-1g/12 horas según el peso del paciente. En todos los pacientes se realizó una valoración en las primeras 4-6 semanas y periódicamente cada 6 semanas, manteniendo el tratamiento dependiendo de la respuesta, valorada según el índice SCORAD.
ResultadosOcho pacientes fueron tratados con MMF: 6 hombres y dos mujeres. La edad media fue de 35 años. El índice SCORAD inicial fue de 70,57 (± 13,96). Todos los pacientes, excepto uno, presentaban dermatitis atópica desde la infancia, y todos ellos habían sido tratados con corticoides sistémicos por brotes frecuentes. Además, se habían utilizado otros tratamientos sistémicos que habían fracasado o se habían suspendido por efectos secundarios (tabla 1).
Resumen de los 8 pacientes tratados con mofetil micofenolato
| Paciente | Sexo | Edad | Inicio de la dermatitis atópica | Terapia previa | Dosis | Duración | Resultados clínicos | Efectos adversos |
| 1 | V | 33 | Infancia | CO, CSA | 1-2g/día | 8 meses | Buena respuesta | Palpitaciones |
| 2 | V | 24 | Infancia | CO, CSA, MTX | 1-2g/día | 9 meses | Respuesta inicial, no respuesta mantenida | No |
| 3 | M | 35 | Infancia | CO, CSA | 1-2g/día | 7 meses | Buena respuesta | No |
| 4 | V | 34 | Infancia | CO, UVBBE, CSA | 2g/día | 4 meses | No respuesta, eritrodermia | Foliculitis, HS |
| 5 | V | 31 | Infancia | CO, UVBBE | 1,5-2g/día | 4 meses | Escasa respuesta | Foliculitis |
| 6 | V | 15 | Infancia | CSA, CO | 1,5-2g/día | 6 meses | Buena respuesta | No |
| 7 | M | 34 | Infancia | CSA, CO, UVBBE | 1-2g/día | 7 meses | Buena respuesta | Molestias digestivas |
| 8 | V | 81 | Adulto | CO | 1g/día | 7 meses | Buena respuesta | No |
CO: corticoides orales; CSA: ciclosporina; HS: herpes simple; MTX: metotrexato; UVBBE: ultravioleta B de banda estrecha.
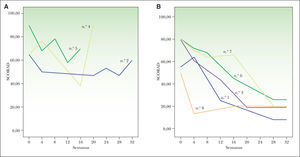
La primera visita se realizó en todos los pacientes entre las 4-6 semanas: 5 de 8 pacientes respondieron favorablemente en la primera visita. Además, dos pacientes que no habían respondido a la dosis de inicio de 500mg/12 horas en el primer control, sí presentaron una respuesta satisfactoria 4 semanas después de aumentar la dosis a 750mg-1g/12 horas. El tratamiento se mantuvo en los 8 pacientes entre 16-36 semanas; tres continuaron con brotes agudos frecuentes de DA que requirieron tratamiento con corticoides orales. El paciente número 4 (tabla 1) presentó un brote eritrodérmico de DA, por lo que se suspendió el tratamiento en la semana 16. En 5 de 8 pacientes se consiguió una clara mejoría de la DA hasta conseguir un SCORAD inferior a 25 (fig. 1). Tres de estos pacientes presentaron un SCORAD inferior a 25 en la semana 16 y en los dos restantes en las semanas 24-26. En un paciente (el número 3) se consiguió retirar MMF y no ha presentado recaídas tras 4 meses sin tratamiento. En dos pacientes (los números 1 y 8) se consiguió un buen control de la DA manteniendo MMF en dosis de 500mg/12 horas.
La mayoría de los pacientes toleró el tratamiento con escasos efectos secundarios. Los efectos secundarios observados (tabla 1) fueron náuseas, diarrea, palpitaciones, foliculitis por S. aureus y herpes simple recidivante (fig. 2). El paciente que refirió palpitaciones no presentó alteraciones en el electrocardiograma, y estas se resolvieron al disminuir la dosis a 500mg/12 horas. Los hemogramas y los estudios bioquímicos realizados, que incluyeron función renal, bioquímica hepática, electrolitos, glucemia, lactato deshidrogenasa (LDH), colesterol y triglicéridos fueron normales.
Evolución del SCORAD durante el tratamiento con mofetil micofenolato comparando los pacientes que respondieron al tratamiento y los no respondedores (numerados según la tabla 1).
El tratamiento de la DA grave del adulto continúa siendo un reto terapéutico, a pesar de la aparición de nuevas alternativas.
Existe una importante variabilidad individual en la respuesta y es muy probable que los pacientes necesiten tratamientos sistémicos en varias ocasiones y durante periodos prolongados, por lo que presentan además el riesgo de una toxicidad acumulada. La utilización de una terapia rotatoria puede ser una alternativa eficaz.
MMF es un potente inmunosupresor utilizado en personas trasplantadas y en el tratamiento de enfermedades autoinmunes 3. Actúa inhibiendo de forma selectiva y reversible la enzima inosina monofosfato deshidrogenasa, suprimiendo la síntesis de novo de purinas. La supresión de esta vía le permite inhibir selectivamente los linfocitos, ya que las otras células inflamatorias utilizan otra vía de síntesis denominada «vía natural».
Nuestra revisión del tratamiento de la DA grave del adulto en 8 pacientes ha demostrado una eficacia y tolerancia similares a las descritas por otros autores (tabla 2). La serie más amplia publicada es la Murray y Cohen 4 de 20 pacientes con DA grave del adulto tratados con MMF durante 5-200 semanas. Obtuvieron una mejoría a las 4 semanas en 17 de 20 pacientes, 10 de 20 tuvieron una remisión completa y en 7 de 20 tuvieron un buen control de la enfermedad con una terapia de mantenimiento. Heller et al 5 también han demostrado recientemente la eficacia del tratamiento con MMF para la DA grave en niños, obteniendo un aclaramiento completo de las lesiones con el tratamiento en 4 de 14, una respuesta excelente (mejoría > 90 %) en 4 de 14 y una buena respuesta (mejoría entre el 60-90 %) en 5 de 14; no encontraron respuesta en un paciente. Solamente la serie de Hansen et al 6 de 5 pacientes no encontró mejoría en ninguno de ellos. Sin embargo, nunca se aumentó la dosis de MMF por encima de 2,5g/día.
Resumen de los estudios publicados sobre el tratamiento de la dermatitis atópica con mofetil micofenolato
| N.° pacientes | Dosis de MMF | Semanas | Respuesta | Efectos adversos | |
| Murray y Cohen 20064 | 20 | 1g/12 horas | 5-200 | 17 mejoría en 4 semanas, 10 remisión completa, 7 terapia de mantenimiento | HZ (4), S. aureus (2), HS (1) |
| Satchell y Barnetson 200011 | 1 | 1.250mg × 2 | 20 | Importante mejoría inicial, pérdida de respuesta en 5 meses | Náuseas, CK, septicemia por S. aureus, endocarditis |
| Neuber et al 200417 | 10 | 2g | 12 | El 100 % mejoría en un paciente a las 12 semanas, > 75 % de mejoría en 3 y > 50 % en 6 pacientes | Náuseas (2), elevación de LDH (2), trombocitopenia (1), insomnio (1) |
| Hansen et al 20006 | 5 | 2-2,5g | 4-12 | Escasa mejoría en un paciente, sin mejoría en otro y empeoramiento en 3 | Elevación de ALT (1), náuseas (1), cefalea (1) |
| Benez y Fierlbeck 200118 | 3 | 2g | 52-116 | Respuesta completa en 3–5 semanas, uno de cada tres requiere corticoides tópicos | No |
| Grundmann-Kollman et al 20013 | 10 | 2g | 8 | Respuesta completa en 7 pacientes a las 4 semanas, recaída posterior en dos pacientes | Retinitis herpética (1) |
| Heller et al 20075 | 14 | 400mg-3g | 2-24 | El 29 % respuesta completa, el 29 % respuesta excelente (> 90 % respuesta), el 35 % buena respuesta (60–90 % mejoría) y el 7 % no respondió | Náuseas, HS y foliculitis |
| Ballester et al, 2009 | 8 | 500mg-2g | 16-36 | Presentaron mejoría clínica 5 pacientes (62,5 %), un paciente en remisión completa, sin mejoría en 3 pacientes (37,5 %) | Náuseas, palpitaciones, eccema herpeticum, HS y foliculitis (2) |
ALT: alanina transferasa; CK: creatín cinasa; HS: herpes simple; HZ: herpes zóster; LDH: lactato deshidrogenasa; MMF: mofetil micofenolato.
Respecto al tiempo de respuesta de MMF comparado con otras opciones terapéuticas, ciclosporina 7ha demostrado una eficacia en estudios aleatorizados y controlados del 59 % en 8 semanas, azatioprina 8 de un 37 % y la fototerapia 9 de un 31 % en 12 semanas. En nuestro estudio, en el grupo de pacientes que respondió al tratamiento, 3 de 5 presentaron un SCORAD inferior a 25 en la semana 16 y en los dos restantes en las semanas 24-26. Sin embargo, la respuesta fue satisfactoria con una mejoría progresiva desde la primera visita en la cuarta semana en 5 de 8 pacientes. Murray et al 4 también establecen que la mayoría de los pacientes responde en 4 semanas de tratamiento, aunque en algunos pacientes pueden ser necesarias 12 semanas de tratamiento para determinar la eficacia.
Los efectos secundarios más frecuentes suelen ser síntomas gastrointestinales como náuseas, vómitos o diarrea que se presentan en el 10-30 % de los pacientes 10. El efecto secundario más grave descrito ha sido un caso de septicemia y endocarditis por S. aureus11. Aunque el 90 % de los pacientes con DA están colonizados por S. aureus12, parece que el restablecimiento de la barrera cutánea obtenido con el tratamiento también podría actuar como factor protector, disminuyendo la incidencia de sobreinfecciones 5,13. Recientemente la FDA ha sugerido la posibilidad de una relación entre la inmunosupresión mantenida por MMF y el desarrollo de leucoencefalopatía multifocal progresiva 14.
Aunque MMF no está aprobado por la FDA para el tratamiento de la DA, se ha demostrado eficaz en pacientes con formas graves y desencadena menos efectos secundarios que el tratamiento a largo plazo con ciclosporina o corticosteroides orales 15,16. Además de las limitaciones por la toxicidad a largo plazo, no hay que olvidar que estos pacientes presentan formas graves refractarias a varios tratamientos sistémicos. MMF no es un tratamiento con respuesta tan rápida como ciclosporina o los corticoides orales. Sin embargo, presenta un tiempo de respuesta similar a otros tratamientos utilizados como metotrexato, fototerapia o azatioprina. Por lo tanto, MMF puede ser una opción más de tratamiento mantenido a largo plazo en formas graves de DA. A pesar de las limitaciones de nuestro estudio retrospectivo y sin un grupo control, concluimos que MMF puede ser útil en pacientes seleccionados con una monitorización estrecha por el riesgo de infecciones.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.