Sr. Director:
La capecitabina es un agente antineoplásico de la familia de las fluoropirimidinas, indicado en el cáncer colorrectal metastásico y el cáncer de mama avanzado. Su principal efecto secundario cutáneo es el síndrome mano-pie (HFS). También se han descrito en la literatura casos de hiperpigmentación cutánea, alteraciones ungueales y afectación de las mucosas secundarias a dicho fármaco. La capecitabina se convierte en 5-fluorouracilo (5-FU) mediante una enzima, la timidin fosforilasa, que se encuentra en mayor concentración en el tejido tumoral. Se administra por vía oral y sus efectos secundarios sistémicos son menores que con el 5-FU1. Presentamos dos nuevos casos de toxicodermia por capecitabina donde, además de un HFS, se asocia un cuadro de hiperpigmentación cutánea localizada y de afectación ungueal grave.
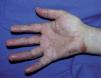
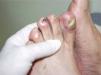
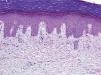
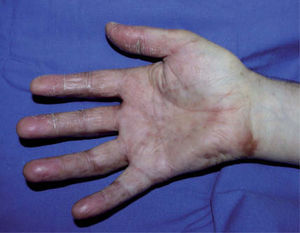
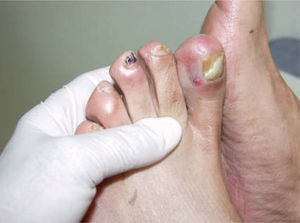
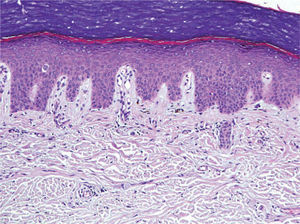
Se trata de dos varones de 53 y 79 años diagnosticados de adenocarcinoma de colon estadio III de Dukes. Tras una sigmoidectomía laparoscópica inician tratamiento adyuvante con capecitabina (Xeloda®) en dosis de 4.000mg/día y 3.000mg/día, respectivamente. Nuestro primer paciente consulta por lesiones cutáneas de 15 días de evolución que se localizaban en las palmas sin disestesia palmoplantar asociada, tras el tercer ciclo quimioterápico. A la exploración física observamos máculas marronáceas de 0,3cm en ambas palmas, junto a intensa descamación e hiperpigmentación periungueal y moderado eritema en las falanges distales (fig. 1). Nuestro segundo paciente refiere eritema y erosiones palmoplantares que se iniciaron tras el segundo ciclo de capecitabina. A la exploración se apreciaba eritrosis palmoplantar intensa, junto a lesiones vesiculoerosivas periungueales y onicopatía importante (fig. 2). Con el diagnóstico de toxicodermia por capecitabina y HFS asociado, se realiza una biopsia cutánea (fig. 3) que confirma nuestro diagnóstico; se inicia tratamiento con corticoides y antibióticos tópicos, y se lleva a cabo una reducción de la dosis de capecitabina a 2.500mg/día en el primer caso, y una suspensión definitiva del tratamiento en el segundo. Los pacientes presentaron un aclaramiento progresivo de las lesiones cutáneas, persistiendo únicamente discreta perionixis y onicodistrofia secundaria 4 meses más tarde en nuestro segundo paciente.
El HFS secundario a capecitabina se presenta en un 50-68 % de los pacientes tratados2 con dicho fármaco. Se caracteriza por eritema y dolor palmoplantar y puede llevar a ulceraciones distales si no disminuimos la dosis o retiramos el fármaco definitivamente3. Su etiopatogenia es desconocida aunque se postulan dos teorías, ambas dependientes de la dosis. La primera hipótesis hace referencia a una menor concentración de timidin fosforilasa en las zonas acrales, lo que provocaría una mayor acumulación de la misma en dicha localización. La segunda aboga por una mayor eliminación farmacológica a través de las glándulas ecrinas, que al estar en mayor concentración en la región palmoplantar también provocaría una mayor dosis acumulativa en esta zona2. El HFS puede aparecer tras la toma de otros fármacos quimioterápicos, principalmente de la familia de las fluoropirimidinas, como es el 5-FU, metabolito activo de la capecitabina4. En nuestros dos pacientes se presentan sendos HFS en distintos grados de intensidad, en el primero de características leves y en el segundo de características graves. El tratamiento es sintomático con emolientes y corticoides tópicos, aunque recientemente se ha sugerido la posibilidad de añadir un inhibidor de la dihidropirimidina deshidrogenasa (DPD) de forma simultánea al tratamiento quimioterápico, ya que parece disminuir la intensidad del HFS. La DPD es la responsable del catabolismo de más del 80 % de las fluoropirimidinas. Si al añadir un inhibidor de esta enzima al tratamiento quimioterápico disminuye la intensidad del HFS, esto indica que posiblemente sea un producto de degradación del fármaco el responsable del HFS5.
Otros efectos secundarios cutáneos menos frecuentes provocados por la capecitabina son mucositis6, onicólisis y onicomadesis7, hiperpigmentaciones cutáneas localizadas o generalizadas8, cambios esclerodermiformes acrales y queratodermias palmoplantares adquiridas.
La hiperpigmentación, efecto secundario llamativo en nuestro primer paciente, aparece en un 3 % de los pacientes tratados con capecitabina8. El primer caso publicado data de 20029, la mayoría se han descrito en personas de raza negra y oriental, y hasta la fecha sólo hemos encontrado dos casos publicados en caucásicos8,10. Ninguno de los dos aportaba un estudio histológico, por lo que no hemos podido realizar estudios comparativos con los hallazgos encontrados en nuestro paciente. Las causas de la hiperpigmentación son desconocidas, aunque se postulan dos teorías: una estimulación directa de la melanogénesis o una hiperpigmentación postinflamatoria8. En nuestro caso, dado que histológicamente no se aprecia un incremento del número de melanocitos, y sí datos de incontinencia pigmentaria, podríamos encuadrarla dentro de esta segunda hipótesis.
La afectación ungueal por el uso de capecitabina no queda prácticamente reflejada en la literatura. En nuestra búsqueda hemos encontrado un único caso publicado7, donde se postulan como posibles mecanismos responsables de la onicólisis, la toxicidad directa farmacológica o la colonización bacteriana o fúngica secundaria, así como el cese de la actividad mitótica de la matriz ungueal en el caso de la onicomadesis.
Presentamos dos nuevos casos de toxicodermia por capecitabina, donde junto con la manifestación cutánea más frecuente, el HFS, se asocian otros efectos tóxicos cutáneos excepcionales, la hiperpigmentación cutánea localizada y la afectación ungueal. Dado que se trata de un agente antineoplásico cuyo uso se está incrementando en los últimos tiempos, debemos conocer sus posibles efectos adversos para conseguir un mejor manejo clínico.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.