Las proteínas cinasas desempeñan un papel fundamental en las vías de señalización intracelular implicadas tanto en la proliferación celular como en la inflamación. El mejor conocimiento de estas vías metabólicas, y del mecanismo patogénico de las señales intracelulares de la psoriasis, está provocando el desarrollo e investigación de un nuevo grupo de fármacos en el tratamiento de esta enfermedad y de otros procesos inflamatorios. Los inhibidores de las cinasas son moléculas de pequeño tamaño que van a permitir un tratamiento vía oral o tópico. El futuro papel de estos fármacos dentro del arsenal terapéutico de la psoriasis está todavía por determinar, ya que la mayoría de moléculas están en fases precoces de investigación. Su hipotético coste inferior al de los tratamientos biológicos pudiera favorecer su aprobación en los próximos años. Tofacitinib, un inhibidor de las cinasas Janus, es el fármaco con investigación más avanzada y resultados prometedores.
Protein kinases play a crucial role in the intracellular signaling pathways involved in inflammation and cell proliferation. Advances in our understanding of these metabolic pathways and of the role played by intracellular signaling in the pathogenesis of psoriasis have led to research in this area and the development of a new class of drugs for the treatment of psoriasis and other inflammatory processes. Since kinase inhibitors are small molecules, oral and topical treatments are possible. The future role of these molecules in the therapeutic arsenal used to treat psoriasis is as yet unknown because in most cases they are still in the early stages of research. The fact that these drugs may cost much less than biologic therapies could favor their approval in coming years. Tofacitinib, a Janus kinase inhibitor, is the drug that has reached the most advanced stage of research and has shown the most promising results.
La introducción de la terapia biológica en la pasada década supuso un gran avance en el tratamiento de los pacientes con psoriasis moderada o grave, ya que consigue respuestas superiores a los tratamientos sistémicos previamente empleados, con una toxicidad menor. Sin embargo, un porcentaje no despreciable de pacientes que varía entre el 20 y el 50%, no responde o no consigue respuestas suficientemente satisfactorias1, por lo que existe un interés por obtener nuevos fármacos que puedan ser efectivos para un mayor número de pacientes. La identificación de un número de genes de susceptibilidad a la psoriasis, y con ello un mejor conocimiento de la patogénesis de las vías metabólicas intracelulares, sobre todo las relacionadas con la transducción de la señal celular, ha generado nuevas perspectivas en el tratamiento de la psoriasis. A diferencia de lo vivido en los últimos años, es muy posible que el nuevo paradigma del tratamiento de la psoriasis no venga de la mano de nuevos biológicos con actividad extracelular, sino de compuestos con capacidad para inhibir determinadas proteínas intracelulares involucradas en la respuesta inmunológica. La proteína blanco ideal sobre la que se pretende que actúen estos fármacos es aquella que posee funciones esenciales para las células inmunes, y que son indispensables para la función de otras células. La inhibición de estas proteínas debería conseguir modificar la respuesta inmunológica que se desencadena en la psoriasis sin afectar órganos relevantes, aunque en muchos casos esas mismas enzimas participan en otros procesos biológicos y, en ocasiones, estos fármacos pueden interactuar con enzimas relacionadas del mismo tipo, haciendo difícil predecir sus efectos y posibles efectos secundarios.
Es en el campo de la Oncología donde más rápidos avances se han hecho con estos tipos de fármacos, y esto ha provocado que en la actualidad haya diversos fármacos en investigación con capacidad para bloquear proteínas citoplasmáticas involucradas en la respuesta inmunológica de la psoriasis, además de otros procesos inflamatorios como son la artritis reumatoide y la enfermedad de Crohn. Estos fármacos son compuestos de pequeño tamaño molecular, lo que permite que sean administrados por vía oral o tópica, por lo que se considera que tendrán posiblemente un coste inferior que el tratamiento actual con fármacos biológicos. El desarrollo de estos fármacos, a pesar de que se encuentra en fases iniciales, es muy rápido, estando algunos a punto de aprobarse para otras patologías inflamatorias, y siendo posible que algunos de ellos estén completamente definidos en la próxima década para el tratamiento de la psoriasis.
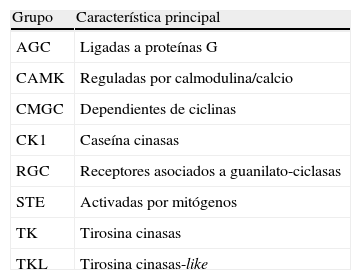
Proteínas cinasasEntre las moléculas actualmente en desarrollo para el tratamiento de la psoriasis se encuentran básicamente las dirigidas contra algunas proteínas cinasas. Las proteínas cinasas son enzimas intracelulares que se encuentran en todas las células y que, mediante la fosforilación, activan o desactivan otras proteínas, con la consiguiente transmisión y amplificación de información fundamental para el control de la fisiología celular2. Ejercen esta función de fosforilación a través de moléculas de adenosín trifosfato (ATP), y la mayoría de fármacos inhibidores van a actuar a este nivel. Estas proteínas cinasas son necesarias para muchos receptores de membrana, los cuales no tienen actividad cinasa propia y necesitan asociarse a estas proteínas para poder transmitir su señal desde el exterior de la célula hasta el núcleo. El genoma humano codifica más de 500 proteínas cinasas diferentes. Estas cinasas se dividen de forma didáctica en 8 grandes grupos, según su semejanza en la secuencia de su dominio catalítico (tabla 1). La mayor parte de las proteínas cinasas transfieren grupos fosfatos a residuos de serina o treonina en un sustrato proteínico. El grupo en el que más se está investigando en el terreno de la psoriasis sería el grupo de las tirosina cinasas.
Clasificación y características básicas de las proteínas cinasas
| Grupo | Característica principal |
| AGC | Ligadas a proteínas G |
| CAMK | Reguladas por calmodulina/calcio |
| CMGC | Dependientes de ciclinas |
| CK1 | Caseína cinasas |
| RGC | Receptores asociados a guanilato-ciclasas |
| STE | Activadas por mitógenos |
| TK | Tirosina cinasas |
| TKL | Tirosina cinasas-like |
Son uno de los principales grupos de proteínas cinasas, pero a diferencia del resto estas fosforilan selectivamente residuos de tirosina, y es por esto que son llamadas proteínas tirosina cinasas (TK)3. Hay unas 90 proteínas TK que están divididas en 2 grandes familias: proteínas TK tipo receptoras (son receptores de membrana celular con actividad cinasa intrínseca) y las proteínas TK citoplasmáticas o no receptoras (tabla 2). Estas últimas, a su vez, se dividen en 9 subfamilias4. Las proteínas TK citoplasmáticas están estrechamente relacionadas con funciones celulares esenciales como la regulación del crecimiento, división, diferenciación, supervivencia y migración celular, así como con el sistema de señalización inmunológica celular2,5. Ocupan un lugar nuclear en la respuesta celular ante cualquier señal química, como pueden ser las citocinas inflamatorias (por ejemplo el factor de necrosis tumoral alfa [TNFα]), diversos patógenos como los virus, factores de crecimiento celular y radiación ultravioleta. Tienen un papel relevante en la activación de linfocitos, macrófagos, neutrófilos y mastocitos, y además regulan actividades tan diversas como la actividad hormonal, la división celular y la expresión génica6.
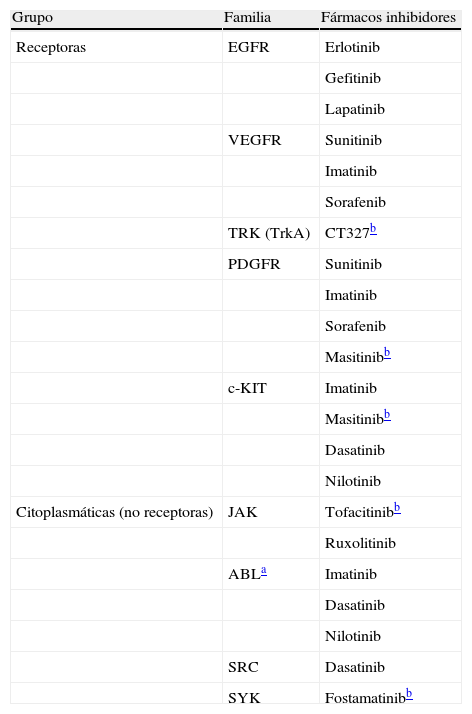
Clasificación de las principales familias de proteínas tirosina cinasas y sus fármacos inhibidores
| Grupo | Familia | Fármacos inhibidores |
| Receptoras | EGFR | Erlotinib |
| Gefitinib | ||
| Lapatinib | ||
| VEGFR | Sunitinib | |
| Imatinib | ||
| Sorafenib | ||
| TRK (TrkA) | CT327b | |
| PDGFR | Sunitinib | |
| Imatinib | ||
| Sorafenib | ||
| Masitinibb | ||
| c-KIT | Imatinib | |
| Masitinibb | ||
| Dasatinib | ||
| Nilotinib | ||
| Citoplasmáticas (no receptoras) | JAK | Tofacitinibb |
| Ruxolitinib | ||
| ABLa | Imatinib | |
| Dasatinib | ||
| Nilotinib | ||
| SRC | Dasatinib | |
| SYK | Fostamatinibb |
ABL: proteína homóloga a la del virus Abelson de leucemia murina; c-KIT: receptor factor de crecimiento mastocitos/células madre (CD117); EGFR: receptor del factor de crecimiento epidérmico; JAK: proteína cinasa Janus; PDGFR: factor de crecimiento derivado de las plaquetas; SRC: sarcoma cinasas; SYK: tirosina cinasa esplénica; TRK (TrkA): receptor del factor de crecimiento neural; VEGFR: receptor factor crecimiento vascular endotelial.
Su importancia clínica viene dada por la relación de la actividad de las proteínas TK con numerosas enfermedades relacionadas con la inflamación local, tales como la psoriasis y la ateroesclerosis, u otros procesos inflamatorios sistémicos, tales como la sepsis o el shock séptico. Además, se sabe que la expresión de proteínas TK mutantes o aberrantes puede derivar en cáncer por una división celular descontrolada. Por todo ello, el bloqueo o inhibición de la actividad de ciertas proteínas TK representa una interesante base terapéutica, tanto para procesos neoplásicos como para procesos inflamatorios. Se han desarrollado numerosas moléculas inhibidoras de las proteínas TK que bloquean la acción de una o más proteínas cinasas que por alguna mutación están permanentemente activadas en algunos tipos de cáncer. En un principio, el desarrollo de inhibidores de proteínas cinasas se dirigió a conseguir fármacos con una elevada selectividad de actuación, aunque posteriormente se ha comprobado que varios de los compuestos en desarrollo actúan sobre más de una cinasa (multikinase inhibitors), y a su vez cada cinasa puede actuar con diferentes citocinas. En algunos casos esta falta relativa de selectividad ha demostrado que puede ser más una ventaja que un inconveniente, ya que abre nuevas oportunidades terapéuticas.
Hasta la fecha 8 inhibidores de las proteínas TK han sido aprobados por la Food and Drug Administration (FDA) de los Estados Unidos, dirigidos al tratamiento de neoplasias de órganos (neoplasia de células renales, páncreas, pulmonar, gástrica) y procesos linfoproliferativos (leucemia mieloide crónica) (tabla 2) y se están desarrollando nuevos inhibidores dirigidos a tratar la psoriasis, aparte de diversos procesos inflamatorios como la artritis reumatoide, la enfermedad de Crohn y el rechazo de órganos trasplantados7.
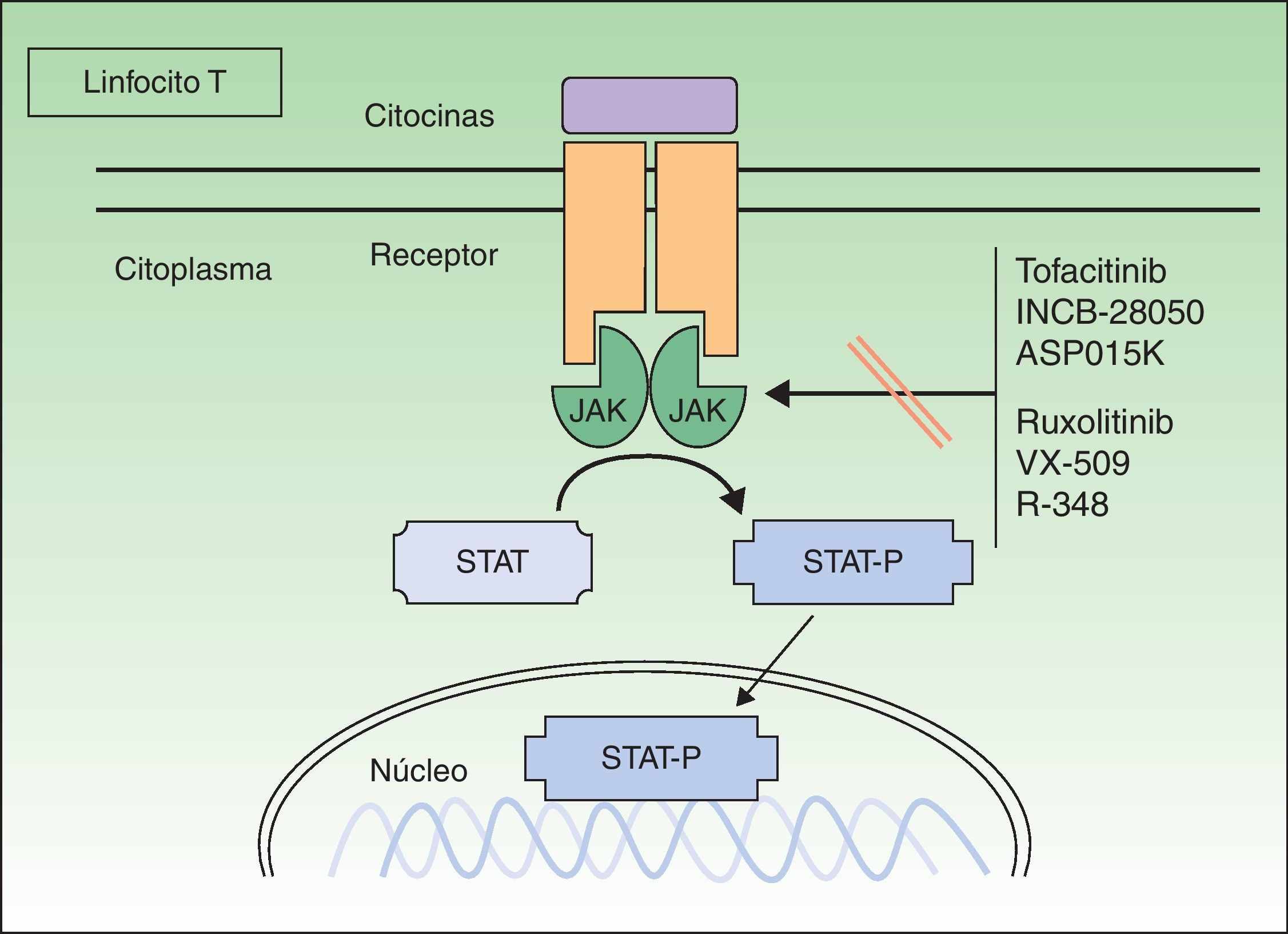
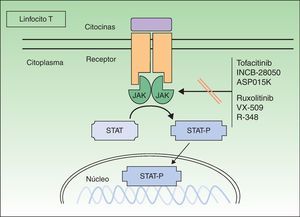
Proteínas cinasas JanusLas proteínas cinasas Janus ([JAK] acrónimo en inglés de cinasas de la familia Janus) son un subgrupo de proteínas TK de tipo citoplasmático cruciales en la iniciación de las vías de señalización activadas por citocinas, y están relacionadas con la fosforilación y activación de las proteínas transductores de señal y activadores de la transcripción (STAT). Las proteínas STAT activadas controlan la expresión de las dianas nucleares en los genes e inducen la transcripción de genes proinflamatorios. Señalizan aproximadamente 40 diferentes citocinas y factores de crecimiento8. Existen 4 tipos de JAK: las Janus cinasa 1, 2 y 3 (JAK 1, JAK 2 y JAK 3) y la TK 2 (TYK 2). Estas JAK actúan en parejas en la porción intracitoplasmática del receptor de la citocina (fig. 1), y cada pareja puede ser activada por diferentes citocinas y a su vez activar a diferentes proteínas STAT (existen hasta 6 tipos). La JAK 1 se asocia a receptores de interferón, interleucina (IL) 6 e IL-10, y a aquellos que contengan la cadena común gamma (γ). La JAK 2 se asocia sobre todo a receptores hematopoyéticos, pero también a las IL-12 y 23, y actúa en forma de dímeros. La JAK 3 es la más específica, ya que solo actúa con receptores que contengan la cadena común γ (IL-2, 4, 7, 9, 15 y 21), junto con la JAK 1. La TYK 2 solo se asocia al receptor del interferón y a la IL-12 y 23, junto con la JAK 2. Por lo tanto, la inhibición de una JAK impedirá la acción de más de una citocina, y por consiguiente la transcripción de genes responsables de la inflamación y del control de la inmunidad innata y adaptativa. Las citocinas con papel relevante en la psoriasis, sobre todo actuando sobre el queratinocito, y que utilizarían el sistema JAK/STAT son las IL -12, 19, 20, 22, 23, 24 y el interferón γ. Otras citocinas importantes, pero que no utilizan este sistema, serían el TNF y la IL-17.
Conocido previamente como tasocitinib, el tofacitinib (CP-690550) tiene una actividad inmunosupresora amplia. Inhibe selectivamente la JAK 3, la cual se encuentra en linfocitos T, linfocitos B, células natural killer y mastocitos. Suprime la transducción de la señal intracelular de los receptores comunes para las IL- 2, 4, 9, 15 y 21, y también interrumpe la activación y proliferación de las células T colaboradoras y las citotóxicas9. La inhibición de la IL-15 es de especial interés en la psoriasis, ya que esta interleucina se expresa en las placas de psoriasis y está asociada a un incremento en la resistencia a la apoptosis de los queratinocitos10. El tofacitinib tiene escasa afinidad por otras JAK, por lo que teóricamente no se producirían algunos de los efectos secundarios relacionados con la inhibición de estas. Existe un único estudio publicado10 en psoriasis, doble ciego y controlado con placebo, con 59 pacientes y dosis decrecientes (5, 10, 20, 30 y 50mg/día) durante 14 días. Se observó una respuesta y efectos secundarios dosis dependiente, especialmente con las dosis de 30 y 50mg. También se observó una disminución de K16, CD3, CD8, CD 11 y CD 25 en las placas biopsiadas.
Se ha realizado un segundo estudio en fase iib, no publicado pero presentado en el congreso de la Academia Europea de Dermatología (EADV, 2010), de 12 semanas de duración en el que participaron 197 pacientes con psoriasis moderada o grave, que fueron tratados aleatoriamente con tofacitinib a dosis de 2, 5 y 15mg cada 12 h, vía oral, o placebo. El 67% de los pacientes tratados con 15mg/12 h de tofacitinib alcanzaron un PASI 75, mientras que solo el 41% de los tratados con 5mg/12 h, el 25% de los que recibieron 2 dosis diarias de 2mg y el 2% de los que recibieron placebo lograron el PASI 75. Los efectos secundarios más frecuentes fueron infección del tracto respiratorio superior y cefalea, además de efectos secundarios dosis dependiente (sobre todo con 15mg): discreta anemia, neutropenia que se normalizó durante el transcurso del estudio e hipercolesterolemia.
Se han iniciado ensayos clínicos de fase iii con 2 dosis diarias de 5mg del fármaco, posología que se considera que es la que proporciona la combinación más adecuada de eficacia y seguridad. En estos ensayos se valorarán además los efectos de la retirada del tratamiento y retratamiento en 600 pacientes11, y una comparación con etanercept.
Asimismo, se están efectuando ensayos con tofacitinib para el tratamiento de la artritis reumatoide, enfermedad inflamatoria intestinal, rechazo de trasplante y ojo seco. Para la artritis reumatoide ya se han finalizado los ensayos en fase iii y podría ser aprobado para esta indicación próximamente.
También se ha desarrollado un modelo murino para determinar el riesgo de reactivación de tuberculosis latente en pacientes en tratamiento con tofacitinib, demostrando la disminución de la contención del Mycobacterium tuberculosis por parte del huésped y promoción de la replicación de la bacteria en el pulmón, con el consiguiente riesgo de desarrollar tuberculosis12.
RuxolitinibLa JAK1 desempeña un papel importante en la señalización de una serie de citocinas proinflamatorias, a menudo en asociación con otros miembros de la familia JAK. La JAK 2 es utilizada principalmente por los receptores de factores de crecimiento hematopoyéticos, como la eritropoyetina y la trombopoyetina13,14. Ruxolitinib (INCB018424) es un inhibidor selectivo de la JAK 1 y JAK 2 que inhibe diversas citocinas involucradas en la señalización de las vías del Th1 y Th17, lo cual incluye las IL-12 y 23 y el interferon γ, implicados en la psoriasis. Es un compuesto especialmente interesante para esta enfermedad, ya que se administraría por vía tópica. Ruxolitinib está aprobado de forma oral para el tratamiento de la mielofibrosis.
En modelos murinos de hipersensibilidad por contacto se ha visto que la aplicación tópica del ruxolitinib induce la supresión de la fosforilación de STAT 3 y, por tanto, el edema, la infiltración linfocítica y la proliferación de queratinocitos, así como la inhibición de la acantosis y de la producción de IL-22 inducida por IL-23 intradérmica.
Existe un estudio abierto15 con 28 pacientes divididos en 5 grupos y tratados durante 28 días con ruxolitinib tópico en 3 concentraciones (0,5 y 1% una vez al día, y 1,5% 2 veces al día). Se comparan estas 3 concentraciones con el vehículo y la concentración de 1,5% con calcipotrieno y betametasona. Se observó una mayor disminución de la puntuación de gravedad de las lesiones con las concentraciones más altas respecto al vehículo y al calcipotrieno. Los efectos secundarios fueron básicamente irritación local (que se observó más frecuentemente con el vehículo) y la absorción sistémica del producto fue mínima
Existe un posterior estudio fase iib, no publicado, doble ciego, distribuido aleatoriamente y controlado con el vehículo, en el que se trataron 200 pacientes con psoriasis en placas crónica leve-moderada (superficies corporales afectas 2-20%) durante 3 meses y se evaluaron las 3 dosis de ruxolitinib tópico (0,5, 1 y 1,5%). Con la crema al 1% la mejoría media del PASI fue del 40% en comparación con el 1% del placebo y con unos efectos secundarios bien tolerados (irritación local que fue más frecuente en los pacientes tratados con placebo y una tasa de infecciones respiratorias del 6,7 versus 2% en grupo placebo).
No existen aún estudios en fase iii iniciados para psoriasis.
Otros inhibidores de las proteínas cinasas JanusExisten otros potentes inhibidores selectivos de la JAK 3 (tabla 3), el ASP015K, el R34816 y el VX-509, con un buen perfil de seguridad, que se están desarrollando como posibles fármacos en el tratamiento de la psoriasis, pero que aún están en las fases iniciales de desarrollo.
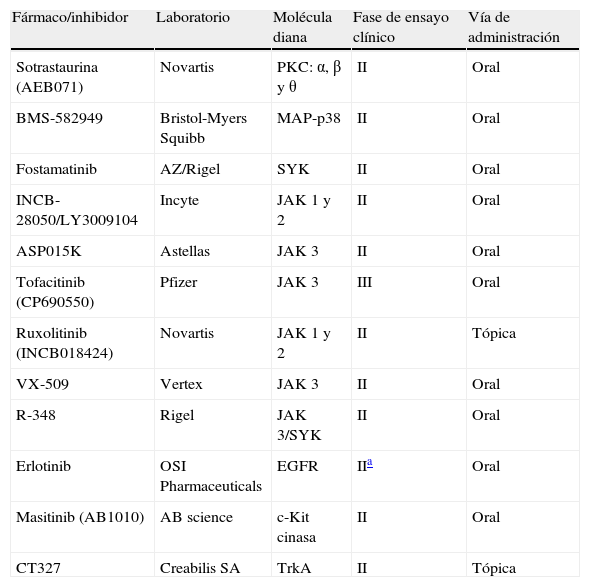
Inhibidores de las cinasas en investigación para el tratamiento de la psoriasis
| Fármaco/inhibidor | Laboratorio | Molécula diana | Fase de ensayo clínico | Vía de administración |
| Sotrastaurina (AEB071) | Novartis | PKC: α, β y θ | II | Oral |
| BMS-582949 | Bristol-Myers Squibb | MAP-p38 | II | Oral |
| Fostamatinib | AZ/Rigel | SYK | II | Oral |
| INCB-28050/LY3009104 | Incyte | JAK 1 y 2 | II | Oral |
| ASP015K | Astellas | JAK 3 | II | Oral |
| Tofacitinib (CP690550) | Pfizer | JAK 3 | III | Oral |
| Ruxolitinib (INCB018424) | Novartis | JAK 1 y 2 | II | Tópica |
| VX-509 | Vertex | JAK 3 | II | Oral |
| R-348 | Rigel | JAK 3/SYK | II | Oral |
| Erlotinib | OSI Pharmaceuticals | EGFR | IIa | Oral |
| Masitinib (AB1010) | AB science | c-Kit cinasa | II | Oral |
| CT327 | Creabilis SA | TrkA | II | Tópica |
EGFR: receptor del factor de crecimiento epidérmico; JAK1, 2 y 3: proteína cinasa Janus tipos 1, 2 y 3 respectivamente; MAP-p38: proteína cinasa activada por mitógeno-p38; PKC: proteína cinasa C; SYK: tirosina cinasa esplénica; TrkA: receptor del factor de crecimiento neural.
Las proteínas cinasas esplénicas (SYK) son otra familia de proteínas TK citoplasmáticas (tabla 2) y ejercen un importante papel en la señalización del receptor de la IgE e IgG en los mastocitos, basófilos y macrófagos, y por lo tanto en la degranulación y liberación de citocinas y en respuestas proinflamatorias y alérgicas17. Fostamatinib es un profármaco que tras absorberse se convierte en un potente y selectivo inhibidor de las proteínas SYK17, y que ha mostrado su eficacia en artritis reumatoide18,19. Actualmente se han iniciado ensayos en fase ii para el tratamiento oral de la psoriasis.
Otros inhibidores de tirosina cinasasEl receptor del factor de crecimiento epidérmico (EGFR) es una proteína con actividad TK intrínseca (tabla 2) y que se encuentra elevada en las placas de psoriasis. Existen casos publicados de pacientes neoplásicos tratados con inhibidores de EGFR (erlotinib) y cuya psoriasis mejoró20–22. Es por todo esto que se ha iniciado un ensayo en fase ii con erlotinib para tratar pacientes con psoriasis, pero ha sido suspendido antes de la selección de pacientes por motivos que desconocemos.
Masitinib (AB1010) es un inhibidor de proteínas TK, especialmente de c-KIT, con propiedades antimastocitarias, y que se está ensayando en varias enfermedades neoplásicas e inflamatorias, como el asma, la mastocitosis, tumores gástricos estromales y artritis reumatoide. Existe un ensayo en fase ii para el tratamiento oral de psoriasis.
CT327 es un inhibidor de la TrkA cinasa, una proteína TK de tipo receptor, de la familia TRK (tabla 2), y que actúa como receptor de alta afinidad del factor de crecimiento neural (NGF), que también se ha implicado en la patogenia de la psoriasis. Este fármaco se está ensayando de forma tópica para el tratamiento de la psoriasis y la dermatitis atópica, habiendo completado un ensayo en fase ii, y en la actualidad existe en marcha otro ensayo fase ii con diferentes concentraciones.
Proteínas cinasas CLa familia de las proteínas cinasas C se clasifican dentro del grupo de las proteínas ligadas a proteínas G (AGC) (tabla 1), y tienen un importante papel en el sistema inmunológico adaptativo y, por tanto, en el control de las enfermedades inflamatorias. Se conocen hasta el momento 12 isoenzimas que presentan diferentes secuencias de aminoácidos y mecanismos de regulación. Se dividen en 3 subfamilias, según sea su estructura y el tipo de acción: clásicas, nuevas y atípicas. Se expresan en diferentes tipos de células que regulan diversos procesos inmunológicos como el desarrollo, diferenciación y activación de los linfocitos y activación de macrófagos y células dendríticas23.
SotrastaurinaLa sotrastaurina (AEB071) es un inhibidor de los subtipos clásicos de proteína cinasa C: PKC-α y PKC-β, y del subtipo nuevo: PKC-θ, las cuales son importantes en la señalización de los linfocitos T. En estudios de fase i esta molécula ha demostrado una actividad inhibitoria dosis dependiente de la proliferación de linfocitos T y de la producción de mARN de IL-2 e IL-17. Se ha comprobado que es muy activa reduciendo el número de células dérmicas productoras de la proteína p40, lo que sugiere que puede producir una inhibición de las IL-12 e IL-2323. La reducción de la proteína p40, asociada a una inhibición de TNFα, podría explicar el porqué de su efecto clínico24.
Su eficacia en psoriasis se puso de manifiesto en un estudio25 en el que se trataron 32 pacientes con psoriasis moderada a grave que fueron distribuidos aleatoriamente a dosis de sostrastaurina de 25, 100, 200 o 300mg, o placebo, 2 veces al día, vía oral, durante 2 semanas. Se comprobó una rápida mejoría clínica e histológica ya a la semana de tratamiento, siendo los pacientes del grupo tratado con 300mg los que consiguieron los mejores resultados (reducción del 69% en el índice PASI). Cuatro de 6 pacientes consiguieron el PASI 75, mientras que el grupo tratado con placebo redujo un 5,3% el PASI. Los efectos secundarios observados fueron leves y comparables a los que presentó el grupo placebo. También se produjo una mejoría histológica, con disminución de linfocitos T, grosor e índice de proliferación epidérmico, subunidad p40 y células de Langerhans.
En este momento se están llevando a cabo estudios de fase ii con placebo en Europa y los Estados Unidos, de los que aún no se conocen los resultados y en los que se han tratado con sotrastaurina a 4 grupos de pacientes con psoriasis moderada a grave, a dosis de 200, 300 y 400mg, 2 veces al día, por vía oral.
Proteínas cinasas activadas por mitógenosOtro grupo de proteínas cinasas involucradas en diversas vías de la regulación celular y la producción de citocinas inflamatorias son las proteínas cinasas activadas por mitógenos (MAP), y entre ellas la proteína p38; todas ellas forman parte del grupo de cinasas de tipo dependientes de ciclinas (CMGC) (tabla 1). Esta proteína ha despertado un gran interés como posible molécula diana para el tratamiento de las enfermedades inflamatorias y, entre ellas, la psoriasis, por ser una enzima importante en la señalización celular para la síntesis de citocinas antiinflamatorias como la IL-10 en macrófagos y proinflamatorias como la IL-1β y el TNF α26.
Sin embargo, los ensayos clínicos fase ii realizados en artritis reumatoide con inhibidores de esta proteína no han producido los beneficios esperados, y hasta la actualidad se han investigado más de 20 diferentes inhibidores de la p38 por vía oral en ensayos clínicos fase i/ii para una variedad de indicaciones clínicas, y ninguno de ellos ha pasado a la fase iii27, sobre todo por el perfil de efectos secundarios. BMS-582949 es el único inhibidor de la MAP p38 que ha finalizado ensayos en fase ii para el tratamiento por vía oral de la psoriasis.
ConclusionesLos inhibidores de las cinasas son un nuevo paradigma en el tratamiento de la psoriasis. Su futuro papel dentro del arsenal terapéutico está aún por determinar, y no tenemos todavía datos de ensayos en fase iii. Son moléculas pequeñas que inhiben vías de señalización intracelulares. Actúan en su mayoría bloqueando más de una cinasa e inhiben la acción de diferentes citocinas, lo cual hace su mecanismo de acción no del todo selectivo. Su administración por vía oral o tópica es también una novedad, tras muchos años sin nuevos fármacos administrados por esta vía. Es posible que este hecho abarate el precio respecto a los fármacos biológicos y facilite su aprobación en el tratamiento de la psoriasis.
La molécula más avanzada es el tofacitinib, con resultados prometedores en los ensayos de fase ii, con un perfil de seguridad a caracterizar en los ensayos de fase iii, pero que parece aceptable, aunque requerirá monitorización analítica y también de una posible reactivación tuberculosa.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.