La terapia fotodinámica (TFD) y el imiquimod son dos excelentes tratamientos utilizados frecuentemente en Dermatología para las queratosis actínicas, el carcinoma basocelular (CBC) o la enfermedad de Bowen. No existen suficientes estudios comparativos entre ellos para poder extraer buenas conclusiones sobre su eficacia, su tolerancia o sus efectos secundarios y para poder situar a un tratamiento por encima del otro en un tipo de lesión o paciente en concreto. Por otra parte, existen situaciones o indicaciones particulares como la queilitis actínica, los pacientes inmunodeprimidos o los CBC localizados en párpados donde estos dos tratamientos pueden considerarse inicialmente contraindicados; sin embargo, existe suficiente evidencia para poder utilizarlos.
Vamos a realizar una revisión de la TFD y el imiquimod, bajo un punto de vista crítico y comparativo entre ellos, para poder ayudar a responder a la cuestión de qué tratamiento es más recomendable en un paciente determinado.
Photodynamic therapy and imiquimod are highly regarded treatments dermatologists frequently prescribe for actinic keratoses, basal cell carcinoma, and Bowen disease. The scarcity of evidence from comparative trials prevents us from drawing well-founded conclusions about the efficacy, tolerance, and adverse effects of these therapeutic options or to recommend one over the other in any particular type of lesion or patient. On the other hand, in certain conditions (eg, actinic chelitis, immunosuppression, and basal cell carcinoma affecting the eyelids), there is evidence to support the use of photodynamic therapy or imiquimod even though they might initially seem contraindicated. We critically review and compare the use of these 2 treatments in order to suggest which is more appropriate in specific cases.
La terapia fotodinámica (TFD) y el imiquimod son dos excelentes tratamientos con indicaciones muy parecidas en Dermatología. Existen muchos estudios que comparan cada uno de los dos tratamientos con otros como la crioterapia1–3, el 5-fluoracilo3,4, o la cirugía5,6, pero son muy escasos los estudios comparativos entre TFD e imiquimod7,8. No es infrecuente en la práctica clínica ordinaria que se plantee la duda de cuál de los dos tratamientos es más adecuado para un determinado paciente, ya que los dos se emplean habitualmente para las queratosis actínicas (QA), el carcinoma basocelular (CBC) y la enfermedad de Bowen (EB). Por otra parte, existen series cortas y casos anecdóticos publicados acerca del empleo de la TFD y/o el imiquimod en otras dermatosis oncológicas tales como el lentigo maligno9, la micosis fungoide10 o la enfermedad de Paget11, y también en otras patologías cutáneas no oncológicas12. Sin embargo, la falta de evidencia científica o la existencia de otras alternativas terapéuticas más adecuadas, hace prever que la lista de las indicaciones aprobadas tanto para la TFD como para el imiquimod, que permita su empleo con mayor frecuencia y seguridad, no vaya a modificarse.
La TFD se administra, en primer lugar, aplicando un fotosensibilizante sobre la lesión a tratar. Este puede ser el ácido aminolevulínico (ALA) o el metil aminolevulínico (MAL) y se incuba en oclusión durante al menos tres horas. Posteriormente se ilumina la zona con una luz que habitualmente suele tener una longitud de onda de entre 570 a 670nm. La TFD con MAL (Metvix crema®; Laboratorios Galderma, Lausane, Suiza) está aprobada, según la ficha técnica del producto, para las QA, el CBC superficial y nodular y para la EB. En el caso de las QA estas deben ser no hiperqueratósicas, localizadas en la cara y/o el cuero cabelludo y se recomienda realizar una única sesión que se puede repetir a los tres meses en caso necesario. Para el tratamiento del CBC superficial y nodular y para la EB se recomienda realizar dos sesiones de TFD separadas, al menos, por una semana.
El imiquimod está comercializado en crema al 5% (Aldara crema®; Laboratorios MEDA, Solna, Suiza) y se aplica por el propio paciente. Está aprobado para el tratamiento de los condilomas acuminados, las QA no hiperqueratósicas y no hipertróficas de la cara y el cuero cabelludo de pacientes inmunocompetentes y para pequeños CBC superficiales (en la ficha técnica no se especifica el tamaño). La posología en el caso de las QA es de una aplicación al día, tres días a la semana durante 4 semanas. Si tras una evaluación no ha existido respuesta se puede repetir otro ciclo de tratamiento de 4 semanas. En el caso del CBC superficial el imiquimod se aplica una vez al día, 5 días a la semana durante 6 semanas.
En este texto revisamos el uso de la TFD y el imiquimod en las indicaciones aprobadas habituales y también en otras situaciones, que inicialmente podrían ser motivo de contraindicación, como en el caso de la queilitis actínica, en los pacientes trasplantados o en los CBC localizados en los párpados, pero en las que por haber demostrado ser eficaces y seguros se puede plantear su uso en pacientes seleccionados. Intentaremos ensalzar las virtudes y los defectos de los dos tratamientos para poder ayudar a responder a la cuestión de qué tratamiento podría ser el más adecuado en una situación concreta.
Queratosis actínicasLas QA son las lesiones precancerosas más frecuentes a las que se enfrenta un dermatólogo. Muchas veces aparecen en el contexto del denominado «campo de cancerización». Este concepto explica las áreas de piel expuestas de forma crónica al sol, donde además de lesiones de QA se pueden demostrar cambios histológicos, como la presencia de queratinocitos displásicos y también cambios moleculares, como mutaciones en la p53, en ausencia de lesiones clínicamente evidentes, que predisponen al desarrollo de carcinomas epidermoides13,14. Para estos pacientes la TFD y el imiquimod son los tratamientos de elección, puesto que son capaces de tratar zonas amplias de piel e incluir al mismo tiempo las lesiones subclínicas. Además, ambos tratamientos proporcionan muy buenos resultados cosméticos3,15,16. Sin embargo, hay ciertas diferencias que pueden condicionar el uso de uno u otro tratamiento.
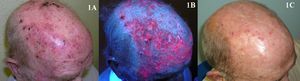
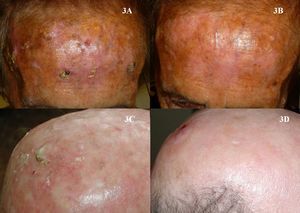
Existen numerosos estudios publicados acerca del empleo de TFD en las QA, pero es complicado establecer con precisión su eficacia puesto que cada estudio utiliza una metodología distinta. Cuando el fotosensibilizante utilizado fue el MAL en una o dos sesiones de tratamiento, los porcentajes de curación fueron del 69 al 91%15,17–20 (fig. 1). El principal efecto secundario de la TFD es el dolor que aparece durante la iluminación. Éste es mayor en pacientes de fototipos bajos y en las lesiones localizadas en la cabeza21. Sin embargo, como en cualquier otro procedimiento en Dermatología, el dolor se puede evitar o paliar con diferentes métodos eficaces, como el aire frío o el bloqueo nervioso con anestesia troncular22. Por lo tanto, el dolor que produce la TFD no debe ser un impedimento para su utilización. En este sentido, a pesar de la mala fama que acompaña a la TFD respecto a su tolerancia, cuando se utiliza para QA es el tratamiento mejor valorado en cuanto a satisfacción por parte del paciente, tal y como muestran todos los estudios que evalúan este parámetro1,8,15,19,23. Debe contribuir a este alto grado de satisfacción el hecho de que el paciente se somete a un tratamiento para el que utiliza poco tiempo, tras el cual se evidencia una mejoría evidente en pocas semanas, sin la necesidad de aplicar un tratamiento por él mismo o sin la posibilidad, en la mayoría de los casos, de que surjan dudas o efectos secundarios que no sepa manejar en su domicilio.
Respecto a las recidivas a largo plazo en los pacientes con QA tratados con TFD, son escasos los estudios con seguimiento superior a 12 meses24–26. Las recidivas al año pueden ser de hasta el 24%27, pero estas son mucho menores si se fracciona la iluminación28,29 o si las lesiones no son hiperqueratósicas30.
Para los pacientes transplantados el empleo de TFD ha demostrado ser muy útil en la curación de QA31,32, en la prevención de aparición de nuevas lesiones33,34 y además reduce el riesgo de aparición de carcinomas epidermoides cuando se emplea periódicamente35. Aunque no siempre se ha demostrado esta capacidad de la TFD en disminuir la incidencia de carcinomas epidermoides en pacientes trasplantados con daño actínico36.
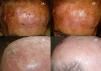
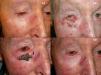
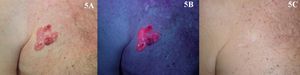
Existen muchos estudios que demuestran la eficacia y seguridad de la TFD para el tratamiento de la queilitis actínica (fig. 2). Se ha utilizado tanto MAL37,38 como el ALA39,40 en dos o tres sesiones con buenas respuestas y con buena tolerancia. Por ello, hay autores que consideran la TFD como el tratamiento de elección de la queilitis actínica41. Sin embargo, en los trabajos donde realizan confirmación histológica tras TFD, en el 20-53%37,42 de los pacientes persistían lesiones de queilitis actínica, y tras 18 meses de seguimiento en el 34,6% de los pacientes se encontraron cambios histológicos de queilitis actínica40. Por todo ello la TFD para el tratamiento de queilitis actínica tiene un nivel B de recomendación y debería considerarse como un tratamiento de segunda línea43.
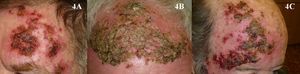
En el caso del imiquimod, al igual que con la TFD, es complicado determinar el porcentaje exacto de curación que tiene este tratamiento para las QA. La mayoría de los estudios evalúan la proporción de pacientes con respuesta clínica completa o parcial, otros la respuesta histológica, y además el régimen de tratamiento es muy diferente de unos estudios a otros. De cualquier forma, según tres metaanálisis, el imiquimod para el tratamiento de las QA es muy eficaz, con respuestas completas (100% de las lesiones resueltas tras el tratamiento) superiores al 70%44–46 de los pacientes (fig. 3). Una de las características más importantes del imiquimod es el alto valor predictivo negativo que tiene la valoración clínica de la respuesta. A diferencia de los trabajos con TFD, en el caso del imiquimod la metodología empleada en muchos de ellos parece ser más rigurosa y realizan una comprobación histológica de la respuesta al tratamiento con mayor frecuencia. En este sentido, la probabilidad de que las lesiones de QA clínicamente resueltas con imiquimod histológicamente también lo estén varía del 86 al 100%3,47–49. Otra característica importante de los estudios de imiquimod en QA respecto a los de TFD es el mayor seguimiento a largo plazo que tienen. Son más numerosos los trabajos que reevalúan la respuesta clínica al año de terminar el tratamiento, y aunque la mayoría refieren recidivas próximas al 10%3,48,50, el estudio de Jorizzo et al. obtuvo un 39% de recidivas al año51. El principal efecto secundario del imiquimod es la reacción inflamatoria local que se produce durante el tratamiento. Esta reacción, que es necesaria e incluso predictiva de una buena respuesta44, aparece a los pocos días del inicio del tratamiento en forma de eritema, inflamación, edema e incluso costras (fig. 4). Además de este efecto secundario local, algunos pacientes desarrollan un cuadro sistémico pseudogripal en forma de malestar general, fiebre y decaimiento. La existencia de estos efectos secundarios propios del imiquimod parecen ser el principal factor determinante de las reticencias de algunos profesionales a la hora de prescribirlo para las QA. Dado que el tratamiento dura 4 semanas, es posible que esta reacción local se prolongue durante casi dos meses y, por lo tanto, requiere de una adecuada información, tanto para el paciente como para sus familiares, para que entiendan bien el proceso al que se va a someter y para evitar llamadas inoportunas, consultas no programadas, o que incluso el paciente acuda a urgencias, donde frecuentemente malinterpretan el cuadro y suspenden el tratamiento. Esta reacción adversa al imiquimod, que ha sido ampliamente estudiada en los protocolos y estudios, es referida en prácticamente el 100% de los pacientes según la mayoría de publicaciones44,46–48. Sin embargo, es paradójico que en la mayoría de estudios concluyen que el imiquimod para el tratamiento de las QA es bien tolerado48,52,53. En los dos únicos trabajos comparativos entre TFD e imiquimod donde se evalúa la preferencia7 y la satisfacción8 del paciente por uno u otro tratamiento, la TFD fue superior al imiquimod. Los intentos para disminuir los efectos secundarios locales del imiquimod manteniendo la eficacia van encaminados a disminuir la concentración del fármaco al 2,5 o al 3,75% con resultados prometedores54,55; sin embargo en Europa, de momento, no se dispone de esta posibilidad.
El empleo de imiquimod en pacientes trasplantados es una contraindicación según la ficha técnica del producto, porque teóricamente es necesario un adecuado sistema inmune para que el mecanismo de acción del fármaco se lleve a cabo correctamente. Sin embargo, hay trabajos que estudian la seguridad y la eficacia en dichos pacientes con resultados más que aceptables en el tratamiento de las QA56,57, incluso en la prevención del desarrollo de carcinomas epidermoides58. Por otra parte, la posibilidad de que el imiquimod produzca alteraciones inmunológicas, locales o sistémicas, en el paciente y pueda dar lugar a tumores cutáneos en la zona de tratamiento59 o a trastornos autoinmunes60 está muy poco referida en la literatura, y la mayoría de trabajos y revisiones aceptan y recomiendan el uso de imiquimod en pacientes inmunodeprimidos57,61.
También se puede plantear el uso de imiquimod en la queilitis actínica, aunque existen menos estudios publicados que en el caso de la TFD. Parece eficaz desde el punto de vista clínico e histológico aplicado al menos durante 4 semanas, según las dos series mas amplias de 1562 y 563 pacientes. Sin embargo, la evidente reacción local que se produce en la mayoría de los casos, junto con la posibilidad de desarrollar aftas orales64 o incluso un brote de herpes simple43 durante el tratamiento, limita mucho su uso en esta localización.
En conclusión, tanto la TFD como el imiquimod son los mejores tratamientos para los pacientes con múltiples QA o campo de cancerización, con una eficacia parecida aunque con ciertas diferencias que conviene tener en cuenta para decidir qué opción terapéutica es más conveniente en una situación o paciente concreto. La tolerancia y la satisfacción del paciente es mayor en el caso de la TFD; sin embargo, parece que las recidivas son menores en el caso del imiquimod. Tanto la TFD como el imiquimod son eficaces en las QA de pacientes inmunodeprimidos por trasplante de órganos, sin embargo la TFD sería ligeramente superior al imiquimod, por su mecanismo de acción y por el mayor número de trabajos que avalan su eficacia en la curación de QA y en la prevención de nuevas lesiones y de carcinomas epidermoides. Para la queilitis actínica el imiquimod sería una opción desaconsejable por sus efectos secundarios, y la TFD una alternativa recomendable en muchos pacientes, aunque no por encima del tratamiento quirúrgico.
Enfermedad de BowenLa TFD utilizada para la EB tiene una eficacia del 69 al 100%2,65–70 (fig. 5). En la mayoría de trabajos se realizan dos sesiones y utilizan ALA como fotosensibilizante. En el trabajo multicéntrico con mayor número de casos, de Morton et al.2, obtuvieron un 80% de respuestas completas con dos sesiones de TFD con MAL y con un año de seguimiento. El resultado cosmético, como señalan muchos trabajos, fue excelente en la mayoría de los casos2,70. Al tratarse frecuentemente de lesiones de pocos centímetros de tamaño y de localización distinta a la cabeza, la tolerancia al tratamiento suele ser muy buena21,71. Según la Guía británica para el tratamiento de la EB, la TFD tiene un nivel de evidencia I y un grado de recomendación A, el más alto de todas las opciones de calificación para un tratamiento72.
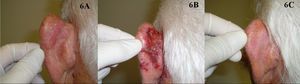
Han sido publicadas 5 series de casos de EB tratados con imiquimod73–77 (fig. 6). El tratamiento duró de 9 a 16 semanas y se obtuvieron respuestas completas del 73 al 88%, algunos de los casos con confirmación histológica y seguimientos de hasta 19 meses. La tolerancia al tratamiento fue mayoritariamente aceptable, aunque en alguno de los casos el paciente abandonó el tratamiento por la reacción local que se produjo. Según la Guía Británica para el tratamiento de la EB, el imiquimod tiene un nivel de evidencia I y un grado de recomendación B72.
En la tabla 1 se muestran los trabajos más relevantes de TFD e imiquimod en el tratamiento de la EB.
Series de casos de enfermedad de Bowen tratados con terapia fotodinámica e imiquimod
| N°pacientes | Forma de aplicar el tratamiento | Porcentaje de RCa | Seguimiento | Confirmación histológica | |
| TFD Autor, año | |||||
| Morton, 20062 | 96 | Dos ciclos de TFD con MAL | 80 | Un año | - |
| de Haas, 200765 | 50 | Una sesión de ALA (compara iluminación continua o fraccionada) | 80 | Dos años | - |
| Morton, 200166 | 40 (EB >20mm) | Tres sesiones con ALA | 78 | Un año | - |
| 45 (EB múltiples en 10 pacientes) | Dos sesiones con ALA | 89 | |||
| Dijkstra, 200167 | 6 | Una sesión con ALA | 90-100 | 6 meses | - |
| Salim, 200368 | 33 | Una sesión con ALA | 82 | Un año | - |
| Varma, 200169 | 50 | Dos sesiones con ALA | 69 | Un año | - |
| Truchuelo, 201170 | 51 | Dos sesiones con MAL | 77 | 16 meses | - |
| Imiquimod, Autor, año | |||||
| Patel, 200673 | 15 | Una vez al día durante 16 semanas | 73 | 9 meses | - |
| Mackeeenzie-Wood, 200174 | 16 | Una vez al día durante 16 semanas | 88 | 6 meses | Sí |
| Peris, 200675 | 5 | Una vez al día, 5 veces a la semana durante 16 semanas | 80 | 24-38 meses | - |
| Mandekou-Lefaki, 200576 | 5 | De una vez al día a tres veces a la semana hasta dos veces al día de 8 a 24 semanas | 80 | - | Sí |
| Rosen, 200777 | 49 | Diariamente o a días alternos de 6 a 20 semanas | 86 | 19 meses | - |
La TFD tiene una serie de condiciones en el tratamiento de la EB que permiten situarla por encima del imiquimod en esta indicación, tal y como señala la Guía Británica para el tratamiento de la EB72. La TFD es superior al imiquimod en la EB, en primer lugar porque estrictamente la TFD está aprobada para esta indicación y el imiquimod no. Por otra parte, hay un mayor número de pacientes incluidos en los trabajos que evalúan la TFD y las respuestas completas son ligeramente superiores que para el imiquimod. De cualquier forma, tanto la TFD como el imiquimod deberían considerarse antes que la cirugía para el tratamiento de la EB. No parece lógico someter a un paciente a un tratamiento quirúrgico cuando existen dos opciones terapéuticas conservadoras con muy buenos resultados clínicos y cosméticos. Para la elección de uno u otro tratamiento se debería tener en cuenta la localización de la lesión, como en el caso de EB perianal, las orejas, o en otras zonas donde la iluminación con la lámpara de TFD puede ser complicada, y de la disponibilidad del pacientes para recibir un tratamiento como la TFD o de la capacidad de aplicárselo él mismo, como en el caso de imiquimod.
Carcinoma basocelularCuando se revisan los estudios sobre la TFD en el CBC ocurre lo mismo que en las QA, es decir, no existe una metodología común y uniforme en los estudios. Hay trabajos donde emplean ALA y otros MAL, también son diferentes las fuentes y las formas de aplicar la luz, y también existen diferencias en cuanto a la manera de evaluar la respuesta de unos trabajos a otros. A pesar de todo, existe consenso en recomendar para el tratamiento del CBC realizar dos sesiones de TFD con ALA o con MAL, separadas al menos por una semana. También existe uniformidad en aceptar que el CBC superficial responde muy bien con dos sesiones TFD, bien sea con ALA o con MAL, con porcentajes de respuesta del 81 al 97% según las series mas amplias de casos67,78–87 y, por lo tanto, se le considera de primera elección según la Guía británica para el tratamiento del CBC (nivel de evidencia I y grado de recomendación A)88. Sin embargo, para el CBC nodular las respuestas son inferiores que en el CBC superficial, con respuestas completas que van de 20 al 94% según las series5,67,83–86,82,89 y además, si tenemos en cuenta que en los trabajos donde se obtienen mejores resultados realizan un pretratamiento antes de la TFD, como un debulking5, un curetaje86 o un afeitado85 previo del tumor o la aplicación de dimetilsulfóxido86, la eficacia real de la TFD en el CBC nodular se podría poner en entredicho. Por otra parte, revisando las recidivas tras periodos de seguimientos variables según cada trabajo (de uno a 6 años), podemos ver que las recidivas en el CBC superficial son del 3 al 22%78,80,84–86, y en el caso del nodular son algo superiores con porcentajes del 14 al 33%5,84–86,89. Por todo ello, para el CBC nodular la TFD se considera de segunda elección (nivel de evidencia I y grado de recomendación B)88, por debajo de la cirugía (nivel de evidencia I y un grado de recomendación A)88 que sería el tratamiento de elección.
Otra conclusión interesante que se puede extraer de la revisión de los trabajos de TFD en el CBC, y donde también existe cierta uniformidad de opinión, es que el hecho de fraccionar la iluminación en dos partes con un intervalo de tiempo variable mejora mucho la respuesta5,29,78,87.
En las tablas 2 y 3 se muestran los trabajos más relevantes de TFD e imiquimod en el tratamiento del CBC superficial y nodular.
Series de casos de carcinoma basocelular superficial tratados con terapia fotodinámica e imiquimod
| N° pacientes | Forma de aplicar el tratamiento | Porcentaje de RCa | Seguimiento | Confirmación histológica | |
| TFD Autor, año | |||||
| Dijkstra, 200167 | 33 | Una sesión con ALA | 82 | 6 meses | - |
| de Haas, 200678 | 505 | Una sesión de ALA (compara iluminación continua o fraccionada) | 89-97 | Un año | - |
| Soler, 200079 | 245 | Una sesión con ALA con previa aplicación de DMSO y dos tipos de luz | 82-86 | 6 meses | - |
| Szeimies, 200880 | 100 | Dos sesiones con MAL | 90 | Un año | - |
| Basset-Seguin, 200881 | 114 | Una sesión con MAL | 81 | Tres meses | - |
| Fantini, 201182 | 116 | Dos sesiones con MAL | 82 | - | - |
| Weenberg, 199683 | 157 | Una sesión con ALA | 92 | 6 meses | Sí |
| Vinciullo, 200584 | 80 | Dos sesiones con MAL | 82 | Dosaños | Sí |
| Horn, 200385 | 49 | Dos sesiones con MAL | 92 | Tres meses | - |
| Christensen, 200986 | 60 | Una o dos sesiones con ALA con DMSO previo | 81 | 6 años | Sí |
| Star, 200687 | 67 | Una sesión con ALA con dos tipos de luz | 84 | 5 años | - |
| Imiquimod Autor, año | |||||
| Geisse, 200295 | 31 | Una vez al día, 12 semanas | 87 | 6 meses | Sí |
| Marks, 200196 | 33 | Una vez al día, 6 semanas | 88 | 6 semanas | Sí |
| Schulze, 200597 | 84 | Una vez al día, 6 semanas | 80 | 12 semanas | Sí |
| Geisse, 200498 | 179 | Una vez al día, 6 semanas | 79 | 12 semanas | Sí |
| Marks, 200499 | 97 | Una vez al día, 6 semanas | 77 | 12 semanas | Sí |
| Quirk, 2006100 | 169 | Una vez al día, 6 semanas | 82 | Dosaños | - |
| Gollnick, 2005101 y 2008102 | 182 | Una vez al día, 5 días a la semana, 6 semanas | 69 | 5 años | - |
| Peris, 2005103 | 30 | Una vez al día, tres veces a la semana, 6 semanas | 91 | 23 meses | - |
| Quirk, 2010104 | 169 | Una vez al día, 6 semanas | 80 | 5 años | - |
| Ruiz-Villaverde, 2009105 | 82 | Tres veces a la semana, 4 semanas | 85 | Dosaños | - |
| Daudén, 2011106 | 446 | Una vez al día, 5 días a la semana, 6 semanas | 83 | - | - |
| Shumack, 2004107 | 66 | Una vez al día, 5 días a la semana, 6 semanas | 83 | 12 semanas | Sí |
Series de casos de carcinoma basocelular nodular tratados con terapia fotodinámica e imiquimod
| N° pacientes | Forma de aplicar el tratamiento | Porcentaje de RCa | Seguimiento | Confirmación histológica | |
| TFD Autor, año | |||||
| Mosterd, 20055 | 85 | Una sesión con ALA. Previo debulking parcial del tumor | 94 | Tres meses | - |
| Dijkstra, 200167 | 8 | Una sesión con ALA | 50 | 3 -12 meses | - |
| Fantini, 201182 | 78 | Dos sesiones con MAL | 33 | - | - |
| Wennberg, 199683 | 10 | Una sesión con ALA | 20 | 6 meses | Sí |
| Vinciullo, 200584 | 33 | Dos sesiones con MAL | 67 | Dos años | Sí |
| Horn, 200385 | 52 | Dos sesiones con MAL, previo rebanado de la parte nodular | 75 | Tres meses | Sí |
| Christensen, 200986 | 36 | Una o dos sesiones con ALA y DMSO y curetaje previo | 81 | 6 años | Sí |
| Rhodes, 200789 | 53 | 2-4 sesiones con MAL | 92 | Tres meses | - |
| Imiquimod Autor, año | |||||
| Peris, 2005103 | 19 | Tres días por semana, 12 semanas | 53 | Dos años | - |
| Shumack, 2002108 | 137 | De dos veces al día diariamente a tres veces a la semana, de 6 a 12 semanas | 42-76 | 6 semanas | Sí |
| Schiessl, 2007109 | 26 | 5 veces a la semana, 6 semanas | 88 | 6 semanas | Sí |
| Huber, 2004110 | 15 | Tres veces a la semana, 12 semanas | 100 | 15 semanas | Sí |
| Eigentler, 2007111 | 101 | Tres veces a la semana, 10 semanas | 57 | 8 semanas | Sí |
| Sterry, 2002112 | 90 | Dos o tres veces a la semana, 6 semanas | 50-65 | 6 semanas | Sí |
| Wu, 2006113 | 34 | Diariamente de 6 a 10 semanas con curetaje previo | 94 | - | Sí |
La utilización de la TFD en la zona periocular, o incluso en tumores localizados en los párpados, puede ser inicialmente una contraindicación absoluta, por las molestias que se le puede producir al paciente y por la posibilidad de no realizar la técnica correctamente. Sin embargo, según la evidencia de la literatura90–93, y también por nuestra experiencia propia, se podría emplear la TFD utilizando una lente ocular opaca antes de aplicar la crema para casos seleccionados de CBC tanto superficiales como nodulares, en pacientes donde la opción quirúrgica sea una contraindicación (fig. 7). La tolerancia en estos casos suele ser buena y se puede emplear desde un punto de vista neoadyuvante, paliativo o incluso con una intención curativa.
El empleo de imiquimod en el CBC superficial ha sido estudiado en muchos trabajos. Da la impresión, al revisar dichos trabajos, que la metodología empleada es más rigurosa y homogénea que en los de TFD, y además el número de trabajos es ligeramente mayor en el caso del imiquimod que en el de la TFD para el tratamiento del CBC superficial94. El porcentaje de respuestas completas de CBC superficiales tratados con imiquimod, según los estudios que incluyeron un mayor número de pacientes, oscila del 69 al 91%95–107, lo que le otorga un nivel de evidencia I y un grado de recomendación A88. En la mayoría de estos trabajos se confirmó la respuesta al tratamiento mediante estudio histológico95–99,107 o con seguimientos de hasta 5 años101,102,104, lo que proporciona mayor garantía a la eficacia del imiquimod en el tratamiento CBC superficial. Sin embargo, al igual que sucede en el tratamiento de las QA con imiquimod, este tratamiento produce una reacción local que se puede prolongar hasta dos meses, que condiciona en muchas ocasiones la correcta cumplimentación del tratamiento y, por lo tanto, limita su empleo en el CBC.
Aunque el imiquimod no está aprobado para el tratamiento del CBC nodular, existe suficiente número de trabajos y experiencia para respaldar su empleo. Del 42 al 100% de los CBC nodulares tratados con imiquimod responden de forma completa al tratamiento103,108–113, según los trabajos que aportan mayor número de casos. Al igual que en la TFD también se ha planteado realizar un curetaje previo para aumentar la eficacia del imiquimod en los CBC nodulares113,114.
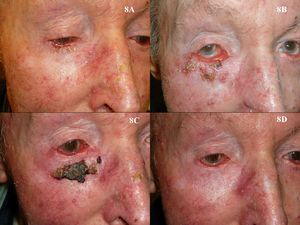
En el caso de los CBC perioculares o de localización en los párpados, al igual que sucede con la TFD, podría ser una contraindicación absoluta el empleo de imiquimod para su tratamiento. Sin embargo, existen muchas publicaciones cuyos resultados ofrecen la oportunidad de utilizarlo en casos seleccionados115–119 (fig. 8). Son especialmente interesantes dos trabajos de García-Martín et al118 y de Cannon et al119. En el primero obtienen una respuesta clínica e histológica completa en los 15 CBC perioculares tratados con imiquimod, con muy buenos resultados estéticos. En el segundo realizan una revisión de los efectos secundarios de los 47 pacientes que recibieron tratamiento con imiquimod de sus tumores perioculares. El efecto secundario más frecuente fue una conjuntivitis de intensidad media en 11 pacientes, y todos los efectos secundarios se resolvieron tras el cese del tratamiento con imiquimod sin ningún efecto secundario residual.
Carcinoma basocelular superficial en el párpado inferior del ojo derecho tratado con imiquimod. A. Previo al tratamiento. B. Reacción local y conjuntivitis leve en la semana 3 de tratamiento. C. Reacción local y conjuntivitis leve en la semana 6 de tratamiento. D. Respuesta clínica y resolución de la conjuntivitis un mes después de finalizar el tratamiento con imiquimod.
Desde un punto de vista económico, tanto la TFD como el imiquimod son más baratos que la extirpación quirúrgica en el tratamiento del CBC120,121,6, y entre los dos tratamientos con la TFD se pueden ahorrar más costes que con el imiquimod cuando se comparan con cirugía6.
Las conclusiones que se obtienen al revisar el empleo de TFD y de imiquimod en el CBC son, en primer lugar, que los dos tratamientos deberían considerarse de primera elección en los CBC superficiales en cuanto a eficacia. Se debería reservar la cirugía para casos refractarios a estos tratamientos, casos de localizaciones comprometidas, cuando se precise de un estudio histológico o atendiendo a la preferencia del paciente. Para la elección entre TFD e imiquimod en el CBC superficial, si se tienen en cuenta la comodidad del tratamiento, las preferencias del paciente y los resultados cosméticos la TFD aporta mayores ventajas y, por lo tanto, debe situarse por encima del imiquimod25,88,122. En segundo lugar, ni la TFD ni el imiquimod superan en eficacia a la cirugía en el tratamiento del CBC nodular. Para los casos de CBC nodular donde la cirugía pueda ser una contraindicación la TFD se considera un tratamiento superior al imiquimod, según la Guía británica para el tratamiento del CBC y la ficha técnica de ambos productos. Por último, tanto la TFD como el imiquimod pueden ser alternativas atractivas en el tratamiento de CBC, tanto superficiales como nodulares localizados en los párpados y el área periocular en pacientes seleccionados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.