La terapia fotodinámica antimicrobiana combina el uso de un fármaco fotosensibilizante, la luz y el oxígeno para erradicar microorganismos patógenos. Trichophyton mentagrophytes es un hongo dermatofito capaz de invadir la piel y tejidos queratinizados. El objetivo de este trabajo es aplicar la terapia fotodinámica antimicrobiana para la inactivación in vitro de T. mentagrophytes utilizando el nuevo azul de metileno como agente fotosensibilizador.
Material y métodosSe aplica un diseño factorial completo para optimizar los parámetros que permiten la fotoinactivación del dermatofito. Se tiene en cuenta la concentración del nuevo azul de metileno, el tiempo de contacto entre el fotosensibilizador y el hongo antes del tratamiento con luz y la fluencia de luz roja aplicada entre 620 y 645nm.
ResultadosLa mínima concentración de nuevo azul de metileno que produce una mortalidad de todas las células de T. mentagrophytes de la suspensión inicial (concentración ∼106 ufc/ml) es 50μM para una fluencia de 81J/cm-2 y un tiempo previo de contacto hongo-fotosensibilizador de 10min. Si se aumenta la concentración a 100μM la fluencia que se necesita disminuye a 9J/cm-2.
ConclusionesLa comparación de nuestros datos con otros publicados muestra que la susceptibilidad de T. mentagrophytes a la terapia fotodinámica antimicrobiana con nuevo azul de metileno es cepa-dependiente. El nuevo azul de metileno es un fotosensibilizador a tener en cuenta para el tratamiento de las micosis cutáneas causadas por este dermatofito.
Antimicrobial photodynamic therapy combines the use of a photosensitizing drug with light and oxygen to eradicate pathogens. Trichophyton mentagrophytes is a dermatophytic fungus able to invade the skin and keratinized tissues. We have investigated the use of new methylene blue as the photosensitizing agent for antimicrobial photodynamic therapy to produce the in vitro inactivation of T mentagrophytes.
Material and methodsA full factorial design was employed to optimize the parameters for photoinactivation of the dermatophyte. The parameters studied were new methylene blue concentration, contact time between the photosensitizing agent and the fungus prior to light treatment, and the fluence of red light (wavelength, 620–645nm) applied.
ResultsThe minimum concentration of new methylene blue necessary to induce the death of all T. mentagrophytes cells in the initial suspension (approximate concentration, 106 colony forming units per milliliter) was 50μM for a fluence of 81J/cm2 after a contact time of 10minutes with the photosensitizing-agent. Increasing the concentration to 100μM allowed the fluence to be decreased to 9J/cm2.
ConclusionsComparison of our data with other published data shows that the susceptibility of T. mentagrophytes to antimicrobial photodynamic therapy with new methylene blue is strain-dependent. New methylene blue is a photosensitizing agent that should be considered for the treatment of fungal skin infections caused by this dermatophyte.
La terapia fotodinámica antimicrobiana (TFDa) utiliza luz visible para eliminar microorganismos patógenos con la ayuda de un fármaco fotoactivable. La interacción de este agente fotosensibilizador (FS) con luz y oxígeno conduce a la formación de especies reactivas de oxígeno (ERO) inductoras de la muerte de los agentes infecciosos a erradicar. Al no utilizar una diana celular concreta, es muy difícil que las células generen resistencias al fármaco fotosensibilizante empleado1.
La TFDa es especialmente atractiva gracias a su selectividad; esto es consecuencia tanto de poder disponer de FS con una afinidad preferente por las células microbianas respecto al tejido del huésped, como de que el efecto fotodinámico se restringe a la zona tratada con luz2.
Trichophyton mentagrophytes es un hongo dermatofito capaz de invadir la capa córnea de la epidermis y estructuras queratinizadas, como pelo y uñas, causando micosis cutáneas conocidas comúnmente como tiñas3,4. Los tratamientos actuales se basan mayoritariamente en el uso de agentes antifúngicos que, sobre todo cuando deben emplearse por vía oral, pueden ocasionar efectos secundarios indeseables5.
El nuevo azul de metileno (NMB) es una fenotiazina plana tricíclica con potencial fototerapéutico, ya que su longitud de onda de absorción se encuentra dentro del margen donde se da la máxima penetración de la luz en el tejido del huésped (entre 600-850nm)6,7. En soluciones acuosas tamponadas el NMB absorbe luz a 630nm y emite fluorescencia a 650nm.
El objetivo de este trabajo es la optimización del método para la fotoinactivación in vitro de T. mentagrophytes utilizando el nuevo azul de metileno como FS.
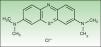
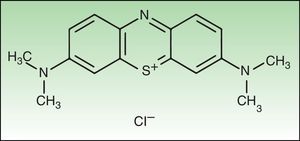
Material y métodosReactivos químicosEl FS NMB (new methylene blue) y el tampón fosfato ([PBS] Sterile dulbecco's Phosphate Buffered Saline pH 7.4) fueron adquiridos en SIGMA-Aldrich, Inc. (St. Louis, MO, EE. UU.). La estructura del NMB se muestra en la figura 1.
El medio de cultivo fúngico, agar de Saboraud (SB), fue preparado a partir de Sabouraud Dextrose Agar CM0041 pH 5,6±0,2 (Oxoid Limited, Basingstoke, Reino Unido).
La disolución madre de NMB 1mM fue preparada en agua tamponada estéril (PBS, pH=7,4). Las disoluciones de trabajo de NMB se disolvieron a oscuras en PBS hasta la concentración deseada y se almacenaron a 4°C.
Cepa fúngica, condiciones de cultivo y preparación de las suspensiones celularesSe ha utilizado la cepa de T. mentagrophytes CECT 2956 obtenida de la Colección española de cultivos tipo (Valencia, España).
Los cultivos de T. mentagrophytes CECT 2956 se realizaron en SB y se incubaron aeróbicamente y en oscuridad a 26°C durante 14 días. Una vez crecidas las colonias, estas se desprendieron de la superficie del medio de cultivo sólido por agitación manual mediante una solución salina estéril con bolas de cristal de 3mm de diámetro. La suspensión celular fue filtrada a través de gasa estéril. Las suspensiones de trabajo se ajustaron a un nivel de concentración de aproximadamente 106 UFC/ml en solución salina estéril.
Fuente de luzT. mentagrophytes fue irradiado con una lámpara LED Photocare (SORISA, Sant Quirze del Vallès, España). Para excitar el NMB se seleccionó una emisión roja entre 620 y 645±10nm.
Diseño de experiencias para optimizar el protocolo de fotoinactivación del dermatofito T. mentagrophytesLa optimización del protocolo para la fotoinactivación de células de T. mentagrophytes mediante TFDa se realizó aplicando el diseño experimental completo resultado de la combinación de 3 variables aplicadas a diferentes niveles: concentración final de NMB (niveles: 0, 0,1, 1, 10, 25, 50, 75, 100 y 1000μM), tiempo de incubación del FS en contacto con el hongo (niveles: 0, 10, 30 y 90min) y tiempo de irradiación (niveles: 0, 10, 30 y 90min).
En la tabla 1 se detallan las experiencias realizadas. En resumen, para cada una de las 9 concentraciones de NMB ensayadas se llevaron a cabo 16 experiencias, lo que dio un total de 144 experiencias.
Diseño experimental para cada una de las concentraciones de nuevo azul de metileno (0, 0,1, 1, 10, 25, 50, 75, 100 y 1000μM)
| t irradiación/min | ||||
|---|---|---|---|---|
| 0 | 10 | 30 | 90 | |
| tincubación/min | ||||
| 0 | Experiencia 1 | Experiencia 2 | Experiencia 3 | Experiencia 4 |
| 10 | Experiencia 5 | Experiencia 6 | Experiencia 7 | Experiencia 8 |
| 30 | Experiencia 9 | Experiencia 10 | Experiencia 11 | Experiencia 12 |
| 90 | Experiencia 13 | Experiencia 14 | Experiencia 15 | Experiencia 16 |
A cada una de las suspensiones de trabajo, de aproximadamente 106 UFC/ml, se adicionó una de las concentraciones de NMB, se incubó a oscuras durante 10, 30 o 90min a 30°C y 120r.p.m. Transcurrida la incubación, para excitar la banda de 630nm del NMB se irradió la muestra, sin lavado previo del FS en exceso, entre 620 y 645nm mediante la fuente de luz durante 10, 30 o 90min, correspondiente a una fluencia de 9, 27 y 81J cm-2, respectivamente.
Finalizado el tratamiento de luz se sembraron 0,1ml de la suspensión sobre placas de Petri que contenían SB, se incubó en oscuridad a 26°C durante 14 días y se realizó el recuento de las colonias formadas después del tratamiento fotodinámico.
El control de toxicidad de la luz (sin FS) y la toxicidad del FS (sin luz) se realizó para cada ensayo y en las mismas condiciones en que se realizaron los experimentos.
ResultadosSe ha evaluado la optimización in vitro de los factores a emplear en la TFDa con NMB frente a T. mentagrophytes (concentración del FS, tiempo de contacto y tiempo de irradiación) mediante la disminución de la viabilidad celular expresado como reducción logarítmica del número UFC/ml a partir de suspensiones celulares iniciales de ∼106UFC/ml. La exposición del hongo a la luz en ausencia del FS no inhibió su crecimiento en cualquiera de las 3 fluencias de luz empleadas (datos no mostrados). El ensayo de toxicidad a oscuras demuestra que el NMB solo es tóxico para el dermatofito si se combina con luz (función roja de la fig. 2).
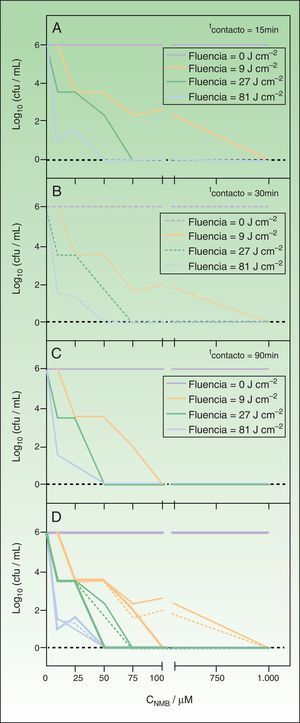
Reducción logarítmica del número de UFC/ml de Trichophyton mentagrophytes después del tratamiento fotodinámico con nuevo azul de metileno (NMB) irradiando la muestra entre 620 y 645nm.
Panel A: tiempo de contacto de 10min. Panel B: tiempo de contacto de 30min. Panel C: tiempo de contacto de 90min. En todos los paneles: control de la luz (función roja); fluencia de 9J/cm-2 (función verde); fluencia de 27J/cm-2 (función rosa); fluencia de 81J/cm-2 (función azul). Panel D: resumen de resultados para los tiempos de contacto ensayados: 10min (línea fina); 30min (línea punteada); 90min (línea gruesa).
Los resultados expuestos en la figura 2 indican que las concentraciones de 0, 0,1 y 1μM de NMB no producen efecto fungicida sobre T. mentagrophytes, ya que se obtiene un cultivo confluente después de irradiar la muestra para todos los tiempos de incubación e irradiación ensayados. No obstante, aplicando concentraciones de 10 y 25μM de NMB ya se detecta un efecto inhibidor del crecimiento que, en algunas condiciones, llega a alcanzar una reducción de hasta 5 unidades logarítmicas en el número UFC/ml, no lográndose en ningún caso la inhibición total del hongo. La erradicación de todas las colonias se pudo conseguir aplicando concentraciones de FS más elevadas: 50, 75 y 100μM, combinadas con los tiempos de incubación e irradiación más largos empleados. Por último, si se irradia la muestra con NMB 1000μM se produce un efecto fungicida total para cualquier combinación de las experiencias ensayadas para esta concentración.
Así que, de los resultados obtenidos al aplicar TFDa sobre suspensiones celulares de T. mentagrophytes (106 UFC/ml), puede extraerse que con un tiempo de agitación e irradiación de 10min (9J/cm-2) la concentración mínima de NMB que produce total mortandad celular es de 100μM, en cambio, para el mismo tiempo de contacto, si se irradia la muestra durante 90min (81J/cm-2) puede disminuirse la concentración de NMB hasta 50μM.
DiscusiónHasta la fecha se han realizado diferentes estudios in vitro utilizando la TFD como posible tratamiento contra las dermatofitosis; la mayoría de ellos se basan en el empleo del ácido 5-aminolevuínico o sus derivados como FS8. En particular, para las onicomicosis el dermatofito más estudiado ha sido Trichophyton rubrum. Así, varias publicaciones científicas demuestran que T. rubrum puede ser tratado in vitro mediante TFD para obtener un efecto fungicida con distintos FS, como el azul de toluidina (toluidine blue O)9, Sylsens B —tricloruro de 5,10,15-tris(4-metilpiridinio)-20-fenil-[21H,23H]-porfina—10–14, deuteroporfirina monometiléster10–12, el ácido 5-aminolevulínico14,15 o la hipericina —1,3,4,6,8,13-hexahidroxi-10,11-dimetilfenantro(1,10,9,8-opqra)perilen-7,14-diona—16.
Sin embargo, son escasos los estudios publicados para tratar las micosis producidas por T. mentagrophytes con TFDa. Jenefar et al.17 demostraron en 2010 que este dermatofito puede ser tratado mediante TFDa utilizando acriflavina a una concentración de 0,2μM, aunque cabe resaltar que no menciona la dosis de luz aplicada. Paz-Cristobal et al.16 también consiguieron inactivar a T. mentagrophytes utilizando hipericina a una concentración entre 20 y 50μM usando diferentes dosis de luz. Es difícil comparar nuestros resultados con los de estos autores, porque tanto los fotosensibilizadores como las condiciones experimentales empleadas son muy diferentes. Asimismo, frente a T. mentagrophytes se han utilizado colorantes de la familia de las fenotiazinas como el NMB18.
Las fenotiazinas han resultado ser útiles en la TFD también frente a distintos tipos de bacterias, como la gram-positiva Staphylococcus aureus o la gram-negativa Escherichia coli19,20. De entre ellas, se ha demostrado que el NMB es más eficaz que el azul de metileno, el azul de toluidina O, o el azul de dimetilometileno frente a cepas de Acinetobacter baumannii resistentes a antibióticos21. Sin embargo, la concentración de NMB necesaria para producir un efecto bactericida sobre Acinetobacter baumannii (2μM con dosis de luz de 30J/cm-2) es muy inferior a la necesaria para inactivar a T. mentagrophytes CECT 2956, según los resultados obtenidos en este trabajo (50 o 100μM a 81 o 9J/cm-2, respectivamente).
Es un dato conocido que las células de mayor tamaño son menos sensibles a la TFDa que las más pequeñas, hecho que convierte a los eucariotas en más resistentes a la fotoinactivación que las bacterias al poseer un mayor número de blancos por célula22. Además, en TFD está generalmente aceptado que el mecanismo tipo ii vía oxígeno singlete (1O2) es la vía principal que causa el daño celular. El 1O2 es una ERO que no se interconvierte con otras ERO, por lo que su principal característica, en relación con su efecto fotodinámico, es su tiempo de vida antes de que regrese a su estado fundamental al transferir su energía. No está claro el valor de este parámetro en el ambiente celular donde el 1O2 puede reaccionar con diferentes biomoléculas pero, en cualquier caso, su tiempo de vida útil limita el espacio en que puede moverse a partir del lugar donde es generado y que se calcula en alrededor de 270nm23. Esto es una distancia muy corta, incluso en la escala de las dimensiones celulares. Un procariota típico tiene una longitud de unos pocos micrómetros, mientras que las eucariotas a menudo alcanzan diámetros de 10-30μm. En particular, los macroconidios de T. mentagrophytes alcanzan un tamaño de 20-50μm de largo y 6-8μm de ancho cuando se desarrollan sobre un huésped. En consecuencia, las reacciones primarias del 1O2 en una célula tienen lugar en una corta distancia de donde se ha generado, por lo que a nivel molecular, el lugar donde se genera es muy importante. Las reacciones primarias del 1O2 con las células vecinas produce ERO secundarias capaces de difundir y provocar un mayor daño oxidativo en las células24.
En el trabajo publicado por Rodrigues et al.18 los autores exponen que el tratamiento de T. mentagrophytes ATCC 9533 con NMB a una concentración de 10μM, con un tiempo de incubación de 30min y una dosis de luz de 20J/cm-2, es suficiente para conseguir que ningún superviviente del dermatofito se desarrolle. Como se ha mostrado en nuestro estudio, la dosis de 10μM no resultó suficiente en ningún caso para erradicar a la cepa CECT 2956 (ATCC 28443). La comparación de ambos datos apunta a que la susceptibilidad a la TFDa es cepa-dependiente, ya que en ambos casos el tiempo de incubación de las suspensiones fototratadas de forma similar, sembradas e incubadas sobre SB, fue de 14 días.
Por último, cabe mencionar que debido a que el estudio se ha realizado in vitro, no pueden extrapolarse sus resultados directamente para el tratamiento de las infecciones fúngicas en pacientes. Las dificultades experimentales no han permitido estudiar los efectos fotodinámicos sobre las hifas de T. mentagrophytes ni sobre sus macroconidios, ya que estos raramente son generados por el dermatofito cuando se cultiva en el laboratorio. Sin embargo, los resultados demuestran que el NMB es un FS a tener en cuenta para el tratamiento de las micosis cutáneas causadas por este dermatofito.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo se ha realizado con la ayuda recibida del Ministerio de Economía y Competitividad de España (CTQ2010-20870-C03-01 y CTQ2013-48767-C3-1-R).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses
Los autores también agradecen a SORISA la cesión de un equipo Photocare para la realización de este estudio.