El síndrome del nevus melanocítico congénito (SNMC) consiste en la proliferación anormal de melanocitos en la piel y el sistema nervioso central, y se debe a mutaciones de las células progenitoras durante el desarrollo embrionario. En muchas de estas células se han detectado mutaciones en el gen NRAS. Se exponen 5 casos de nevus melanocítico congénito gigante, 3 de ellos asociados al SNMC, en los que se ha estudiado dicha mutación. Hasta hace unos años la cirugía era el tratamiento de elección, sin embargo, sus resultados son insatisfactorios, con cirugías agresivas que no mejoran el aspecto estético y reducen mínimamente el riesgo de malignización. En el año 2013 se aprobó el trametinib en el uso del melanoma avanzado con mutaciones de NRAS. Dicho fármaco, que participa en la cascada intracelular de RAS-RAF-MEK-pERK-MAPK, podría ser útil en pacientes pediátricos con SNMC. El conocimiento más amplio de esta enfermedad permitirá crear nuevas estrategias.
Congenital melanocytic nevus syndrome (CMNS) is the result of an abnormal proliferation of melanocytes in the skin and central nervous system caused by progenitor-cell mutations during embryonic development. Mutations in the NRAS gene have been detected in many of these cells. We present 5 cases of giant congenital melanocytic nevus, 3 of them associated with CMNS; NRAS gene mutation was studied in these 3 patients. Until a few years ago, surgery was the treatment of choice, but the results have proved unsatisfactory because aggressive interventions do not improve cosmetic appearance and only minimally reduce the risk of malignant change. In 2013, trametinib was approved for use in advanced melanoma associated with NRAS mutations. This drug, which acts on the intracellular RAS/RAF/MEK/pERK/MAPK cascade, could be useful in pediatric patients with CMNS. A better understanding of this disease will facilitate the development of new strategies.
Los nevus melanocíticos congénitos se consideran hamartomas derivados de la cresta neural, producidos por mutaciones poscigóticas que determinan defectos en la migración y/o diferenciación de los melanocitos. Estos están presentes al nacimiento o se manifiestan a una edad muy temprana1.
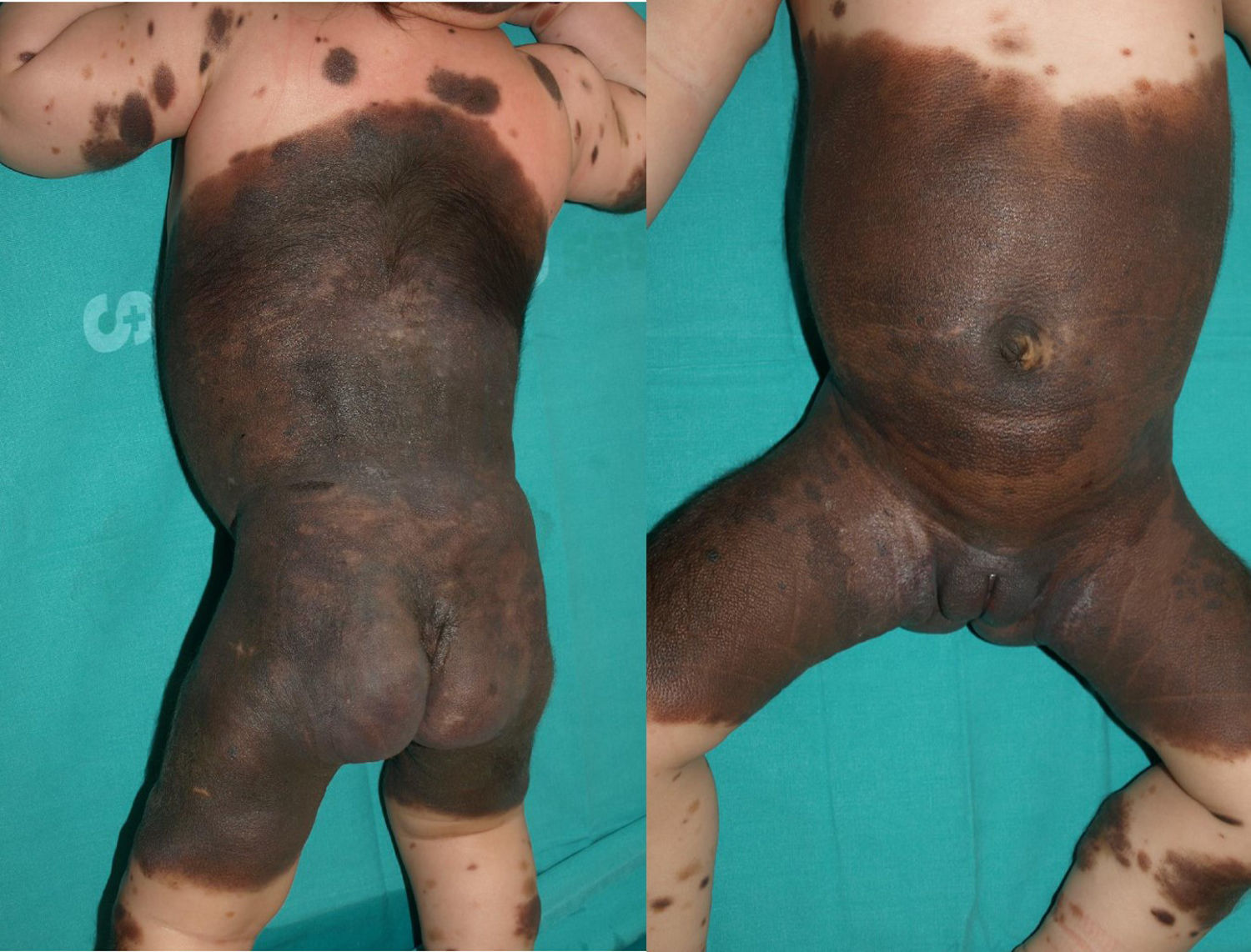
A diferencia del nevus melanocítico adquirido, el congénito suele ser de mayor tamaño y tiene una población celular doble. La primera corresponde a melanocitos de disposición juntural que evolucionan hacia la maduración e involución en la dermis. La segunda población neuromesenquimal corresponde a melanocitos de aspecto linfocitoide que infiltran más profundamente, llegando a los 2/3 inferiores de la dermis y al tejido celular subcutáneo, pudiendo infiltrar los anejos cutáneos y las estructuras vasculonerviosas2.
Kopf, en 1979, clasificó los nevus según su tamaño en pequeños (<1,5cm), medianos (1,5-20cm) y gigantes (>20cm). Además, cuando el nevus supera los 40cm y se encuentra en el tronco se denomina nevus melanocítico congénito gigante «en vestimenta»3.
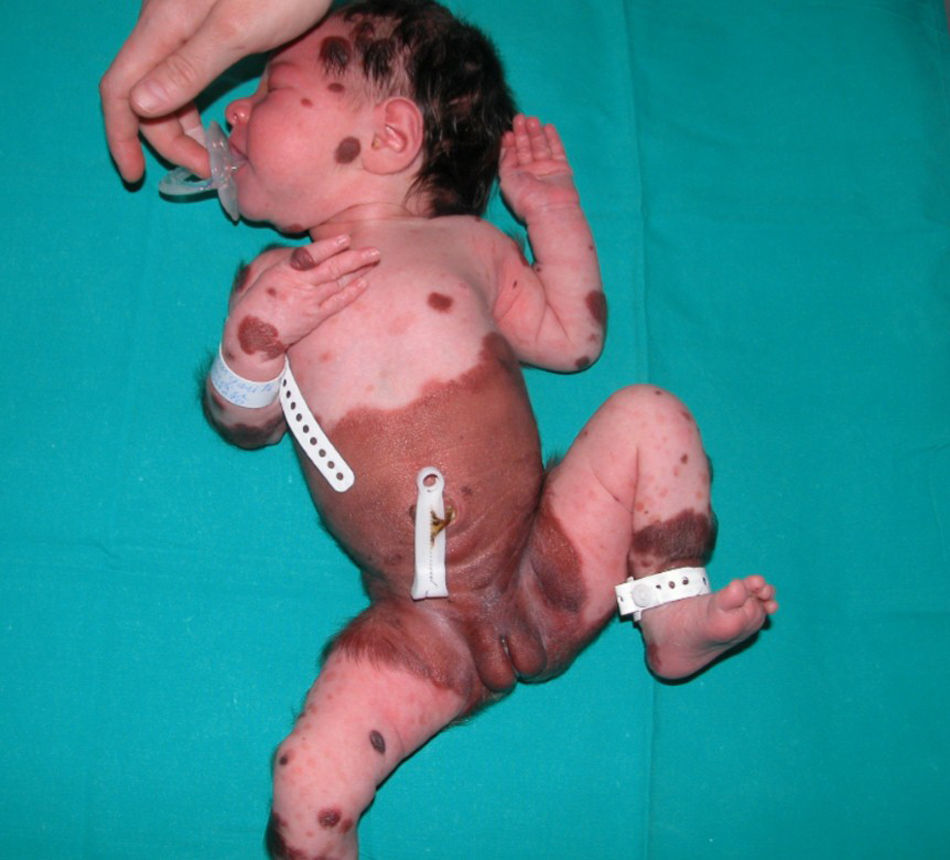
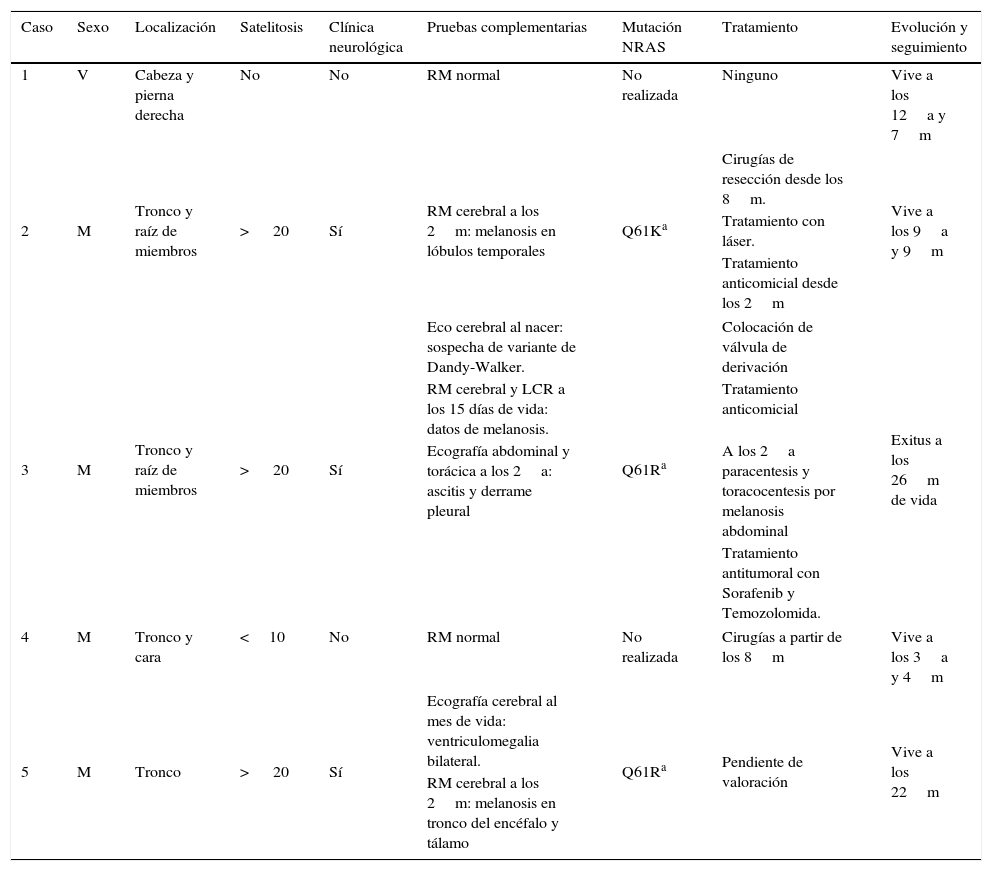
La presencia excesiva de células melanocíticas en la piel y el sistema nervioso central (SNC) fue descrito por Virchow en 1859, y denominada melanosis neurocutánea por Van Bogaert en 1948. En 1972 Fox propuso los criterios que definen esta entidad, posteriormente revisados en 1991 por Kadonga y Friedman4,5. Actualmente, para referirse a esta entidad, se prefiere el término «síndrome del nevus melanocítico congénito» y se define por la presencia al nacer de un nevus melanocítico de más de 5cm o más de un nevus de cualquier tamaño, asociado a compromiso neurológico (clínico o radiológico) y/o 3 o más rasgos faciales típicos6 (fig. 1).
El riesgo de desarrollar dicho síndrome en presencia de un NMCG varía según las series entre un 2,5% y un 45%7,8. Este riesgo es superior ante la presencia de nevus melanocíticos congénitos múltiples (lo que antes se denominaba «satelitosis») y, en menor medida, cuanto mayor es el tamaño del nevus9.
Serie de casosSe exponen los 5 casos de NMCG nacidos en un hospital terciario entre los años 2003 y 2014 de un total de 47.164 nacimientos consecutivos, lo cual permite estimar una incidencia de un caso por cada 9.450 recién nacidos vivos, muy superior a la descrita en la literatura que se estima en 1/20.000 recién nacidos vivos3,4. Además, los casos 2, 3 y 5 desarrollaron el síndrome del nevus melanocítico congénito (tabla 1).
Se exponen 5 casos de nevus melanocítico congénito gigante, 3 de ellos con melanosis neurocutánea, nacidos en un hospital terciario en un periodo de 15 años
| Caso | Sexo | Localización | Satelitosis | Clínica neurológica | Pruebas complementarias | Mutación NRAS | Tratamiento | Evolución y seguimiento |
|---|---|---|---|---|---|---|---|---|
| 1 | V | Cabeza y pierna derecha | No | No | RM normal | No realizada | Ninguno | Vive a los 12a y 7m |
| 2 | M | Tronco y raíz de miembros | > 20 | Sí | RM cerebral a los 2m: melanosis en lóbulos temporales | Q61Ka | Cirugías de resección desde los 8m. | Vive a los 9a y 9m |
| Tratamiento con láser. | ||||||||
| Tratamiento anticomicial desde los 2m | ||||||||
| 3 | M | Tronco y raíz de miembros | > 20 | Sí | Eco cerebral al nacer: sospecha de variante de Dandy-Walker. | Q61Ra | Colocación de válvula de derivación | Exitus a los 26m de vida |
| RM cerebral y LCR a los 15 días de vida: datos de melanosis. | Tratamiento anticomicial | |||||||
| Ecografía abdominal y torácica a los 2a: ascitis y derrame pleural | A los 2a paracentesis y toracocentesis por melanosis abdominal | |||||||
| Tratamiento antitumoral con Sorafenib y Temozolomida. | ||||||||
| 4 | M | Tronco y cara | <10 | No | RM normal | No realizada | Cirugías a partir de los 8m | Vive a los 3a y 4m |
| 5 | M | Tronco | > 20 | Sí | Ecografía cerebral al mes de vida: ventriculomegalia bilateral. | Q61Ra | Pendiente de valoración | Vive a los 22m |
| RM cerebral a los 2m: melanosis en tronco del encéfalo y tálamo | ||||||||
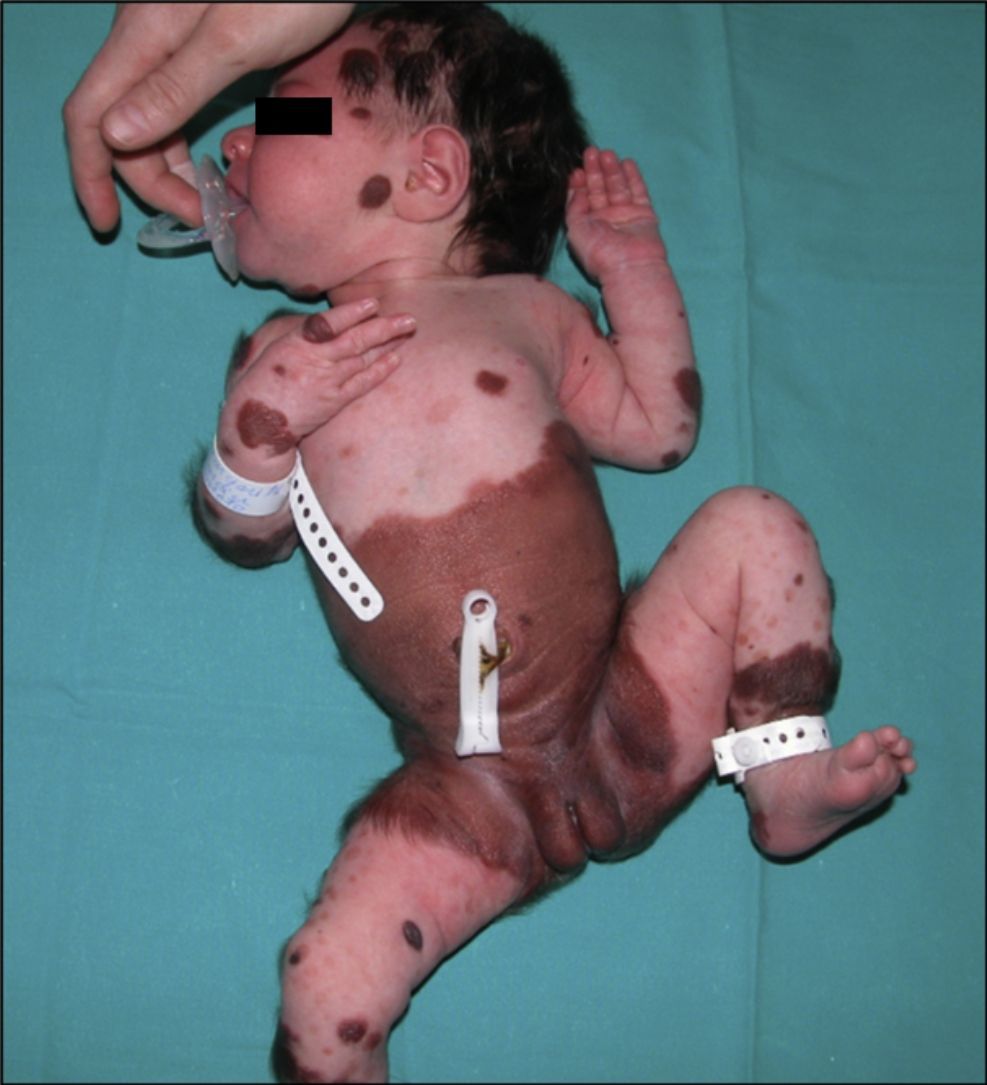
Se trata de una recién nacida mujer con NMCG en «vestimenta» y múltiples «lesiones satélite» que presentaba a los 2 meses de vida crisis parciales y lesiones hiperintensas en T1 en los lóbulos temporales en la resonancia magnética (RM) cerebral. Las lesiones cutáneas se trataron con cirugía y láser. El estudio de biología molecular de la lesión cutánea mostró la presencia de la mutación p.Q61K en NRAS. En la actualidad, la paciente tiene 9 años y 7 meses y presenta buena evolución (fig. 2).
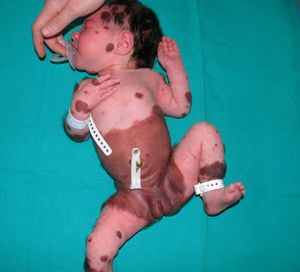
Caso 3Se trata también de una mujer con NMCG en «vestimenta» y «lesiones satélite» que presentaba en la ecografía prenatal de la semana 34 una imagen anecoica en la fosa posterior (fig. 3). Al nacimiento se realizó una ecografía transfontanelar donde se apreciaban ventriculomegalia e imágenes quísticas en relación con la variante de Dandy-Walker. A los 15 días de vida se realizó una punción lumbar que objetivó la presencia de células melánicas y una RM cerebral que mostró la presencia de melanosis en la amígdala, el tálamo, la cápsula interna y el tronco del encéfalo. A los 2 meses de vida comenzó con clínica de hipertensión intracraneal y se colocó una válvula de derivación ventrículo-peritoneal, con buena evolución hasta los 2 años, que comenzó con episodios repetidos de derrame pleural y ascitis masiva secundarios a una melanosis peritoneal. Ante este hallazgo se inicia tratamiento antitumoral con sorafenib y temozolamida, a pesar del cual fallece a los 26 meses de edad. La lesión también mostraba una mutación en p.Q61R en NRAS.
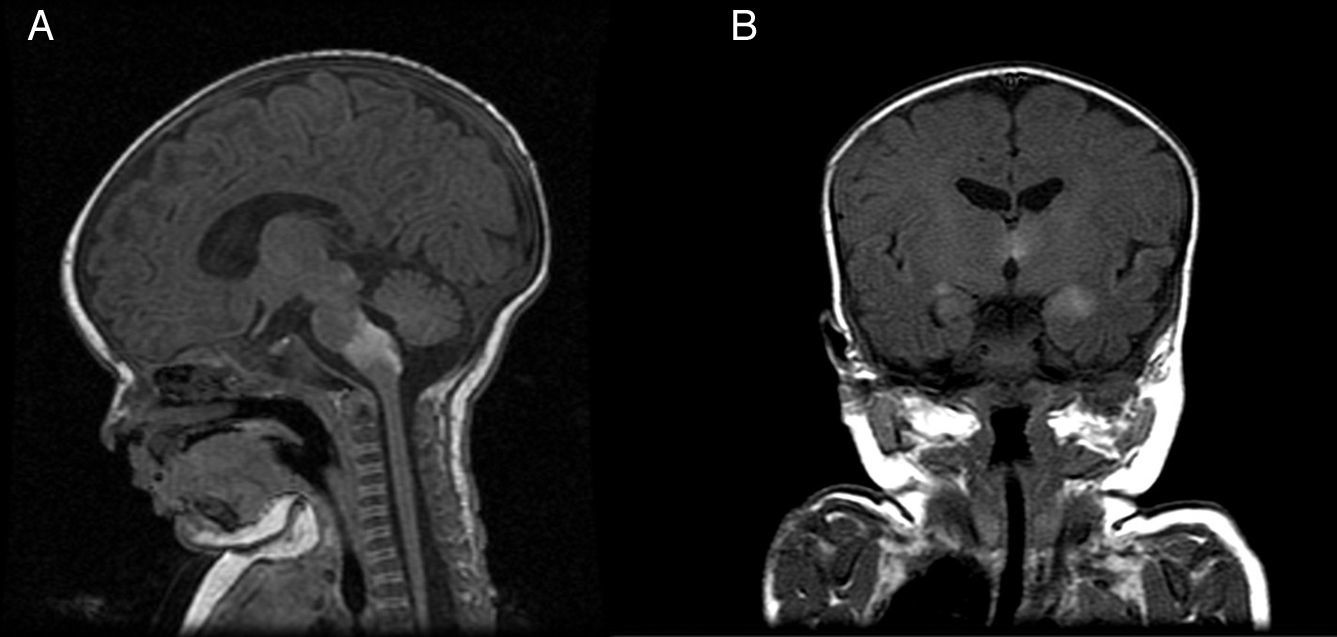
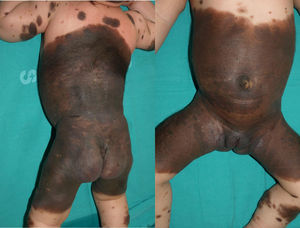
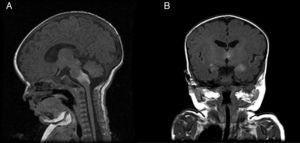
Caso 5Corresponde a una mujer con NMCG en «vestimenta» y «lesiones satélite» que presentaba al nacimiento una parálisis facial central derecha, una parálisis del VI par y una hipertonía marcada. En la ecografía cerebral se objetivó una ventriculomegalia bilateral, y en la RM cerebral se constató la presencia de lesiones de melanosis en los tálamos y en el tronco del encéfalo (fig. 4). La lesión también presentaba la mutación p.Q61R en NRAS. Actualmente tiene 20 meses y reside en Marruecos.
En ningún caso se detectaron lesiones cutáneas malignas durante el seguimiento.
DiscusiónSe ha postulado que el SNMC se origina por mutaciones poscigóticas y esporádicas que afectan a la proliferación y migración de los melanocitos entre las semanas 5.ª y 21.ª del desarrollo embrionario.
Un factor implicado es el factor de crecimiento hepático, capaz de unirse al receptor transmembrana c-met (tirosín quinasa) y activar la cascada RAS-RAF-MEK-pERK-MAPK estimulando el crecimiento de los melanocitos durante la morfogénesis.
Recientemente se ha descrito la mutación en el codón 61 del gen NRAS en estos pacientes, lo que podría determinar la aplicación de nuevas terapias. Dicha mutación aparece en células de la piel y del tejido nervioso de pacientes con SNMC; sin embargo, no se ha detectado en tejidos sanos7,10,11.
En torno al 10% de los pacientes con SNMC presentan síntomas neurológicos en algún momento de su vida, generalmente antes de los 2 años. Se distinguen 2 subgrupos, aquellos con melanosis intraparenquimatosa que tienen mejor pronóstico, y aquellos que desarrollan anomalías que precisan cirugía como la hidrocefalia o la siringomielia, o melanomas del SNC, todos ellos con un pronóstico más desfavorable9.
Los depósitos de melanina son normales en las leptomeninges, la base del cerebro, la cara ventral de la médula a nivel cervical y la sustancia negra12.
La prueba de imagen de elección para la detección de lesiones en el SNC es la RM cerebral, que se recomienda realizar en los primeros 6 meses de vida, sobre todo ante la presencia de 2 o más nevus melanocíticos congénitos. Las localizaciones más frecuentes son la amígdala, el cerebelo, la región pontina troncoencefálica y la médula espinal5.
En estudios recientes se sugiere que los niveles de dopamina en la orina podrían funcionar como un marcador pronóstico de la enfermedad, al encontrarse en algunas series valores más altos en los casos de SNMC respecto a los casos que no presentaron afectación del SNC13.
La presencia de un nevus gigante al nacimiento requiere un manejo multidisciplinar. El riesgo de desarrollar melanoma en estos pacientes no es tan alto como se pensaba (2% para los NMCG) y se desconoce si tras la cirugía disminuye ese riesgo, pues el 30% de las lesiones malignas no se desarrollan en el lecho de un nevus14.
Hasta ahora el tratamiento del síndrome del nevus melanocítico congénito sintomático era paliativo. Durante los últimos años se han aprobado para el tratamiento del melanoma metastásico fármacos que inhiben la activación de BRAF y de MEK, eficaces en los casos en que existen mutaciones en NRAS. Las mutaciones en BRAF son frecuentes en los nevus melanocíticos congénitos pequeños y en los nevus adquiridos, en cuya malignización desempeña un papel importante la exposición solar. Por otro lado, las mutaciones en NRAS se han encontrado en el 70-75% de los pacientes con NMCG y en el tejido nervioso de aquellos que presentan afectación del SNC. Dicho gen participa en la cascada intracelular NRAS-BRAF-MEK-pERK-MAPK, cuya activación estimula el crecimiento de melanocitos15.
Un artículo reciente hace referencia al uso compasivo de un inhibidor de MEK en un niño de 13 años con SNMC que falleció por progresión de la enfermedad, revelando la autopsia una menor expresión de pERK en las células melánicas11.
Los inhibidores de MEK podrían, potencialmente, emplearse en pacientes pediátricos seleccionados con NMCG y mutación del codón 61 de NRAS, con el objetivo de frenar la proliferación anómala de los melanocitos. Hacen falta estudios de calidad que demuestren la eficacia y seguridad de estos fármacos para el uso referido.
Las nuevas líneas de investigación y el conocimiento más amplio de la embriología y fisiopatología de esta enfermedad permitirán crear nuevos horizontes terapéuticos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.