El ruxolitinib oral es un inhibidor de la Janus Kinasa (JAK) 1 y 2, aprobado para el tratamiento de la policitemia vera (PV), la mielofibrosis (MF) y la enfermedad injerto contra huésped (EICH). También se utiliza fuera de ficha técnica para la leucemia neutrofílica crónica (LNC)1,2. Desde su comercialización, los informes de seguridad han revelado que existe un riesgo incrementado de cáncer cutáneo no melanoma (CCNM), especialmente de carcinoma escamoso cutáneo (CEC)3,4. Además, distintos casos publicados señalan una agresividad mayor en los CEC asociados al ruxolitinib1,5.
Ante el aumento de las indicaciones dermatológicas del ruxolitinib, se realizó un estudio retrospectivo bicéntrico que incluyó los pacientes que desarrollaron algún CEC durante el tratamiento con ruxolitinib. El estudio fue aprobado por el Comité de Ética de Investigación con Medicamentos (CEIM). De cada uno de los pacientes, se recogieron las características clínico-patológicas y evolutivas. El análisis descriptivo de las variables cualitativas se expresó como frecuencias absolutas, mientras que las variables cuantitativas se representaron como mediana (rango intercuartílico).
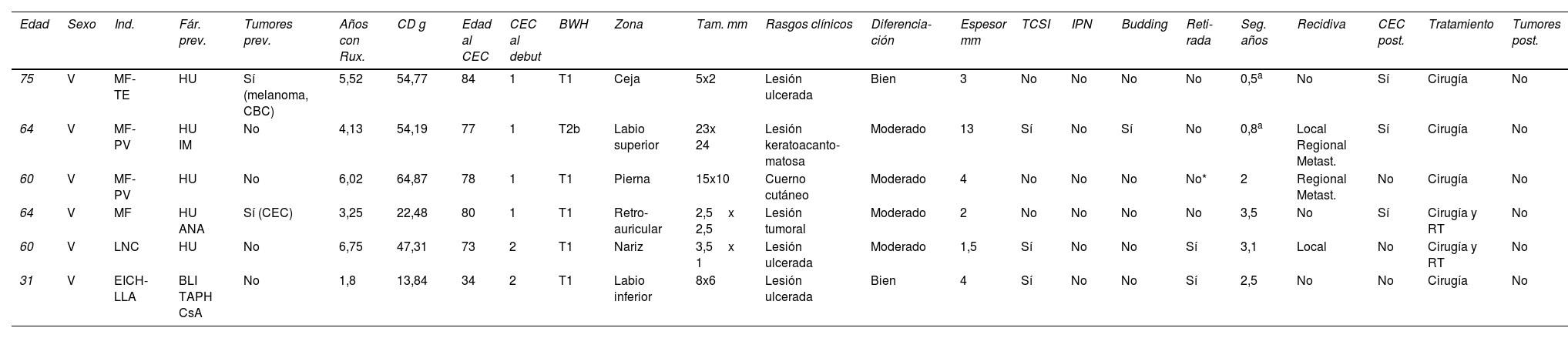
Se identificaron seis pacientes que durante el tratamiento con ruxolitinib desarrollaron al menos un CEC (tabla 1). Todos los pacientes fueron varones y el tratamiento lo recibían cuatro de ellos por una MF, uno por una EICH y otro una LNC. La mediana de edad al diagnóstico de la enfermedad de base fue de 62 años (rango: 52-66). Cinco habían sido tratados previamente con hidroxiurea. Dos casos presentaban antecedentes de cáncer cutáneo. Los pacientes desarrollaron los CEC tras una mediana de 4,8 años (rango: 2,9-6,2) de tratamiento con ruxolitinib y una dosis acumulada de 50,8 (20,2-57,9) g de mediana y una edad mediana de 77,5 años (rango: 67-81).
Características clínico-patológicas de los carcinomas escamosos cutáneos de la serie
| Edad | Sexo | Ind. | Fár. prev. | Tumores prev. | Años con Rux. | CD g | Edad al CEC | CEC al debut | BWH | Zona | Tam. mm | Rasgos clínicos | Diferencia-ción | Espesor mm | TCSI | IPN | Budding | Reti-rada | Seg. años | Recidiva | CEC post. | Tratamiento | Tumores post. |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 75 | V | MF-TE | HU | Sí (melanoma, CBC) | 5,52 | 54,77 | 84 | 1 | T1 | Ceja | 5x2 | Lesión ulcerada | Bien | 3 | No | No | No | No | 0,5a | No | Sí | Cirugía | No |
| 64 | V | MF-PV | HU IM | No | 4,13 | 54,19 | 77 | 1 | T2b | Labio superior | 23x 24 | Lesión keratoacanto-matosa | Moderado | 13 | Sí | No | Sí | No | 0,8a | Local Regional Metast. | Sí | Cirugía | No |
| 60 | V | MF-PV | HU | No | 6,02 | 64,87 | 78 | 1 | T1 | Pierna | 15x10 | Cuerno cutáneo | Moderado | 4 | No | No | No | No* | 2 | Regional Metast. | No | Cirugía | No |
| 64 | V | MF | HU ANA | Sí (CEC) | 3,25 | 22,48 | 80 | 1 | T1 | Retro-auricular | 2,5x 2,5 | Lesión tumoral | Moderado | 2 | No | No | No | No | 3,5 | No | Sí | Cirugía y RT | No |
| 60 | V | LNC | HU | No | 6,75 | 47,31 | 73 | 2 | T1 | Nariz | 3,5x 1 | Lesión ulcerada | Moderado | 1,5 | Sí | No | No | Sí | 3,1 | Local | No | Cirugía y RT | No |
| 31 | V | EICH-LLA | BLI TAPH CsA | No | 1,8 | 13,84 | 34 | 2 | T1 | Labio inferior | 8x6 | Lesión ulcerada | Bien | 4 | Sí | No | No | Sí | 2,5 | No | No | Cirugía | No |
ANA: anagrelida; ATI: invasión del tejido celular subcutáneo; BLI: blinatumomab; BWH: sistema de clasificación de carcinomas escamosos cutáneos del Brigham and Women's Hospital6; CBC: carcinoma basocelular, CD: dosis acumulada; CEC: carcinoma escamoso cutáneo; CsA: ciclosporina A; EICH: enfermedad injerto contra huésped; Fár: fármacos previos; HU: hidroxiurea; IM: imatinib; Ind: indicación; IPN: invasión perineural; LLA: leucemia linfocítica aguda; LNC: leucemia neutrofílica crónica; metast.: metastásicos; MF: mielofibrosis; prev.: previo; PV: policitemia vera; post: posteriores; RT: radioterapia; Rux.: ruxolitinib; Seg.: seguimiento; Tam.: tamaño; TAPH: trasplante alogénico de precursores hematopoyéticos; TE: trombocitemia esencial; V: varón.
En el momento del diagnóstico, dos pacientes presentaron dos CEC, siendo la localización más frecuente el área facial (labio). De acuerdo con el sistema de clasificación de carcinomas escamosos cutáneos del Brigham and Women's Hospital, cinco casos fueron T1 y uno T2b6. La presentación clínica fue heterogénea, siendo lo más común una lesión ulcerada, la mediana del tamaño fue 6,5x4,2mm. En cuatro casos, el grado de diferenciación fue moderado. La mediana del espesor tumoral fue de 3,5mm (rango: 1,8-6,2). En tres casos hubo infiltración del tejido celular subcutáneo, ningún caso mostró infiltración perineural y en un caso se identificó «budding» tumoral. El fármaco se retiró en dos casos de manera consensuada con el paciente. Tras un seguimiento de 2,25 años (rango: 0,72-3,2), hubo una recidiva local y dos metastásicas, una a la piel y otra al pulmón. Tres pacientes presentaron CEC adicionales. Todos los pacientes fueron tratados con cirugía y dos de ellos también recibieron radioterapia. Dos pacientes fallecieron, uno por las metástasis pulmonar del CEC y otro por su enfermedad de base.
Esta serie de casos recoge de manera sistemática las características clínicas y anatomopatológicas de los CEC en pacientes tratados con ruxolitinib, incluyendo los primeros pacientes de la literatura con EICH y LNC.
Se han identificado como factores de CEC de alto riesgo para el desarrollo de una metástasis regional o a distancia la localización en labio o auricular, la presencia de múltiples CEC, la recurrencia, la inmunosupresión, el tamaño mayor a 2cm, la invasión perineural, la pobre diferenciación y, recientemente, el budding tumoral7. A pesar de que las características clínico-patológicas de los tumores primarios de la serie no destacaban por ser de alto riesgo, según los actuales sistemas de clasificación, es resaltable que dos de los seis casos presentasen metástasis a distancia en el seguimiento, lo que sugiere una mayor agresividad.
Los primeros estudios que reflejaron un riesgo elevado de CCNM asociado al ruxolitinib fueron los ensayos clínicos aleatorizados que demostraron su eficacia en MF y PV3,4. Por otro lado, el ruxolitinib no ha mostrado un aumento de CCNM en EICH o LNC8,9. Posteriormente, se publicaron seis casos y una serie de cinco casos de CEC durante la exposición al fármaco, donde los autores alertaron de su carácter agresivo (Material suplementario. tabla 1).
Existen múltiples factores que podrían ser los responsables de la mayor tasa de CEC en estos pacientes, entre los que destaca la HU. Para determinar la influencia real del fármaco, se realizó una cohorte retrospectiva a diez años conformada por 188 pacientes con PV/MF expuestos a ruxolitinib y 376 no expuestos. Después del ajuste por hidroxiurea, el cociente de riesgo (HR) asociado a ruxolitinib fue de 2,69 (IC del 95%: 1,03-7,02) para el desarrollo de un CCNM y de 3,24 (IC del 95%: 1,45- 7,22) para el CEC10.
La razón subyacente de este riesgo no está clara. El ruxolitinib disminuye el número y actividad de las células NK, la función y migración de las dendríticas, el número de células T y las interleucinas inflamatorias. Por tanto, la vigilancia inmuno-oncológica puede afectarse 1,2. Por otro lado, la decisión de suspender el fármaco es controvertida. Algunos autores optan por suspenderlo mientras que, si la enfermedad de base no está controlada y se asocia a un CEC metastásico, se puede mantener combinándolo con un anti-PD11,11.
Dado que los inhibidores de JAK están posicionándose como unos fármacos de 1ª línea en algunas de las patologías dermatológicas más frecuentes, se requiere de una mayor evidencia para establecer el posible aumento del riesgo de desarrollar CEC agresivos en estos pacientes. La decisión de suspender el fármaco debe individualizarse.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Virginia Velasco Tirado, Dra. Mónica Pozuelo Ruiz, Dr. Alberto Romo Melgar, Dr. Carlos Abril Pérez, Dra. Concepción Román Curto, Dr. Miguel Navarro Mira, Dr. Francisco Domínguez de Luis y Dra. Begoña Escutia Muñoz por colaborar con la aportación de casos y seguimiento de estos.