El Rituximab se ha introducido en Medicina como un agente terapéutico con un futuro muy prometedor. Después de su empleo en casos de linfomas B y artritis reumatoide son numerosas las indicaciones que se han establecido dentro de las enfermedades autoinmunes, muchas de ellas dermatológicas. Es por ello que los dermatólogos debemos familiarizarnos con las características de los anticuerpos anti-CD20, así como con el papel de las células B en muchas enfermedades cutáneas. Estos 2 hechos permitirán que pueda utilizarse este fármaco cada vez más y mejor en nuestros pacientes, y a su vez puedan establecerse guías consensuadas de su uso basadas en series amplias de pacientes; es decir, podremos establecer en qué circunstancias y situaciones rituximab estará indicado, acortando de esta manera la enfermedad y disminuyendo la morbilidad en los enfermos por el empleo de fármacos más específicos.
Rituximab was introduced into clinical practice as a medication with considerable potential. Its use in patients with B-cell lymphoma and rheumatoid arthritis revealed numerous indications in autoimmune diseases, many of which involve the skin, thus requiring dermatologists to become familiar with both the characteristics of anti-CD20 antibodies and the role of B cells in multiple skin diseases. Thanks to these developments, we will be able to use rituximab more frequently and appropriately in our patients and draw up consensus guidelines based on large case series. In other words, establishing the indications for rituximab will make it possible to shorten disease course and reduce morbidity due to more specific drugs.
Dentro de la Dermatología, al igual que ha ocurrido en la Medicina en general, la introducción de nuevas terapéuticas han marcado un antes y un después en el manejo de los pacientes. En algunos casos ha sido la indicación novedosa de un producto ya existente, y en otros casos, en cambio, ha sido el empleo por primera vez de una nueva molécula. Así por ejemplo ocurrió con el uso de los retinoides en el tratamiento de la psoriasis o del acné1,2, con la ciclosporina como agente inmunosupresor en trasplantes y después en tantos procesos dermatológicos autoinmunes3, con los fármacos biológicos en el manejo de formas rebeldes de psoriasis4, o más recientemente con el propanolol en el tratamiento de los angiomas5, solo por citar algunos ejemplos. En esta misma esfera de hitos terapéuticos habría que encuadrar a los anticuerpos anti-CD20, inicialmente como indicación en el tratamiento de los linfomas6 y posteriormente en procesos autoinmunes, muchos de ellos dermatológicos. En este, como en otros muchos casos, los procesos dermatológicos han ido tras la estela marcada en el manejo de otros procesos dentro de la onco-hematología, y solo cuando se ha comprendido mejor su mecanismo de acción se ha podido iniciar su administración en otras enfermedades.
La mayoría de los dermatólogos están familiarizados con las enfermedades propuestas por la FDA para el empleo de los anticuerpos anti-CD20 (rituximab [Rtx]). Sin embargo, cada vez son más numerosas las nuevas indicaciones en las que el Rtx puede tener un lugar destacado en el tratamiento y manejo de ciertas enfermedades. Este hecho es debido, principalmente, a que, en contra de lo que se pensaba, este fármaco no es útil solamente en aquellos procesos en los que los autoanticuerpos tienen un papel destacado, sino en todas aquellas enfermedades en las que las células B desempeñan un papel relevante en su patogenia. Esto ha llevado a establecer 2 puntos importantes: ha permitido conocer mejor el papel de las células B en la autoinmunidad6 y ha creado el concepto de B-cell directed therapy for immflamatory skin diseases7 para defininir realmente el significado y el alcance terapéutico que tiene este fármaco. Es decir, partiendo de la base de que las células B tienen un papel y una función en las enfermedades autoinmunes más amplios de lo que se pensaba, se ha establecido la idea de un tratamiento patogénico mediante la administración de Rtx en ciertas enfermedades por el hecho de que estén mediadas con este tipo de células, no necesariamente mediadas por autoanticuerpos.
Así pues, son varios los conceptos que surgen en estas reflexiones y ante los que intentaremos profundizar en esta revisión, y que serán el hilo conductor de esta revisión sobre Rtx en Dermatología. En concreto, deseamos desarrollar los siguientes aspectos relacionados con este fármaco: cuáles son sus características, cuál es su mecanismo de acción, cuáles son las indicaciones y qué puntos deberemos tener en cuenta a la hora de manejar Rtx.
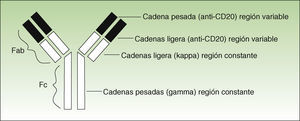
Características del fármacoRtx es un anticuerpo monoclonal quimérico IgG1 kappa compuesto de una fracción Fab murina y de otra Fc humana8–10. Se une específicamente a una proteína transmembrana-antígeno CD20-, el cual se expresa en las células B a partir de las células pre-B y hasta las células preplasmáticas, pero no en células linfopoyéticas más inmaduras o en células plasmáticas maduras. Esta selectividad del Rtx por las células que expresan este antígeno permite alterar mínimamente la producción de inmunoglobulinas. A su vez, permite que las stem cells reinicien con el tiempo la producción nuevamente de células B, o dicho de otra manera y como luego se comentará con más profundidad, aunque no se eliminan directamente las células productoras de anticuerpos, Rtx depleciona las células B con memoria (precursoras de las células plasmáticas CD20-), y de este modo inhibe indirectamente la producción de autoanticuerpos durante un tiempo prolongado.
A pesar de todo, no es conocida la función ni el ligando del antígeno CD2011. A su vez, y sin que se tengan razones para explicarlo, la acción del Rtx en células que expresen este antígeno es diferente dependiendo de dónde asienten. Así, por ejemplo, los anticuerpos anti-CD20 actúan de forma más precisa en células circulantes y en las células localizadas en la región folicular del bazo que en las células ubicadas en las regiones marginales de los ganglios12–14.
Los anticuerpos utilizados en los pacientes pueden ser de varios tipos: humanos (toda la molécula presenta la estructura observada en el ser humano), humanizados (la fracción constante es totalmente humana, así como parte de la porción variable: casi todo el anticuerpo es humano), murinos o de otra especie (toda la molécula es copia de otra especie animal) y quiméricos (la fracción constante es toda humana, y la porción variable es de otra especie) (fig. 1).
A pesar de utilizarse durante años el Rtx, demostrándose su eficacia desde 19871, no fue hasta 2006 cuando la FDA aprobó el uso de este fármaco como primera línea de tratamiento en el línfoma folicular avanzado, y para la artritis reumatoide en el mismo año. Posteriormente se han ido añadiendo otros procesos linfoproliferativos como el linfoma difuso de células grandes B y la leucemia linfática crónica. No existe hoy en día ninguna aprobación oficial para el uso de Rtx en procesos dermatológicos. Eso no significa que no se hayan establecido consensos para su uso en algunas enfermedades de la piel, indicándose en pacientes en los que los tratamientos convencionales no han surtido efecto9,15.
Mecanismo de acción de rituximabPara entender el mecanismo de actuación del Rtx es necesario conocer en primer lugar cómo actúan las células B en las enfermedades autoinmunes. Precisamente, muchas de las acciones de estas células en este tipo de procesos han sido conocidas mejor desde la introducción de los anticuerpos anti-CD20.
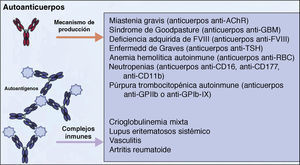
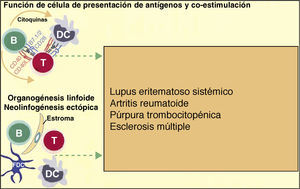
Clásicamente, es aceptado que las células B contribuyen en la economía, así como en muchas enfermedades, con producción de anticuerpos o autoanticuerpos. De hecho, durante años se pensó que esta era casi la única acción relevante de estas células. Buena parte de los autores aceptaba que la presencia de autoanticuerpos era el hallazgo sine qua non para asignar un papel de las células B en las enfermedades autoinmunes. Estos autoanticuerpos proporcionaban criterios diagnósticos y pronósticos, y se les asignó un papel clave en la patogenia de algunas enfermedades. Así, los autoanticuerpos se implicaron en procesos en los que su acción, a través de la unión a antígenos concretos, desarrollaba una enfermedad determinada. Por otra parte, su determinación en sangre periférica permitía el diagnóstico de la enfermedad y analizar su pronóstico. Pudo demostrarse que muchos de estos autoanticuerpos potenciaban el daño de los tejidos a través de su fracción Fc, al unirse a células inflamatorias que aumentaban aún más la inflamación local. Además, se comprobó que en otras enfermedades las células B contribuían en la patogenia mediante la producción de autoanticuerpos y la formación de complejos inmunes circulantes. Estos anticuerpos producirían un daño en el tejido donde se depositan. Este fenómeno se ha descrito en procesos como la vasculitis leucocitoclástica por crioglobulinas, o también en la nefritis lúpica6 (fig. 2). La descripción de polimorfismos en los receptores Fc de alta y baja afinidad en ciertas enfermedades como lupus eritematoso sistémico (LES) y púrpura trombocitopénica puede marcar la especificifidad en la respuesta inmunológica16.
La acción de los autoanticuerpos producidos por las células B pueden mediar el daño tisular a través su unión a antígenos específicos, o mediante su depósito en los tejidos una vez agrupados en complejos inmunes circulantes. Tomada de Martin F et al. 6.
Más recientemente, en enfermedades autoinmunes como el LES, la artritis reumatoide o la púrpura trombocitopénica autoinmune, se ha descubierto que las células B podrían tener un efecto proinflamatorio adicional, actuando como células presentadoras de antígenos a los linfocitos T, aumentando la inflamación de los tejidos con la producción de citoquinas y favoreciendo la producción de tejido linfoide ectópico6 (fig. 3). Así pues, la descripción de más acciones de las células B de las que inicialmente se habían descrito ha permitido ampliar las indicaciones de los fármacos que deplecionan las células B.
Las células B, además, pueden contribuir a la inflamación activamente en las enfermedades autoinmunes mediante la acción de células presentadoras de antígenos a los linfocitos T, y coestimulando el proceso inflamatorio mediante la producción propia de citoquinas al medio. Además, pueden intervenir en la respuesta inflamatoria mediante la formación de tejido linfoide ectópico. Tomada de Martin F et al.6
Los mecanismos por los cuales los anticuerpos anti-CD20 actuarían sobre las células que expresan este antígeno, destruyéndolas y eliminándolas, son principalmente de 3 tipos: mediante citotoxicidad celular desencadenada por el propio anticuerpo; a través de un daño celular mediado por complemento y también induciendo mecanismos de apoptosis en las células sobre las que actúan17,18.
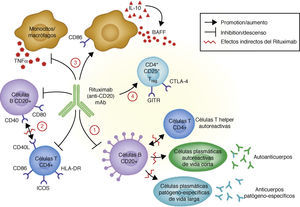
Así pues, de todo lo dicho se puede afirmar que, si bien la acción del Rtx se centra en la acción sobre las células B, su indicación en enfermedades autoinmunes no es solamente por su papel sobre la producción de autoanticuerpos18, sino que existirían otras dianas sobre las que el Rtx actuaría para conseguir el efecto terapéutico (fig. 4):
- 1
La acción más conocida de los anticuerpos anti-CD20, como ya se ha comentado, es a través de la depleción de células B CD20+, lo que resulta en un descenso tanto en la generación de novo de células plasmáticas (autorreactivas), como en la producción de autoanticuerpos.
- 2
A su vez, el Rtx puede interferir en la expresión de la molécula CD40 y de la CD80 en la superficie celular del linfocito B19,20, y de las moléculas CD69, ICOS, HLA-DR y CD40L en las células CD4+Th20–22. De este modo, este fármaco podría regular señales de coestimulación claves, como por ejemplo a través de CD40-CD40L, necesarias para la interacción entre linfocitos B y T, anulando así la acción de estas células en procesos autorreactivos inmunológicos23.
- 3
Un efecto destacado del Rtx es también sobre la producción de ciertas citoquinas proinflamatorias. En concreto, se ha comprobado que disminuye la producción de TNF-α derivado de los monocitos/macrófagos, mientras que la producción de IL-10 y de B-cell-activating factor (BAF) está aumentada. Además, la IL-10 puede aumentar los niveles de BAFF de forma autocrina y paracrina. En este mismo sentido, está aumentada la expresión del CD86 en la superficie celular de monocitos/macrófagos24.
- 4
Por último, la acción de los anticuerpos anti-CD20 se llevaría a cabo mediante la inducción de células CD4+CD25+ T reguladoras (Treg). Estas células pueden identificarse por el aumento en la expresión de ARNm para forkhead box P3 (Foxp3), glucocorticoid-induced tumor necrosis factor receptor family-related gen (GITR) y de cytotoxic T-lymphocyte antigen-4 (CTLA-4)25–27.
Mecanismos de acción del rituximab. Tomada de Nagel A et al.18
De todos los estudios mostrados se desprende una idea fundamental, y es que la acción del Rtx es más amplia de lo que en un primer momento podría pensarse, abarcando desde una acción directa sobre la producción de autoanticuerpos, pasando por procesos intermedios en la respuesta autoinmune (relación linfocito B/T), y para terminar regulando la propia respuesta inmunológica mediante un aumento de células que controla la respuesta misma. Resulta importante señalar también que la intensidad de cada una de estas acciones puede variar mucho en función de las características del anticuerpo monoclonal anti-CD20 que se estudie.
El efecto conseguido por el Rtx ocurre de forma rápida, pero de forma desigual en los pacientes y en las enfermedades estudiadas. Así, en pacientes con artritis reumatoide solo un 20% de los pacientes presentaron depleción completa de células B en la sinovial al mes de realizar el tratamiento28, aunque se observó una disminución global de la inflamación en todos los pacientes. En pacientes con pénfigo vulgar se ha descrito una rápida depleción de células CD19+ (células B), que se objetiva ya a los pocos días del tratamiento, y que como media se mantiene entre 6-9 meses, llegando incluso hasta los 15 meses29. Este efecto ha sido observado en nuestra experiencia30. Pero lo interesante del efecto conseguido por este fármaco es que los linfocitos CD20+, cuando reaparecen nuevamente meses después en el torrente sanguíneo, lo hacen procedentes de células naive, con un nuevo perfil de producción de anticuerpos. Es decir, muchos de estos linfocitos CD20+ reaparecen «reformateados», sin la «programación» para producir autoanticuerpos28,31,32. El conseguir en mayor o menor medida este efecto llevará a que se obtenga una mejor o peor respuesta prolongada en cada paciente.
Dosis y administraciónEn la actualidad existen 3 protocolos de Rtx en curso utilizados en las diferentes enfermedades en las que se ha empleado este fármaco18:
- 1.
Administración semanal de 375mg/m2, durante 4-8 semanas. Este es el esquema que se empezó a utilizar en pacientes con linfoma y que desde su inicio se usa también en otras enfermedades autoinmunes. En 1994 se estableció esta dosis como las más eficaz33.
- 2.
Administración de 2 dosis bisemanales, cada una de 1.000mg. Inicialmente se empezó a utilizar en pacientes con artritis reumatoide34, y posteriormente se ha usado este mismo esquema en pacientes con LES35, dermatomiositis36 o dermatitis atópica37.
- 3.
Finalmente, se han utilizado también los anticuerpos anti-CD20 intralesionalmente, principalmente en linfomas cutáneos (dosis 10mg/ml, administrando al paciente 1ml por lesión durante varias sesiones)38, linfomas orbitarios39 e hiperplasia linfoide40.
A su vez, el tratamiento con Rtx se ha asociado a otros fármacos dependiendo de la enfermedad que se desea tratar. Estos esquemas terapéuticos han cambiado según se ha ido conociendo mejor cómo actúa este fármaco. En concreto, en el LES no se han mostrado diferencias entre una sola dosis de 100mg/m2 o 375mg/m2, comparado con 375mg/m2 en 4 sesiones41. En pacientes con artritis reumatoide no se observó un beneficio añadido cuando se administraron 4 sesiones semanales de Rtx de 375mg/m2, comparado con solamente 2 sesiones42. Como idea general, además, la administración repetida de ciclos periódicamente puede producir mejoras en los pacientes, sin observarse más efectos secundarios43. En enfermedades ampollosas autoinmunes existen pocos estudios con un número importante de pacientes. No obstante, en esas series se establece que con solo 2 ciclos de Rtx se puede obtener una respuesta completa44, y en otros casos la respuesta puede ser más tardía, necesitándose ciclos de mantenimiento durante un tiempo más prolongado45. Por tanto, quedan por conocer aún más las características del fármaco para poderlo administrar de una manera más eficaz, con esquemas terapéuticos que aporten un beneficio mayor a los pacientes, dependiendo de la enfermedad que deseemos tratar.
Se han descrito en la literatura varios estudios llevados a cabo en enfermedades ampollosas autoinmunes que comparan la respuesta del Rtx con otros fármacos inmunomoduladores o inmunosupresores9. Como idea general, no existen estudios que confirmen que sea necesario asociar otros fármacos al Rtx (aparte de corticoesteroides) para conseguir el efecto deseado. Recientemente hemos estudiado 28 pacientes con pénfigo vulgar y pénfigo foliáceo tratados con Rtx en diferentes esquemas terapéuticos (con o sin inmunoglobulinas) y observamos que la administración de dosis intermedias de corticoesterodes, junto a Rtx 375mg/m2 en 4 sesiones semanales, era suficiente para controlar la enfermedad. La asociación de otros fármacos no aportaba ningún beneficio terapéutico a los pacientes46.
Por último, dadas las características del fármaco, es importante tener presentes una serie de pautas a la hora de administrarlo, independientemente de la enfermedad que deseemos tratar. Tal y como se ha comentado ya, el Rtx, al tratarse de un anticuerpo quimérico murino, no deberemos administrarlo si es conocida una sensibilización del paciente a proteínas de ratón. A pesar de todo, para evitar posibles reacciones adversas que después analizaremos, se recomienda realizar un pretratamiento a todos los pacientes, consistente en la administración de metilprednisolona, acetaminofen y difenhidramina. Por lo general, la velocidad de administración inicial deberá ser de 50mg/hora. Si no se observan reacciones adversas podrá aumentarse esta velocidad 50mg/hora cada 30 minutos, hasta un máximo de 400mg/hora. Si la primera infusión es bien tolerada las posteriores podrán comenzarse a 100mg/hora hasta un máximo de 400mg/hora (ver ficha técnica del producto disponible en: http://www.linfoma.roche.es/FichaTecnicaMabth.pdf).
Reacciones adversasPueden clasificarse en diferentes categorías, dependiendo del tipo de reacción y del mecanismo implicado (para una información más detallada consultar la ficha técnica disponible en: http://www.linfoma.roche.es/FichaTecnicaMabth.pdf).
- 1.
Reacciones relacionadas con la perfusión. Los diferentes estudios llevados a cabo en pacientes muestran que en más del 50% de los casos aparecen reacciones relacionadas con la perfusión del fármaco, y en la mayoría de los casos coincide con la primera administración y durante las 2 primeras horas de la infusión. Estos efectos secundarios son de escasa gravedad (grado i/ii de la NCI Toxicity Grade) hasta en el 80-90% de los casos47, y consisten principalmente en fiebre, escalofríos y rigidez. Otros síntomas pueden ser rubor, angioedema, broncoespasmo, vómitos, náuseas, urticaria/exantema, fatiga, cefalea, irritación de garganta, rinitis, prurito, taquicardia, hipertensión, hipotensión, disnea y dispepsia. Las reacciones graves relacionadas con la perfusión (broncoespasmo o hipotensión) pueden ocurrir hasta en el 10% de los casos. De especial relevancia son las complicaciones cardiológicas que se han descrito durante la perfusión, muchas veces reactivándose enfermedades previas (infarto de miocardio, fibrilación auricular, edema pulmonar e insuficiencia cardiaca congestiva). Este hecho ha establecido como contraindicación del uso de Rtx en pacientes con dolencia cardiaca grave previa. Además, dado que puede presentarse hipotensión durante el tratamiento con Rtx, suele recomendarse la no administración de antihipertensivos 12 horas antes de la infusión. Las reacciones más leves relacionadas con la perfusión se resuelven generalmente reduciendo la velocidad de la perfusión. Esta velocidad puede incrementarse nuevamente cuando mejoran los síntomas.
- 2.
Síndrome de lisis tumoral/síndrome de liberación de citoquinas. Ambos procesos están íntimamente relacionados. Aparecen principalmente en pacientes con una masa tumoral importante, cuya destrucción libera al torrente circulatorio gran cantidad de citoquinas. Se caracterizan por la presencia de lesiones urticariformes generalizadas con angioedema asociado a fiebre, broncoespasmo e hipoxia. Además, puede acompañarse de hiperuricemia, hiperpotasemia, hipocalcemia, hiperfosfatemia, fallo renal agudo y elevación de LDH. El fallo respiratorio puede asociarse con infiltrado intersticial o edema pulmonar. En ocasiones estas complicaciones aparecen en la primera o segunda hora de administración del fármaco durante la primera infusión. Los pacientes con insuficiencia pulmonar o infiltración pulmonar tumoral presentan un riesgo mayor para desarrollar síndrome de lisis tumoral, por lo que deberán adoptarse más precauciones en la utilización del Rtx administrando el fármaco más lentamente. Si los efectos secundarios son severos deberá suspenderse la administración de Rtx. En caso de poder administrar nuevamente el fármaco en sesiones posteriores debemos saber que no suele repitirse el síndrome de liberación de citoquinas en las sesiones posteriores.
- 3.
Reacciones de hipersensibilidad. Este tipo de reacciones se presentan durante los primeros minutos de la infusión. Suelen presentarse como reacciones anafilácticas, y en ocasiones parecerse a las reacciones por liberación de citoquinas, pero varía el tiempo de aparición. Conviene disponer de fármacos adecuados para el uso inmediato en este tipo de reacciones, como adrenalina, antihistamínicos y glucocorticoides.
- 4.
Infecciones. Este es un punto muy debatido en relación con el uso de este fármaco. Por una parte, este tratamiento está contraindicado en pacientes que presentan infecciones activas graves (tuberculosis, sepsis, infecciones oportunistas, etc.), y en aquellos enfermos con una inmunodeficiencia grave (niveles de CD4 o CD8 muy bajos). Se recomienda realizar niveles de inmunoglobulinas antes de iniciar el tratamiento con anti-CD20 ya que el riesgo de infección aumenta cuando cuando existe hipogammaglobulinemia. A su vez, este riego se incrementa cuando se produce neutropenia, un efecto secundario que puede aparece de forma tardía en los pacientes tratados con Rtx. A su vez, el médico deberá tener especial precaución en el caso de pacientes con infecciones crónicas o recurrentes, o cuando las condiciones clínicas del paciente predisponga a un riesgo mayor de infecciones. Se han notificado casos de reactivación de virus de la hepatitis B. Por estos motivos, en pacientes con historia de hepatitis es necesario realizar la carga viral antes de iniciar el tratamiento
Los médicos deberán examinar el estado de vacunación de los pacientes y seguir las guías actuales de vacunación antes del tratamiento con Rtx. No está determinada la seguridad de Rtx combinando el uso de vacunas con virus vivos. Por eso no se recomienda su uso en pacientes durante el tratamiento con Rtx, y durante el tiempo que estén deplecionados los linfocitos B. Con la vacunación con virus inactivados el porcentaje de respuesta puede ser menor durante el tratamiento con anti-CD20; por eso se recomienza terminar la vacunación 4 semanas antes de iniciar el tratamiento con Rtx.
En pacientes tratados con este fármaco no se ha encontrado un aumento en las infecciones comparado con el grupo control, observándose principalmente infecciones respiratorias, faringitis e infecciones urinarias48. Recientemente se ha demostrado que en pacientes con pénfigo vulgar tratados con Rtx, y en comparación con otros inmunosupresores, se produce durante el tratamiento disminución de los anticuerpos frente a la desmogleína (anticuerpos reactivos) junto con un incremento de anticuerpos frente a patógenos (anticuerpos frente a virus varicela-zoster, virus Epstein-Barr, virus herpes simple, neumococo, tétanos). Este sorprendente efecto dual observado durante el tratamiento con Rtx podría deberse a un aumento en los niveles de BAAF29,49–51.
- 5.
Otras reacciones adversas más infrecuentes. Destacan, entre otras, alteraciones psiquiátricas, oculares, neurológicas (incluida leucoencefalopatía multifocal progresiva, vértigos, parestesias), digestivas, metabólicas (aumento de LDH, incremento de la glucemia y descenso del calcio), oído (tinnitis, dolor de oído) musculoesqueléticas, renales, cutáneas (síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, dermatitis liquenoide) y hematológicas (pancitopenia).
En algunos pacientes pueden aparecer anticuerpos antiquiméricos o anticuerpos antimurinos (HAMA/HACA) durante el tratamiento con anti-CD20. En estos casos se desarrollan más frecuentemente reacciones alérgicas o de hipersensibilidad si son tratados con otros anticuerpos monoclonales. Se ha relacionado la presencia de estos anticuerpos con la aparición de enfermedad del suero (manifestaciones cutáneas, adenopatías, fiebre, afectación renal y parálisis periférica), más en procesos autoinmunes que en casos de neoplasias hematológicas52. No obstante, con la introducción de anticuerpos anti-CD20 totalmente humanizados53 estos efectos secundarios serán menores en los próximos años. Así pues, de todo lo expuesto, puede deducirse que Rtx es un fármaco con una proyección terapéutico importante en Dermatología, y con un buen perfil de seguridad a 10 años.
Interacciones farmacológicas durante el tratamiento con rituximabNo existen hasta la fecha interacciones farmacológicas descritas con Rtx al asociarse otro fármaco, incluidos los inmunosupresores. Únicamente deberá tenerse presente la posibilidad de anticuerpos HAMA/HACA por el riesgo de administrar otros anticuerpos monoclonales asociados, tal y como se acaba de comentar. Su uso con otros fármacos inmunosupresores, como idea general, debería evitarse por el riesgo mayor de inmunosupresión.
Grupos especiales de poblaciónSe recomienda consultar la ficha técnica el producto disponible en Internet: http://www.linfoma.roche.es/FichaTecnica Mabth.pdf.
Las inmunoglobulinas G atraviesan la placenta. No existen estudios reglados en mujeres embarazadas tratadas con Rtx, sin embargo se han notificado depleción transitoria de células B y linfopenia en algunos niños nacidos de madres expuestas a este fármaco durante el embarazo. Por este motivo, suele recomendarse no utilizar Rtx en el embarazo, al menos hasta 12 meses después de haber suspendido el fármaco. No obstante, estudios en monos no han mostrado indicios de embriotoxicidad intrauterina. A su vez, el análisis de todos los casos aislados descritos en la literatura demuestra que no está incrementado el riesgo de toxicidad en el feto54. A pesar de todo, hasta que se tengan datos más fiables deberá contraindicarse de entrada su uso en gestantes, valorando el riesgo/beneficio en cada caso. En la actualidad el Rtx está incluido en la categoría C de la FDA.
Se desconoce si Rtx se excreta en la leche materna. No obstante, teniendo en cuenta que la IgG materna se excreta en la leche en condiciones normales, y que además se ha detectado la presencia del fármaco en la leche de las monas durante el periodo de lactancia, las mujeres en tratamiento con anticuerpos anti-CD20 no deberían dar el pecho a sus hijos durante un periodo al menos de 12 meses desde la administración del tratamiento.
A su vez, no existen estudios extensos que analicen la eficacia en la población infantil. Sin embargo, en la literatura se muestra la eficacia y seguridad de este fármaco en la edad pediátrica55.
Criterios de exclusión del tratamiento con rituximabDe toda la información disponible hoy en día pueden establecerse las siguientes contraindicaciones o criterios de exclusión en el tratamiento con Rtx9:
- 1.
Embarazo/lactancia.
- 2.
Edad inferior a 18 años.
- 3.
Sensibilización a proteínas murinas.
- 4.
Hepatitis activa B o C.
- 5.
Infección por el VIH (<250 T4/ml).
- 6.
Insuficiencia cardiaca severa.
- 7.
Infección no controlada.
Tal y como comentamos en el inicio de este trabajo, en la actualidad existen solamente autorizaciones oficiales para emplear Rtx en los pacientes con linfomas de células B, leucemia linfática crónica o con artritis reumatoide. Sin embargo, existen numerosas publicaciones que avalan el beneficio de este fármaco no solamente en otros procesos linfoproliferativos, sino también en un número cada vez más mayor de trastornos autoinmunes. Quizá este hecho se deba a los mecanismos que subyacen en ambos tipos de trastornos. Es decir, al igual que en los linfomas B, en muchos procesos autoinmunes es fundamental el papel de la células B, no solamente por su acción para producir autoanticuerpos, sino también para activar a las células T y amplificar así la respuesta inmune.
En la tabla 1 figuran los procesos descritos en la literatura con una respuesta beneficiosa al Rtx. En este apartado solamente analizaremos las entidades dermatológicas.
Procesos en los que se ha descrito una respuesta terapéutica beneficiosa con la administración de rituximab
| • Linfoma no Hodgkin folicular recidivante |
| • Leucemia linfática crónica |
| • Artritis reumatoide |
| • Pénfigo vulgar |
| • Pénfigo foliáceo |
| • Penfigoide ampolloso |
| • Penfigoide de mucosas |
| • Epidermólisis ampollosa adquirida |
| • Pénfigo paraneoplásico |
| • Angioedema |
| • Vasculitis ANCA positiva |
| • Crioglobulinemia |
| • Dermatitis atópica |
| • Enfermedad injerto contra huesped crónica |
| • Dermatomiositis |
| • Síndrome antifosfolípido |
| • Lupus eritematoso sistémico |
| • Púrpura trombocitopénica trombótica |
| • Púrpura trombocitopénica idiopática |
| • Neuropatías IgM nediadas |
| • Enfermedad por aglutininas frías |
| • Hemofilia A |
| • Síndrome de Sjögren |
| • Esclerosis múltiples |
| • Enfermedad de Graves |
| • Anemia hemolítica autoinmune |
| • Enfermedad de Waldestrom |
Este grupo de trastornos constituye una de las indicaciones más claras del uso de Rtx, y a su vez fueron los primeros procesos en los que se indicó este fármaco. Son numerosas las referencias que avalan su uso. Con en fin de plasmar únicamente una muestra de esta respuesta, nos parece relevante el trabajo de Gellrich et al.56. Encuentran una respuesta completa en el 70% de los pacientes tratados mediante 8 sesiones semanales de Rtx (375mg/m2). Los autores establecen que este tratamiento está indicado principalmente en pacientes con linfomas cutáneos B recidivantes, agresivos, cuando además asientan en pacientes mayores y cuando las lesiones cutáneas son múltiples.
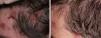
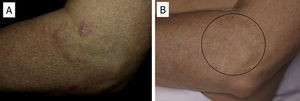
Existen casos aislados de hiperplasia cutánea linfoide por células B donde también la administración de Rtx ha sido eficaz40. En nuestra experiencia este tratamiento ha sido también útil en pacientes con este trastorno, en el que se demostró un infiltrado B clonal (fig. 5). La administración de Rtx en 4 sesiones semanales (375mg/m2) resolvió por completo las lesiones, permaneciendo el paciente asintomático 2 años después.
En algunos casos se ha observado también resolución de las lesiones de linfomas cutáneos primarios después de infiltraciones de Rtx en las lesiones. Fink-Puches et al.38 trataron 8 pacientes con Rtx intralesionalmente (10mg/ml, 1ml en cada lesión), 3 veces por semana hasta conseguir mejoría de las lesiones. Observaron remisión completa en 7 pacientes, con recurrencias en uno de ellos 27 meses después, y en otros 2 casos recurrencias en otras áreas no tratadas 12 y 24 meses después. Los autores resaltan la desaparición de lesiones no infiltradas, probablemente por la absorción del fármaco, actuando después en otras áreas. En nuestra experiencia hemos podido tratar a un paciente con un linfoma B cutáneo marginal, con un nódulo aislado en el cuero cabelludo (fig. 6). Realizamos 2 infiltraciones intralesionalmente (10mg/ml, 1ml en cada sesión) con un intervalo de un mes. Después de 8 meses no se observa enfermedad clínica e histológicamente y el estudio de clonalidad ha resultado negativo.
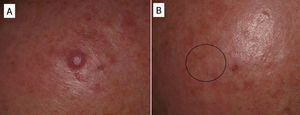
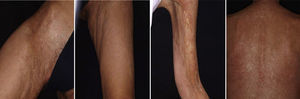
Pénfigo vulgarExisten en la literatura numerosas referencias que demuestran que Rtx es de gran eficacia en el tratamiento del pénfigo vulgar. No existen aún protocolos establecidos sobre cuándo debe emplearse este fármaco, o si su utilización está justificada en algún caso desde el inicio de la enfermedad. A pesar de todo, se han publicado guías basadas en las experiencias de algunos autores, y que, en resumen, plantean que los anticuerpos anti-CD20 deberán emplearse cuando un paciente con pénfigo vulgar no responde a corticoesteroides e inmunosupresores, o cuando las dosis necesarias de estos tienen que ser elevadas para conseguir un efecto terapéutico positivo9,10,15,57. En la mayoría de los casos publicados los pacientes recibieron de forma concomitante tratamiento con inmunosupresores (azatioprina o micofenolato) o inmunomoduladores (inmunoglobulinas)9. Sin embargo, en nuestra experiencia46, al igual que otros grupos afirman, un único ciclo de 4 sesiones semanales (375mg/m2) en combinación con corticoesteroides puede obtener resultados de remisión completa por encima del 85% de los pacientes, en un periodo de tiempo entre 3-34 meses58. Normalmente los pacientes suelen responder a los 6-10 meses de completar el ciclo de Rtx, pero en ocasiones esta respuesta puede ser más tardía. Esta misma es nuestra experiencia (fig. 7). La variabilidad en la respuesta puede estar condicionada por el mayor o menor número de células circulantes CD20+ que tenga el paciente59.
Finalmente, aunque existe una correlación entre el título de anticuerpos antidesmogleína 1 y 3 y la actividad del pénfigo vulgar, en ocasiones no siempe es así46,59. Este hecho puede ser debido a que la acción de Rtx se centra principalmente sobre poblaciones de linfocitos B que producen anticuerpos dirigidos frente a epítopos más patógenos, las cuales son en su mayoría células CD20+.
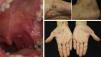
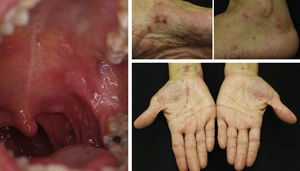
Epidermólisis ampollosa adquiridaExisten pocos casos publicados de pacientes con epidermólisis ampollosa adquirida en los que haya sido necesaria la administración de Rtx para conseguir un control de la enfermedad. Entre ellos destaca el trabajo publicado por Schmidt et al.60, de una paciente que necesitó la administración de Rtx junto a corticoesteroides, inmunosupresores y colchicina para controlar la enfermedad. En nuestra experiencia este fármaco nos ha permitido también controlar a una paciente con una forma inflamatoria de epidermólisis ampollosa adquirida, con lesiones generalizadas y exacerbadas premenstrualmente (fig. 8). Al no controlarse los brotes con corticoesterodies, micofenolato, dapsona y colchicina decidimos asociar Rtx. A los 6 meses las lesiones desaparecieron, y los anticuerpos anti-colágeno vii se negativizaron.
Penfigoide ampolloso y penfigoide de mucosasEn muchos pacientes que presentan alguna de estas dos enfermedades puede conseguirse un control de la enfermedad con tratamiento convencional. Sin embargo, a veces estamos abocados a buscar alternativas terapéuticas ante la falta de respuesta, o la morbilidad creada por el tratamiento. Lourari et al.61 muestran su experiencia en 5 pacientes con penfigoide ampolloso y en 2 con penfigoide de mucosas. En 3 del primer grupo y en uno del segundo consiguen una remisión completa, aunque en uno de ellos las lesiones rebrotaron a los 4 meses.
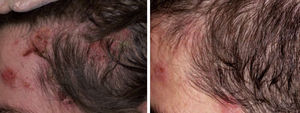
Enfermedad injerto contra huéspedAl igual que en el pénfigo vulgar esta indicación es quizá una de las más prometedoras dentro de nuestra especialidad. Recientemente se ha implicado a los linfocitos B en la patogenia de esta enfermedad, con presencia de anticuerpos dirigidos frente al activador del factor de crecimiento derivado de las plaquetas. Su acción sobre en endotelio vascular puede desencadenar una cascada inflamatoria que conlleva finalmente a fibrosis cutánea. Kim et al.62 han propuesto en esta enfermedad la administración de Rtx (4 infusiones semanales), seguido de una infusión mensual durante 4 meses. Mediante este protocolo trataron 37 pacientes, observando que en 8 la respuesta fue completa y en 24 parcial, permitiendo la disminución de corticoesteroides de forma importante. La mejoría clínica fue mucho mayor en la piel, en la mucosa oral y en las manifestaciones musculoesqueléticas. En nuestra experiencia, en una paciente con una forma crónica de enfermedad injerto contra huésped crónica, Rtx ha permitido una mejoría muy sustancial tanto en la piel como en las mucosas y en las manifestaciones musculoesqueléticas, disminuyendo globalmente la morbilidad que presentaba en casi la mitad (fig. 9).
DermatomiositisRecientemente se han publicado pequeñas series de pacientes en las que el uso de Rtx ha mostrado beneficio clínico y analítico en esta enfermedad. Levine63 publicó su experiencia en 6 pacientes afectos de dematomiositis, basando la administración de Rtx en el papel de los linfocitos B en esta enfermedad. Todos los pacientes experimentaron una mejoría clínica (mejoría funcional) y analítica alrededor de los 3 meses de comenzar con el tratamiento. En 4 casos las lesiones reaparecieron a las 52 semanas. No observaron efectos secundarios relevantes en los pacientes. Mientras se escribe esta revisión no existen guías específicas sobre el manejo de Rtx en dermatomiositis (por ejemplo dosis de 375mg/m2 semanal por 4 semanas o 1g en los días 0 y 15). Se necesitan series más amplias para confirmar estos hallazgos, y en estos momentos se está llevando a cabo un estudio multicéntrico de placebo versus rituximab en pacientes con polimiositis/dermatomiositis y miositis refractaria que espera poder responder a dichos interrogantes.
Eczema atópicoEsta es una de las últimas indicaciones de Rtx publicadas en la literatura. Simon et al.37 administran 2 sesiones de 1.000 mg de Rtx con un intervalo de 15 días entre ambas. Estudian 8 pacientes con eczema atópico severo, y encuentran que todas las lesiones cutáneas mejoran entre 4-8 semanas de iniciar el tratamiento, con una reducción del EASI de 30 a 9 en un periodo e 6 meses. Observan a su vez una reducción de la espongiosis, de la acantosis y de la hiperqueratosis cutánea. Las células B circulantes desaparecen en la totalidad de los pacientes, mientras que solo en el 50% en las biopsias cutáneas. Finalmente, encuentran que mientras la IgE específica frente a alérgenos no se modifica, la cantidad de IgE total disminuye. Concluyen que este tratamiento es de gran trascendencia para formas de eczema atópico grave que no responde a otros tratamientos inmunosupresores.
Vasculitis asociadas a crioglobulinemiaWink et al.64 revisaron todos los casos de vasculitis asociadas a crioglobulinemia en los que se administró Rtx. En el 60% de los casos se consigue una remisión completa, y en el 23% una remisión parcial. En el resto no observan respuesta clínica. En todos los casos encuentran una reducción significativa de las crioglobulinas, del factor reumatoide y de los niveles de IgM. Las complicaciones se presentaron en los casos en los que los niveles de crioglobulinas era mayor, cuando se emplearon dosis mayores de Rtx (dosis de 1.000mg) y cuando existía una activación elevada del complemento.
En aquellos casos en los que se asocia infección activa por el virus de la hepatitis C junto a crioglobulinemia, el tratamiento de primera línea será la administración de interferón pegilado junto a ribavirina. Se recomienda administrar Rtx cuando se asocien vasculitis severa, úlceras cutáneas, neuropatía y nefropatía65.
Angioedema adquiridoExisten muy pocos casos de angioedema adquirido tratados con Rtx, en parte por la rareza de la enfermedad. Los autores refieren que los pacientes con esta entidad pueden mostrar reducción en la frecuencia de los brotes a los 3-4 meses del tratamiento, junto con una disminución de los requerimientos de C1inh, y una normalización de los niveles de C466.
Síndrome antifosfolípidoSe han descrito casos aislados de síndrome antifosfolípido grave, con una mejoría de los pacientes67. Sin embargo, es prematuro afirmar que esta podría ser una indicación para el tratamiento con Rtx antes de adquirir una experiencia mayor68.
Lupus eritematoso sistémicoSe ha demostrado la eficacia de Rtx en el tratamiento de las manifestaciones cutáneas del LES. A modo de ejemplo, los datos del registro nacional francés sobre el uso de Rtx en LES (136 pacientes) muestran una respuesta global del 71% de los pacientes, con una mejoría del 72% en las manifestaciones articulares, del 70% en las cutáneas, del 74% en las renales y del 88% en las hematológicas. Entre los respondedores un 41% sufrió un rebrote de la enfermedad con una respuesta del 91% tras el retratamiento con Rtx. Al igual que en otras enfermedades la eficacia no difiere sustancialmente entre los pacientes de Rtx en monoterapia y aquellos con inmunosupresores concomitantes (quienes tenían una mayor actividad basal de la enfermedad)69.
Perspectivas y conclusionesLa introducción de Rtx nos ha abierto una nueva puerta en la terapéutica médica, y en concreto dentro de la Dermatología. A la indicación inicial de pénfigo vulgar en nuestra especialidad se han ido añadiendo otros procesos en los que este fármaco puede tener un lugar privilegiado. Para entender el alcance de este tratamiento es importante que el médico conozca cómo se puede producir la respuesta inmune en las enfermedades para saber en cuáles podría ser eficaz su administración. A su vez, la acción del Rtx nos ha ayudado a profundizar en el conocimiento patogénico en cada uno de estos procesos. De todo esto se deduce que Rtx no solo sería eficaz en procesos mediados directamente por autoanticuerpos, sino en aquellos en los que el papel del linfocito B es clave, tal y como se ha explicado.
El futuro es esperanzador con el empleo de fármacos que actúan en dianas moleculares que tienen como target la célula B. La incorporación de anticuerpos anti-CD20 humanizados, como el ofatumumab53, permitirán la disminución de efectos secundarios que hoy en día tenemos con Rtx. Además, están en estudio anticuerpos frente a células plasmáticas long-life (CD20−) que se escapan a la acción de Rtx (como el bortezomib)70, o frente a agentes que modulan la acción de las células B como la interleuquina 6 (tocilizumab)71, frente al factor activador de las células B BAFF (belimumab)72, o a otros receptores de los linfocitos B como es el CD22 (epratuzumab)73. Todo este arsenal farmacológico nos permitirá en unos años disponer de nuevas estrategias terapéuticas para procesos en los que, en ocasiones, el tratamiento convencional fracasa o crea una morbilidad importante a los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.