Los pacientes con urticaria crónica espontánea suelen rebrotar tras suspender omalizumab, requiriendo su reintroducción. La optimización previa a la retirada puede reducir las recurrencias, aunque todavía no existe suficiente evidencia. Por otro lado, los factores predictores de recaída reportados se han estudiado mayormente en pacientes que no optimizaron antes de la suspensión.
MétodosEstudio retrospectivo multicéntrico que incluyó los pacientes que suspendieron omalizumab tras ser optimizados con un seguimiento de 12 meses. Se realizaron análisis univariantes y multivariantes (un árbol de clasificación y una regresión de Cox).
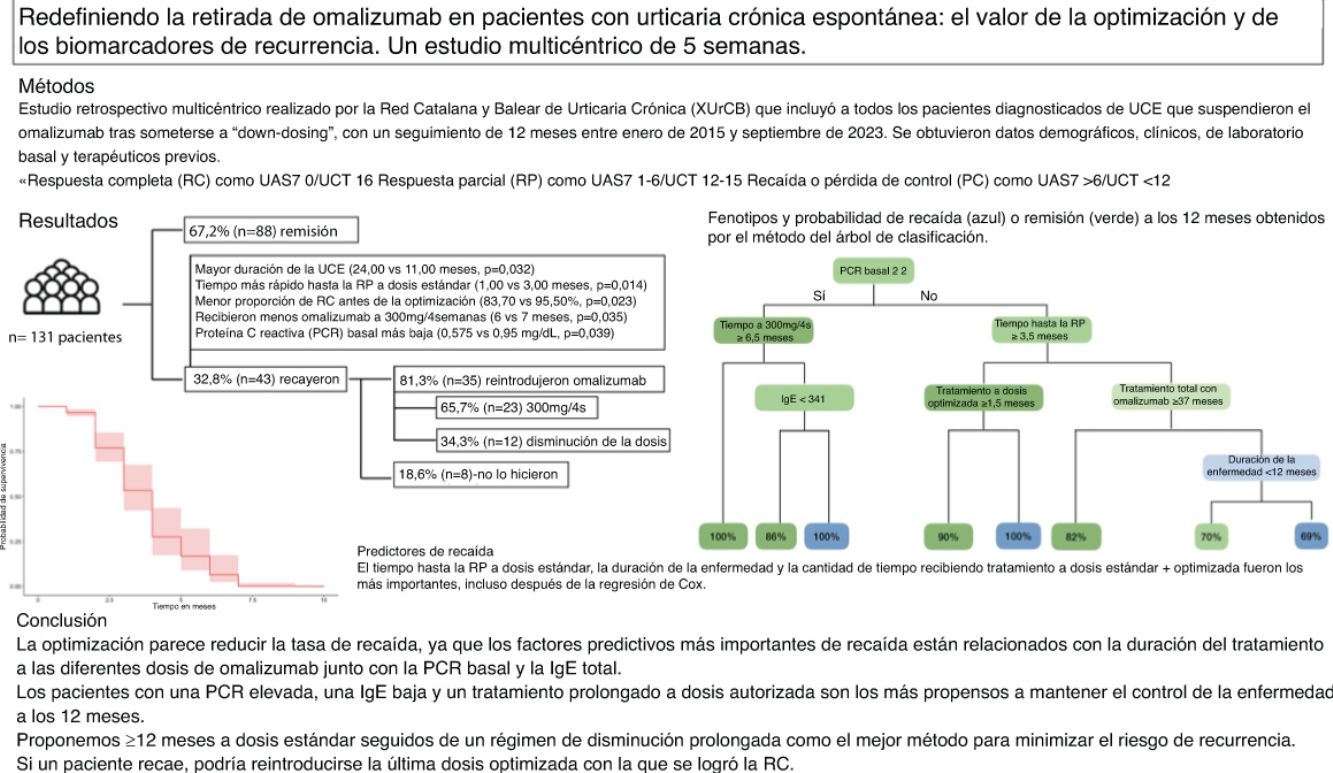
ResultadosSe incluyeron un total de 131 pacientes, de los cuales el 32,8% recayó a los 12 meses. Los pacientes que rebrotaron tenían mayor duración de la enfermedad (24,00 vs. 11,00 meses; p=0,032), una respuesta más rápida a la dosis estándar (1,00 vs. 3,00 meses; p=0,014), menores respuestas completas antes de optimizar (83,70% vs. 95,50%; p=0,023) y menor tiempo de tratamiento a 300mg/4 semanas (6 vs. 7 meses; p=0,035). El análisis multivariante reveló que los pacientes con proteína C reactiva (PCR) elevada e inmunoglobulina E (IgE) basal baja que habían sido tratados durante un tiempo más prolongado tenían más probabilidades de mantener una remisión sostenida a los 12 meses.
ConclusiónLa optimización parece reducir la tasa de recaída tras suspender omalizumab. Los factores más relevantes de recurrencia son la duración del tratamiento con omalizumab junto con los niveles basales de PCR e IgE total. Para minimizar la recaída, proponemos realizar tratamiento a 300mg/4 semanas durante 12 meses seguido de una optimización progresiva durante 18 meses.
Patients with chronic spontaneous urticaria frequently relapse after discontinuing omalizumab and require its reintroduction. Although prior optimization might reduce recurrences, there is scarce evidence on this issue. Moreover, predictors of relapse have been identified in non-optimized patients before suspension.
MethodsWe conducted a multicenter retrospective study with patients who discontinued omalizumab after optimization with a 12-month follow-up. Univariate and multivariate (tree classification method and Cox regression) analyses were performed.
ResultsA total of 131 patients were included, 32.8% of whom relapsed after 12 months. Relapsed patients had longer disease duration (24.00 vs 11.00 months; p=0.032), quicker response to standard dosage (1.00 vs. 3.00 months; p=0.014), fewer complete responses pre-optimization (83.70% vs 95.50%; p=0.023), and shorter treatment duration at 300mg/4 weeks (6 vs 7 months; p=0.035). Multivariate analysis revealed that patients with elevated baseline C-reactive protein (CRP) and low total immunoglobulin E (IgE) who underwent prolonged treatment were more likely to maintain a sustained remission at 12 months.
ConclusionOptimization seems to reduce the relapse rate after discontinuation. The most relevant factors for recurrence are associated with the duration of treatment at different doses of omalizumab, along with the baseline CRP and total IgE levels. To minimize relapse after suspension, a 12-month treatment regimen at 300mg/4 weeks followed by an 18-month dose tapering is proposed.
La urticaria crónica espontánea (UCE) es una enfermedad cutánea caracterizada por la aparición espontánea de habones transitorios, angioedema o ambos, los cuales persisten>6 semanas. Aunque los antihistamínicos se recomiendan como tratamiento de primera línea, el 50% de los pacientes no logran controlar la enfermedad ni siquiera cuadruplicando las dosis1. En tales casos, el omalizumab a una dosis autorizada de 300mg cada 4 semanas es un tratamiento seguro y eficaz para la UCE, logrando controlar con éxito la enfermedad en más del 70% de los pacientes2.
Una vez que la UCE está bien controlada, los pacientes pueden suspender omalizumab debido a la naturaleza autorresolutiva de la enfermedad. Sin embargo, tras la interrupción, los pacientes recaen con frecuencia y requieren su reintroducción, recuperando nuevamente el control de la enfermedad3,4. Para reducir la tasa de recaída, los pacientes podrían beneficiarse de la reducción de la dosis antes de la interrupción, aunque su eficacia no se ha establecido. Se han propuesto dos métodos iniciales principales de optimización: reducir la dosis a 150mg cada 4 semanas o mantener la dosis autorizada, pero prolongando el intervalo de administración5–7. No se han realizado estudios comparativos para determinar qué enfoque es mejor en términos de tolerancia o remisión sostenida tras la suspensión.
Hasta la fecha, se han identificado varios factores predictivos de recaída tras la interrupción del omalizumab; predominantemente en pacientes que no optimizaron el tratamiento antes de la interrupción. La mayoría de los factores predictivos descritos son variables clínicas, como una puntuación basal elevada de la «actividad de la urticaria 7» (UAS7), una mayor duración de la enfermedad, una edad más avanzada o una respuesta inicial rápida3,8,9. Respecto a biomarcadores, algunos estudios sugieren que los niveles basales elevados de inmunoglobulina E (IgE) total se asocian a un mayor riesgo de recaída10–12.
Criterios de valoraciónLos criterios de valoración primarios de este estudio son (i) identificar los factores predictivos de recaída tras la suspensión de omalizumab y (ii) determinar si la optimización reduce la tasa de recaída. Los criterios de valoración secundarios son analizar el manejo terapéutico de las recaídas y la eficacia del retratamiento.
Materiales y métodosPoblación de estudioLa Red Catalana y Balear de Urticaria Crónica (XUrCB) realizó un estudio retrospectivo multicéntrico que incluyó a todos los pacientes diagnosticados de UCE que suspendieron omalizumab tras una reducción progresiva de la dosis, con un seguimiento mínimo de 12 meses desde enero de 2015 hasta septiembre de 2023. Los datos demográficos, clínicos y de laboratorio basales de cada paciente se obtuvieron de los registros sanitarios. Se excluyeron los pacientes que suspendieron omalizumab sin optimización previa; los pacientes con <12 meses de seguimiento y las urticarias crónicas inducibles (UCI) que no se asociaban a UCE. Este estudio fue aprobado por el Comité de Ética (2024/26-DER-HUSC).
Se definió la respuesta completa (RC) como el UAS7 0 y/o Urticaria Control test (UCT) 16; la respuesta parcial (RP) como el UAS7 1-6 y/o el UCT 12-15, y recaída o pérdida de control (PC) como UAS7>6 y/o UCT<12.
Análisis estadísticoEl análisis estadístico se realizó con R Core Team 2022 v.4.2.2. Las variables categóricas se expresaron como porcentajes. Las variables continuas se expresaron como media±desviación estándar (DE) o mediana y rango intercuartílico (IQR) según la distribución de cada variable determinada con la prueba de Shapiro-Wilk o Kolmogorov-Smirnov.
Para el análisis univariante, la comparación entre los datos cualitativos de 2 grupos se realizó mediante la prueba chi-cuadrado de Pearson. Del mismo modo, al comparar los datos cuantitativos se utilizaron las pruebas U de Mann-Whitney o T-Student, cuando procedía. Se realizó un análisis multivariante mediante el método de árbol de clasificación que incluía variables demográficas, analíticas y clínicas. Limitamos el número de nodos de decisión a 4 y determinamos las variables más relevantes del modelo obtenido para predecir la recaída. Estas variables se combinaron con las estadísticamente significativas obtenidas en el análisis univariante y las principales previamente reportadas en la literatura como factores predictivos en un análisis de regresión de Cox. El nivel de significación estadística se fijó en p<0,05.
Se estimaron los puntos de corte para la duración del tratamiento a dosis estándar y optimizadas que mejor discriminan entre los pacientes que recaen y los que no.
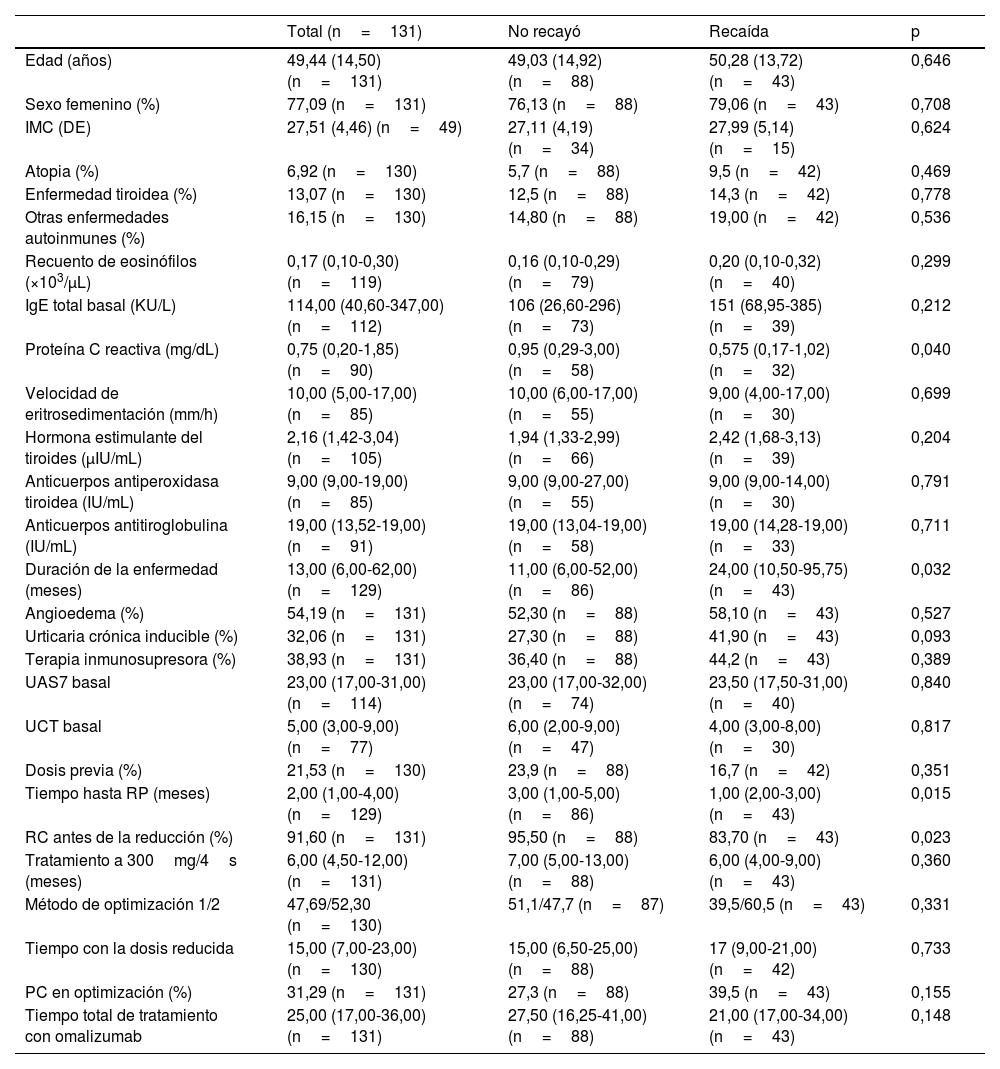
ResultadosSe identificó un total de 257 pacientes que recibieron una reducción progresiva de la dosis de omalizumab. De estos un total de 131 pacientes (50,97%) suspendieron omalizumab y tuvieron un seguimiento mínimo de 12 meses (tabla 1). Los pacientes eran predominantemente mujeres (n=101; 77%) con una edad media de 49,44±14,50 años (n=131) y un índice de masa corporal (IMC) de 27,51±4,46 (n=49). El 13,07% (n=17) y el 16,15% (n=21) de los pacientes presentaban antecedentes de enfermedad tiroidea y otras enfermedades autoinmunes, respectivamente.
Datos demográficos, clínicos, resultados de las pruebas de laboratorio basales y datos terapéuticos previos
| Total (n=131) | No recayó | Recaída | p | |
|---|---|---|---|---|
| Edad (años) | 49,44 (14,50) (n=131) | 49,03 (14,92) (n=88) | 50,28 (13,72) (n=43) | 0,646 |
| Sexo femenino (%) | 77,09 (n=131) | 76,13 (n=88) | 79,06 (n=43) | 0,708 |
| IMC (DE) | 27,51 (4,46) (n=49) | 27,11 (4,19) (n=34) | 27,99 (5,14) (n=15) | 0,624 |
| Atopia (%) | 6,92 (n=130) | 5,7 (n=88) | 9,5 (n=42) | 0,469 |
| Enfermedad tiroidea (%) | 13,07 (n=130) | 12,5 (n=88) | 14,3 (n=42) | 0,778 |
| Otras enfermedades autoinmunes (%) | 16,15 (n=130) | 14,80 (n=88) | 19,00 (n=42) | 0,536 |
| Recuento de eosinófilos (×103/μL) | 0,17 (0,10-0,30) (n=119) | 0,16 (0,10-0,29) (n=79) | 0,20 (0,10-0,32) (n=40) | 0,299 |
| IgE total basal (KU/L) | 114,00 (40,60-347,00) (n=112) | 106 (26,60-296) (n=73) | 151 (68,95-385) (n=39) | 0,212 |
| Proteína C reactiva (mg/dL) | 0,75 (0,20-1,85) (n=90) | 0,95 (0,29-3,00) (n=58) | 0,575 (0,17-1,02) (n=32) | 0,040 |
| Velocidad de eritrosedimentación (mm/h) | 10,00 (5,00-17,00) (n=85) | 10,00 (6,00-17,00) (n=55) | 9,00 (4,00-17,00) (n=30) | 0,699 |
| Hormona estimulante del tiroides (μIU/mL) | 2,16 (1,42-3,04) (n=105) | 1,94 (1,33-2,99) (n=66) | 2,42 (1,68-3,13) (n=39) | 0,204 |
| Anticuerpos antiperoxidasa tiroidea (IU/mL) | 9,00 (9,00-19,00) (n=85) | 9,00 (9,00-27,00) (n=55) | 9,00 (9,00-14,00) (n=30) | 0,791 |
| Anticuerpos antitiroglobulina (IU/mL) | 19,00 (13,52-19,00) (n=91) | 19,00 (13,04-19,00) (n=58) | 19,00 (14,28-19,00) (n=33) | 0,711 |
| Duración de la enfermedad (meses) | 13,00 (6,00-62,00) (n=129) | 11,00 (6,00-52,00) (n=86) | 24,00 (10,50-95,75) (n=43) | 0,032 |
| Angioedema (%) | 54,19 (n=131) | 52,30 (n=88) | 58,10 (n=43) | 0,527 |
| Urticaria crónica inducible (%) | 32,06 (n=131) | 27,30 (n=88) | 41,90 (n=43) | 0,093 |
| Terapia inmunosupresora (%) | 38,93 (n=131) | 36,40 (n=88) | 44,2 (n=43) | 0,389 |
| UAS7 basal | 23,00 (17,00-31,00) (n=114) | 23,00 (17,00-32,00) (n=74) | 23,50 (17,50-31,00) (n=40) | 0,840 |
| UCT basal | 5,00 (3,00-9,00) (n=77) | 6,00 (2,00-9,00) (n=47) | 4,00 (3,00-8,00) (n=30) | 0,817 |
| Dosis previa (%) | 21,53 (n=130) | 23,9 (n=88) | 16,7 (n=42) | 0,351 |
| Tiempo hasta RP (meses) | 2,00 (1,00-4,00) (n=129) | 3,00 (1,00-5,00) (n=86) | 1,00 (2,00-3,00) (n=43) | 0,015 |
| RC antes de la reducción (%) | 91,60 (n=131) | 95,50 (n=88) | 83,70 (n=43) | 0,023 |
| Tratamiento a 300mg/4s (meses) | 6,00 (4,50-12,00) (n=131) | 7,00 (5,00-13,00) (n=88) | 6,00 (4,00-9,00) (n=43) | 0,360 |
| Método de optimización 1/2 | 47,69/52,30 (n=130) | 51,1/47,7 (n=87) | 39,5/60,5 (n=43) | 0,331 |
| Tiempo con la dosis reducida | 15,00 (7,00-23,00) (n=130) | 15,00 (6,50-25,00) (n=88) | 17 (9,00-21,00) (n=42) | 0,733 |
| PC en optimización (%) | 31,29 (n=131) | 27,3 (n=88) | 39,5 (n=43) | 0,155 |
| Tiempo total de tratamiento con omalizumab | 25,00 (17,00-36,00) (n=131) | 27,50 (16,25-41,00) (n=88) | 21,00 (17,00-34,00) (n=43) | 0,148 |
En cuanto a las características de la UCE, la mediana de duración, evaluada en el momento de iniciar con el omalizumab, fue de 13,00 meses (IQR, 6,00-62,00 meses; n=129). La UCE asoció angioedema en el 54,19% (n=71) y UCI en el 32,06% (n=42) de los pacientes. Al inicio del estudio, la mediana del UAS7 fue de 23,00 (IQR, 17,00-31,00; n=114) y del UCT fue de 5,00 (IQR, 3,00-9,00; n=77). A nivel analítico destaca la mediana basal de los niveles de IgE total y PCR siendo de 114,00 UI/mL (IQR 40,60-347) y 0,75 mg/dL (IQR: 0,20-1,85) respectivamente.
Los pacientes fueron tratados durante una mediana de 6,00 meses (IQR, 4,50-12,00; n=131) a 300mg cada 4 semanas, requiriendo una dosificación ascendente a 450 o 600mg cada 2 o 4 semanas en el 21,53% (n=28). La RP se alcanzó en una mediana de 2 meses (IQR, 1,00-4,00; n=129) tras el inicio, y el 91,6% obtuvo una RC antes de la optimización. Todos los pacientes se sometieron a una dosificación descendente durante una mediana de 15,00 meses (IQR, 7,00-23,00; n=131). Inicialmente, el 47,69% de los pacientes redujeron la dosis a 150mg cada 4 semanas, mientras que el 52,30% mantuvo la dosis y prolongó la administración a intervalos de 300mg cada 6 semanas. El 31,29% de los pacientes presentaron PC durante la reducción de la dosis, sin diferencias entre los dos métodos de reducción.
Los pacientes interrumpieron el omalizumab tras un total de 25,00 meses (IQR, 17,00-36,00) de tratamiento. Durante los 12 meses siguientes a la interrupción, el 32,8% (n=43) de los pacientes recayeron tras una mediana de tiempo de 3,00 (IQR, 2,00-4,50) meses. Se reintrodujo omalizumab en el 81,3% (n=35) de los pacientes. La dosis de 300mg cada 4 semanas se inició en el 65,7% (n=23) de los pacientes, mientras que el 34,28% reinició una dosis optimizada. Todos los pacientes recuperaron el control de la enfermedad.
El análisis univariante reveló que los pacientes que recayeron tenían mayor duración de la enfermedad (24,00 frente a 11,00 meses; p=0,032), un tiempo más corto hasta la RP a dosis estándar (1,00 frente a 3,00 meses; p=0,014), una menor RC antes de la optimización (83,70 frente a 95,50%; p=0,023) y fueron tratados durante un periodo más corto con omalizumab a 300mg cada 4 semanas (6 frente a 7 meses; p=0,035). Además, la mediana de la PCR basal fue menor en los pacientes que recayeron (0,575 frente a 0,95mg/dL; p=0,039) y la IgE basal total fue mayor, pero no alcanzó significación estadística (151 frente a 106UI/mL; p=0,204).
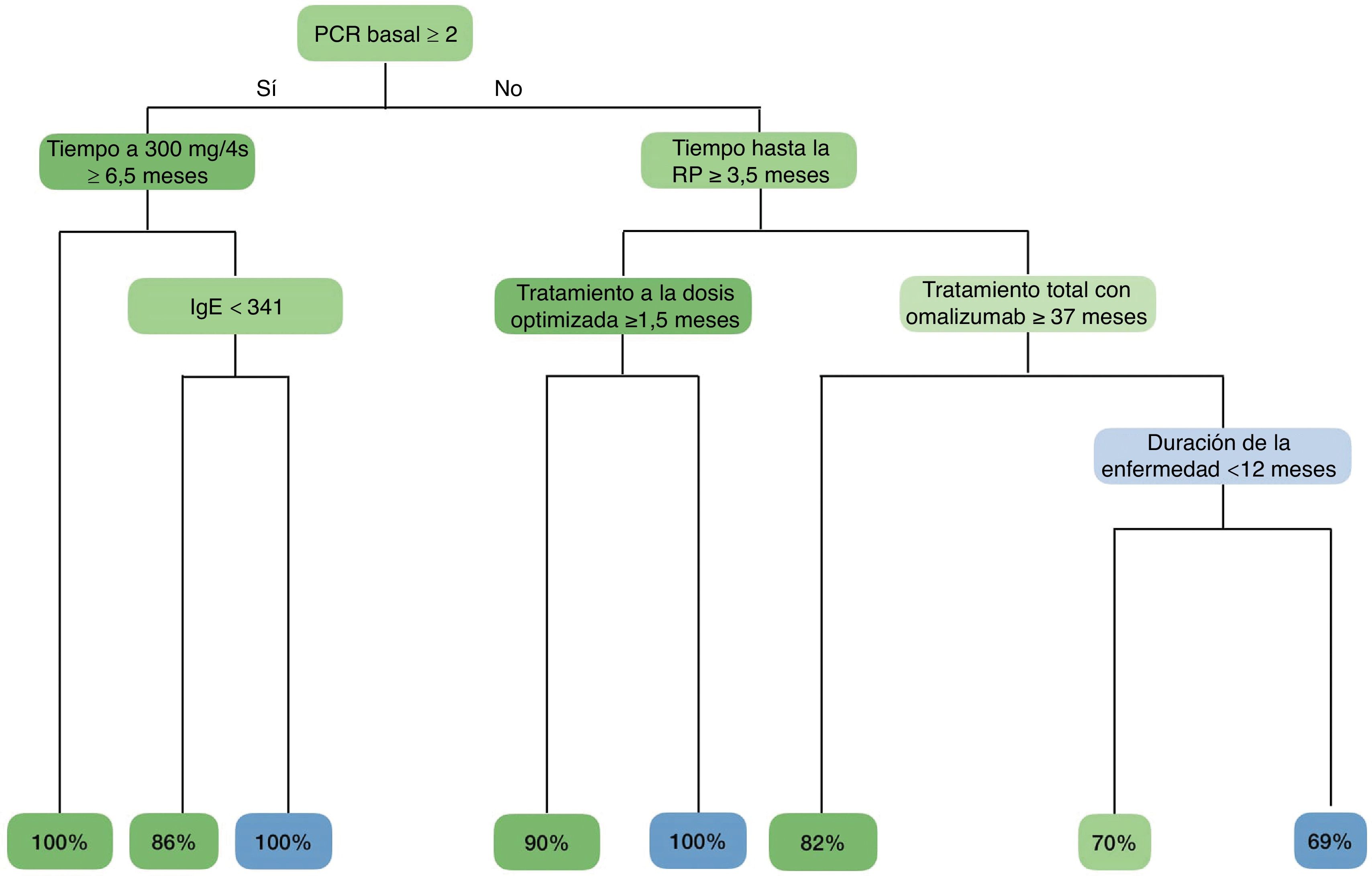
Se construyó un árbol de clasificación que incluía todas las variables de la tabla 1, con una tasa de precisión global del 81% (fig. 1). Como se muestra en el algoritmo, identificamos un fenotipo que mantuvo una RC tras 12 meses en todos los casos: pacientes con una PCR≥2mg/dL basal que recibieron, al menos, 6,5 meses de omalizumab a dosis estándar. También se encontraron 2 fenotipos que estaban fuertemente asociados con la recaída: pacientes con PCR≥2mg/dL basal e IgE≥341KU total que recibieron <6,5 meses de omalizumab a dosis autorizada y pacientes con PCR≤2mg/dL basal, que alcanzaron una RP<3,5 meses y recibieron dosis optimizadas durante <1,5 meses.
Fenotipos y probabilidad de recaída obtenidos mediante el método del árbol de clasificación. Las variables relacionadas con la ausencia de recaída se muestran en verde, mientras que las asociadas a la recaída se muestran en azul. La intensidad de los colores verde y azul se correlaciona con su importancia en el algoritmo (cuanto más oscuro, más importante). En la última fila, se muestra la proporción de pacientes que no recaen (en verde) y los que realmente recaen (en azul) en función de su fenotipo.
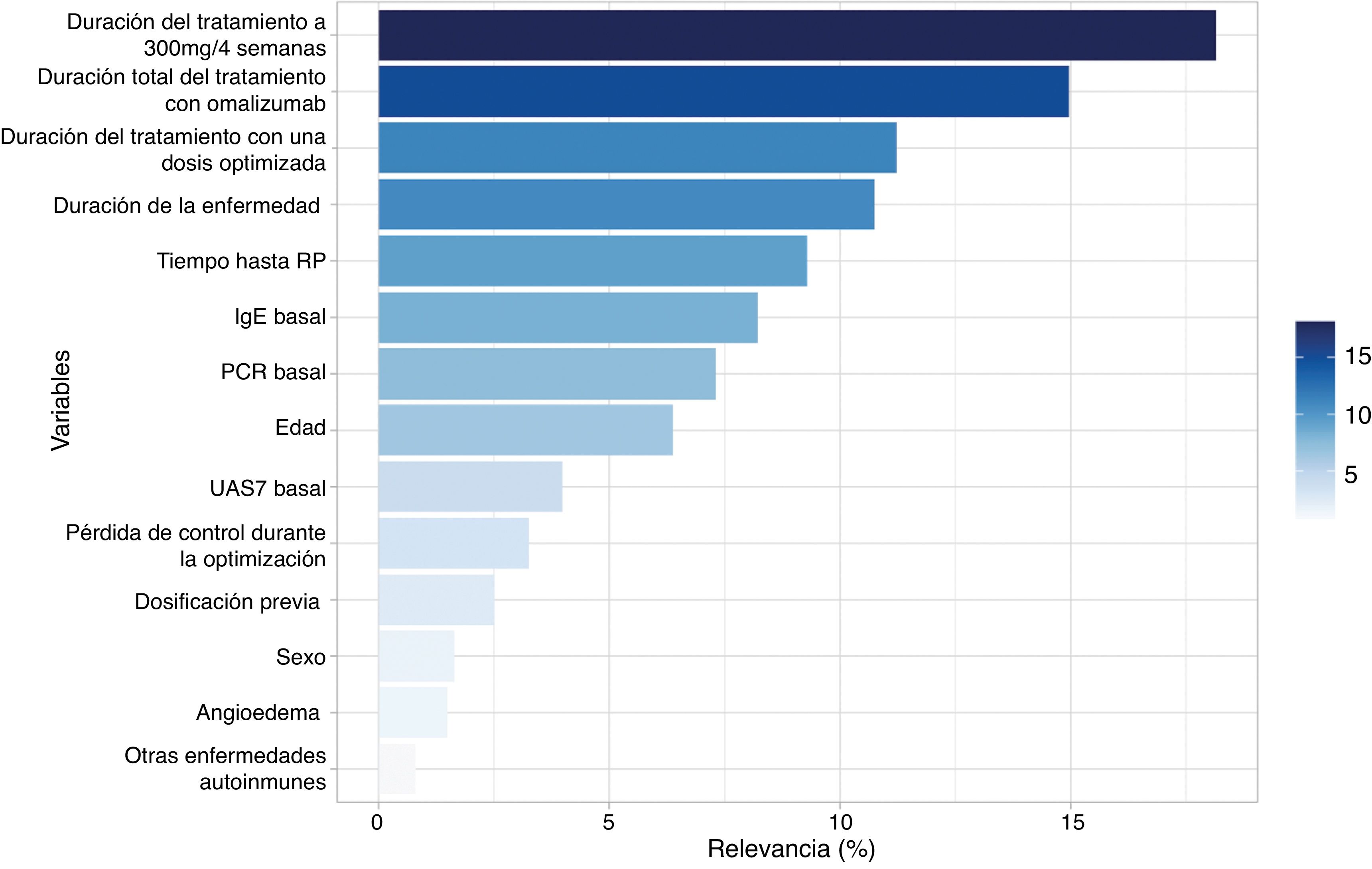
Posteriormente, organizamos las variables en función de su relevancia en el algoritmo de clasificación (fig. 2). El tiempo hasta la RP y la duración de la enfermedad junto con el tiempo durante el cual el paciente recibió el tratamiento a dosis estándar, dosis optimizadas y la suma de estas 2 últimas fueron las variables predictivas más importantes, representando el 65% de la capacidad del modelo.
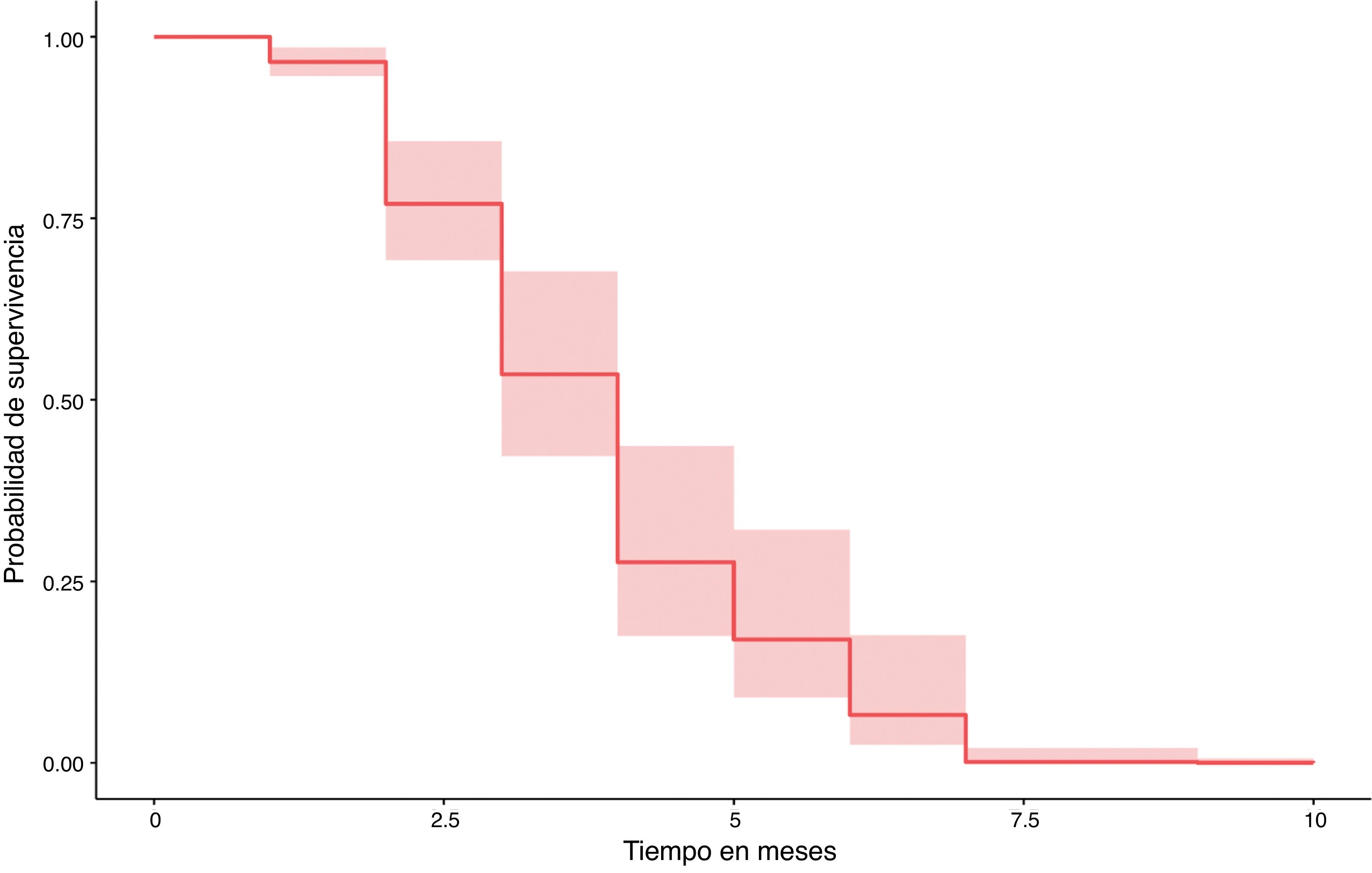
Estas 5 variables se incluyeron con la PCR basal, la IgE total basal, la edad y el sexo en un modelo de regresión de Cox. Se obtuvo una curva de supervivencia (fig. 3). Todas las variables excepto el sexo (p=0,394) y la duración de la enfermedad (p=0,829) siguieron siendo estadísticamente significativas (p<0,001). Teniendo en cuenta la importancia de la duración del tratamiento, calculamos los puntos de corte para reducir el riesgo de recaída: 12 meses a la dosis autorizada y 18 meses para el régimen optimizado.
DiscusiónLos pacientes diagnosticados de UCE suelen experimentar recaídas tras suspender omalizumab durante el primer año, siendo mayor el riesgo los 2 primeros meses9,13. Sin una optimización previa, la tasa de recaídas es de aproximadamente el 60% en el plazo de 2 meses3. Para mantener la remisión de la enfermedad a largo plazo, se han propuesto diversos métodos de optimización con una ligera disminución de la tasa de recaídas, aproximadamente del 35% al 56%9,14–17. Además, la reducción de la dosis puede retrasar la aparición de la recaída15.
En nuestro estudio, observamos una tasa de recaída del 32,8% (n=43) en una mediana de tiempo de 3,00 (IQR, 2,00-4,50) meses. Se trata de la tasa de recurrencia más baja de la que se tiene constancia y aboga firmemente por el beneficio de optimizar antes de retirar el fármaco. Cabe destacar que no se encontraron diferencias entre la proporción de pacientes que recayeron con los distintos métodos de optimización. El ensayo OPTIMA confirmó que el retratamiento con el omalizumab recuperó con éxito el control sintomático en pacientes con PC tras la suspensión4. Omalizumab se reinició en el 81,3% (n=35) de nuestros pacientes. Destacamos que el 34,28% (n=15) reiniciaron con una dosis optimizada y lograron una RC. Por lo tanto, los pacientes que optimizaron y recayeron podrían reintroducir la última dosis optimizada cuando estaban en RC en lugar de 300mg cada 4 semanas.
Se han identificado varios biomarcadores que permiten predecir la respuesta a omalizumab a dosis estándar18. Sin embargo, se dispone de menos evidencia sobre los factores predictivos de recaída, especialmente en pacientes que se sometieron previamente a una optimización. Los biomarcadores pueden clasificarse en 3 grupos: demográficos, características de la UCE y parámetros moleculares.
Los datos demográficos no parecen influir en el riesgo de recaída. La edad se asocia a una mayor gravedad de la UCE, pero su potencial como biomarcador de recaída es controvertido, habiéndose publicado resultados dispares. Meertens et al. informaron de que los pacientes de edad avanzada tienen un mayor riesgo de recaída, mientras que otro estudio demostró que los pacientes menores de 40 años eran los que más recaían9,17. De forma similar, se han publicado resultados opuestos en cuanto al sexo12,19. El IMC se asocia a la respuesta a la dosis estándar y a la tolerancia a la optimización, pero no se ha descrito como biomarcador de recaída. Cuando es elevado, se asocia a una mala respuesta al omalizumab y a la necesidad de aumentar la dosis, mientras que cuando es bajo se correlaciona con una mejor tolerancia a la reducción de la dosis15,20. En nuestro estudio no encontramos diferencias significativas en la edad, el sexo o el IMC, ni en el análisis univariante ni en el multivariante.
Las características de la UCE más relevantes para la recaída son su duración, el UAS7 basal y la respuesta a omalizumab a 300mg cada 4 semanas. Una mayor duración de la enfermedad se ha asociado previamente con un mayor riesgo de recurrencia tras la interrupción3,15. El análisis univariante reveló una mayor duración en los pacientes que recaen; aunque tras el análisis multivariante perdió significación. Contrariamente a los hallazgos del análisis post hoc de los ensayos clínicos ASTERIA I/II y Marzano et al. en los que los pacientes no fueron optimizados previamente, no encontramos diferencias en el UAS7 basal entre los pacientes que experimentaron recaída y los que no3,8. Tampoco se encontraron diferencias en la presencia de angioedema, asociación con la UCI, tratamiento previo con fármacos inmunosupresores o necesidad de intensificación previa.
La respuesta y la duración del tratamiento con omalizumab influyen enormemente en la tasa de recaídas. El tiempo transcurrido hasta la RP fue significativamente más corto en los pacientes que recayeron en nuestra serie, lo que concuerda con estudios previos8,9. Los pacientes que responden más rápidamente iniciarán antes la reducción progresiva y, en general, recibirán menos tratamiento con el omalizumab. La reducción de la duración del tratamiento puede impedir que la enfermedad se autolimite, lo que conduce a un mayor riesgo de recaídas9. Aunque omalizumab no es un fármaco modificador de la enfermedad, la proporción de pacientes que permanecieron asintomáticos tras su suspensión aumenta con cursos repetidos de tratamiento21. De hecho, las variables asociadas a la duración del tratamiento con omalizumab fueron las más relevantes en el árbol de clasificación y permanecieron estadísticamente significativas tras la regresión de Cox. Por lo tanto, proponemos lograr una RC sostenida durante 12 meses con dosis estándar de omalizumab seguida de un régimen de disminución gradual durante 18 meses, como el mejor enfoque para minimizar la tasa de recurrencia.
Se han estudiado múltiples biomarcadores moleculares en la UCE, siendo la IgE total basal el más importante. Una IgE total basal elevada se asocia a una respuesta rápida al omalizumab y el cociente IgE sérica elevada a las 4 semanas/ IgE sérica basal es, hasta la fecha, el mejor predictor de buena respuesta18. Pequeños estudios han asociado una IgE basal elevada con un mayor riesgo de recurrencia, con un punto de corte en torno a 100-150KU/L, aunque estudios más amplios no han reproducido este hallazgo3,10–12. Observamos niveles basales de IgE más elevados en los pacientes que recayeron, que no alcanzaron significación estadística en el análisis univariante pero sí en la regresión de Cox.
La respuesta inflamatoria está estrechamente implicada en la patogenia de la UCE, y un tercio de los pacientes presentan un nivel sérico elevado de la PCR. Este biomarcador se asocia con la gravedad de la enfermedad y la refractariedad a los antihistamínicos22. No hay evidencia suficiente para apoyar el uso de esta molécula como biomarcador de mala respuesta al omalizumab18. Cabe destacar que un estudio reciente halló que los niveles elevados de PCR se asocian con una mejor tolerancia a las dosis optimizadas23. Basándonos en este último estudio, observamos una PCR más elevada en los pacientes que mantuvieron la RC frente a los pacientes que recayeron. Este resultado siguió siendo estadísticamente significativo tras la regresión de Cox, lo que sugiere que una PCR baja es un factor predictivo de la recurrencia.
Por último, los resultados de otras pruebas de laboratorio, como el recuento basal de eosinófilos, la velocidad de sedimentación globular, la hormona estimulante del tiroides, la peroxidasa antitiroidea o los anticuerpos antitiroglobulina, no difirieron entre los grupos ni se han descrito previamente como biomarcadores18.
ConclusionesLos factores predictivos más importantes de recaída en nuestro estudio se asociaron con la duración del tratamiento a diferentes dosis de omalizumab junto con la PCR basal y la IgE total. Los pacientes con la PCR elevada, la IgE baja y un tratamiento prolongado a dosis autorizadas son los más propensos a mantener el control de la enfermedad a los 12 meses. En este sentido, proponemos ≥12 meses de dosis estándar seguidos de un régimen de disminución prolongada como el mejor método para minimizar el riesgo de recurrencia. Además, si un paciente recae, podría reintroducirse la última dosis optimizada que logró la RC.
Las principales limitaciones de nuestro estudio son su diseño retrospectivo, la inclusión de pacientes que sólo recibieron optimización previa, el pequeño tamaño de la muestra y la ausencia de datos más allá de los 12 meses. Se necesitan más estudios para evaluar nuestros hallazgos y el perfil de eficacia del algoritmo propuesto.
Declaración del comité de revisión institucionalEl estudio se realizó de acuerdo con las directrices de la Declaración de Helsinki, y fue aprobado por la Junta de Revisión Institucional (o Comité de Ética) del GRUPO HOSPITALARIO QUIRÓNSALUD-CATALUNYA (código de protocolo 2023/03-DER-HUSC, 29/08/2023).
Declaración de consentimiento informadoSe renunció al consentimiento del paciente debido a la naturaleza retrospectiva del estudio y al uso de datos agregados anonimizados sin ninguna información identificativa de los pacientes.
FinanciaciónNinguna.
Conflicto de interesesG. Melé-Ninot ha sido asesor médico para Abbvie, Leo Pharma, Lilly, Sanofi y Novartis. Actividades educativas para Almirall, Avène, Abbvie, Laboratorio Reig Jofre, Leo Pharma, Lilly, Meda, Novartis, Sanofi, y Uriage.
V. Expósito-Serrano ha sido asesor médico y/o ponente y/o ha recibido fondos de investigación de Abbvie, Lilly, LEO Pharma, Novartis y Sanofi Genzyme.
M. Bonfill-Ortí ha sido asesor médico y/o ponente para Leo Pharma, Abbvie, Lilly, Novartis, Sanofi Genzyme, Roche y Sun Pharma.
A.M. Giménez-Arnau es o ha sido recientemente ponente y/o asesor y/o ha recibido fondos de investigación de Almirall, Amgen, AstraZeneca, Avene, Celldex, Escient Pharmaceutials, Genentech, GSK, Instituto Carlos III-FEDER, Leo Pharma, Menarini, Mitsubishi Tanabe Pharma, Novartis, Sanofi-Regeneron, Servier, Thermo Fisher Scientific, Uriach Pharma, Noucor.
Ribó P. ha sido asesor médico y/o ponente y/o ha recibido fondos de investigación de Sanofi y Novartis.
J. Spertino ha sido asesor médico y/o ponente y/o ha recibido fondos de investigación de Abbie, Lilly, Leo Pharma, Novartis, Sanofi Genzyme y Noucor.
Los demás autores declararon no tener ningún conflicto de intereses.
Disponibilidad de datosLos datos que respaldan las conclusiones de este estudio están disponibles a través del autor correspondiente previa solicitud razonable.