Proteger a los niños de la radiación ultravioleta es uno de los principales objetivos de todas las campañas de prevención del cáncer cutáneo. Sin embargo, el conocimiento acerca de las diferencias en riesgos derivados de la fotoexposición con respecto a los adultos y de las estrategias idóneas para afrontarlos son escasos. Entre los factores que favorecen una mayor susceptibilidad de la piel infantil se encuentran ciertos condicionantes anatómicos y funcionales en los niños por debajo de los 2 años de edad y hábitos de mayor exposición en las 2 primeras décadas de la vida. Los filtros en forma de emulsión en aceite con principios activos inorgánicos parecen ser los más seguros para los niños, aunque se requiere la adición de algunos filtros orgánicos para obtener un SPF 50. La oxibenzona y probablemente el octocrileno son filtros que deberían evitarse en los fotoprotectores pediátricos. El uso de fotoprotectores debe ser parte de una estrategia fotoprotectora basada en evitar la exposición solar en las horas del mediodía y usar ropas y gorros.
Todo ello justifica la implementación de campañas de prevención primaria que eduquen a los niños en hábitos de fotoprotección, y continuar la investigación básica y epidemiológica en la búsqueda de estrategias y fotoprotectores concretos para cada edad.
One of the main goals of all skin cancer prevention campaigns is to protect children from ultraviolet radiation. However, little is known about how sun exposure risks differ between adults and children or about how these risks are best managed. Children's skin is more susceptible to sun damage for a number of reasons, including certain anatomical and functional aspects in children under 2 years of age and habits that predispose to greater sun exposure during the first 2 decades of life. Oil-based emulsions containing inorganic filters appear to be safest sunscreens for children, although the addition of certain organic filters is necessary to achieve a sun protection factor of 50. Oxybenzone, and probably also octocrylene, should be avoided in sunscreens for children. Sunscreen use should be part of an overall sun protection strategy that includes avoidance of exposure to midday sun and the use of protective clothing and hats.
The above considerations justify the implementation of primary prevention campaigns focused on sun protection education for children and the continuation of basic and epidemiological research into specific sun protection strategies and sunscreens for each age group.
El sol permite la vida en la Tierra, proporciona sensación de bienestar y controla los biorritmos. Además, es fundamental para la síntesis de vitamina D. Sin embargo, también son conocidos los efectos perjudiciales de la radiación solar tanto a corto —eritema, inmunosupresión— como a largo plazo —fotocarcinogénesis y daño actínico—. Estos efectos adversos han justificado el desarrollo y evolución de una serie de medidas destinadas a minimizarlos, conocidas globalmente como fotoprotección y consideradas adecuadas para toda la población expuesta. Sin embargo, se ha propuesto que la población infantil sería especialmente susceptible a los efectos dañinos de la radiación solar. Estas consideraciones, unidas a una demanda social al respecto, han favorecido el desarrollo por parte de la industria de líneas de fotoprotección de uso exclusivo infantil, así como de estrategias de prevención primaria dirigidas a la población pediátrica.
Aunque pudiera parecer este contexto temerario, es lícito formularse la pregunta de si realmente la consideración de la edad infantil como diana diferenciada en fotoprotección tiene sentido. Es decir ¿existe evidencia científica que justifique distinguir las estrategias de fotoprotección pediátrica de las que se llevan a cabo para el resto de la población? Una estrategia de fotoprotección específicamente infantil sería razonable si la infancia, por cuestiones fisiológicas relacionadas con la edad o con sus hábitos, implicase un riesgo intrínseco añadido en referencia a los efectos adversos de la radiación solar. Por otro lado, también debería evaluarse de forma diferenciada en caso de que los componentes mismos de la estrategia de fotoprotección —por ejemplo los excipientes contenidos en los productos empleados o inclusive los propios filtros solares— supusiesen en la infancia un riesgo adicional, bien por efectos directos de estas sustancias (dermatitis alérgica, carcinogénesis), bien indirectos (por ejemplo hipovitaminosis D por baja fotoexposición).
La segunda cuestión importante es que aun asumiendo que en efecto la edad infantil represente un grupo diferenciado que requiera una aproximación particular en materia de fotoprotección, deberemos conocer si las estrategias y posibilidades técnicas disponibles las implementan de forma adecuada.
¿Existe un riesgo incrementado asociado a la fotoexposición en la infancia con respecto a la edad adulta?Riesgos relacionados con los hábitos de exposiciónEn su conjunto los datos acerca de la exposición solar en la infancia son limitados y proceden en su mayoría de entrevistas en grupos seleccionados y voluntarios. Existe la tendencia a considerar que el tiempo de exposición al sol en la infancia es mayor que en la edad adulta, circunstancia que condicionaría que durante estos años se acumulase buena parte de la irradiación —y por lo tanto, también del riesgo— que un individuo va a recibir a lo largo de su vida. Wright y Reeder estimaron, a partir de la evaluación de 345 escolares, que su exposición solar diaria media era de 2,3 horas, y que esta era superior en los días lectivos que durante los fines de semana, de ahí el promover la fotoprotección en las escuelas1.
La evaluación de qué dosis eritematógena puede representar este número de horas es enormemente difícil de establecer, además de ser muy variable en función de la latitud o de las condiciones climáticas. En su conjunto se considera que entre el 25 y el 50% del total de la dosis eritematógena recibida hasta los 60 años de edad ocurre durante la niñez, considerando como niño, según la Convención de los Derechos del Niño de 1990, desde el nacimiento hasta los 18 años2,3. Por tanto, parece que este es, para muchos individuos, el periodo de la vida en el que están más expuestos a la radiación solar, lo que justifica estimular la fotoprotección a esta edad.
Riesgos relacionados con diferencias estructurales entre la piel infantil y la de los adultosOtro factor de riesgo adicional para la piel del niño podría venir condicionado por el hecho de que la susceptibilidad al daño derivado de la luz solar fuera mayor que en los adultos o los mecanismos de defensa menos eficientes que en aquellos. La asunción de que la piel del niño es más sensible o más susceptible que la piel de los adultos a los daños solares parece justificada en los niños menores de 2 años4. Como se puede apreciar en la tabla 1 la piel de los lactantes presenta diferencias estructurales con respecto a la de los adultos5. Por un lado, tanto el estrato córneo como la epidermis completa son más delgados, el tamaño de los corneocitos y de las células de la capa granulosa es más pequeño y hay mayor cantidad, lo que sugiere un mayor recambio. Además, la proporción de lípidos por proteína es menor, así como la concentración de melanina. Con respecto a esta última algunos estudios de espectroscopia de reflectancia difusa han permitido demostrar que la piel de los niños menores de 12 meses tiene menor concentración de melanina que la de los niños entre 16-24 meses de edad6.
Diferencias en la estructura de la piel del lactante y del adulto42
| Estructuras cutáneas | Piel del lactante | Piel del adulto |
| Epidermis | ||
| Corneocitos | Más pequeños | Más grandes |
| Células granulares | Más pequeñas | Más grandes |
| Profundidad dermatoglifos | Similar al adulto | |
| Melanina | Menos | Más |
| Dermis | ||
| Pápila dérmica (densidad, tamaño y morfología) | Más homogéneas | Menos homogéneas |
| Transición dermis papilar/reticular | Ausente | Presente |
| Características cutáneas | ||
| Concentración de factor hidratante natural | Menor | Mayor |
| pH | Mayor (solo RN) | Menor |
| Secreción sebácea | Menor | Mayor |
| Contenido de agua del estrato córneo | Mayor | Menor |
| Densidad de fibras de colágeno | Menor | Mayor (adulto joven) |
| Funciones cutáneas | ||
| Absorción de agua | Mayor | Menor |
| Desorción de agua | Mayor | Menor |
| Función barrera | Competente | Competente |
| Pérdida transdérmica de agua | Mayor | Menor |
RN: recién nacidos.
En niños por encima de esta edad el grosor de la piel es similar a la de los adultos. Sin embargo, la especial estructura anatómica de la piel de los niños condiciona que la parte superior de las papilas dérmicas resulten más expuestas a la radiación solar, de manera que las células madre de la capa basal se encuentran expuestas a mayores dosis de radiación UV favoreciéndose, de este modo, el escalón de inicio del cáncer cutáneo no melanocitario7 (tabla 1).
No obstante, estas diferencias estructurales de la piel no tienen necesariamente un impacto en algunos de los aspectos fotobiológicos, como el eritema. De este modo, se ha demostrado que no hay diferencias en la dosis eritemática mínima (DEM) de niños por debajo de los 15 años de edad respecto a la de los adultos8.
Melanogénesis como marcador de daño actínico y marcador de riesgo de melanomaSi consideramos que el bronceado es iniciado por la p53 que se activa cuando existe daño en el ADN y que la exposición solar incidental induce bronceado ya en los niños menores de 1 año9, puede concluirse que el daño derivado de la radiación actínica se inicia en los primeros años de vida. Aquí de nuevo cabe plantearse si la melanogénesis, como mecanismo de defensa frente a la radiación solar, muestra diferencias funcionales en la edad infantil con respecto a la edad adulta. En este sentido se ha comprobado cómo aunque los niños desde los 6 meses presentan pigmentación como respuesta a la radiación solar, esta es menor en el intervalo de 6-12 meses con respecto a los 16-24 meses, circunstancia que pone en evidencia variaciones en la melanogénesis en relación con la edad10.
El desarrollo de nevos melanocíticos ha sido considerado como un signo de daño actínico y un marcador de riesgo para melanoma. De este modo, Whiteman et al., en un estudio epidemiológico en Australia, encontraron que la presencia de más de 10 nevos melanocíticos de al menos 5mm multiplicaba por 9,9 el riesgo de presentar un melanoma en la infancia11.
En estudios epidemiológicos internacionales se ha comprobado cómo al comparar niños de 8-9 años de un mismo grupo étnico pero en latitudes distintas el número de nevos fue hasta 7 veces superior en las áreas de mayor irradiación —Australia frente a Gran Bretaña—12. También se ha encontrado relación epidemiológica entre el número de nevos y aquellas zonas corporales sometidas a mayor número de episodios de quemadura solar13. Algunos autores proponen que no sería tanto la dosis acumulada como las exposiciones excesivas intermitentes que se producen en la práctica de deporte al aire libre o de episodios vacacionales las que incrementarían el riesgo de nevos melanocíticos14,15, aunque esto es algo no completamente demostrado.
Los nevos melanocíticos de los niños son también diferentes de los nevos de los adultos en cuanto a su epidemiología, morfología, genética y riesgo asociado de melanoma. La hipótesis es que pueden derivar de melanocitos en diferentes momentos de maduración16.
Radiación actínica en la infancia y riesgo de cáncer cutáneo en la vida adultaMelanomaSin duda uno de los riesgos más relevantes supuestamente asociados a la exposición solar es el posible incremento del riesgo de padecer un melanoma. En su conjunto, el riesgo de melanoma en la infancia es bajo, y representa entre el 2 y el 3% del total de melanomas17. Sin embargo, este riesgo se incrementa en el tiempo, de forma que el 85% de melanomas por debajo de los 20 años se concentran en el intervalo entre los 15 y los 19 años18.
De este modo es probable que el peso de la predisposición genética sea mucho mayor en los melanomas desarrollados en los primeros años de la vida, mientras que la radiación solar podría adquirir un mayor peso etiológico en los acontecidos en la adolescencia. En este sentido, en un estudio caso control sobre melanoma en la adolescencia, los casos presentaron un mayor número de episodios de quemadura solar que los controles19. Existen otros datos a favor de esta propuesta. Se ha detectado una mayor incidencia de melanoma en relación con la latitud del lugar de residencia en la infancia, circunstancia que permite sugerir la implicación de la radiación solar de forma similar a lo que ocurre en la edad adulta20. Algunos datos a partir de población inmigrante ponen de manifiesto cómo el riesgo de melanoma en inmigrantes se iguala al de la población nativa cuando el desplazamiento se realiza en los primeros años de la vida, circunstancia que parece hablar a favor del peso de la radiación solar en los primeros años de la vida en la incidencia de melanoma21.
En un estudio caso control realizado en 1990 se propuso que el riesgo de melanoma en la edad adulta asociado a la radiación solar estaba condicionado por la cantidad de radiación recibida durante la infancia22. Sin embargo, deben tenerse en cuenta numerosos factores de sesgo tales como la cantidad de radiación recibida en la edad adulta, los hábitos personales de exposición o el número de episodios de quemadura solar.
Uno de los condicionantes de la fotoexposición temprana en el desarrollo de melanoma en la edad adulta puede venir dado por las características del daño genético inducido cuando la radiación ocurre durante la infancia23. En pacientes con melanoma primariamente invasivo con una edad media al diagnóstico de 47 años, y con una intensa exposición solar en los primeros años de su vida, la mutación más frecuentemente encontrada fue BRAF, mientras que aquellos con una mayor exposición a la edad de los 50 y 60 años, con una media al diagnóstico de 62 años, presentaron con más frecuencia mutaciones en NRAS24. En consonancia con estos datos los nevos melanocíticos adquiridos en zonas fotoexpuestas en niños y adolescentes con frecuencia presentan mutaciones en BRAF y menos frecuentemente en NRAS. Sin embargo, en los nevos presentes al nacimiento la mayoría presentan mutaciones en NRAS, aunque aquellos con características histológicas de nevos congénitos pero con historia clínica de aparición más tardía muestran más frecuentemente mutaciones en BRAF25.
Cáncer cutáneo no melanocitarioLa incidencia de cáncer cutáneo no melanoma en la infancia es prácticamente despreciable, excepto en aquellos casos en los que existen trastornos genéticos en la reparación del ADN como el xeroderma pigmentoso o el síndrome del nevo basocelular25. Aunque en estos casos la exposición solar parece desempeñar un papel relevante, no es conocida la trascendencia de la radiación solar acumulada durante la infancia cuando el cáncer cutáneo no melanoma se desarrolla durante la vida adulta. Un estudio reciente afirma que la exposición solar en la infancia es más importante en el desarrollo del carcinoma escamoso que del basocelular26.
Riesgos relacionados con el fototipoEl riesgo para la mayoría de melanomas en adolescentes está en relación con los genes que controlan la pigmentación de la piel y la propensión a desarrollar nevos melanocíticos. Un número elevado de nevos y efélides, el cabello pelirrojo, los ojos azules, la incapacidad para broncearse, así como la historia familiar son los principales determinantes de melanoma entre los adolescentes27. Este riesgo asociado al fototipo condiciona claras diferencias en el riesgo de cáncer cutáneo entre niños y adultos emigrantes de áreas de alta a baja latitud3.
En una investigación llevada a cabo en Colorado estudiando el desarrollo de nevos melanocíticos de los 3 a los 8 años de edad, los niños blancos no hispanos fueron los que presentaron un incremento mayor con respecto a otros grupos raciales, en torno a 4-6 nevos/año, siendo el número medio de nevos más elevado en las zonas crónicamente expuestas de los niños que de las niñas28. Si el número de nevos melanocíticos es un factor de riesgo para el desarrollo de melanoma, estos niños podrían presentar un mayor riesgo para el desarrollo de este tumor, en relación directa con su exposición solar en la infancia29.
Riesgos asociados a la inmunosupresiónNumerosos estudios —realizados en modelos de laboratorio o en individuos adultos— permiten afirmar que la radiación UV disminuye tanto la respuesta inmunológica primaria como las células T de memoria a una gran variedad de antígenos30. Sin embargo, se presume que los efectos sobre la respuesta inmune en edades tempranas pueden modificar no solo las respuestas presentes, sino quizás también las futuras. En los ratones neonatos la radiación con UV se asocia a una síntesis disminuida de citocinas, con un deterioro de la red de células de Langerhans con pérdida de la capacidad para captar el antígeno y estimular la proliferación de células T. Además, se ha comprobado que suprime la respuesta de tipo Th2 y favorece un incremento del número de Tregs en los nódulos linfáticos31.
Estas acciones podrían condicionar una inmunosupresión antígeno-específica que suponga un aumento del riesgo de desarrollar cáncer cutáneo en el futuro. La observación experimental de cómo una única dosis de RUV puede causar cáncer en recién nacidos pero no en adultos en modelos de laboratorio pone de manifiesto cómo el impacto del daño actínico puede ser mucho mayor en un sistema inmunológico inmaduro32.
Incluso la efectividad de las pautas de vacunación podría verse influida, en opinión de algunos autores, por los efectos inmunomoduladores de la radiación UV33.
Sin embargo, no todas las acciones de la radiación UV sobre el sistema inmunológico infantil son perjudiciales, ya que también proporciona protección frente al desarrollo de fotodermatosis como la erupción solar polimorfa o enfermedades autoinmunes mediadas por células T, como la esclerosis múltiple o el asma.
Punto clave
Aunque se sabe por experiencias en animales que la radiación UV posee efectos inmunoduladores tanto negativos, favoreciendo la carcinogénesis, como positivos, evitando procesos autoinmunes, no se tiene el conocimiento de cómo ocurre esto en la población infantil ni qué repercusiones tiene en la realidad.
El empleo de productos fotoprotectores es el método de protección solar más utilizado en general y también en la población infantil34. En 1998 se publicó un estudio que relacionaba el uso de fotoprotector con el desarrollo de nevus melanocíticos en niños europeos de raza blanca, con la hipótesis de que quizás su uso favorecía exposiciones solares más prolongadas35. Esta observación parecía sugerir un efecto negativo, aunque colateral al incremento de exposición, en cuanto al empleo de sustancias fotoprotectoras. Sin embargo, estudios posteriores han permitido sugerir un efecto contrario cuando se empleaban fotoprotectores de amplio espectro y factor de protección solar (FPS) elevado. Esto es, una disminución del desarrollo de nevos melanocíticos en niños, especialmente en los niños pecosos36. Esta misma polémica ha surgido en referencia a la relación entre el empleo de fotoprotectores solares y el riesgo de melanoma. Aunque inevitablemente los datos son indirectos y sometidos a no pocos sesgos, el único metaanálisis publicado sobre el tema permitió concluir la ausencia de datos que demostrasen la asociación entre fotoprotectores tópicos y el incremento de melanoma37. Por el contrario, incluso algunos autores han evidenciado que el uso regular de fotoprotector podría prevenir el melanoma38. Un reciente metaanálisis concluye que por ahora no hay evidencia de que los fotoprotectores prevengan el desarrollo de nevos melanocíticos en niños39.
Riesgos asociados a los efectos adversos tópicos o sistémicos de los fotoprotectoresEn su conjunto, los fotoprotectores se considera que contienen moléculas seguras, en particular los de última generación. Estas últimas moléculas son de tamaño relativamente grande y apenas pueden penetrar más allá de la epidermis, circunstancia que limita las posibilidades de interacción con el sistema inmunológico o la absorción40.
Sin embargo, debe recordarse que en los niños el estrato córneo continúa desarrollándose a lo largo de los primeros años de la vida41. La piel de los lactantes hasta el año de vida tiene un mayor grado de hidratación, más permeabilidad para el agua y menor concentración de factor natural hidratante42. Estas circunstancias hacen especialmente relevante la vigilancia en cuanto al riesgo de absorción o de reacciones adversas de los fotoprotectores en la infancia.
La oxibenzona (benzofenona 3) es un fotoprotector de amplio espectro. Se ha observado que penetra en la piel humana in vitro y también se ha encontrado en la orina tras su aplicación tópica. De hecho, en un estudio poblacional se encontró en el 97% de los sujetos estudiados, incluidos niños mayores de 6 años43. Sin embargo, no se demostró que esta circunstancia afectase el eje hipotálamo-hipófisis-gonadal en adultos44. Se han encontrado diversos filtros solares, entre ellos la oxibenzona, excretados en la leche materna, y esta cantidad era proporcional a la cantidad aplicada en la piel de la madre. Por esta razón los autores recomiendan limitar el uso de estas sustancias en gestantes y lactantes. Por el momento, no se ha demostrado ninguna toxicidad debida a la absorción sistémica de ingredientes de los fotoprotectores41.
El octocrileno es un éster formado por la condensación de difenilcianoacrilato con 2-etilhexanol que forma parte de la familia de los cinamatos. Es un filtro introducido hace aproximadamente una década que absorbe tanto la radiación UVB como UVA cercano y además es un importante estabilizador de otros muchos filtros, especialmente los cinamatos y el butil-dibenzoilmetano, incrementando su eficacia y haciéndolos más resistentes al agua.
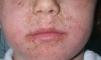
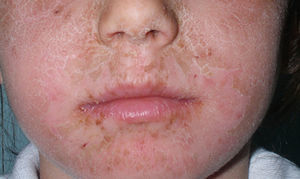
Las ventajas galénicas del octocrileno han hecho que cada vez se use más y a mayor concentración. Más de 300 de los fotoprotectores comercializados actualmente en el mercado español contienen octocrileno. Aunque globalmente debe considerarse una sustancia segura, desde hace unos años se han descrito tanto reacciones alérgicas como fotoalérgicas, incluyendo pequeñas series infantiles (fig. 1). Mientras que en la edad adulta a menudo se asocia a fotoalergia, con frecuencia por reacción cruzada con ketoprofeno, en la infancia la manifestación más habitual es en forma de dermatitis alérgica de contacto, casi siempre de relevancia presente45.
El retinil palmitato está presente en muchos cosméticos y también como aditivo en alimentos. Recientemente se ha postulado su papel como fotocarcinógeno por exceso de producción de especies reactivas del oxígeno. El retinol o vitamina A es un nutriente esencial con muchas funciones biológicas. En la piel se acumula en forma de retinil-palmitato. Los estudios en ratones han demostrado que el retinil palmitato aumenta la actividad fotocarcinogenética de la radiación UVB46, aunque su uso en humanos desde hace más de 50 años no ha permitido evidenciar que exista ningún reflejo clínico de ello47.
La voluntad por minimizar todos estos riesgos en la infancia ha favorecido las recomendaciones de emplear preferentemente fotoprotectores con filtros inorgánicos. Los filtros inorgánicos, como el óxido de cinc y de titanio, tienen la ventaja de ser muy fotoestables y de no provocar reacciones alérgicas. Sin embargo, son menos cosméticos que los filtros orgánicos. En este punto, las posibilidades tecnológicas han permitido elaborar moléculas cada vez más pequeñas, de entre 20 a 50 nanómetros frente a los 200-300 nanómetros habituales en formulaciones previas. Así, se han conseguido moléculas de tamaño incluso inferior a 0,2 micras, transparentes a la luz visible48. La aplicación de la nanotecnología hace a estas sustancias más transparentes y por tanto más cosméticas, pero surgen las dudas acerca de si su menor tamaño puede favorecer su absorción a través de la piel y, por lo tanto, su toxicidad. Un reciente estudio realizado en animales de experimentación permitió demostrar cómo tras el empleo de una fórmula de nanopartículas de dióxido de titanio estas permanecían de forma agregada en las capas más externas de la epidermis, tanto en la piel intacta como en la irradiada con un simulador solar49. En este sentido, por ahora no hay evidencias de su mayor absorción ni tampoco de un potencial efecto citotóxico o genotóxico. No obstante, no existen datos referentes al uso de estos productos en lactantes y niños que avalen —o no— la seguridad en este grupo poblacional. El amplio empleo del dióxido de titanio, que se utiliza como blanqueante de pasta de dientes o en la leche descremada, y del óxido de cinc, presente en las pastas barrera para los bebés o como aditivo en cereales, sin haberse detectado problemas asociados a su uso, van a favor de su seguridad en este grupo de edad41.
Aunque en condiciones basales estas moléculas solo son capaces de penetrar hasta el estrato córneo, podrían plantearse dudas en aquellos casos en que el estrato córneo no está íntegro50. Hasta la fecha, sin embargo, los estudios realizados tanto en piel humana como sobre modelos animales no han permitido demostrar esta circunstancia, ni siquiera en aquellos casos de piel dañada, como sería el caso en individuos con dermatitis atópica51.
Debido a su frecuente uso combinado en los meses de mayor exposición solar debe recordarse que los fotoprotectores pueden aumentar la absorción de los repelentes de insectos N, N- dimetil-meta-toluamida (DEET) especialmente cuando el DEET se aplica en primer lugar. Tampoco se recomiendan aquellos productos que combinan ambas sustancias41 Además, mientras que los fotoprotectores se deben reaplicar los repelentes de insectos no, para así evitar su toxicidad debido a la absorción percutánea52.
Punto clave
En la actualidad no existen evidencias de que ninguno de los filtros utilizados en los fotoprotectores tengan efectos perjudiciales en los niños. No obstante, el uso de filtros orgánicos como la oxibenzona o el octocrileno, así como de nanopartículas de los filtros inorgánicos es controvertido, especialmente en niños pequeños y en aquellos con problemas de integridad del estrato córneo.
La vitamina D es una hormona fundamental para el adecuado desarrollo y mantenimiento del sistema musculoesquelético y desempeña un importante papel en otras funciones del organismo como el sistema immune o el cardiovascular53. El efecto de las prácticas para prevenir el cáncer cutáneo sobre los niveles séricos de vitamina D depende de las medidas fotoprotectoras que cada individuo realice, el lugar donde viva, el fototipo, la edad y la ingesta oral de vitamina D. Esta circunstancia se pone de manifiesto en estudios epidemiológicos en adultos en lugares como Australia, Bangladesh y Hong Kong, con una alta irradiancia solar a lo largo de todo el año, en los que se demuestran niveles séricos de vitamina D de media inferiores a lo deseable54.
La evidencia disponible hasta la fecha no ha permitido demostrar que el uso de sustancias fotoprotectoras afecte a los niveles de vitamina D en la población general55. La falta habitual de implementación de los requisitos teóricos para una adecuada aplicación de los fotoprotectores puede favorecer de hecho la producción de vitamina D en muchos individuos56. De hecho se ha demostrado cómo la producción de vitamina D se incrementa exponencialmente dependiendo de la cantidad de radiación UVB recibida cuando se aplica menos espesor de fotoprotector del recomendado (<2mg cm-2)57. Desafortunadamente, no se dispone de estudios específicos en la población infantil.
Aunque es indiscutible que la vitamina D es importante para mantener un buen estado de salud, recomendar su obtención mediante una exposición intencionada a la radiación solar no es adecuado, ya que la radiación ultravioleta es un reconocido carcinógeno humano58. De este modo se ha establecido que la dosis de radiación UV efectiva para producir 1.000 UI de vitamina D, que es la que garantiza los niveles suficientes de esta vitamina en sangre para cumplir sus funciones, se consigue con 25% de la dosis eritematógena mínima de radiación UV incidente en un 25% de la superficie corporal (manos, brazos y cara), además de tener en cuenta la radiación solar ponderada por el momento en el que se hace la determinación53. Por otro lado, la exposición solar fuera del pico solar entre las 10 y las 15h solar en primavera, verano y otoño tiene un impacto limitado en la síntesis cutánea de vitamina D59. Además, la cantidad de fotones de radiación UVB que alcanzan la superficie terrestre durante los meses de invierno en latitudes superiores a 35° es muy poca. No hay estudios en niños que permitan sugerir qué nivel de exposición solar es necesario para no hacer necesarias las recomendaciones dietéticas de ingesta de vitamina D. De esta forma, tanto la Academia Americana de Pediatría (AAP) como el Comité de Nutrición de la Asociación Española de Pediatría recomiendan suplementar a los lactantes menores de un año con 400 UI de vitamina D3 al día desde el nacimiento, o recurrir al uso de fórmulas infantiles suficientemente enriquecidas60. Aquellos niños por encima de esta edad y adolescentes que no ingieran 400 UI/día en su dieta deberían ser suplementados con dicha cantidad.
¿Las estrategias fotoprotectoras actuales se corresponden con las necesidades en fotoprotección infantil?Campañas de fotoprotecciónComo en cualquier aspecto de nuestra salud, la estrategia más adecuada a largo plazo para realizar una exposición solar adecuada y responsable es la de la concienciación y adquisición de hábitos saludables en la población. La incorporación de estos hábitos es mejor hacerla en la infancia, por lo que estos mensajes han de llegar a la población infantil a través de campañas de educación para la salud que les enseñen cómo integrarlos en su forma de vivir. Estas campañas han de ser coordinadas con otras que promuevan otros comportamientos saludables, como la prevención de la obesidad y el síndrome metabólico. De hecho, estimular hábitos fotoprotectores se ha visto que no incrementa el sedentarismo en los niños, ni tampoco su índice de masa corporal. De forma idónea, estas campañas deberían orquestarse de forma coordinada y con medios suficientes desde los organismos que regulan la salud pública. De hecho, en contraposición a lo que pudiéramos pensar, las intervenciones a través de los consejos de los pediatras o los dermatólogos son útiles, pero modifican poco los hábitos de la población61. Campañas de amplia difusión en la sociedad como SunSmart en Australia62, SunSafe o SunWise en EE. UU.63–65 o incluso con un ámbito más reducido SolSano66 en nuestro país, tienen como objetivo educar a los niños y a sus padres para realizar actividades al aire libre pero evitando los perjuicios que la exposición solar puede conllevar.
Medidas generales de fotoprotecciónLas medidas fotoprotectoras que en principio se recomiendan para los niños, independientemente de su fototipo, incluyen llevar gorros y ropas, limitar la exposición solar en las horas centrales del mediodía, y para los niños mayores de 6 meses uso habitual de fotoprotectores con al menos un FPS 1567.
Uso de fotoprotectoresComo se ha desarrollado en párrafos previos, la inmadurez de la barrera epidérmica y la prevalencia de dermatitis atópica, especialmente en los niños más pequeños, refuerzan la necesidad de que los fotoprotectores para este grupo de edad sean mínimamente irritantes, con escaso o nulo potencial de sensibilización y que no se absorban. También es importante que no irriten los ojos (los niños se frotan la cara). Por otro lado, resulta fundamental que permitan una fotoprotección de amplio espectro, preferentemente duradera y resistente al agua y a la actividad física, condiciones habituales de empleo a esta edad. Ahora bien, ¿cumplen los fotoprotectores infantiles con estos requisitos?
Puede sorprender comprobar que la Recomendación de la Comisión de la Unión Europea de 22 de septiembre de 2006 no establece ningún requisito obligado para los fotoprotectores pediátricos. En general, estos contienen los mismos tipos de filtros que los de los adultos, si bien algunos de ellos poseen las mismas características que los fotoprotectores destinados a «pieles sensibles» y la mayoría son resistentes o muy resistentes al agua (capaces de soportar 2-4 inmersiones de 20min, según la normativa).
Las emulsiones en aceite que incorporan filtros inorgánicos parecen ser las más adecuadas para evitar la sensibilización, la irritación y la fotoalergia, pero no se han testado en niños4. No obstante, se ha demostrado que solo aquellos fotoprotectores pediátricos que combinan filtros orgánicos e inorgánicos en su fórmula pueden proporcionar un FPS 50, y no así los que solo contienen filtros inorgánicos68.
Un factor importante en la efectividad de un fotoprotector es que se aplique en cantidad suficiente. Los adultos tienden a ponerse entre una cuarta parte y la mitad de los 2mg/cm2 recomendados, de manera que el SPF se reduce proporcionalmente a la cantidad aplicada. Recientemente se ha comprobado que esto también ocurre en los niños cuando se lo aplican ellos mismos69. El estudio realizado en niños de 5-12 años permitió determinar que la cantidad media de fotoprotector aplicada fue de 0,48mg/cm2, siendo mayor si se aplica con un envase provisto de dispensador que si se hace presionando un envase blando o aplicándolo con un roll-on. En cuanto a la edad, los niños de 5-7 años tienden a ponerse más cantidad de fotoprotector (0,62-0,65mg/cm2) que los de 10-12 años (0,28-0,37mg/cm2).
Recomendaciones para una adecuada fotoprotección infantilAtendiendo a todo lo expuesto, y en consonancia con las recomendaciones de la Academia Americana de Pediatría38 y de la Academia Americana de Dermatología 2012, los consejos para la fotoprotección de niños y adolescentes que proponemos quedan expuestos en la tabla 2.
Medidas de fotoprotección para niños y adolescentes
| • Evitar el sol del mediodía y usar ropas, sombreros y gafas |
| • Utilizar un fotoprotector con las siguientes características: |
| FPS 30 o superior reaplicándolo cada 2h |
| Amplio espectro de protección (en su etiqueta ha de llevar la palabra UVA rodeada por un círculo) |
| Resistente al agua |
| Evitar la oxibenzona en su composición (y quizás el octocrileno, especialmente en niños con base atópica) |
| • Especial cuidado si existen nevus, pecas o antecedentes familiares de melanoma |
| • Énfasis en realizar fotoprotección >10 años (ya que a partir de esta edad disminuye enormemente el uso de medidas fotoprotectoras y comienza la búsqueda del bronceado) |
| • En adolescentes desaconsejar los rayos UVA |
| • Aunque la exposición de la piel al sol es una fuente de vitamina D, en la infancia se recomienda la administración de 400 UI de vitamina D3 al día durante el primer año de vida, así como por encima de esta edad y en adolescentes que no ingieran dicha cantidad en su dieta. |
| • Recomendaciones de fotoprotección para los niños menores de 2 años |
| Evitar la exposición solar |
| Ropa ligera pero de trama apretada |
| Aplicar fotoprotector solo en zonas no cubiertas por ropa o gorro cuando sea necesario |
Según la evidencia existente y expuesta en este artículo existen datos que apoyan unas estrategias de fotoprotección específicas en la infancia dadas las peculiaridades anatómicas, fisiológicas y funcionales de la piel infantil. También lo hacen recomendable los presumibles efectos que la radiación UV recibida en la edad infantil tendrá años más tarde en la carcinogénesis. Faltan, sin embargo, muchos datos al respecto. De este modo, sería idóneo conocer cuáles son los requisitos y necesidades para cada intervalo de edad, habida cuenta de que la consideración de la «edad infantil» como un todo es poco realista. También será necesario personalizar la estrategia de fotoprotección en función del fototipo, de la latitud y de los hábitos de exposición.
En cuanto a las medidas concretas, especialmente los fotoprotectores, que es la medida más utilizada, los conocidos como productos de fotoprotección infantil se limitan a perfilar algunas de las características —alta protección, resistencia al agua y a la actividad física, predominio de los filtros inorgánicos— presentes en los fotoprotectores habituales para los adultos.
Habida cuenta de que aunque las necesidades de una fotoprotección infantil están ahí, la regulación/normativa actual solo establece unos límites genéricos coherentes con las limitaciones tanto en el conocimiento íntimo de las peculiaridades del daño actínico en la infancia como, en consecuencia, de las capacidades técnicas para implementarlas. La existencia de fotoprotectores específicos infantiles está justificada, pero no solo para recordar la importancia de proteger de forma especial a este colectivo, sino porque deben ofrecer elementos diferenciadores y adaptados a este grupo de edad.
Es probable que, en este contexto, y a la espera de conocer mejor el espectro del daño actínico en la infancia, tanto desde el punto de vista epidemiológico como fisiopatogénico, las estrategias más adecuadas —aunque también las más difíciles de implementar— son aquellas que tienen que ver con el desarrollo y ejecución de campañas de prevención y la difusión e integración por parte de la población general, y de los niños en particular, de hábitos saludables de fotoprotección.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no hay conflicto de intereses.