Actualmente disponemos de escasa evidencia científica que defina el efecto exacto del uso de determinados fármacos sobre el desarrollo embrionario o fetal en gestantes con psoriasis debido a la ausencia de ensayos clínicos llevados a cabo en esta población por razones éticas. La información publicada respecto al uso de terapia biológica durante la gestación es escasa, y se basa en estudios retrospectivos y observacionales, y la experiencia de su uso en psoriasis, por el momento, es escasa. Los datos recogidos en la literatura parecen ofrecer una seguridad aceptable respecto al uso de terapia biológica durante la gestación; sin embargo no existe una evidencia absoluta. Esta revisión intenta describir con detalle la experiencia acumulada publicada en la literatura respecto al uso de terapia biológica en la gestación, aunque, como sabemos, la mayoría de los artículos se refieren a otro tipo de enfermedades reumatológicas, pero su uso en psoriasis crece progresivamente.
Scarce scientific evidence is available to define the precise effects that certain drugs might have on embryonic and fetal development if taken by pregnant women with psoriasis, given the ethical concerns that preclude enrolling such women in clinical trials. The little information on the use of biologics during gestation that has been published is based on retrospective and observational studies, and experience with these drugs in this context in psoriasis is still very limited. The literature seems to suggest that biologic therapy is safe during pregnancy, but there is no certainty. This detailed review of accumulated experience with biologic therapy during pregnancy relies mainly on descriptions of the management of other types of rheumatic disease, although the use of these agents in psoriasis is growing steadily.
Tanto la Food and Drug Administration de Estados Unidos (FDA) como la Agencia Europea del Medicamento (EMA) consideran que todavía no se ha demostrado la seguridad de la terapia biológica para la psoriasis durante la gestación, haciendo énfasis en la necesidad de farmacovigilancia posterior a la comercialización en mujeres gestantes. Estos agentes biológicos son clasificados por la FDA dentro de la categoría B, es decir, que no se ha detectado riesgo aparente en estudios efectuados en animales de experimentación, pero que no se han realizado estudios controlados en mujeres que hayan recibido estos fármacos durante la gestación, por lo que no se sabe si pueden ocasionar daño fetal en el ser humano1. El grado de evidencia científica asignado al uso de estos fármacos durante la gestación y la lactancia es de nivel iii-iv, en función de la información procedente de estudios descriptivos no experimentales, estudios comparativos y de casos-controles2. Aunque no hay una evidencia absoluta, la experiencia acumulada en la literatura sobre la exposición de gestantes a terapia biológica parece ofrecer una seguridad aceptable; sin embargo, la interpretación de los datos debe ser prudente y se deben tener en cuenta múltiples aspectos. Los datos recogidos se refieren sobre todo a la experiencia en mujeres diagnosticadas de artritis reumatoide y enfermedad inflamatoria intestinal, y la experiencia de su uso en psoriasis es por el momento escasa.La exposición a terapia biológica durante el embarazo se puede clasificar atendiendo a las circunstancias de la misma:
- -
Gestaciones no planeadas, en las que las exposiciones suceden durante la concepción y el primer trimestre.
- -
Gestaciones en las que el tratamiento es intencional, debido a la naturaleza refractaria de la enfermedad.
La duración y el tiempo de exposición a los agentes biológicos durante la gestación son variables; en la mayoría de los registros la mayoría de las mujeres suspendían la terapia biológica en el momento de la confirmación del embarazo, generalmente en el primer trimestre1. Por otro lado, el desarrollo de cada embarazo depende de muchos otros factores, como la propia enfermedad y su actividad y la existencia de comorbilidades asociadas, y estos datos están ausentes en muchos de los artículos publicados.
La información en la que se basa esta revisión sobre terapia biológica en las gestantes con psoriasis procede de series pequeñas de casos, grandes estudios retrospectivos y registros, tanto de compañías farmacéuticas como de diversas organizaciones y asociaciones internacionales, incluyendo la Organización de los Especialistas en Información Teratológica (OTIS), que es un grupo de investigación colaborativa de EE. UU. y Canadá que recoge la información relativa al uso de agentes anti TNF-α durante la gestación1. Las 2 bases de datos más importantes que recogen datos sobre la exposición a infliximab durante el embarazo son el registro de seguridad de infliximab de la FDA- Crohn’ Therapy, Resource, Evaluation and Assesment Tool (FDA-TREAT) y la Base de datos de seguridad de infliximab3. La Sociedad Británica de Reumatología identificó 35 gestaciones de un total de 11.473 pacientes tratadas con agentes dirigidos contra el factor de necrosis tumoral alfa (TNF-α)4. Johnson & Johnson mantiene la Search of Benefit Risk Management Worldwide Safety Database (base de datos SCEPTRE)5, que incluye todos aquellos casos registrados de gestación en pacientes que han recibido infliximab antes o después de la concepción. El registro español BIOBADASER identificó 14 embarazos en 13 mujeres entre 3.550 mujeres expuestas a terapia biológica para el tratamiento de diversas enfermedades reumatológicas6.
Agentes biológicos dirigidos contra el factor de necrosis tumoral alfaEl TNF-α es una citocina multifuncional que, durante el embarazo, regula la síntesis hormonal, la arquitectura placentaria y el desarrollo embrionario; la elevación en los niveles de TNF-α circulantes se ha asociado con preeclampsia, abortos e infertilidad en modelos animales y humanos, y se sabe que desempeña un papel importante en la pérdida fetal mediada tanto por vía hormonal como inflamatoria7,8. Recientemente se han publicado 2 estudios observacionales de cohorte que mostraron la efectividad y fiabilidad respecto del uso de agentes antiTNF-α en pacientes con historia de abortos espontáneos recurrentes e infertilidad9,10. Por lo que se refiere al efecto de la terapia antiTNF-α sobre la fertilidad masculina, se sabe que el factor TNF-α es producido por las células germinales testiculares e interviene de forma importante en la regulación de la espermatogénesis. Generalmente los niveles de esta citocina en el líquido seminal son bajos, pero tienden a incrementarse en diferentes enfermedades inflamatorias e infecciosas, y las concentraciones patológicamente elevadas de TNF-α pueden producir un déficit funcional y de la integridad genómica de los espermatozoides11.
También se ha de tener en cuenta que el TNF-α es importante en el desarrollo del sistema inmune, por lo que la exposición a agentes anti TNF-α en mujeres gestantes podría interferir con el desarrollo del sistema inmune del recién nacido, pero en este momento se desconocen las posibles implicaciones a largo plazo (más allá de la exposición transplacentaria), si es que existen12.
A continuación se describe en detalle la evidencia científica publicada respecto al uso en mujeres gestantes de cada uno de los fármacos biológicos utilizados para el tratamiento de la psoriasis.
InfliximabInfliximab es un anticuerpo monoclonal compuesto por una porción variable de origen murino y una porción constante de origen humano. Se une con alta especificidad y afinidad a las formas triméricas, diméricas y monoméricas del TNF-α; además neutraliza el receptor transmembrana y las células portadoras del TNF-α. Actualmente se han registrado más de 300 gestaciones en mujeres que recibían infliximab, procedentes bien de publicaciones bien comunicaciones en diferentes reuniones científicas13.
Mahadevan et al.14 fueron los primeros en describir el uso intencionado de infliximab durante la gestación para la inducción y mantenimiento de la remisión de la enfermedad de Crohn, en una serie de 10 pacientes, 8 de las cuales mantuvieron el tratamiento durante toda la gestación y 2 solo durante el primer trimestre. Todas ellas dieron a luz a recién nacidos vivos y no se registraron malformaciones congénitas ni crecimiento intrauterino retardado; hubo 3 casos de partos prematuros y uno de bajo peso al nacer.
La mayor parte de los datos relativos al curso y pronóstico de gestantes tratadas con infliximab proceden de la información recogida en 2 grandes registros: la Base de datos de seguridad de infliximab que gestiona Centocor y el registro TREAT. Katz et al.15 analizaron el primero e identificaron 131 mujeres embarazadas expuestas al fármaco. Pudieron recogerse datos de 96 pacientes (82 con enfermedad de Crohn, 8 con artritis reumatoide, una con colitis ulcerosa y 3 de diagnóstico desconocido), y el tiempo de exposición a infliximab pudo ser calculado en 90 de las 96 pacientes; el 29% estuvieron expuestas en los 3 meses previos a la concepción y durante el primer trimestre de embarazo. De los 96 embarazos el 67% resultaron en recién nacidos vivos, el 15% en aborto involuntario y el 19% en aborto terapéutico. De los 68 recién nacidos vivos 5 tuvieron diversas anomalías: malrotación intestinal (había evidencia de exposición adicional intraútero a leflunomida, un teratógeno conocido) y tetralogía de Fallot, entre otras. Sin embargo, estos resultados son similares a los hallados en la población general de mujeres embarazadas o de gestantes con enfermedad de Crohn no expuestas a infliximab.
El registro TREAT es un registro prospectivo de pacientes con enfermedad de Crohn, tratados o no con infliximab; Lichtenstein et al. revisaron 5.807 pacientes e identificaron 36 mujeres embarazadas con exposición previa a infliximab16. Las tasas de aborto (11% en pacientes expuestas frente a 7,1% en no expuestas) y de complicaciones perinatales (8,3% expuestas frente a 7,1% no expuestas) no fueron significativamente diferentes en ambos grupos de pacientes.
Carter et al.17 sugirieron una posible asociación entre un tipo de anomalías congénitas y el uso de terapia anti TNF-α durante la gestación. El acrónimo VACTERL se utiliza para describir la asociación de defectos vertebrales, atresia anal o ano imperforado, anomalías cardiacas (con mayor frecuencia defectos en el septo auricular, defectos en el septo ventricular y tetralogía de Fallot), fístula traqueoesofágica, atresia esofágica, anomalías renales y/o radiales y anomalías en las extremidades inferiores, y tiene una incidencia de 1,6/10.000 recién nacidos vivos. Otros fármacos que inhiben el factor TNF-α, como son la talidomida y el valproato sódico, se han relacionado con el desarrollo de anomalías congénitas, algunas de las cuales forman parte de la asociación VACTERL. Revisando más de 120.000 acontecimientos adversos, los mencionados autores encontraron 61 anomalías congénitas en 41 niños nacidos de madres que tomaban estos agentes. Veinticuatro de estos 41 niños (59%) tuvieron una o más anomalías congénitas que formaban parte del grupo VACTERL; 7 tuvieron 2 o más y solo uno fue diagnosticado de auténtico VACTERL. Catorce de estos niños nacieron de madres que tomaban etanercept y 10 de madres que tomaban infliximab. Sin embargo, la valoración real de estos resultados es discutible debido al desconocimiento del número de gestantes expuestas, así como de la metodología en la recogida de datos: no se especificó la dosis ni el tiempo de exposición al fármaco; tampoco se describe el número de mujeres expuestas, lo que crea dificultades a la hora de estimar la magnitud del riesgo asociado; por último, las anomalías descritas son muy comunes en la población, y algunas de ellas aisladas no necesariamente forman parte del complejo VACTERL18.
En una reciente publicación de Crijns et al.19, en la que comparaban la distribución del grupo de anomalías VACTERL de la serie de Carter et al. con su distribución en la población general, según la base de datos EUROCAT, que engloba una gran población europea y contiene registros de anomalías congénitas desde 1980 incluyendo recién nacidos vivos y muertes, no se encontraron diferencias estadísticamente significativas.
Schnitzler et al.20 llevaron a cabo un estudio observacional que evaluaba los resultados del embarazo en 212 mujeres diagnosticadas de enfermedad inflamatoria intestinal tratadas con agentes anti-TNFα. Los resultados de 42 embarazos con exposición directa al tratamiento anti-TNFα (35 infliximab, 7 adalimumab) se compararon con los de 23 embarazos previos al diagnóstico de la enfermedad inflamatoria intestinal, 78 embarazos antes del inicio de infliximab, 53 embarazos con exposición indirecta a infliximab y 56 correspondientes a embarazos en mujeres sanas. Treinta y dos de los 42 embarazos terminaron en recién nacidos vivos con una mediana de edad gestacional de 38 semanas. Hubo 7 partos prematuros y 6 recién nacidos presentaron bajo peso al nacer. Un niño nacido en la semana 33, que pesó 1.640g, murió a los 13 días debido a una enterocolitis necrosante. Se produjeron un total de 8 abortos (uno de ellos voluntario) en 7 mujeres. Hubo un caso de trisomía 18 en el hijo de una madre tratada con adalimumab. En este estudio no se encontraron diferencias significativas entre los embarazos en pacientes con exposición directa al tratamiento con anti TNF-α durante el embarazo y los embarazos con exposición previa o anteriores al tratamiento con esta modalidad terapéutica, es decir, que la exposición directa al tratamiento anti-TNFα durante el embarazo no se relacionó con una mayor incidencia de resultados adversos del embarazo en pacientes con enfermedad inflamatoria intestinal. Recientemente, Argüelles-Arias et al.21 han publicado una serie de 12 pacientes embarazadas (4 con colitis ulcerosa y 8 con enfermedad de Crohn) que fueron expuestas a infliximab durante la gestación; 6 pacientes recibieron el fármaco de forma ininterrumpida durante toda la gestación, 2 interrumpieron voluntariamente el tratamiento y 3 pacientes interrumpieron infliximab durante el primer trimestre. Ocho partos fueron por cesárea y 4 por vía vaginal. Ninguno de los recién nacidos presentó anomalías congénitas, retraso del crecimiento intrauterino o bajo peso al nacer, aunque hubo un caso de parto prematuro.
Por lo que respecta a pacientes con psoriasis Puig et al.22 publicaron un caso de una mujer gestante con antecedentes de psoriasis de 20 años de evolución que desarrolló una psoriasis pustulosa generalizada durante su primera gestación, refractaria al tratamiento inicial con corticoides sistémicos y ciclosporina, en la que se inició terapia con infliximab a dosis de 5mg/kg, alcanzando la respuesta PASI75 tras la primera infusión y el blanqueamiento completo a la semana 6 del inicio del tratamiento. La paciente quedó embarazada durante el tratamiento, que se continuó durante 19 meses sin detectarse efectos adversos ni anomalías fetales. Posteriormente, en una segunda gestación, la misma paciente estuvo expuesta a infliximab durante el primer trimestre, dando a luz a un recién nacido sano.
En la valoración del cociente riesgo beneficio del tratamiento con infliximab durante el embarazo hay que tener en cuenta que la exposición materna a infliximab puede modificar la maduración normal del sistema inmunitario del niño y puede predisponer a un riesgo incrementado de infecciones, o a una respuesta anormal frente a la vacunación13. En un caso de exposición materna a infliximab durante toda la gestación descrito por Vasiliauskas et al.23 el neonato presentó una evaluación normal de su sistema inmune a los 6 meses de nacimiento, a pesar de que se detectaron niveles bajos, aunque terapéuticos, de infliximab en el suero del neonato. Sin embargo, se desconoce el verdadero grado de eventual inmunosupresión y cabe esperar que la presencia de niveles detectables de infliximab en el suero del recién nacido interfiera con su capacidad para combatir tuberculosis u otras infecciones y la tolerancia a vacunas con virus vivos atenuados. Mahadevan et al.24 no objetivaron alteraciones con respecto a la respuesta inmunitaria vacunal en 8 niños nacidos de madres expuestas a infliximab durante toda la gestación, pero recientemente se ha publicado un caso de muerte a consecuencia de una infección tuberculosa diseminada posvacunal de un niño cuya madre recibió infliximab durante todo el embarazo para el tratamiento de su enfermedad de Crohn25. El neonato recibió la vacuna BCG a los 3 meses de edad, falleciendo al mes y medio de su administración. La mayoría de los casos de tuberculosis diseminada se han descrito en pacientes inmunocomprometidos, sin embargo en este niño no fue posible evaluar el estado de su sistema inmunitario ni la existencia de algún tipo de inmunodeficiencia25.
El uso de vacunas con virus vivos atenuados está contraindicado en pacientes sometidos a terapia biológica, y en el último Congreso Mundial de Gastroenterología se aprobó por consenso el retraso en la administración de vacunas con virus vivos atenuados a niños que habían sido expuestos intraútero a terapia biológica, al menos hasta que los niveles del fármaco en el suero del niño sean indetectables, lo que puede requerir varios meses26. Por el momento se desconocen las consecuencias a largo plazo que pudiera tener la exposición fetal a la terapia biológica en el sistema inmune del neonato.
AdalimumabAdalimumab es un anticuerpo monoclonal recombinante de origen humano que se une con alta especificidad y afinidad al TNF-α e inhibe su unión a receptores específicos27. La mayoría de los datos publicados en la literatura provienen de gestantes diagnosticadas de artritis reumatoide y enfermedad inflamatoria intestinal. La OTIS publicó en 201128 los resultados de una cohorte de 161 gestantes expuestas a adalimumab durante el primer trimestre de embarazo (101 con enfermedad de Crohn y 60 con artritis reumatoide) comparándolos con un grupo de 68 gestantes con artritis reumatoide, 11 con enfermedad de Crohn y 134 mujeres sanas no expuestas a tratamiento con adalimumab. El 3,4% de las mujeres en el grupo de artritis reumatoide expuestas a adalimumab tuvieron un hijo con un defecto congénito importante, en comparación con el 4,6% de las mujeres con artritis reumatoide no expuestas. Un 14,1% de las mujeres con enfermedad de Crohn expuestas a adalimumab tuvieron hijos con un defecto congénito importante en comparación con el 10% del grupo de pacientes con enfermedad de Crohn no expuestas al fármaco. Dentro del grupo de gestantes sanas se detectaron defectos congénitos mayores en el 4,1%. La tasa de aborto espontáneo en los grupos expuestos a adalimumab fue del 10,0% y 12,9% (artritis reumatoide y enfermedad de Crohn respectivamente) frente al 4,4% y 9,1% en los correspondientes grupos no expuestos y el 1,5% en el grupo de gestantes sanas. No se encontraron diferencias estadísticamente significativas entre grupos en relación con la tasa de malformaciones congénitas, mientras que se observó una tasa mayor de abortos espontáneos en el grupo de gestantes expuestas a adalimumab; según los autores esta diferencia podría deberse a la inclusión temprana en el estudio, que es cuando el riesgo de aborto es mayor, de las pacientes expuestas a adalimumab.
Dessinioti et al.29 han descrito recientemente el caso de una gestante diagnosticada de psoriasis y expuesta a adalimumab durante el primer trimestre, con una evolución gestacional y parto normales sin evidencia de malformaciones congénitas.
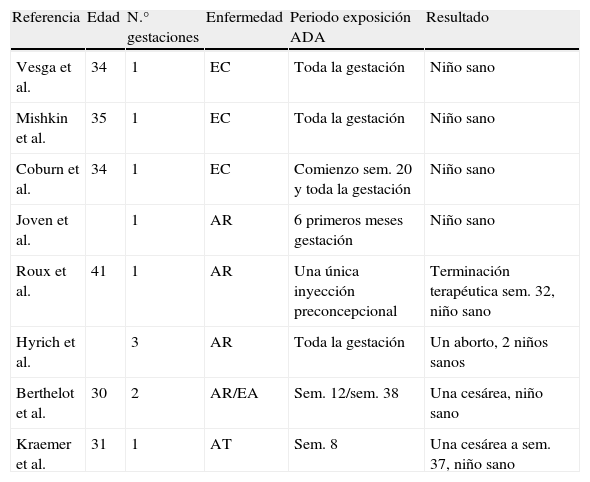
En la tabla 1 se detallan otros casos aislados de exposición a adalimumab durante la gestación sin que se haya observado una mayor tasa de malformaciones congénitas, abortos o complicaciones durante la gestación30.
Otras series de casos aislados con evidencia de exposición a adalimumab durante la gestación
| Referencia | Edad | N.° gestaciones | Enfermedad | Periodo exposición ADA | Resultado |
| Vesga et al. | 34 | 1 | EC | Toda la gestación | Niño sano |
| Mishkin et al. | 35 | 1 | EC | Toda la gestación | Niño sano |
| Coburn et al. | 34 | 1 | EC | Comienzo sem. 20 y toda la gestación | Niño sano |
| Joven et al. | 1 | AR | 6 primeros meses gestación | Niño sano | |
| Roux et al. | 41 | 1 | AR | Una única inyección preconcepcional | Terminación terapéutica sem. 32, niño sano |
| Hyrich et al. | 3 | AR | Toda la gestación | Un aborto, 2 niños sanos | |
| Berthelot et al. | 30 | 2 | AR/EA | Sem. 12/sem. 38 | Una cesárea, niño sano |
| Kraemer et al. | 31 | 1 | AT | Sem. 8 | Una cesárea a sem. 37, niño sano |
AR: artritis reumatoide; AT: arteritis de Takayasu; EA: espondilitis anquilopoyética EC: enfermeddad de Crohn.
Adaptada y traducida de Jürgens et al.30.
Como se ha comentado previamente, existe una base científica para investigar las aplicaciones de los inhibidores de TNF-α en el ámbito de la fertilidad como terapéutica en la denominada «infertilidad inflamatoria». Concretamente Winger et al.31 han publicado varios trabajos que intentan demostrar la efectividad de esta terapia en este grupo de pacientes. En un primer artículo investigaron y compararon la eficacia de la administración combinada de terapia antiTNF-α (adalimumab y etanercept) junto con inmunoglobulinas intravenosas y anticoagulantes orales frente a la monoterapia con anticoagulantes orales en 75 pacientes con historia de abortos espontáneos recurrentes y trombofilia hereditaria. Los mencionados autores obtuvieron un resultado favorable, con diferencias estadísticamente significativas respecto al número de gestaciones a término y bajo riesgo de complicaciones gestacionales y perinatales en el grupo de terapia combinada. Otro estudio publicado recientemente por los mismos autores32 evalúa el riesgo asociado con la terapia preconcepcional con adalimumab en mujeres subfértiles con elevación del cociente de citocinas Th1/Th2 sometidas a terapia de fecundación in vitro y la tasa de malformaciones congénitas. El grupo expuesto al fármaco recibió 2 dosis de adalimumab separadas por un intervalo de 2 semanas entre los días 41-65 previos a la transferencia de embriones. El primer grupo recibió 2 dosis de adalimumab con un intervalo de 2 semanas. La tasa de anomalías fue del 2,44 y 2,11% para los grupos 1 y 2 respectivamente, que es comparable a la observada en la población general sometida a fecundación in vitro. En el grupo tratado se observó un caso de síndrome de DiGeorge y en el grupo no tratado se observó un caso de síndrome de Edward. Los autores no objetivaron un incremento de malformaciones congénitas utilizando un inhibidor TNFα preconcepcional, pero se necesitarían estudios más amplios para poder confirmar estos datos.
Por lo que se refiere al paso transplacentario, tanto infliximab como adalimumab son inmunoglobulinas IgG1, es decir moléculas largas hidrofílicas con una masa molecular aproximada de 150kD, por lo que únicamente pueden transferirse a nivel placentario mediante transporte activo mediado por un receptor específico3. El primer paso en la transferencia maternofetal de IgG tiene lugar a través de un receptor denominado receptor neonatal (FcRn). Se trata de una molécula heterodimérica compuesta por una cadena α y β2-microglobulina que se une a la IgG con alta afinidad a un pH 6-6,5, siendo la eficiencia en el transporte transplacentario diferente para las distintas subclases de Ig según el esquema IgG1>IgG4>IgG3>IgG2. Infliximab y adalimumab son anticuerpos de tipo IgG1. Durante el primer trimestre de gestación FcRn es altamente detectable a nivel del sincitiotrofoblasto, pero no antes de la semana 14 de gestación. Sin embargo, algunos autores han detectado transferencia de IgG al tejido embrionario a las 4 semanas de gestación, sugiriendo que podría existir un mecanismo alternativo —aún no identificado— de transporte placentario de inmunoglobulinas durante las primeras semanas de gestación3. Por tanto, se observaría un transporte mínimo de estos fármacos durante el primer trimestre, pero que se incrementaría conforme progresa el embarazo, debido a la expansión del sincitiotrofoblasto placentario y la discontinuidad del citotrofoblasto, que comenzaría a formarse en el segundo trimestre. Además, se han encontrado receptores FcRn en la superficie de las microvellosidades del intestino fetal a partir de las 18 semanas de gestación, ya que si tenemos en cuenta que al comienzo del 5.° mes el feto comienza a deglutir líquido amniótico y que este es el principal proceso implicado en el aclaramiento de proteínas del líquido amniótico, por lo que sería otro posible mecanismo a tener en cuenta en la transferencia materno-fetal.3
EtanerceptEtanercept es una proteína de fusión formada por la unión de la porción extracelular del receptor p75 del factor de necrosis tumoral y la fracción constante de la IgG1 humana, que actúa mediante la inhibición competitiva de la unión del TNF-α a su receptor en la superficie celular. Ha demostrado su eficacia en el tratamiento de la psoriasis moderada o grave del adulto y del niño, artritis psoriásica, artritis reumatoide, espondilitis anquilopoyética y artritis reumatoide juvenil (artritis reumatoide)1.
La Sociedad Británica de Reumatología identificó 35 gestaciones de un total de 11.473 pacientes tratadas con terapia antiTNF-α y documentó el seguimiento en 32 embarazos (29 pacientes tenían artritis reumatoide, una artritis psoriásica, una espondilitis anquilopoyética seronegativa y una artritis juvenil idiopática). Veintitrés de estas mujeres continuaron esta terapia (etanercept en 17, infliximab en 3 y adalimumab en 3) en el momento de la concepción, y 11 mujeres estaban tomando de forma concomitante metotrexato y leflunomida. Solo 2 pacientes continuaron la terapia con antiTNF-α durante el primer trimestre (en un caso hasta la semana 20 y en el otro durante toda la gestación). Catorce mujeres tuvieron recién nacidos vivos, 6 abortos involuntarios (4 con etanercept, una con adalimumab, una con infliximab, incluyendo las 3 pacientes que tomaban metotrexato de forma paralela) y 3 abortos electivos (3 con etanercept, 2 con metotrexato). No se observó un incremento de toxicidad maternofetal ni tampoco se detectaron anomalías congénitas. Una de las pacientes con artritis reumatoide, que estaba recibiendo tanto etanercept como leflunomida en el momento de la concepción, dio a luz un niño sano de forma prematura, a las 34 semanas de gestación. Otra paciente con artritis reumatoide que también recibió etanercept en el momento de la concepción dio asimismo a luz a un bebé sano, pero con bajo peso al nacer (2.180g). En la paciente que continuó etanercept en el segundo trimestre se realizó una cesárea de urgencia por sufrimiento fetal intraparto. La paciente que continuó con etanercept durante toda la gestación tuvo un parto a término con cesárea por hemorragia intraparto. En esta serie de 32 mujeres con enfermedades reumáticas expuestas a anti-TNFα en el momento de la concepción o en los 10 meses anteriores, no se objetivó un aumento en la tasa de malformaciones congénitas, abortos o complicaciones durante el embarazo, en comparación con la población general4.
La OTIS registró el seguimiento de 33 pacientes embarazadas diagnosticadas de artritis reumatoide que se habían expuesto a antiTNF-α durante el primer trimestre de gestación (etanercept en 29 casos e infliximab en 4) entre 1999 y 2004 y comparó los datos con los de 77 pacientes con artritis reumatoide que no se encontraban bajo tratamiento con antiTNF-α y 50 pacientes sanas. En el grupo de etanercept se identificaron 3 abortos espontáneos y un solo defecto mayor (trisomía 18); no se encontraron diferencias estadísticamente significativas en la presencia de parto prematuro ni bajo peso al nacer con respecto al grupo control de pacientes con artritis reumatoide sin terapia biológica, pero sí con respecto al grupo de pacientes sanas, por lo que los autores sugieren que esto podría atribuirse al efecto de la enfermedad subyacente más que a la terapia biológica33,34. La misma organización realizó otro estudio retrospectivo en 256 pacientes gestantes entre 2005 y 2008 (102 con artritis reumatoide, 25 con psoriasis y artritis psoriásica, 16 con EA y 32 con otras enfermedades) en el que compararon el grupo de 175 pacientes expuestas a etanercept con el grupo control no expuesto de 81 pacientes. No se observaron diferencias estadísticamente significativas respecto a la tasa de abortos, partos prematuros o malformaciones congénitas34,35.
El registro español BIOBADASER identificó 14 embarazos en 13 mujeres de un total de 3.550 mujeres expuestas a terapia biológica para diversas enfermedades reumatológicas. Ocho pacientes habían recibido etanercept, 4 infliximab y 2 adalimumab. Hubo 7 nacimientos sin complicaciones (4 con etanercept y 3 con infliximab), 3 abortos terapéuticos (2 con etanercept y uno con adalimumab) y un aborto espontáneo con infliximab6.
Strangfeld et al.36 recogieron datos procedentes del registro alemán RABBIT, que evalúa pacientes con artritis reumatoide que han iniciado terapia biológica, hallando 37 embarazos en 29 mujeres que fueron expuestas a agentes anti-TNFα durante la concepción o al menos durante el primer trimestre de gestación (infliximab=2, adalimumab=5, etanercept=20, otros=8). No se encontraron diferencias estadísticamente significativas entre el peso de los recién nacidos ni se objetivaron malformaciones congénitas.
Viktil et al.37 han publicado recientemente una serie de 1.461 madres gestantes y 1.198 padres que fueron expuestos a terapia anti-TNFα 3 meses antes de la concepción, o durante la misma, con la siguiente distribución por fármacos: n=37 etanercept, n=3 adalimumab, n=101 azatioprina, n=8 metotrexato, n=2 leflunomida, n=119 sulfasalazina, n=58 hidroxicloroquina, n=633 prednisolona y n=723 AINE. Ninguno de los niños nacidos de madres del grupo con exposición a adalimumab, etanercept, leflunomida y metotrexato (previa a la concepción) desarrollaron malformaciones.
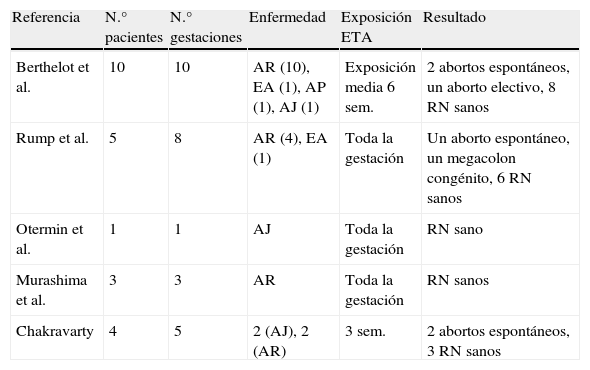
La Sociedad Británica de Reumatología publicó en 201138 los datos de 130 embarazos de gestantes diagnosticadas de artritis reumatoide (n=118) expuestas a fármacos antiTNFα antes o durante la gestación, evaluando y comparando los resultados mediante la clasificación de las pacientes en 4 grupos: grupo 1a (n=21) expuestas a antiTNFα y metotrexato y/o leflunomida en el momento de la concepción; grupo 1b (n=50) con exposición a antiTNFα en el momento de la concepción; grupo 2 (n=59) con exposición a antiTNFα previa a la concepción; grupo 3 (n=10) o grupo control, que no estuvieron expuestas a antiTNFα. La tasa de abortos espontáneos observada fue mayor en el grupo expuesto a antiTNFα en el momento de la concepción (33% con metotrexato y/o leflunomida, 24% sin metotrexato y/o leflunomida), en comparación con la tasa del 17% en el grupo con exposición previa a antiTNFα y el 10% en el grupo control. De las complicaciones observadas entre los 88 recién nacidos vivos hubo 19 partos prematuros (11 [26%] en el grupo 1 y 8 [17%] en el grupo 2). Cuatro fetos murieron intraútero (2 en el grupo 1b y 2 en el grupo 2). Un recién nacido falleció a las 27h posparto por hipoxia (etanercept durante el primer trimestre) y se registraron 4 malformaciones congénitas: 2 en el grupo 1b (luxación congénita de cadera y estenosis pilórica) y 2 en el grupo 2 (malformaciones mandibulares y bebé en magdalena de arándanos). Otras pequeñas series de casos registradas respecto al tratamiento con etanercept durante la gestación se detallan en la tabla 210,39–42.
Otras series de casos aislados que demuestran la experiencia del uso de etanercept durante la gestación
| Referencia | N.° pacientes | N.° gestaciones | Enfermedad | Exposición ETA | Resultado |
| Berthelot et al. | 10 | 10 | AR (10), EA (1), AP (1), AJ (1) | Exposición media 6 sem. | 2 abortos espontáneos, un aborto electivo, 8 RN sanos |
| Rump et al. | 5 | 8 | AR (4), EA (1) | Toda la gestación | Un aborto espontáneo, un megacolon congénito, 6 RN sanos |
| Otermin et al. | 1 | 1 | AJ | Toda la gestación | RN sano |
| Murashima et al. | 3 | 3 | AR | Toda la gestación | RN sanos |
| Chakravarty | 4 | 5 | 2 (AJ), 2 (AR) | 3 sem. | 2 abortos espontáneos, 3 RN sanos |
Al igual que ocurre en el caso de adalimumab, se han publicado estudios que sugieren un beneficio de la administración de etanercept en mujeres con historia previa de infertilidad. Jerzak et al.43 han publicado recientemente un estudio cuyo objetivo era evaluar el efecto de la terapia con etanercept en la actividad de las células NK periféricas, en 30 mujeres no gestantes con historia de abortos espontáneos o fracaso de la terapia de fecundación in vitro. Todas ellas recibieron 4 dosis de etanercept a dosis de 25mg 2 veces/semana antes de la concepción, evaluando la actividad periférica NK mediante citometría de flujo. Los autores de este estudio objetivaron un descenso en la actividad celular NK con el subsecuente éxito gestacional. Murashima et al.10 publicaron 3 casos de mujeres gestantes con artritis reumatoide con una larga historia de infertilidad, que lograron el embarazo pocos meses después de introducir la terapia con etanercept para el tratamiento de su enfermedad.
Aunque etanercept no es una inmunoglobulina, su estructura compartida con estas hace que su paso transplacentario durante el primer trimestre sea mínimo, pero no así durante el segundo y tercer trimestres del embarazo. Hay publicaciones que demuestran la existencia de esta transferencia placentaria cuantificada mediante la medición de niveles en suero materno, cordón umbilical y suero neonatal, objetivando una concentración de fármaco en el cordón umbilical significativamente menor que en el suero materno durante el segundo y tercer trimestres del embarazo y que disminuye progresivamente en el suero del neonato tras el parto, lo que indica que existe transferencia placentaria del fármaco, pero dando lugar a concentraciones notablemente menores que las existentes en el suero materno44.
UstekinumabUstekinumab es un anticuerpo monoclonal humano que se une con alta afinidad y especificidad a la subunidad p40 de las IL12 y 23, bloqueando su actividad. La experiencia en el uso de ustekinumab para el tratamiento de la psoriasis es escasa debido a su relativamente reciente comercialización, por lo que actualmente no se dispone de publicaciones al respecto en pacientes embarazadas. Martin et al.45 desarrollaron un estudio en monos Cynomolgus con el objetivo de evaluar los potenciales efectos del uso de ustekinumab durante la gestación y la lactancia. Los posibles efectos sobre el sistema inmunológico se evaluaron mediante el estudio del inmunofenotipo de linfocitos de sangre periférica y el estudio immunohistopatológico de los tejidos linfoides en fetos y recién nacidos, y por la respuesta de anticuerpos T-dependiente en los bebés. El tratamiento con ustekinumab no produjo toxicidad materna y tampoco a nivel fetal ni del recién nacido. Se detectó la presencia de ustekinumab en el suero de fetos en el día 100 de gestación y en el suero de niños en los 120 días posparto. En la leche materna se objetivaron niveles bajos del fármaco.
Lactancia y terapia biológicaLa seguridad en el uso de agentes antiTNF-α durante la lactancia no está clara. La estructura inmunoglobulínica de infliximab y adalimumab podría permitir, en teoría, la transferencia a través de la leche materna, pero al tratarse de moléculas proteicas de cadena larga, se podría inferir que se inactivarían por las enzimas digestivas presentes en el tracto gastrointestinal del recién nacido.
Kane et al.46 registraron 3 pacientes con enfermedad de Crohn que habían sido tratadas con infliximab durante el embarazo hasta la semana 30 y en los 14 primeros días posparto, detectando niveles de infliximab en el suero materno pero no en la leche materna ni en el suero fetal. Otros casos aislados registrados en los que se utilizaba infliximab durante la lactancia no evidenciaron toxicidad fetal, lo que hace pensar que el uso de este fármaco sería seguro durante este período.
Adalimumab, al igual que infliximab, podría transferirse a través de la leche materna; sin embargo, no disponemos de evidencia científica publicada ni de estudios en animales o humanos, por lo que no podrían establecerse recomendaciones.
En relación con etanercept hay escasos trabajos publicados que parecen avalar la relativa seguridad del uso de este fármaco durante la lactancia, evidenciando mínimas concentraciones del fármaco en la leche materna y una escasa o nula absorción por parte del neonato. Ostensen et al.47 describen el caso de una gestante de 30 años con artritis reumatoide tratada con etanercept 25mg 2 veces por semana durante toda la gestación, con reinicio del tratamiento 4 semanas después del parto debido a la reactivación de la enfermedad de base, objetivando una baja concentración de etanercept en la leche materna. Murashima et al.48 publicaron el caso de una gestante de 40 años con artritis reumatoide tratada con etanercept 25mg 2veces por semana discontinuando el tratamiento tras el parto; los niveles de etanercept en suero neonatal disminuyeron progresiva y rápidamente en las 12 semanas siguientes al parto hasta hacerse indetectables, a pesar de que podían detectarse concentraciones mínimas del fármaco en la leche materna, lo que indica la posibilidad de transferencia placentaria, pero no a través de la lactancia materna. Berthelsen et al.49 describen el caso de una paciente de 34 años diagnosticada de espondilitis anquilopoyética tratada con etanercept 25mg 2 veces por semana durante toda la gestación y período de lactancia, objetivando escasos niveles del fármaco en la leche materna con disminución rápidamente progresiva de los niveles en el suero del lactante, hasta ser indetectables, lo que apoya la teoría de la posibilidad de la ausencia de transferencia del fármaco a través de la leche materna.
La escasa experiencia publicada respecto al uso de terapia biológica durante la lactancia es sugestiva de una seguridad aceptable; sin embargo, existen datos que indican que pueden detectarse concentraciones bajas del fármaco en la leche materna y se desconoce el efecto a medio y largo plazo de la exposición de estos agentes sobre el sistema inmune, todavía inmaduro, del neonato.
ConclusiónEn resumen, la información publicada respecto al uso de terapia biológica durante la gestación es escasa y se basa en estudios retrospectivos y observacionales, ya que, por cuestiones éticas, no se pueden llevar a cabo ensayos clínicos sobre la seguridad de estos fármacos durante el embarazo. Aunque se han llevado a cabo estudios en animales, los resultados no siempre permiten predecir la respuesta en humanos, y no garantizan la seguridad del producto debido a diferencias interespecíficas que podrían deberse, entre otros factores, al diferente metabolismo del fármaco.
La mayoría de los datos publicados se han obtenido de series de pacientes diagnosticadas de artritis inflamatoria y enfermedad inflamatoria intestinal, y la experiencia de su uso en psoriasis, por el momento, es escasa. Dentro de estos estudios hay variables que hacen difícil la interpretación de los datos. Excepto en algunos estudios concretos, no ha habido intentos sistemáticos de correlacionar la enfermedad de base con la evolución del embarazo en pacientes expuestas a terapia biológica y, además, algunas pacientes tomaban de forma concomitante otros fármacos en el momento de la concepción.
Se han documentado escasos efectos adversos derivados del uso de terapia biológica durante la gestación, como son prematuridad, abortos involuntarios, bajo peso al nacer y preclampsia; sin embargo, las correspondientes tasas son similares a las de la población general de mujeres embarazadas no expuestas a esta terapia. Asimismo, se han registrado escasos casos de malformaciones fetales y anomalías congénitas, cuya incidencia parece ser similar a la de la población general y su asociación con la terapia biológica no está probada. Se ha de tener en cuenta que la mayoría de las mujeres con psoriasis y otras enfermedades inflamatorias mediadas inmunológicamente suspenden la terapia biológica en el momento de saber que están embarazadas, y los casos en que se ha mantenido la administración del fármaco durante toda la gestación no son numerosos.
Para establecer el riesgo asociado de la exposición a terapia biológica durante la concepción y embarazo se deberían registrar todos los casos de embarazo que tengan lugar en mujeres tratadas con antiTNF-α y ustekinumab, y se debería llevar un seguimiento a largo plazo para ayudar a relacionar las anomalías congénitas detectadas referentes a la terapia biológica.
Los datos recogidos en la literatura parecen ofrecer una seguridad aceptable respecto al uso de terapia biológica durante la gestación; sin embargo no existe una evidencia absoluta, por lo que la decisión de utilizar terapia biológica durante la gestación debería realizarse valorando adecuadamente cada caso y evaluando el equilibrio entre la importancia del mantenimiento de un adecuado control de la enfermedad y el riesgo potencial de daño fetal.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.