El prurito es el síntoma más frecuente asociado a enfermedades dermatológicas y sistémicas. Su diagnóstico es clínico, aunque en ocasiones será necesario realizar pruebas complementarias para identificar o confirmar el origen. La medicina traslacional ha permitido descubrir nuevos mediadores pruritógenos y nuevos receptores. Saber reconocer adecuadamente la principal vía por la que media el prurito en cada paciente será clave para el éxito terapéutico. La vía histaminérgica predomina en enfermedades como la urticaria o las reacciones a fármacos, mientras que la vía no histaminérgica predomina prácticamente en la mayoría de las otras dermatosis incluidas en esta revisión. La clasificación del prurito, las pruebas complementarias, la fisiopatología y los pruritógenos implicados, incluyendo citoquinas y otras moléculas, así como la sensibilización central al prurito que sufren estos pacientes formarán parte de este primer manuscrito sobre el prurito.
Pruritus is the most common symptom of dermatologic and systemic diseases. The diagnosis of pruritus is clinical, although additional tests may be necessary to identify or confirm the cause. Translational medicine has led to the discovery of new mediators of itch, or pruritogens, as well as new receptors. Knowing how to properly recognize the main pathway that mediates itch in each patient is the key to successful treatment. Although the histaminergic pathway predominates in conditions like urticaria or drug-induced pruritus, it is the nonhistaminergic pathway that predominates in nearly all other skin diseases covered in this review. Part 1 of this 2-part review discusses the classification of pruritus, additional testing, the pathophysiology of itch and the pruritogens implicated (including cytokines and other molecules), and central sensitization to itch.
Samuel Hafemreffer describió el prurito en el siglo XVII como actualmente reconocemos este síntoma. El prurito es una sensación somática desagradable e incómoda para el paciente1, donde existe un importante componente sensorial, emocional y motivacional que dirige y regula una conducta irresistible hacia el rascado. La medicina traslacional2 ha permitido descubrir el papel de nuevos protagonistas en su compleja fisiopatología. Una diafonía entre la piel, el sistema inmune y el sistema nervioso inician y mantienen el prurito a largo plazo. Como dijo el poeta Ogden Nash, «la felicidad es rascarse cada vez que sentimos picor», sin embargo, los pacientes que sufren prurito crónico asocian un importante impacto negativo en su calidad de vida.
EpidemiologíaStänder et al.3 publicaron que el 22-26% de la población general sufre prurito crónico. Leader et al.4 registraron un intervalo entre el 8-28% en la población general. Concretamente, el 78% de los pacientes mayores de 65 años presentan prurito5, el 87% de los pacientes atópicos6, el 84% de los pacientes con psoriasis7, el 35% de los hemodializados8, y el 45% de los pacientes VIH9. Hasta en un 44,5% de los pacientes no se conseguirá demostrar el origen del prurito (prurito de origen desconocido o POD)10.
Clasificación del pruritoEl prurito crónico es aquel cuya duración es mayor de 6 semanas. Los distintos tipos de prurito quedan reflejados en la tabla 1.
Distintos tipos de prurito
| Neurogénico: Inducido por mediadores pruritógenos e inflamatorios (peptidérgicos y no peptidérgicos), en ausencia de daño neuronal. Los linfocitos Th2 parecen jugar un papel relevante en el desarrollo y mantenimiento del prurito |
| Neuropático: Representa el 8% del total de casos de prurito crónico, donde el daño neuronal directo afecta tanto a la integración como a la transmisión de la pruritocepción periférica y central. Muchos de estos pacientes asocian dolor. Son causas la neuralgia postherpética, síndromes de atrapamiento (notalgia parestésica, prurito braquiorradial, meralgia parestésica), masas en el SNC, degeneración de fibras nerviosas (diabetes mellitus, alcohol, quimioterapia), enfermedad de Fabry, o la neuropatía de fibra pequeña. Suele asociar una disminución de la densidad de fibras nerviosas en la epidermis |
| Pruritoceptivo: Activación de fibras sensoriales aferentes por pruritógenos en la piel. Puede estar desencadenado por irritantes externos o enfermedades inflamatorias cutáneas |
| Psicógeno: Existe un origen psicosomático o psiquiátrico. Fobias, trastorno obsesivo-compulsivo, enfermedades psicóticas (CIE-10 F54 recoge el prurito psicógeno dentro de otros trastornos somatomorfos). El prurito psiquiátrico tiene una prevalencia del 32% de los pacientes, donde el cuero cabelludo es la zona más frecuente |
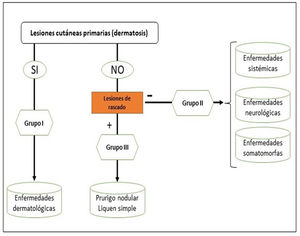
Podemos clasificar el prurito en función de si el origen es dermatológico, sistémico, neurológico, somatomorfo, de origen mixto, u otros (en este último incluiríamos el idiopático o POD). Sin embargo, la clasificación recomendada por el International Forum for the Study of Itch (IFSI)11 es en tres grupos:
- -
Grupo I o primario: prurito crónico sobre piel alterada o inflamada (primariamente).
- -
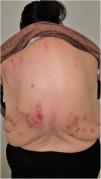
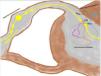
Grupo II o somatomorfo (antes llamado prurito sine materia): prurito crónico sobre piel inicialmente no afecta. También son identificadas como las dermatosis invisibles. Ej., dermatosis facticia. Un signo clásico durante la exploración es el signo de la mariposa (fig. 1)
- -
Grupo III o predominio de excoriaciones: prurito crónico con lesiones de rascado.
Se puede seguir el algoritmo de la figura 2 para identificar el grupo en el que se encuentra cada paciente.
En la tabla 2 se enumeran algunas de las enfermedades que asocian prurito con mayor frecuencia.
Enfermedades sistémicas que asocian prurito
| Metabólicas/endocrinas | Hiperparatiroidismo, déficit de hierro, diabetes mellitus, alcoholismo, hiper- e hipotiroidismo, síndrome carcinoide |
| Hepático/biliar | Colangitis biliar primaria, cirrosis biliar primaria, hepatitis infecciosas |
| Renal | Insuficiencia renal crónica |
| Autoinmunes | Dermatomiositis, esclerosis sistémica, síndrome de Sjögren |
| Infecciosas | VIH, infección por helmintos y parásitos, hepatitis virales (VHB, VHC), escabiosis, dermatofitosis, oncocercosis, varicela |
| Hematológicas | Policitemia vera, trombocitosis esencial, linfoma Hodgkin y no Hodgkin, anemia ferropénica, mastocitosis, mieloma múltiple |
| Neurológicas | Esclerosis múltiple, tumores cerebrales, notalgia parestésica, prurito braquiorradial, neuralgia postherpética, neuropatía de fibra pequeña |
| Psiquiátrica | Depresión, ansiedad, trastornos delirantes, anorexia nerviosa |
El prurito premonitorio es aquel que aparece meses e incluso años antes de una enfermedad sistémica o neoplásica. Existen trabajos que han publicado el riesgo de neoplasia hematológica12 o de vía biliar en pacientes previamente diagnosticados de POD.
Historia clínicaEn la tabla 3 se presentan los detalles importantes de la anamnesis en los pacientes con prurito, tanto las generalidades como la orientación específica según el origen del mismo.
Anamnesis del paciente con prurito
| Preguntas focalizadas en el prurito | 1. Fecha de inicio y duración2. Localización (aparición, propagación)3. Calidad del prurito (inflamatorio vs. neuropático)4. Intensidad o gravedad5. Curso: fluctuaciones diurnas, curso continuo/atáctico, mejoría espontánea/agravamiento6. Factores desencadenantes; factores de alivio7. Comportamiento de rascado8. Asociación temporal con enfermedades preexistentes, cirugías, ingesta de medicamentos, otros acontecimientos9. Tratamientos previos (con/sin éxito)10. Teoría del propio paciente sobre la causa11. Factores de carga psicosocial: deterioro de la calidad de vida relacionada con la salud, angustia mental, trastornos del sueño |
| Preguntas generales | 1. Enfermedades preexistentes (incluidas las dermatosis)2. Ingesta de medicamentos, transfusiones de sangre3. Intervenciones quirúrgicas previas4. Alergias: alergias de tipo I y de tipo IV5. Antecedentes de atópica6. Historial de viajes7. Embarazo |
| Preguntas dirigidas | 1. Familiares afectos y prurito nocturno --> escabiosis2. Prurito tras contacto con el agua --> prurito acuagénico, descartar policitemia vera3. Prurito durante el ejercicio --> prurito colinérgico4. Síntomas B --> linfomas, neoplasias5. Ictericia --> afectación de la vía biliar/hígado6. Empeoramiento en invierno --> eccema asteatósico, xerosis |
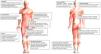
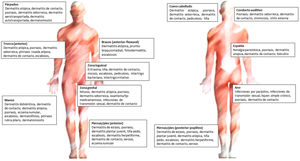
En la figura 3 se encuentran los principales diagnósticos según la localización.
Pruebas complementariasEl diagnóstico del prurito es clínico. Los pacientes clasificados como grupo II y III son candidatos a realizar un estudio complementario según la anamnesis y sospecha diagnóstica. Los pacientes con lesiones cutáneas pueden precisar de cultivos microbiológicos, biopsia cutánea (con o sin IFD), IFI, orina de 24h para porfirias, y estudio en fresco para micosis o escabiosis. La analítica general constará de creatinina, urea, tasa de filtración glomerular estimada, potasio, glucosa, ferritina, bilirrubina, transaminasas (GOT, GPT, GGT), fosfatasa alcalina, LDH, TSH, hemograma completo, análisis de orina (tira reactiva), velocidad de sedimentación globular (VSG) y proteína C reactiva (PCR). En pacientes embarazas además se deberá solicitar el estudio de ácidos biliares en sangre en ayunas si existe sospecha de colestasis.
Pruebas complementarias dirigidas13En la tabla 4 se describen las pruebas complementarias específicas en pacientes con prurito.
Pruebas complementarias dirigidas en pacientes con prurito
| Prurito anal | Estudio de parásitos, huevos de lombriz, tacto rectal, PSA |
| Prurito acuagénico y genital, prurito de origen desconocido | Prueba de intolerancia a la lactosa/sorbitol |
| Anomalías del hemograma/sospechas de enfermedades linfoproliferativas | Vitamina B12, ácido fólico, electroforesis de proteínas, inmunofijación, estado JAK2, biopsia de médula ósea (si es necesario) con (inmuno)citología e histología |
| En caso de deficiencia de hierro/irregularidades fecales | Prueba de guayacol en heces |
| En caso de sospecha de enfermedad hepatobiliar | Serología de la hepatitis (anti-HAV, HbsAg, anti-HBc, anti-HCV), ácidos biliares, anticuerpos antimitocondriales (AMA), anticuerpos citoplasmáticos antineutrófilos perinucleares (pANCA), anticuerpos antinucleares (ANA), anticuerpos antimúsculo liso (SMA), anticuerpos antiantígeno hepático soluble (SLA), anticuerpos microsómicos hígado-riñón (LKM), anticuerpos antitransglutaminasa tisular, alfa-fetoproteína (en caso de cirrosis hepática/masa hepática) |
| En caso de niveles patológicos de glucosa en ayunas | HbA1c, prueba de tolerancia a la glucosa |
| En caso de sospecha de trastornos endocrinos | Hormona paratiroidea, fosfato, calcio, T3, T4, 25-OH colecalciferol, anticuerpos antirreceptores de TSH (TRAH), anticuerpos contra el receptor de TSH (TRAb), anticuerpos contra la peroxidasa tiroidea (TPO-Ab) |
| En caso de sospecha de VIH | Serología VIH, serología sífilis (si es necesario) |
| En caso de sospecha de mastocitosis | Niveles de triptasa, metilimidazol ácido acético en orina de 24h |
| En caso de sospecha de tumores neuroendocrinos | Cromogranina A, ácido 5-hidroxiindolacético en orina de 24h |
| En caso de sospecha de alergia | IgE total, IgE específica (si es necesario), prick test, pruebas epicutáneas |
En cuanto a las pruebas de imagen, se solicitarán conforme a la sospecha clínica inicial. La radiografía de tórax se considera el estándar, pero una ecografía abdominal, TC, RMN, gastroscopia, biopsia ecoguiada de ganglios, etc., acompañarán a las pruebas de laboratorio a criterio del clínico. Lo cierto es que el manejo de los pacientes con prurito requiere de un trabajo multidisciplinar con otros especialistas.
Escalas para medir el pruritoEn la práctica clínica las más utilizadas son la escala de valoración numérica (NRS) o la escala visual analógica (EVA). Existe una escala validada en español, bajo licencia, la ItchQoL14, que es un cuestionario de 22 ítems que mide síntomas, funciones, emociones y autopercepción. Es una tarea compleja y con ciertas limitaciones comparar los resultados de mejoría del prurito en ensayos clínicos porque no está establecida una normalización de medición de gravedad del prurito, así como instrumentos de medida distintos, etc.
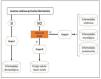
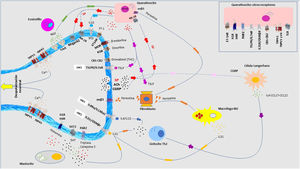
Fisiopatología del prurito: diafonía neuro-inmune-cutáneaEn los últimos años se ha investigado mucho sobre la relación estrecha que existe entre la piel, el sistema inmune y el sistema nervioso. La participación de cada uno de ellos juega un papel fundamental tanto en el desarrollo como en el mantenimiento del prurito a largo plazo. Aunque se expongan de manera independiente cada uno de estos sistemas, la realidad es que existe una convivencia continua entre ellos, de modo que se entienden como un conjunto y no de forma aislada. En la figura 4 se exponen de forma esquemática y parcialmente resumida los principales mediadores y receptores pruritógenos.
En las terminaciones nerviosas de las fibras C en la piel se expresan multitud de receptores. La despolarización es iniciada por la entrada de iones calcio a través de TRPA1 y TRPV1, que son activados por la unión del receptor a su molécula afín. Los distintos pruritógenos son liberados por el queratinocito, mastocito, linfocito Th2, macrófago o fibroblasto. Se forman bucles de retroalimentación positiva entre distintos pruritógenos, como la periostina y TSLP. La liberación por las terminaciones nerviosas de sustancia P (SP), y el péptido relacionado con el gen de la calcitonina (CGRP) actúa sobre el queratinocito y la célula de Langerhans, respectivamente, potenciando el ambiente neuroinflamatorio. 5HT: serotinoina; ACh: acetilcolina; CB1-CB2: receptor cannabinoide; ET-1: endotelina-1; ET-1R: receptor ET-1; H1R-H4R: receptor histamina; KOR: receptor opioide kappa; MOR: receptor opioide mu; NGF: Factor de crecimiento neurona; NK-1R: receptor neurokinina-1; ST2: receptor-like IL-1; TrkA: Receptor kinasa A tropomiosina.
Los nervios aferentes sensitivos, heterogéneos y polimodales, pueden clasificarse en fibras Aδ (de 2-5μm de diámetro, mielinizadas, y velocidad de conducción 8-15m/s), y las fibras C (de 0,2-1,5μm de diámetro, amielinizadas, y velocidad de conducción a 1-2m/s). Las terminaciones nerviosas forman parte del microambiente cutáneo junto con el microbioma, queratinocitos, y células del sistema inmune, interaccionando con ellos mediante la recepción tanto de mediadores peptidérgicos (sustancia P [SP] y el péptido relacionado con el gen de la calcitonina [PRGC]) como no peptidérgicos (artemina, neurotrofina). Las fibras de tipo C pruritoceptivas comprenden menos del 10% del total de la población neuronal sensitiva cutánea15. Se han descrito cuatro clases de neuronas no peptidérgicas16: NP1 (neuronas que expresan el receptor del prurito asociado a MrgprD), NP2 (expresan el receptor 1 de la histamina, MrgprA3 y MrgprC11) y NP3 (expresan receptor 1 de la histamina, polipéptido natriurético b, receptor para la IL31 y de la oncostatina M, así como JAK1), y NP4.
Las fibras C amielínicas son mecanorreceptores de bajo umbral estimuladas por dolor, estímulos térmicos y por pruritógenos. Expresan receptores para proteasas, citoquinas, y canales iónicos dependientes de voltaje (TRPA1 y TRPV1). Estas fibras C y Aδ (neuronas de primer orden) se proyectan directamente hacia la médula espinal (ME) pasando por el ganglio de la raíz dorsal, haciendo sinapsis con las interneuronas y neuronas de segundo orden en el asta posterior de la sustancia gris intramedular (principalmente lámina I y II).
Mediadores pruritógenosHistamina17Principal mediador histaminérgico de las fibras C amielínicas. Secretada por mastocitos, basófilos, neuronas y queratinocitos. Tanto TRPV1 como TRPA1 están implicados en la señalización central por histamina tras la activación de su receptor.
Sustancia P (SP)18Neuropéptido de la familia de las taquicininas implicado en el prurito no histaminérgico. Producida y secretada por las fibras nerviosas induce la degranulación de mastocitos y la secreción de factor de crecimiento neuronal (NGF) por los queratinocitos. Sus receptores, neurokinina-1 (NK-1R) y Mrgpr, están expresados en las fibras C, queratinocitos, células endoteliales y del sistema inmune. Los pacientes con prurito crónico muestran una sobreexpresión de SP.
Serotonina19Neurotransmisor liberado por mastocitos, plaquetas, y células endoteliales, capaz de activar fibras C y Aβ. Relacionado con prurito urémico y colestásico.
Endotelina-120Potente vasoconstrictor peptidérgico secretado por queratinocitos que participa en la mediación del prurito a través de su receptor A. Su secreción está inducida por la activación de PAR2, entre otros.
Neuropéptido Y (NPY)21Las interneuronas inhibidoras intramedulares expresan receptores para esta molécula, que sinaptan con las fibras aferentes excitadas por la secreción de péptido natriurético b.
Polipéptido natriurético b (ppnb)22Secretado por el SNC, estimula la liberación de pruritógenos por el queratinocito y células dendríticas. Activa TRPV1, MrgprA3 y MrgprC11 en las fibras aferentes periféricas. Su señalización central pasa por la desinhibición de las interneuronas excitatorias GRPR+. Se ha propuesto como una molécula clave en el desarrollo del prurito en pacientes con DA.
Periostina23Proteína secretada por fibroblastos que induce el prurito dependiente de la unión a integrina αvβ3 directamente sobre las terminaciones nerviosas pruriceptivas, así como la activación de TRPA1 y TRPV1. Su actividad está retroalimentada por TSLP y el ppnb. Potencia la respuesta inflamatoria mediada por linfocitos Th2. Participa en el proceso de fibrosis de queloides y esclerosis sistémica.
Canales iónicos TRP (TRPV1-TRPA1-TRPV4-TRPM8)24Los receptores del grupo vanilloides están expresados en neuronas peptidérgicas que responden a bradiquinina, prostaglandinas, o retinoides. TRPV1 (familia de la ankyrina) es activado por la mostaza, ajo y tetrahidrocannabinol (THC). La despolarización neuronal mediada por TRPV1 induce la liberación de mediadores peptidérgicos (SP y GRPR). TRPV4, expresado en queratinocitos, neuronas y macrófagos, participa como mediador de estímulos térmicos, químicos, osmóticos y mecánicos, así como el prurito inducido por serotonina. TRPM8 es un sensor de frío activado por el mentol.
ReceptoresReceptor de la neurokinina-1 (NK-1R)25,26Pertenece a la familia de los receptores acoplados a proteína G. La isoforma completa muestra una afinidad elevada por la SP. Está expresado en fibras nerviosas, queratinocitos, mastocitos y fibroblastos. Este receptor está expresado en el sistema nervioso periférico y central. Entre el 89-94% de las neuronas de la vía ascendente del tracto espinotalámico y espinoparabraquial lo expresan. En el cerebro está expresado en el tálamo, corteza cingulada, ganglio basal y cerebelo. Se ha demostrado la sobreexpresión de NK-1R en la epidermis de piel con prurito. Los antagonistas de este receptor pueden ser de utilidad en el tratamiento del prurito27.
Receptores acoplados a proteína GReceptores 7-transmembrana expresados tanto en fibras nerviosas como mastocitos. Median el prurito no histaminérgico a nivel periférico28. Existe una interacción neuroinmune interesante entre los mastocitos y las fibras nerviosas por su proximidad observada en biopsias de urticaria o reacciones a fármacos. En 2001 se descubrieron las Mas-related G protein-coupled receptor (Mrgpr), implicados en el prurito agudo y crónico. La SP se une al MrgprX2 expresado en mastocitos, induciendo la degranulación IgE independiente. En el prurito colestásico los ácidos biliares son afines al MrgprX429. MrgprX2 está en el foco de investigación en dermatosis inflamatorias que cursan con prurito30.
Receptores opioidesForman parte del grupo de los receptores acoplados a la proteína G. Las endorfinas endógenas son afines a los receptores opioides μ (MOR) expresados en las fibras C y Aβ. Estas sinaptan con las interneuronas excitadoras GRPR+ en el asta posterior, cuya señalización es pruritógena. Los receptores opioides ¿ (KOR) se unen a dinorfina cuya actividad es antipruritógena31. Existe un equilibrio entre la activación de MOR y KOR de forma fisiológica, controlado principalmente por la secreción de dinorfina. A nivel de la ME existe una subpoblación de interneuronas inhibitorias dinorfina+. La pérdida de función de estas interneuronas está implicada en la sensibilización central del prurito y la alloknesis. Butorfanol (agonista KOR/antagonista MOR) disminuye la actividad cerebral relacionada con el picor32. Se ha demostrado una reducción de los niveles de IL31 en los pacientes tratados con derivados opioides33.
Receptores de histamina (HR)34Receptores acoplados a proteína G que activan de forma indirecta el TRPV1 a través de lipooxigenasas. El HR-4 está presente en los queratinocitos y en las fibras C. Aunque la mayoría de los antihistamínicos actúan como antagonistas selectivos del H1R, también se ha demostrado que la cetirizina y rupatadina inhiben la acción de PAF35, cetirizina disminuye la secreción de IL436, fexofenadina inhibe la liberación de triptasa37, o la ebastina inhibe la vía inflamatoria mediada por linfocitos Th238.
Receptores activados por proteasas (PAR)39Expresados en neuronas, células inmunes, astrocitos y queratinocitos. Su activación favorece la transcripción de citoquinas, quimiocinas y factores de crecimiento.
Receptor A de la endotelina-120Mediador pruritógeno no histaminérgico cuya señalización es a través de la enzima convertidora de la endotelina neural 1 y la vía Erk1/2. Esta vía está sobreexpresada en prurigo nodular.
OtrosLos toll like receptor (TLR)40, el receptor 5 del ácido lipofosfatídico41 o el receptor 2 cisteinil leucotrieno 4 (LTC4)42 también se han relacionado con la mediación del prurito.
CitoquinasIL31/OSMt43La IL31 fue descubierta en 2004, producida y liberada por linfocitos T CD4+, mastocitos, macrófagos, basófilos, eosinófilos, queratinocitos y células dendríticas. Su receptor heterodímero (receptor IL31 [IL31R]/receptor β de la oncostatina M [OSMRβ]) está expresado en piel, y cerebro, entre otros órganos. La IL31 está coexpresada con TRPV1 y TRPA1, involucrado directamente en el prurito. Los linfocitos Th2 la liberan bajo distintos estímulos y también por mastocitos a través de la activación de Mrgpr. La secreción patológica de IL31 produce alteración de la barrera cutánea tanto por influencia en la diferenciación y expresión de filagrina como por la proliferación y diferenciación del queratinocito (acantosis, paraqueratosis e hiperplasia epidérmica)44. La señalización intracelular de la IL31 es por vía JAK1/STAT3, Ras-Erk1/2 y PI3K/AKT. Otro papel neuroinmune de la IL31 es la estimulación neuropoyética promoviendo el aumento de las fibras nerviosas cutáneas45. Se han detectado niveles elevados en DA46 y en prurigo nodular47, con cierta correlación con la gravedad de la enfermedad.
IL4/IL13Citoquinas paradigmáticas de la vía inflamatoria de tipo 2. Producidas y liberadas principalmente por linfocitos Th2, basófilos, y mastocitos. Ambas actúan directamente sobre las terminaciones nerviosas que expresan receptores para ellas48. El receptor heterodímero IL4Rα/IL13Rα1 cuando es activado induce la primera fosforilación de la JAK para iniciar la señalización intracelular (en este caso la activación de los canales iónicos dependientes de voltaje para la despolarización neuronal). La IL4 es capaz de potenciar la respuesta neuronal a otros pruritógenos como cloroquina, la histamina, la IL3149 y la TSLP.
Alarminas (IL33, thymic stromal lymphopoietin [TSLP])Secretadas por el queratinocito inducen la polarización inmunitaria de tipo 2 a través de la señalización OX40L/OX4050. El receptor de la TSLP está expresado en neuronas sensoriales51, mientras que el receptor de la IL33, ST2, es un heterodímero compartido con la IL152, que señaliza a través de TRPV1 y TRPA1. En humanos el bloqueo de estas citoquinas con etokimab (anti-IL33) o tezepelumab (anti-TSLP) no han ofrecido resultados significativos en DA.
Janus kinasa (JAK)53,54Las JAK son proteínas de la familia de las enzimas asociadas a receptores de citoquinas. Actualmente hay descritos 4 subtipos: JAK1-2-3 y TYK2. Mediante molécula de ATP se autofosforilan para activar la vía STAT3/STAT6. IL31, IL4, e IL13 señalizan a través de JAK1, interviniendo en el desarrollo del prurito neuroinflamatorio. Los inhibidores JAK1 han demostrado un control rápido y eficaz del prurito en DA. El desarrollo de inhibidores JAK tópicos como delgocitinib y ruxolitinib abren una ventana de oportunidad interesante para el control local del prurito.
CélulasQueratinocito55Considerados la primera línea del sistema nervioso por su elevada bioactividad y la capacidad de secretar pruritógenos. Expresan receptores PAR2, TRL3, HR1-HR4, receptor de la endotelina A y B, 5-HTR, OSMRβ, integrina αvβ3, TSLPR, receptores para NPY, incluidos TRPV3 y V4. La disrupción de la barrera epidérmica por distintas noxas puede empeorar por la secreción de pruritógenos, que aumentan el gradiente inflamatorio y la pérdida transepidérmica de agua.
Células de Merkel56Participa en la inducción del ciclo de picor-rascado por estímulos mecánicos a través del receptor Piezo2. La alteración funcional del complejo formado por estas células y las terminaciones pruritoceptivas (fibras C) MrgprA3+ en los casos de piel seca y en el prurigo nodular. Expresa TRPM8.
Mastocitos57Célula cargada de pruritógenos, capaces de activar la vía histaminérgica y no histaminérgica. Localizados próximamente a las fibras nerviosas participan en la potenciación del prurito neuroinflamatorio.
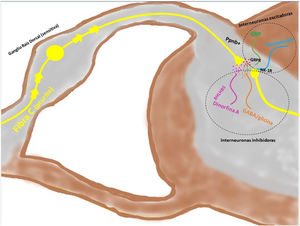
Transmisión del mensaje a través de la médula espinal (vía ascendente)Los axones provenientes de la periferia son proyectados directamente hacia el asta posterior de la ME (región exterior de la lámina I y II para las vías peptidérgicas, y la región interior de la lámina II para las no peptidérgicas), previo paso por el ganglio de la raíz dorsal. El 2-5% del total de la población neuronal intramedular participa en la transducción del prurito, donde NK-1R es el principal receptor. La presencia de interneuronas excitadoras (SP+ y GRPR+) e inhibidoras (GABA+) juegan un papel clave en la modulación de la señalización ascendente del prurito. Estas interneuronas expresan VGLUT2 (transportador vesicular de glutamato), neurotensina y somatostatina. La presencia de interneuronas BHLH+ (basic helix loop helix) son muy importantes dado que regulan la neurogénesis y definen la identidad neuronal dentro de la ME. Las interneuronas BHLHB5+ son de tipo inhibitorio58, que pueden ser activadas por el mentol, la capsaicina, o la dinorfina. Expresan receptores para somatostatina y NPY. Otra población de interneuronas inhibitorias son las GABAérgicas, localizadas en la lámina I y III, que además coexpresan receptores para la glicina59, otro neurotransmisor inhibidor. Cuando existe una clara polarización excitatoria de interneuronas excitatorias GRPR+ se induce el reclutamiento de interneuronas encefalinérgicas que intentan mitigar dicho estímulo intenso de prurito. Otra subpoblación de interneuronas excitadoras expresa SOM+, que intensifican la señalización del prurito a las neuronas de segunda orden. La activación de BHLHB5+ con dinorfina disminuye la sensación de prurito. La señalización a través de las fibras pruriceptivas que alcanzan el asta posterior inducen la secreción de ppnb que activa las interneuronas excitadoras péptido secretor de gastrina. En la figura 5 se muestra de forma esquemática lo explicado anteriormente.
Las fibras C despolarizadas que transmiten la señal pruritoceptiva liberan ppnb cuando alcanzan la lámina I y II del asta posterior de la médula espinal, estimulando las interneuronas excitadoras que expresan GRP. Otra de las interneuronas excitadoras expresa el receptor NK-1 para la sustancia P. Existen interneuronas inhibidoras, BhblB5 son una de ellas, importantes dado que liberan dinorfina A, y también GABA, y glicina, impidiendo la señalización central del prurito. La pérdida de esa función inhibitoria es una de las causas de la sensibilización central del prurito. BHLHB5: B helix-loop-helix protein; GRP: péptido liberador de gastrina; GRPR: receptor de GRP; NK-1R: receptor neurokinina 1; ppnb: polipéptido natriurético b.
Las interneuronas están implicadas en la «teoría de control de puertas», cuyo objetivo es controlar la señalización nociceptiva y no nociceptiva a nivel central. La pérdida de control podría ser responsable de la sensibilización central del prurito60, presente en pacientes con prurito crónico. La activación de interneuronas inhibitorias es crucial para evitar que la señalización pase a las neuronas de segundo orden proyectadas al SNC, donde se procesará el prurito y dará lugar al componente motor (rascado), pero también emotivo (placer tras el rascado), necesarios para mantener el ciclo de prurito-rascado61.
Procesamiento del prurito en el cerebro (SNC)Gracias a la neurobiología hoy en día se conocen las áreas del cerebro implicadas en el circuito del prurito. La primera estación que recibe las fibras del tracto espinotalámico y trigeminotalámico es el tálamo (principalmente el núcleo ventrobasal), y el núcleo parabraquial62. A su vez, el tálamo contiene neuronas que pueden ser activadas por pruritógenos tanto histaminérgicos como no histaminérgicos. Más del 70% de la población neuronal de la zona posteromedial del área ventrobasal del tálamo responde a más de un tipo de pruritógeno. En la corteza somatosensorial se reconoce la intensidad y localización del prurito, emitiendo la señal motora de rascado. La corteza prefrontal y la amígdala median el componente emocional y placentero que implica el rascado63. La amígdala64 es activada por estímulos pruritógenos y desactivada por el rascado, participando activamente en el procesamiento sensorial y afectivo del prurito. En la sustancia gris periaqueductal y en el área del tegmento ventral se han detectado unas neuronas GABAérgicas que participan en la percepción desagradable y aversiva del prurito, que es activada con el prurito activo del paciente, posiblemente jugando un papel relevante en la adicción del paciente por rascarse. Existe un verdadero componente motivacional del prurito, y es la necesidad urgente de rascado. La corteza cingular anterior, corteza motora y premotora participan en este proceso, de hecho, sus neuronas se desactivan cuando el paciente se rasca activamente.
Vía descendente del prurito: acción motora de rascadoLos principales neurotransmisores son la noradrenalina (NA) y la serotonina (5-HT)65. La principal población de neuronas NA+ están localizadas en el locus coeruleus, así como sus receptores α1 adrenérgicos presentes en las interneuronas inhibidoras de la ME66. El receptor 5-HT1A expresado en las interneuronas GRPR+ también participa directamente en la señalización descendente del prurito. La sustancia gris periaqueductal (PAG) recibe señales tanto de la amígdala como del núcleo parabraquial, participando de forma activa en el procesamiento del prurito. Se descubrieron una subpoblación de neuronas glutaminérgicas que expresaban taquikinina-1 (TAC1+) que facilitaban el ciclo de picor-rascado67. La ablación de estas neuronas disminuye el rascado inducido por el prurito, y la activación genera la acción de rascado. La corteza cingular anterior forma un circuito con el núcleo talámico anterolateral y el estriatum dorsomedial modulando el prurito de origen histaminérgico a través de un circuito espinal dependiente de interneuronas BHLHB568.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.