El pioderma gangrenoso es una enfermedad perteneciente al grupo de las dermatosis neutrofílicas. Además de una clínica cutánea característica puede presentar manifestaciones viscerales. Presentamos el caso de una mujer de 34 años con un brote de pioderma gangrenoso exacerbado por yodo, con afectación pulmonar, y revisamos otros casos de pioderma gangrenoso con afectación pulmonar publicados hasta la fecha. Discutimos la posible implicación del yodo como factor de exacerbación del pioderma gangrenoso. Destacamos la afectación pulmonar como manifestación extracutánea más frecuente de esta entidad, y recordamos la granulomatosis de Wegener como principal diagnóstico diferencial del pioderma gangrenoso con afectación pulmonar. Es importante considerar la posible presentación de manifestaciones extracutáneas en el pioderma gangrenoso, entre las que destaca la afectación pulmonar, para evitar técnicas diagnósticas agresivas, al menos inicialmente.
Pyoderma gangrenosum is a neutrophilic dermatosis that, in addition to its characteristic skin manifestations, can cause visceral alterations. Our patient was a 34-year-old woman with pyoderma gangrenosum that was exacerbated by iodine and that also affected the lungs. Other published cases of lung involvement in pyoderma gangrenosum are reviewed and we discuss the possible exacerbation of this disease by iodine. Lung involvement is the most common extracutaneous manifestation of pyoderma gangrenosum and the main differential diagnosis is then with Wegener granulomatosis. It is important to remember the possible presentation of extracutaneous manifestations of pyoderma gangrenosum, including particularly lung involvement, in order to avoid subjecting a patient to aggressive diagnostic tests, at least in the initial stages.
El pioderma gangrenoso se describió inicialmente por Brunsting et al. en 19301–4. Se trata de una enfermedad inflamatoria, no infecciosa, infrecuente y de etiología desconocida, perteneciente al grupo de las dermatosis neutrofílicas1,5. Puede presentar manifestaciones extracutáneas entre las que destaca la afectación pulmonar6–9. Existen factores externos que pueden exacerbar su sintomatología10. Se presenta el caso de una paciente con pioderma gangrenoso y afectación pulmonar y se revisan los casos publicados en la literatura.
Caso clínicoMujer de 34 años diagnosticada de pioderma gangrenoso desde hace 9 años. Durante ese primer brote de pioderma gangrenoso presentó una lesión cavitada pulmonar, que planteó los principales diagnósticos diferenciales de tuberculosis o de afectación pulmonar por el pioderma gangrenoso. La prueba de tuberculina fue positiva y los cultivos de esputo fueron negativos. La biopsia pulmonar abierta de la lesión mostró ganulomas epitelioides necrotizantes. La tinción de Ziehl y la prueba de reacción en cadena de la polimerasa (PCR) para Mycobacterium tuberculosis fueron negativas. A pesar de que los resultados de las pruebas realizadas no eran compatibles con tuberculosis, se decidió igualmente tratamiento tuberculostático durante 6 meses, teniendo en cuenta los posibles falsos negativos y la necesidad de un tratamiento corticoideo prolongado en esta paciente. Hace 5 años presentó un nuevo brote que requirió corticoterapia oral. Posteriormente y hasta la actualidad los brotes fueron de menor intensidad, resolviéndose con tratamiento corticoideo tópico. También durante este tiempo las pruebas radiológicas pulmonares de control han mostrado normalidad.
Destacaban también entre sus antecedentes una anemia ferropénica de larga evolución y una dudosa alergia a contrastes yodados.
El motivo de consulta actual fue un brote de lesiones dolorosas en los miembros inferiores, ulceradas y con facilidad para el sangrado, de un mes de evolución. En otro centro se había pautado azitromicina (500mg/día), yoduro potásico (solución sobresaturada 8ml/8 horas) y curas con fomentos de permanganato potásico. Tras 24 horas de iniciar este último tratamiento aparecieron múltiples lesiones en el tronco y los miembros, así como reactivación de otras ya presentes.
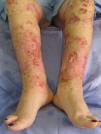
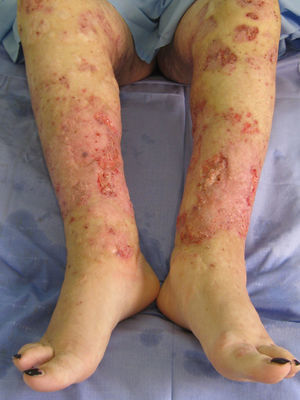
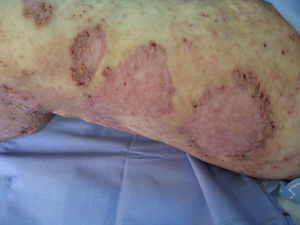
En la exploración física se objetivaba fiebre de 39°C, marcada afectación del estado general, palidez mucocutánea y papulopústulas diseminadas que evolucionaban a costras hemorrágicas. En los miembros inferiores y las nalgas se observaban lesiones papulopustulosas confluentes en úlceras de borde irregular, eritematovioláceo y socavado, algunas de ellas con fibrina en el fondo (fig. 1). Sobre lesiones ya cicatrizadas de brotes previos de pioderma gangrenoso aparecieron papulopústulas periféricas a modo de reactivación (fig. 2).
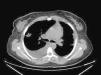
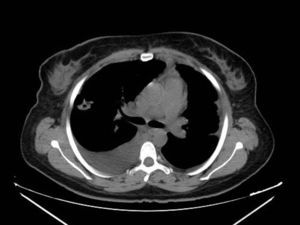
Se hicieron determinaciones analíticas en las que destacó una severa anemia microcítica e hipocrómica que requirió la administración de concentrados de hematíes. En los hemocultivos se aisló Staphylococcus aureus meticilín-sensible. Los anticuerpos antinucleares (ANA) y anticuerpos anticitoplasma del neutrófilo de patrón perinuclear (pANCA) fueron positivos a títulos bajos (no significativos), siendo los ANCA con patrón citoplasmático (cANCA) negativos. La radiografía de tórax mostraba dos opacidades pulmonares cavitadas en los campos derechos, compatibles entre otras posibilidades con émbolos sépticos. Debido a estos hallazgos radiográficos fue necesario descartar una endocarditis mediante ecocardiograma, que fue normal. En una tomografía axial computarizada (TAC) torácica se observaron las mismas lesiones cavitadas pulmonares (fig. 3).
Dado que la paciente estaba diagnosticada de pioderma gangrenoso y las lesiones eran similares a las que padecía habitualmente en los brotes, la posibilidad de patergia y el mal estado general, se decidió no realizar una biopsia cutánea.
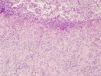
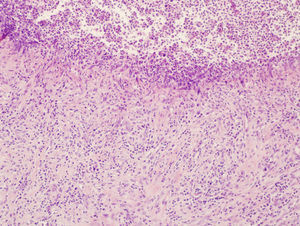
Revisamos la anatomía patológica de la biopsia pulmonar realizada hacía 9 años (fig. 4). La presencia de granulomas epiteliodes necrotizantes con abundantes neutrófilos, y la negatividad para bacilos ácido alcohol resistentes (BAAR) y PCR de Mycobacterium tuberculosis, concordaría con afectación pulmonar por el pioderma gangrenoso.
La paciente se diagnosticó de pioderma gangrenoso con probable exacerbación por yodo y afectación pulmonar asociada. Además de curas tópicas de las úlceras con ácido fusídico y apósitos de poliamida y silicona, se inició prednisona (1mg/kg/día) y antibioterapia intravenosa con imipenem (1g/6 horas) y vancomicina (1g/24 horas y posterior ajuste según los niveles sanguíneos del fármaco). El cuadro cutáneo evolucionó favorablemente dejando cicatrices cribiformes. En una radiografía de tórax realizada a los 4 meses se evidenció resolución completa de las lesiones pulmonares.
DiscusiónEl caso presentado nos plantea dos problemas principales: la posible implicación del yodo como factor de exacerbación de un brote de pioderma gangrenoso y la afectación pulmonar por el pioderma gangrenoso.
El yododerma puede producirse por la administración oral, parenteral y, menos frecuentemente, tópica de yodo. Se caracteriza por papulopústulas en áreas ricas en glándulas sebáceas. No presenta datos patognomónicos. Su histología tampoco es diagnóstica. La resolución es autolimitada en 2-6 semanas tras suspender el yodo, dejando hiperpigmentación postinflamatoria. Su tratamiento consiste en evitar el yodo en la dieta, medicaciones y medios de contraste radiográfico11–13.
Se conocen enfermedades cutáneas que pueden agravarse por el yodo, entre las que se encuentra el pioderma gangrenoso10.
En el caso que presentamos la paciente no ha hecho una dieta restrictiva de yodo desde esa primera reacción al contraste, ni la está realizando en la actualidad. Desde este último cuadro descrito no ha presentado nuevas lesiones. Estas observaciones orientan más a que la clínica cutánea se deba a un brote de pioderma gangrenoso exacerbado por yodo que a un yododerma.
El pioderma gangrenoso puede tener afectación visceral, siendo la más frecuente la afectación pulmonar. Los hallazgos más frecuentes son nódulos uni o bilaterales con o sin necrosis. También puede manifestarse como derrame pleural, abscesos, opacidad pulmonar unilateral o pneumonitis intersticial6–9. Histológicamente se observan granulomas inflamatorios necróticos inespecíficos con infiltrado neutrofílico, datos observados en la biopsia pulmonar de la paciente2,8. Las lesiones pulmonares pueden aparecer simultáneamente con la clínica cutánea, como en nuestro caso, o bien hacerlo más tarde2,9,14. Se ha descrito una mayor frecuencia de neoplasias hematológicas en casos de pioderma gangrenoso con afectación pulmonar15.
Hemos realizado una revisión de los casos de pioderma gangrenoso con afectación pulmonar publicados en la literatura (tabla 1). Para realizar la búsqueda se utilizó la base de datos Pubmed. Al introducir los datos (“Pyoderma Gangrenosum”[Mesh] OR “pyoderma gangrenosum”[ti] OR “pyoderma gangrenosum”[tw] OR “pyoderma”[tw] OR “Neutrophilic dermatoses” [ti] OR “Neutrophilic dermatoses” [tw]) AND (“Lung”[Mesh] OR lung[tw] OR lung[ti] OR pulmonary[tw] OR pulmonary[ti] OR cavitation[tw] OR cavitary[tw] OR tracheal[tw] OR tracheobronquial[tw] OR tracheitis[tw]) se obtuvieron 91 referencias. Se realizó también una búsqueda similar en la base de datos Embase y se completó con búsquedas libres en Pubmed, Elsevier y Dermabase. Se eliminaron las referencias que no trataban el tema objeto de estudio, así como los artículos publicados en lengua no inglesa ni española que carecían de abstract. Finalmente, en 29 artículos se comunicaron un total de 32 casos de pioderma gangrenoso con afectación pulmonar. Aunque el sesgo de publicación puede afectar a los resultados, la manifestación pulmonar más frecuente fueron las lesiones nodulares con o sin cavitación, presentes en 11 pacientes. Trece casos presentaron alguna neoplasia hematológica, siendo más frecuentes el síndrome mielodisplásico y la gammapatía monoclonal. En 16 casos se realizaron procedimientos diagnósticos invasivos de las lesiones pulmonares.
Casos publicados de pioderma gangrenoso con afectación pulmonar
| Autores | Sexo | Edad (años) | Biopsia pulmón* | Afectación pulmonar | Afectación hematológica | Referencia bibliográfica |
| Kanoh S et al | V | 54 | Sí | Infiltrados. Vidrio de reloj. Consolidación | Síndrome mielodisplásico | Mayo Clin Proc. 2009;84:555-557 |
| Rajan N et al | M | 0,33 | No | Opacidades en forma de cuña | No | Pediatr Dermatol. 2009;26:65-69 |
| Kitagawa KH et al | M | 82 | Sí | Masa | No | J Am Acad Dermatol. 2008;59:S114-116 |
| Liu ZH et al | V | 65 | No | Nódulos con y sin cavitación | Mieloma IgA | Eur J Dermatol. 2008;18:583-585 |
| Field S et al | M | 52 | Sí | Consolidación. Nódulos cavitados | No | Clin Exp Dermatol. 2008;33:418-421 |
| Mirkamali A et al | - | - | - | Absceso pulmonar estéril | Gammapatía monoclonal IgA | Med Mal Infect. 2007;37:835-839 |
| Chahine B et al | M | 33 | Sí | Nódulos con y sin cavitación | Disglobulinemia monoclonal | Presse Med. 2007;36:1395-1398 |
| Chahine B et al | V | 29 | Sí | Enfisema. Lesiones quísticas. Micronódulos | Leucemia aguda monocítica | Presse Med. 2007;36:1395-1398 |
| Bhat M et al. | M | 37 | Sí | Infiltrados pulmonares | No | CMAJ. 2007;177:715-718 |
| Takeuchi K et al | M | 5 | No | Opacidades difusas bilaterales | No | Eur J Pediatr. 2003;162:344-345 |
| Kanno T et al | V | 76 | - | Absceso pulmonar estéril | - | Hinyokika Kiyo. 2002;48:565-568 |
| Mlika RB et al | V | 67 | - | - | Leucemia linfocítica | Int J Dermatol. 2002;41:65-68 |
| Mlika RB et al | V | 45 | - | - | No | Int J Dermatol. 2002;41:65-68 |
| Krüger S et al | M | 45 | Sí | Nódulos pulmonares con necrosis central | No | Chest. 2001;119:977-978 |
| Riahi I et al | - | - | - | - | - | Ann Med Interne (Paris). 2001;152:3-9. |
| Brown TS et al | V | 17 | Sí | Absceso. Consolidación con cavitación central | No | J Am Acad Dermatol. 2000;43:108-112 |
| Vadillo M et al | V | 73 | No | Derrame pleural | Síndrome mielodisplásico | Br J Dermatol. 1999;141:541-543 |
| Wang JL et al | M | 24 | Sí | Opacidad. Derrame pleural | No | Thorax. 1999;54:953-955 |
| Fukuhara K et al | M | 75 | No | Infiltrado. Derrame pleural. Masa cavitada. Abscesos pulmonares | No | Br J Dermatol. 1998;139:556-558 |
| Grattan CE et al | M | 28 | No | Lesiones quísticas | No | Br J Dermatol. 1998;139:352-353 |
| Peters FP et al | M | 48 | No | Infiltrados pulmonares. Derrame pleural | Síndrome mielodisplásico | Ann Hematol. 1998;77:135-138 |
| Kasuga I et al | V | 50 | Sí | Mútiples nódulos. Derrame pleural | No | Respir Med. 1997;91:493-495 |
| Merke DP et al | V | 0,75 | Sí | Traqueítis necrotizante | No | J Am Acad Dermatol. 1996;34:681-682 |
| Cartier H et al | M | 54 | - | Nódulo cavitado | Gammapatía monoclonal IgA | Ann Dermatol Venereol. 1995;122:97-101 |
| Lebbé C et al | M | 58 | Sí | Opacidad. Nódulos cavitados | No | J Am Acad Dermatol. 1992;27:623-625 |
| Vignon-Pennamen MD et al | V | 38 | No | Consolidación | No | Dermatologica. 1991;183:255-264 |
| Vignon-Pennamen MD et al. | M | 60 | Sí | Derrame pleural. Nódulo cavitado | Gammapatía monoclonal IgA | Arch Dermatol. 1989;125:1239-1242 |
| Gibson LE et al. | M | 66 | Sí | Infiltrados pulmonares | Síndrome mielo-proliferativo | Mayo Clin Proc. 1985;60:735-740 |
| McCulloch AJ et al | M | 53 | Sí | Consolidación | No | Thorax. 1985;40:314-315 |
| Moragon M et al | V | 59 | Sí | Infiltrados pulmonares | Síndrome mielodisplásico | Actas Dermosifiliogr. 1990;81:413-416 |
| Poiraud C et al | V | 56 | No | Enfermedad pulmonar intersticial | Síndrome mielodisplásico | Ann Dermatol Venereol. 2010;137:212-215 |
El principal diagnóstico diferencial del pioderma gangrenoso con afectación pulmonar es la granulomatosis de Wegener. En nuestro caso puede descartarse esta opción por la ausencia de afectación nasofaríngea y renal, cANCA negativos y una evolución favorable con corticoides orales en monoterapia. Una granulomatosis de Wegener sin asociación de ciclofosfamida al tratamiento corticoideo hubiera tenido muy mal pronóstico2,6.
La historia clínica y las restantes pruebas complementarias realizadas nos permiten descartar otras causas de afectación pulmonar.
ConclusiónPresentamos un caso de pioderma gangrenoso probablemente exacerbado por yodo, con afectación pulmonar concomitante. En la revisión realizada destacamos la posible implicación del yodo en la exacerbación del pioderma gangrenoso. Remarcamos también que ante el diagnóstico de pioderma gangrenoso debe descartarse afectación visceral al menos mediante anamnesis, exploración física, analítica sanguínea básica y radiografía de tórax. En casos de pioderma gangrenoso con lesiones pulmonares hay que sospechar afectación pulmonar por el propio pioderma gangrenoso. Esta sospecha podría evitar procedimientos diagnósticos agresivos. En casos de pioderma gangrenoso con afectación pulmonar resistente a tratamiento corticoideo en monoterapia se debe plantear la posibilidad de una granulomatosis de Wegener.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.