Presentamos una revisión actualizada en materia de avances en la aplicación de la tecnología al proceso diagnóstico y terapéutico en dermatología. Respecto a las técnicas de diagnóstico, realizamos una breve reseña sobre la tomografía de coherencia óptica, la microscopia láser multifotónica, la espectroscopia, la termografía y la resonancia magnética nuclear de 7tesla, siendo que estas últimas también prometen incorporarse al arsenal diagnóstico en el futuro. En cuanto a los avances en terapéutica, la aplicación de tecnologías basadas en la luz, como el láser, ven ampliar sus aplicaciones con nuevas dianas y longitudes de onda, además de desarrollarse dispositivos de uso casero. Comentamos también el uso de plasma, ultrasonidos, radiofrecuencia, traser, fotoestimulación y administración transepidérmica de fármacos con fines terapéuticos. Finalmente, mencionamos los aspectos básicos de la nanotecnología y su proyección futura en el campo de la dermatología.
We review novel technologies with diagnostic and therapeutic applications in dermatology. Among the diagnostic techniques that promise to become part of dermatologic practice in the future are optical coherence tomography, multiphoton laser scanning microscopy, Raman spectroscopy, thermography, and 7-T magnetic resonance imaging. Advances in therapy include novel light-based treatments, such as those applying lasers to new targets and in new wavelengths. Devices for home therapy are also appearing. We comment on the therapeutic uses of plasma, ultrasound, radiofrequency energy, total reflection amplification of spontaneous emission of radiation, light stimulation, and transepidermal drug delivery. Finally, we mention some basic developments in nanotechnology with prospects for future application in dermatology.
Tradicionalmente, el proceso diagnóstico se ha basado en la información procedente de una anamnesis y de una exploración física minuciosas. El médico se servía de sus sentidos para explorar al paciente y obtener información objetiva de su estado de salud. El estetoscopio, el primer instrumento diseñado para mejorar sus habilidades diagnósticas, fue inventado en 1816 por el doctor René Laënnec1. A partir del sigloxix, con el desarrollo de la anatomía patología se generalizó la toma de biopsias de los órganos enfermos. En 1895, el físico alemán Wilhelm Röntgen descubrió los rayosX y su potencial en medicina tras radiografiar accidentalmente la mano de su mujer. Antes de que acabara el sigloxix y junto al descubrimiento del radio, en 1898, por el matrimonio Curie, comenzaron a usarse las radiaciones ionizantes en patologías diversas2. Desde entonces, la aplicación de los últimos descubrimientos en física, química y biología molecular ha configurado el desarrollo tecnológico de la medicina occidental. En dermatología, la introducción del estudio histopatológico mejoró notablemente el proceso diagnóstico. Aunque la piel es un órgano fácilmente accesible a la inspección ocular y a la toma de biopsias, en los últimos años existe una demanda creciente de nuevas técnicas para el diagnóstico in vivo y en tiempo real, que puedan acoplarse con procesos terapéuticos mínimamente invasivos y con una toxicidad aceptable. En este sentido, la dermatoscopia tiene un sitio consolidado, y la microscopia confocal se abre camino en la práctica habitual. El futuro abordaje diagnóstico y terapéutico del paciente dermatológico pasa por un enfoque multidisciplinar y la aplicación de los avances en física, química y biología molecular, que complementen o incluso superen a técnicas tan útiles hoy en día como la luz pulsada y la terapia fotodinámica. En la presente revisión comentamos las técnicas diagnósticas y terapéuticas que aún no tienen aplicación rutinaria en la práctica asistencial, a excepción de los equipos de uso doméstico para tratamientos cosméticos, en virtud de que marcan una tendencia que creemos importante destacar (tabla 1).
Tecnologías en desarrollo para el diagnóstico y la terapéutica en dermatología
| DiagnósticoTomografía de coherencia ópticaMicroscopia láser multifotónicaEspectroscopia RamanTermografíaResonancia magnética nuclear 7 teslaTerapéuticaNuevas dianas en laserterapiaGlándulas sebáceasLípidosGlándulas sudoríparasPigmentos exógenos y tatuajesBacterias y hongosInmunoterapiaCáncer de piel no melanomaNuevas longitudes de onda en laserterapia1.565 nmThulium 1.940 nmOtras energíasPlasmaUltrasonidosRadiofrecuencia fraccionadaTraserFotoestimulación |
Traser: total reflection amplification of spontaneous emission of radiation.
La tomografía de coherencia óptica (OCT) se usó inicialmente para valorar la retina. Esta técnica de imagen permite medir la intensidad de la luz reflejada por el tejido mediante un proceso denominado interferometría de baja coherencia. Utiliza luz infrarroja (1.300nm) y, a diferencia de la microscopia láser confocal de reflectancia (MLCR), ofrece imágenes virtuales de «secciones verticales» al plano en el que incide el haz de luz y tiene una mayor resolución en profundidad (hasta 2mm). Sin embargo, la OCT tiene menor resolución lateral que la MLCR (resolución lateral 10-15μ), que le impide distinguir estructuras celulares y detalles citológicos3-8.
Microscopio láser multifotónicoEsta técnica está basada en la existencia de propiedades de autofluorescencia de la piel. El microscopio láser multifotónico (MLMF) produce una excitación de fluoróforos endógenos dérmicos y epidérmicos (melanina, queratina y NADH) que, normalmente, son excitados por longitudes de onda en el espectro de la luz ultravioleta. Sin embargo, el MLMF utiliza un láser de femtosegundos (1fs=1×10–15s) con luz en el espectro del infrarrojo cercano, que posee menor dispersión que la luz visible. El alto número de fotones emitidos por este láser en una fracción de tiempo tan corta permite que en ocasiones incidan 2 fotones de luz infrarroja prácticamente a la vez en una misma molécula fluorófora de la piel. Estos fluoróforos se comportan como si recibieran un solo fotón en el espectro ultravioleta, excitándose y emitiendo luego fluorescencia de luz en el espectro de luz visible, que es detectada por el sistema óptico del microscopio.
De forma similar a la MLCR, el MLMF obtiene imágenes de alta resolución a nivel celular e intracelular en un plano horizontal a la superficie cutánea. La mayoría de los estudios con esta técnica en dermatología se han hecho ex vivo, pero ya existen en el mercado sistemas para el estudio de la piel in vivo9-11.
Espectroscopia RamanLa espectroscopia Raman (ER) es un método para la identificación de la composición química de una muestra, mediante el uso de un láser. Con ello podemos clasificar las lesiones cutáneas en función de su composición molecular. En la piel, se ha demostrado su capacidad de diferenciar lesiones malignas con una sensibilidad superior al 90%, aunque con menor especificidad12-14. La ER proporciona información sobre la composición bioquímica del tejido analizado, pero ofrece escasa información sobre su estructura y su situación anatómica. No obstante, combinada con OCT que proporciona la información espacial complementaria, se consigue un análisis morfológico y bioquímico conjunto. Debido a que las células neoplásicas tienen diferente huella espectroscópica respecto del tejido sano, la ER podría ser útil en delinear márgenes quirúrgicos en la cirugía de Mohs15-16.
TermografíaLa termografía se ha empleado en medicina con fines diagnósticos, utilizando la información procedente de imágenes infrarrojas del cuerpo humano. Esta técnica determina las áreas del cuerpo que presentan un flujo sanguíneo irregular, por aumento o por defecto, lo cual se traduce en cambios de temperatura. Se ha utilizado, por ejemplo, en el herpes zoster y en el seguimiento de hemangiomas17-19.
Resonancia magnética nuclear 7 teslaLa resonancia magnética nuclear (RMN) proporciona imágenes anatómicas de alta resolución de forma no invasiva. La resolución de imagen permite diferenciar el estrato córneo, la epidermis y la dermis20. El uso de la RMN en dermatología pertenece aún al campo de la experimentación, a pesar de que ya en los años noventa del siglo pasado multitud de publicaciones indicaban su uso potencial. Sin embargo, la capacidad de producción de campos magnéticos no superaba los 3tesla (T), lo cual se traducía en una pobre definición de las imágenes, dada la baja señal generada por las células de la capa córnea y de la dermis en la resonancia convencional21. Parte de la investigación actual se ha centrado en el empleo de diversos contrastes, como, por ejemplo, el contraste de transferencia de magnetización (MT). Este permite evaluar especialmente la interacción de las diferentes capas del tejido cutáneo con los fluidos intersticiales22.
Recientemente se han desarrollado equipos de RMN que utilizan imanes que aumentan la potencia del campo magnético creando «campos magnéticos» ultra highfield (UHF) por encima de 3T, cuya resolución alcanza niveles similares o incluso superiores a los histológicos. Actualmente la limitación de esta técnica es principalmente económica y de infraestructura, puesto que las instalaciones necesarias para albergar un equipo capaz de generar semejante campo magnético son de gran tamaño y extremadamente costosas.
TerapéuticaDispositivos láser y nuevas dianasDurante años, la terapia láser dermatológica se ha dirigido a 3 «dianas» o cromóforos clásicos (hemoglobina, melanina y agua) que nos ha permitido tratar con éxito distintas lesiones vasculares y pigmentadas, eliminar folículos pilosos, tratar cicatrices de acné y algunos signos de envejecimiento cutáneo. No obstante, podríamos ampliar nuestras dianas terapéuticas y actuar no solo a nivel de estructuras macroscópicas, como folículos pilosos o vasos sanguíneos, sino en estructuras subcelulares y organelas citoplasmáticas23.
Glándulas sebáceasRecientemente se han estudiado con mayor precisión cuáles son las longitudes de onda más eficaces en el tratamiento de las glándulas sebáceas, que están implicadas de forma directa en la fisiopatología del acné. Mediante un láser de electrones libres, que permite sintonizarlo en cualquier longitud de onda del espectro electromagnético, encontramos picos de absorción en las glándulas sebáceas a 1.210, 1.728, 1.760, 2.306 y 2.346nm. En el rango de los 1.700nm, con pulsos de 100-125ms, este láser ha logrado un daño térmico selectivo para las glándulas sebáceas.
La terapia fotodinámica (TFD) también ha logrado cierto grado de inhibición de las glándulas sebáceas con un efecto beneficioso para las lesiones inflamatorias de acné. Para prevenir un daño excesivo en los queratinocitos, se ha ensayado con éxito la exposición a luz roja (635nm) o azul (420nm) de baja potencia durante la incubación con ácido aminolevulínico (ALA), previniendo así la acumulación masiva de protoporfirinaix. Esta protoporfirina es responsable del daño citotóxico en los queratinocitos al realizar la exposición a luz roja de alta energía. El empleo de TFD con luz roja o azul de baja potencia se ha llamado «terapia fotodinámica de fotoinhibición» (iTFD)24.
LípidosEntre los diferentes picos de absorción para los distintos lípidos cutáneos destaca la longitud de onda de 1.210nm, que junto a la utilización de sistemas de enfriamiento epidérmico, ha mostrado un daño térmico selectivo del tejido celular subcutáneo. A esta longitud de onda se produciría una «fototermoestimulación» (PSP por sus siglas en inglés), que es un nuevo concepto terapéutico. La PSP tendría la capacidad de estimular los adipocitos y las células mesenquimales del tejido celular subcutáneo para el tratamiento del cuadro estético conocido como «celulitis» e incluso de grandes lipomas. También se han obtenido resultados satisfactorios mediante el uso de fibras que, situadas lateralmente bajo la superficie cutánea, emiten láser de 1.440nm a nivel de la unión dermohipodérmica25.
Glándulas sudoríparasDiversas longitudes de onda (Nd:YAG, diodo 924/927nm, diodo 800nm) se están utilizando para destruir las glándulas sudoríparas ecrinas en la hiperhidrosis axilar. También se aplican sistemas de radiofrecuencia y ultrasonidos para dañar térmicamente estas glándulas. En 2011, la FDA aprobó un dispositivo para tratar mediante microondas la hiperhidrosis axilar26-31.
Pigmentos exógenos y tatuajesLos láseres de pulsos ultracortos (picosegundos) parecen ser superiores a los que operan con pulsos de nanosegundos en la eliminación del pigmento, especialmente con pigmentos difíciles de eliminar con los sistemas actuales, como el azul y el verde32-36. Estos dispositivos utilizan longitudes de onda ya conocidas: el láser de alejandrita y el de neodimio:Yag para los colores negro, azul y verde, el láser ND:Yag a 532nm para el rojo, el amarillo y el naranja.
Bacterias, hongos y otros patógenos cutáneosExisten estudios que muestran que someter a T.rubrum durante 2min a 42,5°C puede inactivarlo. Sin embargo, no se pueden extrapolar las conclusiones de este ensayo in vitro a las condiciones de la práctica clínica. Se han utilizado láseres de Nd:Yag pulsados y Q-switched, así como láseres a 1.320, 870 y 930nm en el tratamiento de la onicomicosis37-41. También existen estudios con terapia fotodinámica que han demostrado su utilidad incluso en casos de onicomicosis por hongos no dermatofitos, que suelen responder muy mal al tratamiento farmacológico clásico42,43.
Láser en inmunoterapiaLa eficacia que los láseres vasculares han demostrado en algunos estudios en patologías como el lupus eritematoso, la psoriasis o la rosácea inflamatoria, podrían deberse no solo a su acción sobre los vasos, sino que se sospecha la implicación de algunos mecanismos de modulación inmunológica44,45.
Cáncer de piel nomelanomaPublicaciones recientes muestran la eficacia de los láseres vasculares en el tratamiento del carcinoma basocelular46-50. Sin embargo, se postula que esta técnica podría tener el riesgo de que las posibles recidivas muestren un crecimiento multifocal, de modo parecido a lo que ocurre con las recidivas después de la crioterapia.
Dispositivos láser y nuevas longitudes de ondaEntre los avances más recientes se encuentra el descubrimiento de la potencial aplicación de «viejas» longitudes de onda para el tratamiento de «nuevas dianas». Por ejemplo, el láser de alejandrita de pulso largo, que se ha utilizado preferentemente en depilación, puede ser usado en el tratamiento de lesiones vasculares51. Asimismo, se investiga en la combinación de tratamientos láseres y fármacos antiangiogénicos como un tratamiento prometedor en un futuro próximo. Un ejemplo es el láser de colorante pulsado combinado con rapamicina tópica en malformaciones capilares.
Nuevas longitudes de onda• 1.565nm. Se ha aprobado un láser fraccionado no ablativo que emite luz infrarroja a 1.565nm con mayor penetración que a 1.540 o 1.550nm, aunque todavía es pronto para saber si es más eficaz que los anteriores.
• Láser Thulium 1940nm. El láser fraccionado no-ablativo a 1.940nm es una nueva longitud de onda con mayor coeficiente de absorción por el agua que en otras longitudes de onda no-ablativas (1.410-1.550nm), aunque menor que los láseres ablativos.
Otras formas de administrar energíaPlasmaSe ha definido al plasma como el cuarto estado de la materia. El plasma está constituido por un gas altamente ionizado que se convierte en un material radiante. De hecho, el 99% de la materia visible del universo es plasma. Algunos ejemplos incluyen las estrellas, la aurora boreal y los relámpagos.
Los plasmas también se clasifican como plasmas fríos o calientes. Los plasmas fríos se pueden utilizar para producir un daño térmico controlado de la piel con formación de nuevo colágeno y remodelación de la arquitectura dérmica para tratamientos de rejuvenecimiento. También se ha utilizado dispositivos de plasma frío para mejorar la cicatrización de heridas, para producir hemostasia y para el tratamiento de dermatosis infecciosas y de la dermatitis atópica, entre otras. A día de hoy, se usan de forma rutinaria principalmente en dermatología cosmética para rejuvenecimiento52,53.
UltrasonidosAdemás de sus aplicaciones diagnósticas, los ultrasonidos podrían tener nuevos usos en el campo terapéutico. En los últimos años se ha desarrollado la ultracavitación para lipoescultura corporal por sonografía54 y la destrucción selectiva de glándulas sudoríparas como tratamiento de la hiperhidrosis axilar55,56.
Por otro lado, se han publicado artículos que subrayan la utilidad de los ultrasonidos para favorecer la penetración transcutánea de diversos fármacos mediante el efecto conocido como sonoforesis, mejorando así su biodisponibilidad57-65. Otros usos terapéuticos se basan en la posibilidad de focalizar los ultrasonidos a diferentes profundidades en el espesor de la piel. Por ejemplo, los ultrasonidos pueden producir el calentamiento de la dermis y un efecto de tensado dérmico por su acción sobre el colágeno, en terapias de rejuvenecimiento.
RadiofrecuenciaLos costes de fabricación de los aparatos de radiofrecuencia son menores que los de los dispositivos con láseres, haciéndolos por tanto más accesibles. Dentro de las novedades en esta área, se están utilizando radiofrecuencias fraccionadas, que producen microlesiones en la superficie de la piel similares a las producidas por los láseres fraccionados de CO2. Se acompañan de un dispositivo con un cilindro rodante, o roller, que se desliza sobre la superficie cutánea. También existen sistemas que emiten la radiofrecuencia fraccionada a través de un sistema de agujas que permite introducir la energía en planos tisulares más profundos66-70.
TráserEl concepto «tráser» proviene del acrónimo total reflection amplification of spontaneous emission of radiation y fue una idea de Morgan Gustavsson. Se trata de utilizar colorantes fluorescentes, que son excitados mediante una fuente energética, generalmente lumínica, que se libera de forma súbita como el flash de una cámara fotográfica. El colorante fluorescente absorbe en una longitud de onda precisa, excitándose y reemitiendo posteriormente en otra banda estrecha (pico) de fluorescencia con una longitud de onda cercana (fenómeno de Stokes Shift). Este pico de intensidad dependerá del colorante fluorescente seleccionado. El tráser no es un láser (no tiene resonador óptico e induce una luz no coherente ni colimada), ni tampoco es una luz pulsada (no utiliza filtros). El tráser es un sistema más simple que aquellos, lo que abarata los costes de fabricación. Además, utiliza colorantes baratos, no tóxicos y duraderos, por lo que es una tecnología muy atractiva para su desarrollo futuro.
Utilizando distintos colorantes el tráser es sintonizable en múltiples bandas de luz pulsada, desde el UVA hasta el infrarrojo cercano. Se ha experimentado con diversos colorantes, como la sulforodamina 640nm, que emite un pico de 658nm y se ha mostrado eficaz en depilación, y el pirrometano 556nm, que emite fluorescencia con un pico de 543nm y es útil para tratamientos vasculares. Ya existen estudios clínicos e histológicos sobre su utilidad en estas 2 aplicaciones. Podría tener usos médicos, domésticos e industriales. En un futuro próximo comprobaremos si esta tecnología es capaz de sustituir en un solo equipo a la tecnología láser71.
Equipos de uso doméstico (home devices)A diferencia de los apartados anteriores, en donde la mayoría de las técnicas comentadas se encuentran todavía en desarrollo y aún no aplicadas a la práctica asistencial habitual, presentamos aquí una breve reseña sobre los equipos de uso doméstico. En los últimos años ha habido una invasión en el mercado de estos dispositivos para el tratamiento de problemas dermoestéticos. La mayoría de ellos se han dirigido a 5 áreas terapéuticas:
- 1)
Depilación (Epila®, Silkin®, Gillette®, Phillips®, Boots®, Palomar®, Tria Beauty®…).
- 2)
Rejuvenecimiento (Palovia®, Solta®, Syneron®…).
- 3)
Acné (Blue light®, Omnilux®…).
- 4)
Estimulación capilar.
- 5)
Celulitis.
A pesar de tener precios asumibles para el público general, su eficacia es mucho menor que la de los equipos profesionales, por lo que no los reemplazan. No obstante, pueden ser de utilidad en muchos casos. Aún no está del todo establecido su perfil de seguridad, y además este está condicionado fuertemente por el nivel de instrucción del paciente en el uso del mismo72-75.
FotoestimulaciónLos light emitting diodes (LED) actúan mediante la estimulación de los fibroblastos dérmicos, que aumentan la síntesis de procolágeno. Aunque existen muchos estudios a nivel de experimentación animal, apenas hay estudios controlados con medicina basada en la evidencia que demuestren su eficacia. Sí que está contrastada la eficacia de la TFD con LED en dermatología, que se está utilizando en fotorrejuvenecimiento, eritema, cicatrices, acné y alopecia. Respecto a esta última, empieza a haber más estudios y ya están comercializados diversos sistemas de emisión con LED en gorras, cascos y peines o cepillos76-78.
Administración transepidérmicaLos láseres fraccionados ablativos de CO2 permiten abrir la barrera epidérmica mediante la formación de canales dermoepidérmicos, que pueden ser utilizados para introducir biomoléculas (antioxidantes, ácido hialurónico y proteínas), fármacos (retinoides), fotosensibilizantes para TFD y células madre para terapias regenerativas. Existen sistemas para acelerar e incrementar la penetración de fármacos y biomoléculas mediante sistemas de compresión por ultrasonidos. De igual forma, a través de estos canales dermoepidérmicos también podríamos extraer sustancias intradérmicas79-81
Soldado de tejidosExisten múltiples estudios donde se demuestra la posibilidad de «soldar» tejidos mediante técnicas de soldado fotomecánico por «adhesivos» activados por luz, logrando alcanzar temperaturas de unos 60°C. Esta técnica podría mejorarse mediante nanotecnología, que permite el diseño de nanofibras y nanopartículas (NP), habiéndose utilizado en la piel, y en los tejidos nervioso y vascular82-85.
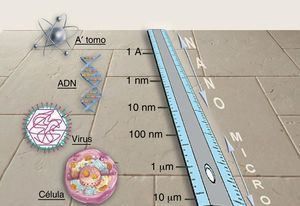
NanotecnologíaLa nanotecnología consiste en la manipulación de la materia en una escala atómica y molecular. Debemos a la imaginación de Richard Feyman, premio Nobel de Física en 1965, sus bases conceptuales. En su célebre conferencia de 1959 («There is plenty of room at the bottom») describió la posibilidad de procesos de síntesis de materiales mediante la manipulación directa de los átomos. Aunque existe una gran expectación sobre el desarrollo y las posibles aplicaciones de nuevas tecnologías diseñadas a escala nanométrica, todavía asistimos a los primeros pasos de esa esperada revolución técnica. La nanotecnología se basa en las ventajas que ofrece la fabricación de materiales a escala nanométrica (entre 1 y 100nanómetros) (fig. 1), que es la escala de las biomoléculas. Cuando trabajamos con un material a escala nanométrica, muchas de sus propiedades ópticas, mecánicas, magnéticas, eléctricas y químicas cambian. Esto se debe a que las partículas interaccionan más con el medio que las rodea al aumentar exponencialmente su relación volumen-superficie, lo que hace que las leyes de la física cuántica se adapten mejor para predecir sus propiedades que las leyes de la física clásica. Mediante nanotecnología seremos capaces de crear nuevos materiales, que abren un campo enorme de aplicaciones en medicina y en la vida cotidiana: diagnósticos más precoces y nuevos tratamientos para el cáncer; microprocesadores y ordenadores más rápidos; teléfonos móviles flexibles; materiales más duros y flexibles; baterías; nuevos tejidos industriales (autolimpiables, invisibles al ojo humano, con gran resistencia y elasticidad), y otras aplicaciones industriales en las que se está trabajando en la actualidad.
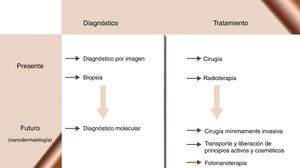
Nanotecnología y ciencias de la salud: nanomedicinaLa nanomedicina busca la aplicación de los conocimientos nanotecnológicos en el ámbito sanitario. Ya somos capaces de diseñar NP capaces de funcionar de modo coordinado como biosensores que diagnostiquen, monitoricen y traten la enfermedad en estadios precoces, y por tanto, cuando es curable. Los investigadores en esta área preconizan una nueva era para la medicina (fig. 2), que lograría la cronificación y, quizás, la curación de enfermedades como el cáncer, la diabetes, la aterosclerosis, la enfermedad de Alzheimer o la infección por VIH. En el trasfondo de estas ideas subyace la esperanza de crear una «medicina personalizada» capaz de ajustar un régimen terapéutico a cada paciente en cada momento evolutivo de su enfermedad. Desde sus inicios, la nanomedicina ha imaginado revolucionar la terapéutica mediante nanoestructuras, que actuarían como vehículos para transportar fármacos hasta sus dianas moleculares, aumentando su eficacia y disminuyendo la toxicidad de los mismos86-90.
NanopartículasExisten NP orgánicas (liposomas o dendrímeros) e inorgánicas (puntos cuánticos, nanoesferas, nanotubos de carbono y NP metálicas). La estructura de una NP inorgánica está constituida, fundamentalmente, por un núcleo (core) y una cubierta (shell). Cada uno de estos compartimentos ofrece distintas posibilidades para el diseño de medios de contraste, transporte y liberación selectiva de fármacos.
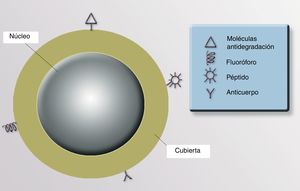
CubiertaLa cubierta define las características ópticas, magnéticas, electrónicas y de fluorescencia de la partícula. Su cubierta nos permite recubrirla con materiales fluorescentes para identificar su presencia, lo que tiene utilidad diagnóstica y terapéutica. Si en esta cubierta situamos determinados anticuerpos monoclonales con afinidad hacia uno o varios receptores celulares específicos, podríamos direccionar la NP con precisión a un órgano, un tejido e incluso a un tipo celular diana (células neoplásicas, infectadas por virus o bacterias intracelulares, poblaciones de células inflamatorias concretas, etc.). También se puede recubrir la superficie de las NP con moléculas para aumentar su estabilidad y evitar la degradación y su captación por macrófagos, aumentando la vida media y la biodisponibilidad del fármaco asociado a estas NP91 (fig. 3).
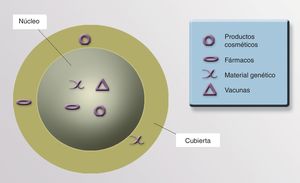
NúcleoEl núcleo de las NP nos permitiría transportar fármacos, virus modificados, proteínas, material genético, vacunas o cosméticos que actuarían en el lugar preciso (fig. 4).
Dispositivos nanométricos con uso diagnósticoLos puntos cuánticos (quantum dots) son cristales de varios nanómetros de diámetro formados por materiales semiconductores como CdSe, CdTe, InP o InAs. El confinamiento cuántico, es decir, el confinamiento espacial de las partículas con carga (electrones) del nanocristal, determina las propiedades ópticas, eléctricas y térmicas especiales del punto cuántico.
La principal aplicación de los puntos cuánticos en las ciencias biomédicas consiste en su uso como marcadores fluorescentes de moléculas en células y tejidos. Iluminadas mediante un láser producirán una intensa fluorescencia que nos permitirá la búsqueda de tumores. Tras su inyección en tumores de ratones, se han utilizado para definir el ganglio centinela y logrando una mayor exactitud en su mapeo92-98. Esto puede ser útil para el marcado selectivo de células tumorales (con anticuerpos específicos del tumor) facilitando asimismo la cirugía de Mohs, para el diagnóstico precoz de tumores o para la terapia fotodinámica, ya que pueden generar radicales de O2 sin necesidad de una molécula fotosensibilizante. Por tanto, los puntos cuánticos actuarían como nuevos agentes activos en terapia fotodinámica. Sin embargo, existe una limitación importante debido a que desconocemos la toxicidad de estas NP, que —no lo olvidemos— están constituidas por metales pesados99.
Sistemas de transporte y liberación de fármacosOtra solución que ofrece la nanomedicina es el desarrollo de sistemas de transporte y liberación controlada de fármacos. La idea consiste en utilizar nanoestructuras que transporten el fármaco y, solamente cuando han reconocido la diana, lo liberen como respuesta a un estímulo determinado. De este modo se reduce la toxicidad en los tejidos sanos y se incrementa la efectividad terapéutica.
NanoemulsionesConstituyen un sistema muy prometedor de administración de fármacos en dermatología100. Sus aplicaciones incluyen, entre otras, la administración en forma de nanoemulsiones de antioxidantes, antiinflamatorios no esteroideos, fotosensibilizantes para terapia fotodinámica, antimicrobianos y fotoprotectores. A nivel de fotoprotección tópica ya se comercializan fotoprotectores físicos, con óxido de titanio y hierro; al ser transparentes, evitan la dispersión de la luz incidente, mejorando la aceptación del paciente y su adherencia.
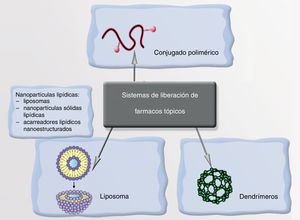
NanopartículasLa NP transporta el fármaco y lo libera cuando reconoce la diana en respuesta a un cierto estímulo, conllevando una enorme selectividad y precisión terapéutica. Los vehículos de estos fármacos pueden ser liposomas, nanopartículas poliméricas o dendrímeros (fig. 5). Un ejemplo de ello podría ser la encapsulación del minoxidil en liposomas para aumentar su absorción en los folículos pilosebáceos aumentando su biodisponibilidad en la raíz de los mismos. Ya se comercializan soluciones con vitaminas antioxidantes en el interior de liposomas, que aumentan su biodisponibilidad a nivel dérmico y evitan su oxidación al contacto con el aire. De igual modo pueden encapsularse sustancias antiandrogénicas, finasterida, o retinoides, que podrían reducir así los efectos secundarios derivados de su administración sistémica101-107.
Fotoablación con nanopartículas metálicasLas propiedades fototérmicas de las nanoestructuras metálicas las convierten en candidatas para su uso en el tratamiento ablativo con láser. Dirigiendo un láser de una longitud de onda adecuada se consigue la excitación plasmónica de la superficie metálica de una nanoestructura formada por una cubierta metálica sobre una superficie de vidrio, produciendo calor. Esta tecnología podría revolucionar las terapias basadas en fuentes de luz, principalmente con luz roja o cercana al infrarrojo, que tiene una capacidad de penetración de varios centímetros en el espesor de los tejidos.
Mediante las moléculas de superficie adecuadas (anticuerpos) podrían seleccionarse dianas moleculares concretas que permitirían la destrucción térmica selectiva de las células tumorales y/o el soporte vascular de un tumor cutáneo. En terapéutica, podríamos dirigir un láser o una fuente de luz a un área cualquiera de la superficie cutánea y actuar sobre poblaciones celulares que carecen de un cromóforo clásico. Se han utilizado NP de oro conjugadas con anticuerpos anti-EGFR en el tratamiento del carcinoma escamoso en ratones, destruyendo las células tumorales con la mitad de la energía que precisaría una célula benigna. También en ratones, se ha conseguido una ablación fototérmica selectiva de melanomas con NP de oro agregadas a un péptido que se dirige al receptor de la melanocortina tipo1 que se encuentra sobreexpuesto en el melanoma maligno108-113.
Los nanotubos de carbono, que pertenecen a la familia de los fullerenos y consisten en láminas de grafito plegadas en una estructura tubular, también absorben la luz en el espectro cercano al infrarrojo y son capaces de generar calor. Como en el caso de las NP, podríamos aprovechar que se acumulan en el estroma de los tumores debido a su mayor permeabilidad a través de vasos capilares formados para nutrir al tumor, y tras aplicar un láser u otra fuente de iluminación se podría destruir un tumor por fotoablación114-116.
Otro campo interesante para explorar es el de las lesiones vasculares cutáneas, como telangiectasias y malformaciones capilares. Si se diseñan nanoestructuras metálicas capaces de acumularse en su periferia o sobre su revestimiento endotelial, también se podría emplear la fotoablación gracias a las propiedades plasmónicas de su superficie tras ser irradiada con una fuente lumínica de energía.
Biosensores nanométricosUna NP puede actuar como un biosensor que permitiría un ajuste de la dosis y del régimen terapéutico, reduciendo la toxicidad sistémica sin renunciar a conseguir el máximo efecto terapéutico.
Como ya habrá podido deducir el lector, la investigación en las aplicaciones biomédicas de la nanotecnología ofrece un campo lleno de posibilidades para mejorar nuestras técnicas de diagnóstico, monitorización y terapéutica, que también revolucionará la dermatología en las próximas décadas.
Nuevas toxicidadesEl desarrollo de nuevas tecnologías es indisociable de la aparición de nuevas toxicidades para pacientes y personal sanitario. Existen estudios por cromatografía con espectroscopia de masas del humo que se produce tras la depilación láser, donde se ha demostrado la presencia de más de 14 sustancias potencialmente tóxicas como la metilpiridina, el dietilftalato o el trimetildisulfuro, entre otras117.
La difusión y la demanda creciente de nuevas tecnologías con aplicaciones terapéuticas y, sobre todo, en el campo de la cosmética hacen que estas técnicas se apliquen ampliamente y casi de forma indiscriminada en todo tipo de lesiones dermatológicas antes de que se conozcan bien las posibilidades reales de cada técnica y sus efectos secundarios.
La alta reactividad de las NP también podría alterar otros mecanismos biológicos distintos a los que se habían determinado en su diseño, lo que se ha dado en llamar nanotoxicidad. Además, también podrían convertirse en nuevos irritantes y alérgenos. Los puntos cuánticos poseen metales pesados, por lo que podrían tener efectos citotóxicos, especialmente si no se los diseña con un recubrimiento hidrofílico. Por otro lado, permanecen semanas o meses dentro de las células y no conocemos casi nada de cómo se metabolizan o cuáles son sus rutas de excreción. De hecho, algunas partículas no biodegradables podrían permanecer indefinidamente en el organismo, pudiendo causar una activación permanente del sistema inmune en un intento de eliminarlas y, quizá, desencadenando enfermedades autoinmunes. Resultan claves para determinar el perfil de seguridad118:
- 1)
La vía de entrada al organismo.
- 2)
El tamaño de la NP (más tóxicas cuanto más pequeñas).
- 3)
Su biocompatibilidad.
- 4)
Su biodegradabilidad.
Por tanto, en nuestra opinión y en la de los expertos, todavía deben realizarse estudios más exhaustivos para asegurar su seguridad.
Los avances en la ciencia y la técnica se abren paso poco a poco en la práctica habitual de los dermatólogos, y los conceptos y términos que hoy nos son extraños puede que sean mañana el estándar de los métodos diagnósticos y terapéuticos. Hemos querido hacer una breve reseña sobre algunos avances que se están dando, todavía en el campo experimental o con aplicaciones limitadas, pero que en el futuro podrían complementar o hasta reemplazar a técnicas presentes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
A la Dra. Izaskun Ocerin Guerta por permitirnos usar los gráficos de su autoría.