El penfigoide de las membranas mucosas (PMM) es un grupo heterogéneo poco frecuente de trastornos ampollosos subepidérmicos autoinmunes que afecta predominantemente a las mucosas. El diagnóstico y el tratamiento pueden ser difíciles y el retraso terapéutico puede llegar a causar cicatrices graves y complicaciones, como son el desarrollo de una estenosis esofágica y uretral, la presencia de sinequias conjuntivales y finalmente la ceguera.
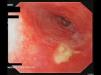
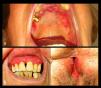
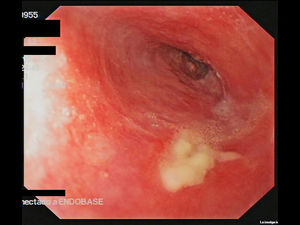
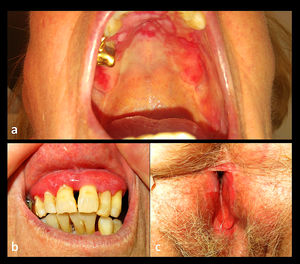
Una mujer de 88 años fue derivada a nuestro servicio para valoración de erosiones en la mucosa oral. Como antecedente de importancia, únicamente presentaba una disfagia de nueve años de evolución, secundaria a una estenosis esofágica de causa indeterminada, motivo por el cual había sido sometida a dilataciones endoscópicas en múltiples ocasiones (fig. 1). Al examen se evidenciaba una gingivitis erosiva, además de erosiones orales y genitales de gran tamaño (fig. 2). El resultado de las biopsias de las lesiones localizadas en la zona vulvar fueron inespecíficas y la inmunofluorescencia directa (IFD) tanto de la mucosa no afectada del área genital como labial fueron negativas. La IFD en salt split (IFI) reveló la unión de anticuerpos IgG en la zona epidérmica de la ampolla. La IFI demostró el depósito de IgG en la membrana basal. Las pruebas de ELISA fueron negativas para los anticuerpos anti Dg1, Dg3 y BP180. La inmunotransferencia de los extractos epidérmicos no afectados fue negativa para IgG: BP230, BP180, envoplakin de 210 kDa, periplakin de 190 kDa, Dg1 y Dg3. La inmunotransferencia de la proteína recombinante del dominio C-terminal de BP180 (BP180ct) detectó una reactividad de la IgG en el suero de la paciente. Basado en estos hallazgos, se estableció el diagnóstico de PMM y se inició tratamiento con prednisona (30 mg/día) en pauta descendente, dapsona de 50 mg/día y tacrolimus en forma de enjuagues bucales a una concentración de 2 mg/L. Tanto la disfagia como las erosiones orales y genitales remitieron, sin embargo, la paciente desarrolló una fibrosis cicatricial de la vulva, además de presentar una fusión de los labios y del meato uretral.
La esofagitis erosiva (EE) es un hallazgo frecuente en las esofagogastroduodenoscopias (EGD) de pacientes con una enfermedad por reflujo gastroesofágico (ERGE), en la afectación de la mucosa por fármacos, en infecciones, en tumores malignos y por trastornos autoinmunes1. Entre los trastornos autoinmunes, el PMM es una de las patologías que probablemente esté infradiagnosticada. En el PMM, la mucosa esofágica se verá afectada con una frecuencia de entre el 2% y el 30%; sin embargo, debido a que la EGD sólo se realizará en pacientes sintomáticos, la frecuencia de la afectación de la mucosa esofágica en el PMM probablemente esté subestimada2.
En aquellos pacientes con el diagnóstico de un PMM y la presencia de lesiones esofágicas, suelen estar también afectadas otras tres mucosas de promedio. La mucosa oral estará afectada hasta en el 86% de los casos3. La disfagia puede indicar el compromiso del esófago, aunque clínicamente esta será difícil de distinguir de la odinofagia. Por todo lo anteriormente comentado, se recomienda la realización de una EGD en todos aquellos pacientes en los que recientemente se haya diagnosticado una PMM2,4. Aunque la EGD no está exenta de complicaciones y no siempre está disponible en todos los hospitales, concordamos con otros autores2–4 en que la EGD se debería indicar especialmente en aquellos pacientes sintomáticos o en los que exista afectación de varias mucosas.
La cavidad oral es el inicio, así como la porción más accesible del tracto digestivo, y debido a que la EGD se realiza mediante una videogastroscopia transnasal, en estos pacientes se puede ver omitida la exploración oral durante este procedimiento. Por ello, en todo paciente que presente erosiones, cicatrices o estenosis esofágicas, la cavidad oral se debe explorar clínicamente. Asimismo, la presencia de gingivitis o erosiones hará necesario realizar un examen del área anogenital, las fosas nasales, la faringe, la mucosa ocular y de la piel, para descartar, de esta forma, un PMM y evaluar la gravedad de la enfermedad.
El diagnóstico y el tratamiento del PMM puede ser un reto. En esta paciente, la IFI reveló una positividad epidérmica, compatible con un penfigoide ampolloso, un liquen plano penfigoide y el PMM. Este hallazgo excluyó el diagnóstico de una epidermólisis ampollosa adquirida, de un penfigoide P200 y de un PMM anti-laminina 3325. Finalmente, la inmunotransferencia fue positiva para BP180ct, un hallazgo muy específico de PMM6. De esta forma, basándonos en las características clínicas, histopatológicas y moleculares, se llegó al diagnóstico de un PMM.
Los tratamientos de primera línea para el PMM incluyen el uso de corticosteroides sistémicos, que generalmente precisarán de la combinación con otros tratamientos inmunosupresores7. La dapsona o el metotrexato son medicamentos a revisar en estadios leves y moderados de la enfermedad8. En casos más graves, particularmente cuando existe una afectación ocular, la ciclofosfamida se ha utilizado en pulsos endovenosos mensuales a dosis bajas de 500 mg, presentando buenos resultados, así como una mejor tolerancia que pautada de forma continua9. El uso fuera de ficha técnica de los anti-TNF y especialmente de los anti-CD20 con o sin inmunoglobulinas intravenosas asociadas, de igual forma ha sido descrito en aquellos casos más recalcitrantes, presentando respuestas satisfactorias, aunque recidivas frecuentes de la enfermedad7.
En conclusión, el manejo multidisciplinario será indispensable para lograr un diagnóstico rápido y para realizar una mejor valoración de la extensión y de la gravedad de la enfermedad. Así se buscará identificar de manera oportuna el compromiso de zonas de elevado riesgo como son la laringe, la mucosa ocular y el esófago, dado que estas áreas van a requerir la indicación de tratamientos más agresivos10.
ReconocimientoEstamos muy agradecidos con el Dr. J.M. Mascaró Jr. del Hospital Clínic (Barcelona), con el Dr. N. Ishii de la Facultad de Medicina de la Universidad de Kurume (Fukoka) y con el Dr. T. Hashimoto de la Facultad de Medicina de la Universidad de Graduados (Osaka) por su invalorable ayuda con este caso.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.