Pembrolizumab es un anticuerpo monoclonal que pertenece al grupo de los nuevos fármacos anti-tumorales estimulantes del sistema inmunitario, los cuales actúan por medio del bloqueo de puntos clave en la cascada inmunológica. Concretamente, bloquea el receptor programmed cell death (PD1) cuya función es inducir la apoptosis de linfocitos T evitando una excesiva proliferación y función de los mismos, por lo que dicho bloqueo conlleva una estimulación de la respuesta inmune1. Diversos cánceres como el melanoma, pulmón, riñón y mama entre otros, pueden presentar una elevada expresión de PD1-L como mecanismo de evasión inmunológica por parte de las células tumorales, por lo que su bloqueo o el de su receptor PD1 ayudaría a poner fin a esa evasión2,3.
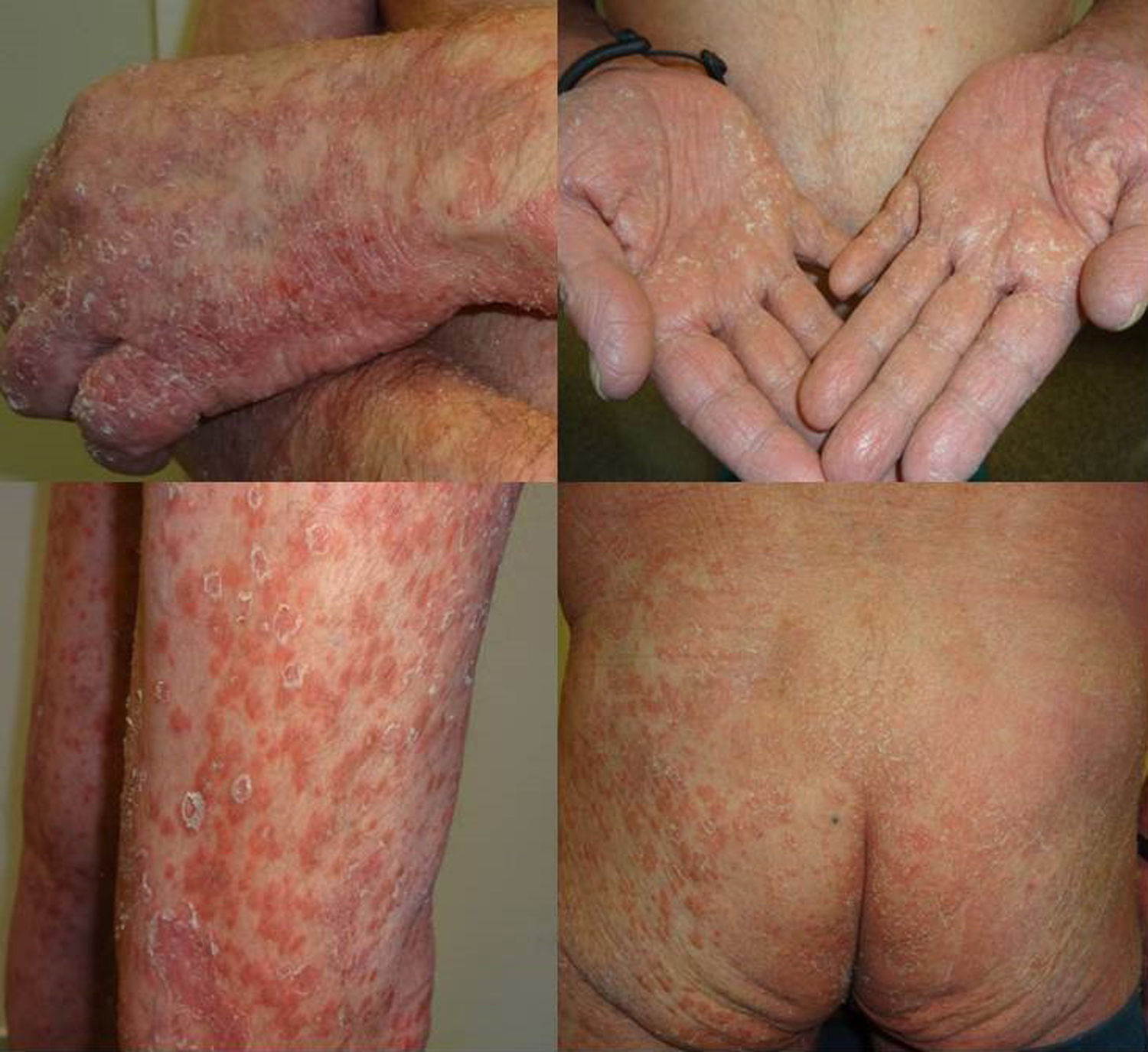
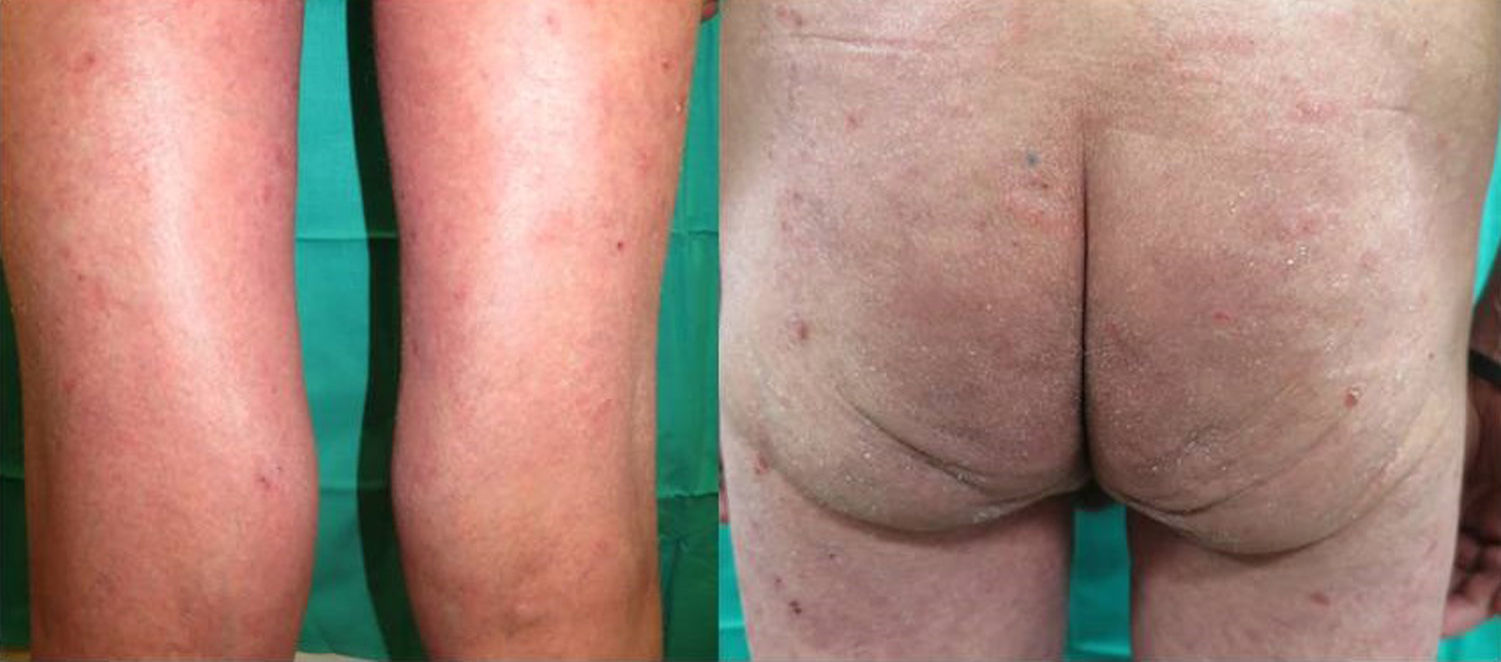
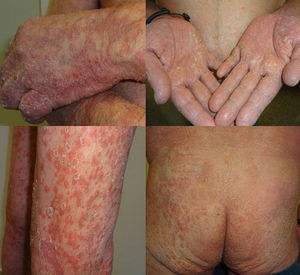
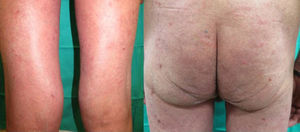
Presentamos un varón de 67 años de edad con antecedentes de infarto de miocardio e ictus cerebeloso, con diagnóstico desde hacía 3 meses de adenocarcinoma pulmonar metastásico con expresión de PD1-L en más del 5% de las células tumorales, medido mediante inmunohistoquímica. El paciente fue remitido a dermatología para valoración y tratamiento de su psoriasis antes del inicio de tratamiento con pembrolizumab en el contexto de un ensayo clínico, debido a su neoplasia pulmonar. Presentaba una psoriasis estable con tratamientos tópicos localizada en codos, rodillas y glúteos con PASI 3 y BSA 5%. Sin embargo, tras el primer ciclo de pembrolizumab presentó un empeoramiento progresivo de su psoriasis con PASI 22 y BSA 60%, llegando prácticamente a una eritrodermia psoriásica tras la segunda infusión con un BSA 81% y un PASI 33 (fig. 1). Iniciamos tratamiento con acitretino a dosis de 25mg/día que tuvimos que aumentar a 35mg/día tras el empeoramiento del segundo ciclo. La respuesta tumoral a pembrolizumab fue excelente ya tras la segunda infusión del fármaco, así como la mejoría de su psoriasis con acitretino a partir del mes y medio de tratamiento, por lo que se decidió mantener ambos fármacos. En los 3 sucesivos ciclos de infusión no ha sufrido nuevos brotes, manteniendo 3 meses después del brote inicial un PASI 4 (fig. 2), lo que nos ha permitido reducir la dosis de acitretino a 20mg/día.
La psoriasis es una enfermedad inflamatoria crónica a la que cada vez más evidencias sitúan dentro del espectro auto-inflamatorio, donde linfocitos T hiperreactivos producen una gran cantidad de interleucinas y factor de necrosis tumoral (TNF) ocasionando un recambio epidérmico acelerado. Hasta la fecha no se ha reportado ningún caso de empeoramiento o inducción de psoriasis en pacientes tratados con pembrolizumab u otros inductores de respuesta inmune, si bien es cierto que dado su mecanismo de acción y la fisiopatología de la psoriasis parece lógico que puedan producirse estas reacciones adversas. Recientes estudios han demostrado una disminución de la expresión del receptor PD1 en linfocitos de sangre periférica en pacientes con artritis psoriásica y artritis reumatoide, lo que parece correlacionarse inversamente con la gravedad de la clínica articular ya que disminuiría la población linfocitaria susceptible de ser inhibida por la vía PD1, aunque no parece influir en el PASI de pacientes con psoriasis4,5. Es asumible según estas evidencias, ciertas alteraciones cuantitativas de los linfocitos T PD1 en pacientes con psoriasis, lo que conllevaría una hiperactividad de los linfocitos T, la cual se tornaría exponencial mediante el empleo de bloqueadores del receptor PD1, explicando el claro empeoramiento de la psoriasis de nuestro paciente. Esta hipótesis precisaría de series más largas, así como realizar la medición tanto de los linfocitos PD1 positivos mediante citometría de flujo y técnicas inmunohistoquímicas, como de los niveles de PD1-L mediante inmunohistoquímica en pacientes con psoriasis, a fin de conocer mejor la fisiopatología de la psoriasis e incluso abrir el camino a nuevas dianas terapéuticas.
En cuanto al tratamiento de la psoriasis agravada o inducida por fármacos estimuladores de la respuesta inmune no existen aún publicaciones al respecto, según nuestra experiencia, el acitretino podría ser una buena opción para conseguir un control óptimo de su psoriasis compatible con la continuidad del tratamiento anti-neoplásico, haciendo necesario series de pacientes que corroboren nuestra experiencia clínica.
En general, los principales efectos adversos asociados a los nuevos fármacos estimuladores de la respuesta inmune son derivados de su propio efecto, es decir, a través de una respuesta auto-inmune contra los diferentes tejidos del organismo, así se han descrito hipo e hipertiroidismo, hepatitis, diarrea, enterocolitis e hipofisitis como fenómenos más frecuentes. A nivel cutáneo prurito, rash maculopapular e incluso eritrodermia, Stevens-Johnson y necrólisis epidérmica tóxica están descritos. Los pacientes con antecedentes de autoinmunidad suponen el mayor grupo de riesgo a sufrir dichos efectos secundarios, siendo una contraindicación relativa para su empleo6–8.
Sin embargo, son fármacos que están demostrando buenas respuestas en determinados tipos de cáncer9. Esto hace previsible su uso creciente en los enfermos con cáncer, por lo que los facultativos debemos estar alerta, y realizar un seguimiento y esfuerzo terapéutico mayor a nuestros pacientes con enfermedades auto-inmunes y auto-inflamatorias de base.
Al Dr. Óscar Juan Vidal del Servicio de Oncología del Hospital Universitari i Politécnic La Fe, Valencia, España.