La infección por el virus del papiloma humano es una afección muy prevalente. Se revisan los aspectos más novedosos del tratamiento de las lesiones producidas por este virus, especialmente las verrugas anogenitales.
Las sinecatequinas y las nuevas formulaciones de imiquimod destacan como novedades, mientras que la terapia fotodinámica y la inmunoterapia intralesional carecen de evidencia científica suficiente para recomendar su uso rutinario. Las vacunas terapéuticas y las moléculas inhibidoras parecen poseer un gran potencial, aun cuando se encuentran en fases iniciales de investigación.
Sería deseable disponer de estudios más homogéneos, con muestras más grandes y con seguimientos suficientemente prolongados que permitiesen comparar directamente la efectividad entre las diferentes modalidades terapéuticas a corto y largo plazo.
Human papillomavirus infection is very common. In this article, we review the latest developments in the treatment of lesions caused by this virus, with a particular focus on anogenital warts.
Sinecatechins and new imiquimod formulations are among the most significant new developments. Others include photodynamic therapy and intralesional immunotherapy, but there is insufficient evidence to recommend their routine use. Finally, while therapeutic vaccines and inhibitory molecules appear to hold great promise, they are still in the early phases of investigation.
More studies are needed, and these should have similar designs, larger samples, and sufficiently long follow-up periods to enable the direct comparison of the short-term and long-term effectiveness of different treatment options.
El virus del papiloma humano (VPH) es el causante de las verrugas vulgares y de las anogenitales, y se asocia a displasia precancerosa y cáncer. Se ha relacionado con los carcinomas de pene, vagina, vulva, anogenitales y orofaríngeos1. Existen multitud de genotipos diferentes (>180)2. Los genotipos 16 y 18 poseen un potencial carcinogénico bien conocido (se detectan en hasta el 70% de los carcinomas del cérvix uterino), mientras que los genotipos 6 y 11 con bajo riesgo oncogénico, son los responsables de las verrugas víricas anogenitales. Otros genotipos están relacionados con verrugas víricas en otras localizaciones anatómicas tales como plantas y palmas, dorso de manos, cara, piel lampiña, mucosas, etc.
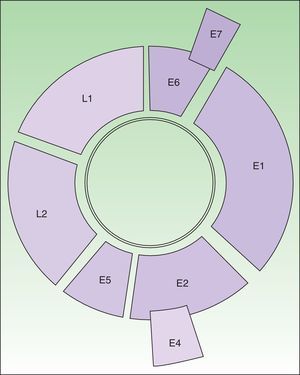
El VPH es un virus de ADN de doble cadena que codifica 8 genes1,2 (fig. 1). L1 y L2 codifican las proteínas estructurales que forman la cápside. E6 y E7 codifican oncoproteínas que actúan interfiriendo la actividad normal de p53 (impidiendo la apoptosis) y de pRB (deteniendo el ciclo celular), respectivamente. La expresión combinada de estas proteínas facilita la inestabilidad genómica y cromosómica. El último paso en la carcinogénesis es la integración del ADN vírico en el genoma celular.
Representación del genoma del VPH tipo 16 (8000 pb). Molécula de ADN circular bicatenaria. E6 y E7 son oncogenes. E1 participa en la replicación del ADN viral (actividad helicasa). E2 participa como proteína auxiliar en la replicación y también interviene en la regulación de la transcripción. E4 disgrega las citoqueratinas para facilitar su liberación. E5 estimula el crecimiento celular mediante la interacción con receptores. Las proteínas de la cápside son producto de los genes L1 (principal) y L2 (secundaria); ambos de expresión tardía. Entre L1 y E6 estaría localizada la región reguladora.
Existen múltiples opciones terapéuticas para el manejo de las verrugas víricas, sin que se haya comprobado que una sea claramente superior a las demás. La necesidad y elección del tratamiento debería ser consensuado entre paciente y terapeuta, teniendo siempre en cuenta la morfología y la extensión de las lesiones. El seguimiento del paciente como mínimo cada 4 semanas es primordial para observar la evolución y modificar el tratamiento si la respuesta no fuese adecuada3. Los tratamientos pueden clasificarse dependiendo de si se los aplica el propio paciente o son aplicados en la consulta por un facultativo. También pueden clasificarse según el objetivo, diferenciando entre los que persiguen la eliminación del virus por acción directa o mediante inmunomodulación, y los que simplemente pretenden la destrucción de las células infectadas. Entre las múltiples terapias de las que disponemos se encuentran el ácido salicílico, el ácido láctico, el ácido retinoico, la cantaradina, la bleomicina, el 5-fluorouracilo, el interferón-alfa, la podofilotoxina (solución 0,5%, crema 0,15%), el imiquimod (crema 5%), el cidofovir (crema 1% o intralesional), el ácido tricloroacético (solución 80-90%), la crioterapia, la electrocirugía, la exéresis quirúrgica, el curetaje y el láser (CO2, YAG). A continuación se revisan las principales novedades, especialmente en el tratamiento de las verrugas anogenitales externas.
Novedades en el tratamientoImiquimodExisten nuevas formulaciones de imiquimod crema disponibles en el mercado: al 2,5 y al 3,75%. Esta última ha sido aprobada recientemente en Estados Unidos y Canadá para el tratamiento de verrugas anogenitales externas (Zyclara® 3,75%). Se realiza una aplicación única diaria hasta la resolución o hasta un máximo de 8 semanas. En los ensayos fase iii se consiguieron porcentajes de aclaramiento de todas las lesiones de hasta el 29% (vs 10% placebo), alcanzándose los mejores resultados en las mujeres (porcentajes de hasta el 37%). Existe un único estudio publicado de tratamiento con imiquimod al 3,75% comparado con imiquimod al 2,5% y con placebo4, en el que se incluyeron 534 mujeres. A las 8 semanas se produjo la remisión completa de las lesiones en el 36,6% de las pacientes tratadas con imiquimod al 3,75% frente al 14,2% de las pacientes que recibieron placebo (p<0,001)4. La disminución media del número lesiones en el grupo con imiquimod al 3,75% fue del 63,5%, mientras que fue solo del 10,7% en el grupo placebo. La formulación de imiquimod al 3,75% fue más efectiva que la del 2,5% en los anteriores parámetros, pese a no alcanzar la significación estadística y sin que se observara un incremento de los efectos indeseados. Es difícil realizar una comparación directa de la eficacia entre imiquimod crema al 5% y la nueva formulación, ya que no hay estudios directamente comparativos y existen grandes diferencias respecto al diseño de los estudios por separado. Lo que sí se comprueba cuando se comparan los resultados de los ensayos de fase iii es una mejor tolerancia a la nueva concentración respecto a la del 5%, siendo las reacciones cutáneas locales mucho menos frecuentes4,5. La aplicación diaria de imiquimod crema al 3,75% puede considerarse una nueva opción terapéutica para las verrugas genitales, especialmente en las mujeres, en las que dicha concentración parece ser más efectiva4,5. La gran ventaja que aporta esta nueva formulación es la simplificación y acortamiento del régimen terapéutico (cada noche, máximo 8 semanas) y una mejor tolerancia, lo cual redunda en una mayor adherencia al tratamiento por parte de los pacientes5. Esta nueva presentación no ha sido todavía comercializada en nuestro país y desconocemos qué precio tendrá.
Sinecatequinas (polifenon E)El polifenon E es un extracto estandarizado de las hojas del té verde (Camellia sinensis). La epigalocatequina galato es la catequina más importante e interviene en múltiples vías de señalización celulares, activando la vía de las caspasas, regulando la expresión de Bcl-2 e inhibiendo la telomerasa1. Mediante estos mecanismos se consigue inhibir el ciclo celular, activar la apoptosis, inhibir la transcripción del VPH y activar la inmunidad celular6. Al combinar todas estas actividades se eliminan tanto las células clínicamente afectas como aquellas con infección subclínica.
Las sinecatequinas en pomada al 15% han sido aprobadas en los Estados Unidos para el tratamiento de las verrugas anogenitales externas (Veregen® 15 ointment). La posología es de 3 aplicaciones diarias durante un máximo de 16 semanas. Existen estudios aleatorizados y controlados realizados con pacientes de ambos sexos que han mostrado unas tasas generales de aclaramiento de las lesiones de entre el 54 y el 65%, mientras que los pacientes de los grupos placebo obtenían tasas medias del 35%7–10. Llama la atención este porcentaje de eliminación de verrugas en los grupos placebo de los ensayos clínicos, mayor a los conocidos para otros tratamientos contra los condilomas. Según la monografía del producto esto puede deberse al miristato de isopropilo y al propilengicol, excipientes potencialmente irritantes utilizados en la formulación, tanto de la pomada como del vehículo. Las tasas de recurrencia fueron de 6-12% a las 12 semanas de seguimiento. En estos estudios también se utilizó la pomada al 10%, mostrando resultados similares, siendo esta última concentración la que se acaba de comercializar en España (Veregen 100mg/g pomada, laboratorios Bial, tubo 15 gramos: 60 euros).
El efecto del fármaco no se empieza a observar clínicamente hasta aproximadamente la tercera semana, y es más evidente a partir de la cuarta o sexta semana7. Los signos y/o síntomas locales son los efectos indeseados más frecuentes (80%), sobre todo el eritema y el prurito, y se manifiestan a partir de la segunda o tercera semana de tratamiento7–10. Pese al alto porcentaje de reacciones, estas son bien toleradas. La reacción inflamatoria, indicativa de la actividad del fármaco, traduce una activación inmunológica local mediada por citocinas proinflamatorias. Se ha observado que los individuos respondedores tienen una incidencia superior de reacciones cutáneas locales en comparación con los no respondedores8. En definitiva, parece un tratamiento efectivo, seguro y bien tolerado, ya que son pocos los pacientes que suspenden el tratamiento debido a los efectos indeseados del preparado. Como contrapartida decir que es un tratamiento largo que puede prolongarse hasta las 16 semanas y que debe aplicarse 3 veces al día, lo cual puede afectar al cumplimiento del mismo. La mayoría de los estudios aleatorizados y controlados excluyen a pacientes con infección por el VIH y trasplantados, hecho que limita los resultados a individuos inmunocompetentes. Tampoco existen datos sobre efectividad en las verrugas internas.
Deberían realizarse estudios comparativos con imiquimod, con periodos de seguimiento prolongados, para poder comparar las tasas de aclaramiento de las lesiones y, sobre todo, las tasas de recidiva.
Se sabe que las sinecatequinas poseen además actividad antivírica y antineoplásica, lo cual las puede hacer potencialmente útiles aplicadas tópicamente como tratamiento del cáncer de piel no melanoma y en infecciones por herpes simple o por virus varicela-zoster6.
Terapia fotodinámicaSe basa en la respuesta inmunitaria que se produce tras la destrucción tisular inducida por una reacción fototóxica. Se ha observado que el ácido 5-aminolevulínico (ALA) se acumula en mayor cantidad en las células infectadas por el VPH que en la piel normal adyacente11. Se ha propuesto como una opción para aquellas lesiones rebeldes al tratamiento, o en aquellos casos en los que existen recurrencias pese a haberse realizado un tratamiento correcto. También se puede utilizar en el tratamiento de la neoplasia intraepitelial cervical y vulvar12.
Se ha probado TFD con luz blanca y ALA combinada con queratolíticos en pacientes con verrugas palmo-plantares resistentes a otros tratamientos. El número de sesiones de TFD fueron de 6 y la tasa de respuesta fue de un aclaramiento del 56% de las verrugas a las 18 semanas13. Con el metil aminolevulinato (MAL) existe menos evidencia. También se ha propuesto la combinación de TFD con MAL y láser de CO2 para el tratamiento de las verrugas periungueales14. En el caso de las verrugas genitales externas existen más estudios, y estos sugieren que una o 2 sesiones de terapia fotodinámica (TFD) con ALA pueden ser tan efectivas como la exéresis o el láser, y con unas tasas de recurrencia menores a las 12 semanas15,16. Parece que los mejores resultados se obtendrían con formulaciones de 5-ALA en gel al 16-20% asociadas a dosis de 100-150J/cm2 de luz roja17. Los efectos secundarios serían locales en forma de dolor, quemazón y eritema17. Parece que el efecto terapéutico de la TFD en los condilomas vendría dado por una rápida activación de las células dendríticas y de los linfocitos CD4 en la piel lesional18. Como ventajas de la TFD destacan la alta efectividad y seguridad, la rápida curación y el buen resultado estético12. Los principales inconvenientes son el dolor durante la iluminación, la disponibilidad de la luz roja, la dificultad de realizar oclusión de las lesiones en la localización anogenital, la necesidad en algunos casos de tener que curetear o infiltrar el fotosensibilizante en las lesiones mas grandes o gruesas para mejorar la penetración y aumentar la efectividad y el coste del MAL tópico (unos 280 euros la crema de 2g).
Inmunoterapia intralesionalEn los últimos años se han publicado casos anecdóticos y series cortas de casos de la aplicación intralesional con diferentes antígenos para el tratamiento de las verrugas recalcitrantes, especialmente las periungueales y las plantares, tanto en adultos como niños19–21. Este método de tratamiento utiliza la capacidad del sistema inmune para desarrollar una respuesta de hipersensibilidad retardada Th1 contra varios antígenos y, a la vez, contra el VPH. Se asocia a una producción de citocinas que activan linfocitos CD8 y células natural killer, necesarias para la erradicación de la infección por VPH22. Este tratamiento no solo puede erradicar la verruga tratada, sino también las lesiones a distancia, a diferencia de los tratamientos tradicionales22. Es por esto que normalmente se inyecta solamente dentro de la lesión más grande. Se han usado diferentes agentes, siendo los más conocidos el antígeno de Candida (candidina) y el antígeno del virus de la parotiditis (paperas). Más recientemente se han publicado casos aislados o series cortas con los resultados de la infiltración de PPD (tuberculina)19, vacuna triple vírica (paperas, rubeola y sarampión)20,21 y vacuna contra Micobacteria w (para verrugas anogenitales)23. Las infiltraciones se realizan habitualmente cada 1-3 semanas, inyectándose entre 0,1 y 0,3ml, con un máximo de 3-5 sesiones. Los resultados referidos son altamente satisfactorios y a un coste razonable. La candidina suele comprarse en forma de kits que utilizan en pruebas intradérmicas los alergólogos y permiten inyectar a muchos pacientes, por lo tanto su uso para un paciente aislado o pocos pacientes puede no ser barato. En cuanto al precio de las otras modalidades (vacunas, PPD), este estaría alrededor de los 9-15 euros por vial, permitiendo la aplicación de más de una dosis por vial. Este procedimiento puede realizarse de 2 maneras: una es inyectando directamente en las verrugas y la otra es realizando primero una infiltración intradérmica en el antebrazo, hacer una lectura de la reacción local de hipersensibilidad (eritema e induración, positivo a partir de 5mm) a las 48-72h y después inyectar un volumen en las verrugas proporcional a la reacción previa positiva22. Estos tratamientos se reservan para lesiones recalcitrantes, ya que no están aprobados para esta indicación y carecen de ensayos clínicos bien diseñados que los sustenten. Es además difícil la comparación de los diferentes antígenos, dada la poca homogeneidad de las pautas de tratamiento y del seguimiento. Los efectos secundarios más frecuentemente descritos son leves y consisten en una reacción inflamatoria en el sitio de la inyección y síntomas pseudogripales22.
Vacunas profilácticas como tratamientoExisten en el mercado 2 vacunas profilácticas para la infección del VPH, una tetravalente (VPH 6, 11, 16 y 18) y otra bivalente (VPH 16 y 18). Las vacunas actuales se basan en la administración de partículas, sin material genético en su interior, constituidas por la proteína estructural L1 del virus purificada obtenida mediante recombinación genética. Estas partículas mimetizan una partícula vírica consiguiendo inducir una respuesta inmune humoral. Se observan niveles elevados tanto de anticuerpos sistémicos como locales en mucosas genitales1. Esta respuesta humoral parece que también acabaría estimulando una respuesta de la inmunidad celular. El precio de las 3 dosis de vacuna tetravalente en nuestro país es aproximadamente de 450 euros.
Desde la aprobación de estas vacunas profilácticas en 2006 se han descrito casos aislados de remisión de verrugas recalcitrantes (plantares y manos) en pacientes tratados con la pauta habitual de la vacuna tetravalente (no en inyección intralesional)24–26. No se conoce bien cuál es el mecanismo exacto de esta respuesta, ni si se trata de una relación casual por regresión espontánea. No existen ensayos que usen la vacuna profiláctica contra VPH como tratamiento de las verrugas. Es posible que la vacuna produzca una protección cruzada con anticuerpos contra otros genotipos de VPH que estén presentes en esas verrugas. Tal como sucede en las vacunas terapéuticas, también podrían estar implicadas algunas citocinas locales, con inducción de células productoras de interferón o linfocitos CD8 citotóxicos. También es posible que los constituyentes no VPH de la vacuna profiláctica desempeñen algún papel26.
Vacunas terapéuticasSe está explorando también la posibilidad de realizar tratamiento con vacunas dirigidas contra las oncoproteínas E6/E7 de los VPH oncogénicos. Estas vacunas estimularían la inmunidad celular donde los linfocitos T, tanto los Th1 como los CD8+, actuarían específicamente contra estas proteínas diana27.
Podrían tener un futuro en el tratamiento de lesiones precancerosas y cancerosas producidas por el VPH, las cuales siguen expresando de forma constante estas proteínas. Se han desarrollado diferentes tipos de estas vacunas, siendo las basadas en péptidos una estrategia prometedora debido a su seguridad, estabilidad y facilidad de producción28.
Todavía se requiere más investigación, ya que no existe una evidencia clínica suficiente debido a que no existen ensayos clínicos bien diseñados y con un número suficiente de pacientes.
Moléculas inhibidoras de las proteínas del virus del papiloma humanoEn la actualidad no existen tratamientos específicos dirigidos directamente contra el VPH. Existen diversos motivos por los que es necesario desarrollar este tipo de fármacos. En primer lugar, el antivírico ejerce el efecto directo contra el virus por lo que actúa tanto frente a las lesiones clínicamente visibles como contra las imperceptibles. También serían necesarios en las lesiones multifocales como las neoplasias intraepiteliales de vulva o ano, en donde la ablación no siempre es posible. Los individuos inmunodeprimidos también se beneficiarían, ya que la eliminación del VPH y la inmunoterapia requieren de un sistema inmune normofuncionante.
La única enzima que codifica el VPH es la E1 con actividad helicasa, hecho que dificulta el desarrollo de un inhibidor2,29. En la actualidad se están investigando las distintas proteínas víricas y sus interacciones con el objetivo de crear nuevas moléculas con efecto antivírico directo: moléculas directamente inhibidoras contra las proteínas E1-E2 o contra su interacción, contra la unión de E2 con proteínas celulares (nanomolécula JQ1)2 y contra E6 y E7. En cuanto a estas últimas, claves en la oncogénesis del VPH, se han diseñado péptidos capaces de inhibir directamente la formación del complejo que degrada a la proteína p531,29. También se están investigando inhibidores de la entrada del VPH en las células tras una exposición, como la carragenina (derivado de alga roja), que inhibe la unión del VPH (a través de la proteína L1 de la cápside) a los proteoglicanos de las membranas basales epiteliales1.
Estas estrategias todavía están en fases muy iniciales de investigación. Algunas se han suspendido tras la aparición de las vacunas y seguramente falten años hasta que alguna de ellas acabe formando parte del arsenal terapéutico contra el VPH.
ConclusiónRaramente las verrugas anogenitales causan sintomatología o complicaciones importantes; la causa por la que se tratan suele ser estética o psicológica y no debe olvidarse la posibilidad de la autorresolución (hasta el 30%)6. Sin duda el avance terapéutico más destacable es la introducción de las sinecatequinas al arsenal terapéutico contra el VPH. Los datos de los que se dispone indican una eficacia correcta y un buen perfil de seguridad. En cuanto a la comparación entre las sinecatequinas y el imiquimod deben tenerse presentes las diferencias existentes en referencia a los diseños de los principales estudios. En los realizados con las sinecatequinas se evalúa la resolución a las 16 semanas tanto de las verrugas basales como de aquellas que aparecen nuevas durante el tratamiento o el periodo de seguimiento. Mientras que para el imiquimod 5% tan solo se tuvieron en cuenta para el análisis las verrugas presentes al inicio del estudio30–32. Por estos motivos se podría subestimar la eficacia de las sinecatequinas. Además existe un estudio de coste-efectividad que concluye que el uso de las sinecatequinas sería más favorable33. En la tabla 1 hemos intentado resumir y comparar los tratamientos más novedosos con los clásicos.
Resumen de las nuevas opciones terapéuticas en verrugas anogenitales y comparación con los principales tratamientos clásicos tópicos
| Tratamiento | Posología | Aclaramiento | Recurrencias (a 12 semanas) |
| Imiquimod 3,75% | Una aplicación/día durante máx. 8 semanas | 36,6% verrugas basales y las de nueva aparición a las 8 semanas4 | 19,4%4 |
| Imiquimod 5% | Tres aplicaciones a la semana durante máx. 16 semanas | 47,8-50% solo verrugas basales31,32 (sem 16) | 8,8-13%31,32 |
| Podofilotoxina | Dos aplicaciones/día ×3 días seguidos a la semana, máx. 4-6 semanas | 62-70% verrugas basales y nueva aparición a las 4 semanas3587% a las 6 sem34 | 38-43%34,35 |
| Sinecatequinas 10% | Tres aplicaciones/día hasta la resolución completa o máx. 16 semanas | 51-56%9,10 verrugas basales y las de nueva aparición a las 16 semanas | 4-6,5%9,10 |
| Terapia fotodinámica (ALA) | Una o dos sesiones17 | 95% verrugas basales y nueva aparición17 | 8%17 |
| Inmunoterapia intralesional (vacuna micobacteria w) | Una sesión semanal (máx. 10) | 89% verrugas basales y nueva aparición23,a | 0% a los 5 meses23,a |
ALA: ácido amino-levulínico.
En cuanto a la terapia fotodinámica y la inmunoterapia intralesional, la ausencia de estudios bien diseñados y con muestras grandes restringe su uso a casos recalcitrantes. En referencia a los pacientes inmunocomprometidos por el VIH o trasplantados y con verrugas en localizaciones mucosas, existen pocos estudios que evalúen el uso de todos estos nuevos tratamientos para el VPH.
Para finalizar, remarcamos la falta general de evidencia que existe en el tratamiento de una infección tan frecuente. Sería deseable realizar estudios comparativos directos, con diseños homogéneos y periodos de seguimiento lo suficientemente prolongados entre los diferentes tratamientos disponibles para comparar bien su efectividad. Por otra parte, el desarrollo de las vacunas terapéuticas y de nanomoléculas inhibidoras del virus supone un vasto y apasionante campo de investigación, que seguramente se desarrollará de forma más clínica en un futuro no lejano.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.